Антибактериальное действие катионного пептида варнерина опосредовано активацией аутолитических систем атакуемых бактерий
Автор: Филатова Л.Б., Лемкина Л.М., Кононова Л.И., Полюдова Т.В., Коробов В.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
На бактериях Staphylococcus epidermidis 33 изучены бактериолитические эффекты тритона Х-100, цетавлона и низкомолекулярного амфифильного пептида варнерина. Показано, что наибольшим литическим действием обладают катионный детергент цетавлон и варнерин. Наблюдаемый в присутствии этих соединений бактериолизис обусловлен неспецифической активацией локализованных в клеточных стенках пептидогликангидролаз.
Низкомолекулярные катионные пептиды, варнерин, бактериолитическое действие, пептидогликангидролазы, детергентная активность
Короткий адрес: https://sciup.org/147204480
IDR: 147204480 | УДК: 579.234+579.22
Текст научной статьи Антибактериальное действие катионного пептида варнерина опосредовано активацией аутолитических систем атакуемых бактерий
Быстрое формирование резистентности и полирезистентности бактерий к антибиотикам определяет необходимость поиска новых соединений этого класса не только среди продуктов химического синтеза, но и функционирующих в природе на всех уровнях организации живых систем. Особое внимание исследователей привлекают убиквитарные низкомолекулярные катионные пептиды (НКП), обеспечивающие эффективную защиту про- и эукариотических организмов от ближайшего бактериального окружения (Кокряков, 1999). Механизмы антибактериального действия НКП во многом определяются высоким положительным зарядом их молекул даже в нейтральных условиях, а также гидрофобными свойствами, благодаря значительному содержанию в них алифатических аминокислот. Выраженная амфифильность способствует проявлению мембранотропных эффектов НКП, важными следствиями которых являются быстрое падение мембранного потенциала и резкое снижение внутриклеточного уровня АТФ (Garcera et al., 1993). Вместе с тем, обнаружены и литические эффекты этих антибактериальных соединений, которые могут быть связаны с активацией ими аутолизинов клеточных стенок атакуемых бактерий (Bierbaum et al., 1987). К аутолитическим ферментам относятся различные гли-кан- и пептидгидролазы, связанные с главным компонентом клеточных стенок бактерий пептидогликаном (Shockman et al., 1996; Baba, Schneewind, 1998). Функциональная активность этих ферментов специфически проявляется лишь на конкретных стадиях роста и деления бактериальных клеток
(Vollmer et al., 2008; Bourgeois et al., 2009). Показана и неспецифическая активация аутолизинов внешними факторами, в частности, детергентами, которая приводит к глубоким нарушениям пептидогликанового слоя клеточных стенок бактерий и их осмотической гибели (Hinks et al., 1978).
Цель настоящей работы – сравнительный анализ бактериолитических эффектов известных поверхностноактивных соединений тритона Х-100 (октилфе-ноксиполиэтоксиэтанол) и цетавлона (цетилтриметиламмоний бромид), а также гидрофобного катионного пептида варнерина, выделенного из сред культивирования бактерий Staphylococcus warneri KL-1 (Коробов и др., 2010).
Материалы и методы
Работа проведена на коллекционном штамме Staphylococcus epidermidis 33, полученном в ГНИИСКМБП им. Тарасевича (Москва). Бактериальную культуру выращивали на среде LB до середины логарифмической фазы роста. Бактерии осаждали (10 000 g, 10 мин) на центрифуге 3K30 (Sigma, Германия), дважды отмывали в том же режиме 0.01 М Tris- HCl буфером (рН 7.2) и ресуспендировали в буфере до оптической плотности ( OD 600 ), равной 5.0. Для активации неспецифических аутолитических процессов к препаратам бактерий добавляли детергенты тритон Х-100 (конечные концентрации 0.05% и 0.1%), цетавлон (конечные концентрации 0.05% и 0.1%) или низкомолекулярный пептид варнерин (конечная концентрация 8 мг/мл). Инкубацию проб проводили на шейкере Sertomat (Sartorius, Германия) при 150 об/мин и 37°С в течение 4 ч с измерением оптической плотности ежечасно на спектрофотометре PD-
303 (Apel, Япония) при 600 нм. По завершению инкубации из всех проб готовили мазки для окрашивания бактерий по методу Грама, используя комплект реагентов “Микро-ГРАМ” и пропись фирмы-изготовителя (НИЦФ, С.-Петербург, Россия). Микроскопирование окрашенных препаратов проводили на микровизоре проходящего света мVizo-103 (ЛОМО, Россия). Для получения растворимой части бактериальных препаратов аликвоты сред культивирования центрифугировали, как указано выше. В полученных супернатантах изучали содержание и спектр аутолитических ферментов, используя ренатурируемый электрофорез в 9% ПААГе (Mani et al., 1993), содержащем убитые автоклавированием (0.5 ати, 30 мин) и отмытые дистиллированной водой бактерии S. epi-dermidis 33 (1.6 мг сухого веса/мл геля). После окончания процедуры разделения гели отмывали дистиллированной водой в течение 30 мин, помещали в ре-натурирующий буфер (50 мМ MES-NaOH, pH 6.0; тритон Х-100 0.1%) и инкубировали в течение 16 ч при 37°С. После ренатурации гели промывали водой, окрашивали 0.1% метиленовым синим в 0.01% КОН в течение 1 ч и отмывали от красителя водой до проявления прозрачных зон лизиса импрегнированных в гель бактериальных клеток на синем фоне связавших краситель не лизированных бактерий.
Результаты и обсуждение
Динамика лизиса бактериальных суспензий в присутствии детергентов и варнерина представлена на рис. 1. Видно, что наиболее выраженным литическим действием на бактерии S. epidermidis 33 обла- дает катионный детергент цетавлон – через 1 ч инкубирования в присутствии 0.1% раствора этого детергента около 90% бактериальных клеток лизируется, а через 4 ч в препаратах лизируются практически все клетки. Снижение концентрации этого сурфактанта до 0.05% значительно сдерживает бакте-риолитический эффект и через 2 ч инкубации лизируется лишь половина имеющихся в пробах бактерий. В значительно меньшей степени выражено бак-териолитическое действие нейтрального детергента тритона Х-100. Расчет использованных в этих экспериментах эмульгирующих концентраций обоих поверхностноактивных факторов показал, что мощное литическое действие цетавлона (0.1%) проявляется при 3 ККМ (критическая концентрация мицел-лообразования), в то время как даже при 6 ККМ эффект тритона Х-100 (0.1%) был, по-существу, не сопоставим с бактериолитической активностью цетавлона. По-видимому, интенсивность бактериолизиса бактерий определяется не только способностью детергентов снижать поверхностное натяжение на границе клеточных поверхностей и среды, но и воздействием на более глубокие структуры бактериальных клеток. Катионные свойства цетавлона, вероятно, способствуют быстрому достижению им отрицательно заряженной плазматической мембраны и ее мицеллизации. Подтверждением этому является выраженный бактериологический эффект катионного гидрофобного пептида варнерина. Как следует из представленных данных, пептид, по существу, имитирует действие цетавлона.
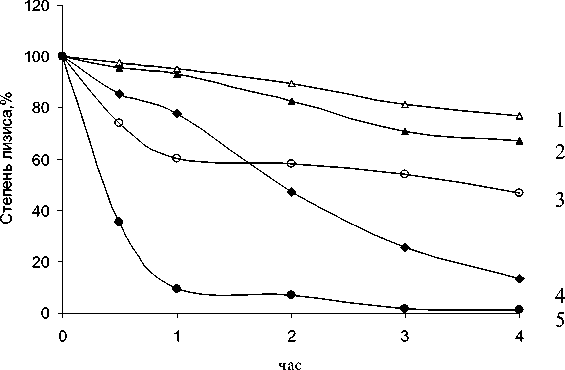
Рис. 1 . Динамика лизиса бактерий S. epidermidis 33 под действием низкомолекулярного пептида варнерина и детергентов (тритон Х-100, цетавлон, додецилсульфат натрия):
1 – тритон Х-100 (0.05%); 2 – тритон Х-100 (0.1%); 3 – цетавлон (0.05%); 4 – варнерин (8 мг/мл); 5 – цетавлон (0.1%)
Различия в проявлении эффектов литических факторов хорошо выявляются при микроскопическом изучении бактериальных суспензий через 2 ч инкубации в присутствии детергентов и варнерина (рис. 2). Видно, что действие цетавлона и варнери-на приводит к потере бактериальными клетками значительных количеств пептидогликана, что выявляется меньшим, нежели в контроле, связыванием красителя. В незначительной степени это характерно и для бактерий, инкубированных с тритоном. Во всех вариантах экспериментов обращает на себя внимание выраженный диспергирующий эффект детергентов и варнерина, проявляющийся относительно равномерным распределением бактерий на поверхности стекла, в отличие от хорошо прокрашивающихся генцианвиолетом мощных кластеров бактерий в контрольном препарате.
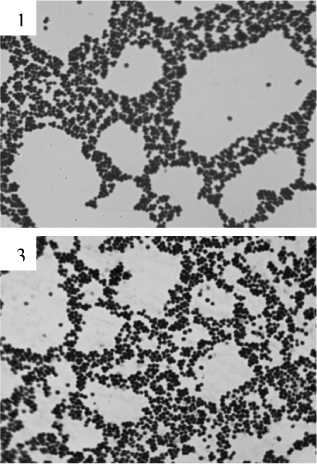
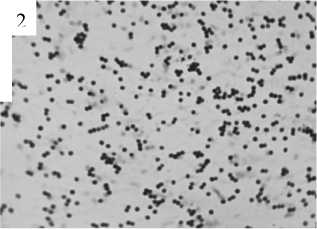
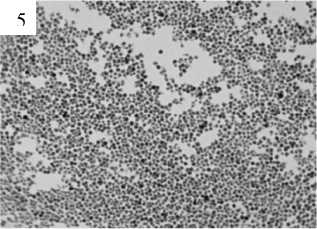
Рис. 2 . Препараты бактерий S. epidermidis 33 (окраска по методу Грама), подвергшихся действию низкомолекулярного пептида варнерина и различных детергентов в течение 2 ч (ув. 100×2):

1 – контроль; 2 – варнерин (8 мг/мл); 3 – тритон Х-100 (0.05%); 4 – тритон Х-100 (0.1%); 5 – цетавлон (0.05%);
6 – цетавлон (0.1%)
Существенные данные, раскрывающие механизмы действия поверхностноактивных соединений и пептидного антибиотика варнерина, получены при электрофоретическом исследовании супернатантов суспензий бактерий после инкубации с детергентами и пептидом. Как видно из представленной на рис. 3 энзинограммы, наибольшая активация ауто-лизинов бактерий наблюдается под влиянием цетавлона и варнерина. При анализе состава обнаруженных в лизатах пептидогликангидролаз, обращает на себя внимание наличие в их спектрах как одинаковых, так и активируемых в значительной степени цетавлоном (“низкомолекулярные”) и варнерином (“высокомолекулярные”) фракций. Эти данные во многом раскрывают механизмы литических превращений бактерий (см. рис. 1) в присутствии использованных детергентов и варнерина, в основе которых, на наш взгляд, лежит неспецифическая активация локализованных в клеточных стенках бактерий гидролаз за счёт их “освобождения” из анионных сайтов связывания (Zoll et al., 2010).
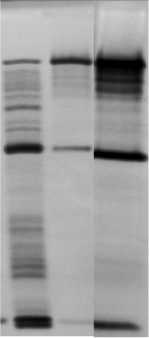
1 2 3
Рис. 3 . Энзимограмма (негативное изображение) аутолитических ферментов бактерий S. epidermidis 33, активирующихся при действии низкомолекулярного пептида варнерина и детергентов:
1 – цетавлон (0.1%); 2 – тритон Х-100 (0.1%); 3 – варнерин (8 мг/мл)
Таким образом, результаты предпринятого анализа бактериолитических эффектов цетавлона и варнерина позволяют констатировать наличие у пептида детергентной активности, как важной составляющей арсенала его антибактериального действия.
Работа поддержана грантами Президента РФ «Ведущие научные школы» НШ-64403.2010.4; Российского фонда фундаментальных исследований и Министерства промышленности, инноваций и науки Пермского края № 10-04-96086-р_урал_а; Программы Президиума РАН «Молекулярная и клеточная биология» и Междисциплинарного проекта фундаментальных исследований, выполняемых в учреждениях УрО РАН.
Список литературы Антибактериальное действие катионного пептида варнерина опосредовано активацией аутолитических систем атакуемых бактерий
- Кокряков, В.Н. Биология антибиотиков микробного происхождения/В.Н. Коряков//СПб.: Наука, 1999. 164 с.
- Коробов, В.П. Выделение и характеристика нового низкомолекулярного антибактериального пептида семейства лантибиотиков/В.П. Коробов, Л.М. Лемкина, Т.В. Полюдова, В.К. Акименко//Микробиология. 2010. Т. 79, № 2. С. 228-238.
- Baba, T. Targeting of muralytic enzymes to the cell division site of Gram-positive bacteria: repeat domains direct autolysin to the equatorial surface ring of Staphylococcus aureus/T. Baba, O. Schneewind//EMBO J. 1998. Vol. 17. P. 4639-4646.
- Bierbaum, G. Autolytic system of Staphylococcus simulans 22: influence of cationic peptides on activity of N-acetylmuramoyl-L-alanine amidase/G. Bierbaum, H.G. Sahl//J. Bacteriol. 1987. Vol. 169. P. 5452-5458.
- Bourgeois, I. Characterization of AtlL, a bifunctional autolysin of Staphylococcus lugdunensis with N-acetylglucosaminidase and N-acetylmuramoyl-Lalanineamidase activities/I. Bourgeois, E. Camiade, R. Biswas [et al.]//FEMS Microbiol. Lett. 2009. Vol. 290. P. 105-113.
- Garcerá, M.J. In vitro pore-forming activity of the lantibiotic nisin. Role of protonmotive force and lipid composition/M.J. Garcerá, M.G. Elferink, A.J. Driessen, W.N. Konings//Eur. J. Biochem. 1993. Vol. 12. P. 417-422.
- Heilmann, C. Identification and characterization of a novel autolysin (Aae) with adhesive properties from Staphylococcus epidermidis/C. Heilmann, G. Thumm, G.S. Chhatwal [et al.]//Microbiology. 2003. Vol. 149. P. 2769-2778.
- Hinks, E.T. Effects of temperature on the autolytic enzyme system of Streptococcus faecalis/E.T. Hinks, L. Daneo-Moore, S. Braverman//J. Bacteriol. 1978. Vol. 136. P. 491-496.
- Mani, N. Isolation and characterization of autolysisdefective mutants of Staphylococcus ureus created by Tn917-lacZ mutagenesis/N. Mani, P. Tobin, R. K. Jayaswal//J. Bacteriol. 1993. Vol. 175. P. 1493-1499.
- Shockman, G.D. Bacterial walls, peptidoglycan hydrolases, autolysins, and autolysis/G.D. Shockman, L. Daneo-Moore, R. Kariyama, O. Massidda//Microb. Drug. Resist. 1996. Vol. 2. P. 95-98.
- Zoll, S. Structural basis of cell wall cleavage by a staphylococcal autolysin/S. Zoll, B. Pätzold, M. Schlag [et al.]//PLoS Pathog. 2010. Vol. 6: e1000807.
- Vollmer, W. Bacterial peptidoglycan(murein) hydrolases/W. Vollmer, B. Joris, P. Charlier, S. Foster//FEMS Microbiol. Rev. 2008. Vol. 32. P. 259-286.


