Антибактериальное действие лизоцима против возбудителей остеомиелита S. aureus и S. epidermidis
Автор: Шипицына И.В., Осипова Е.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Использование лизоцима в качестве бактерицидного агента против ведущих возбудителей хронического остеомиелита может стать альтернативой либо дополнением к существующим антибактериальным препаратам. Цель работы — оценить антибактериальное действие лизоцима в отношении клинических штаммов Staphylococcus aureus и Staphylococcus epidermidis. Материалы и методы. В качестве тест-культур использовали музейные штаммы Staphylococcus aureus (АТСС 25923), Staphylococcus epidermidis (АТСС 14990) и клинические штаммы (n = 48), в том числе MRSA (n = 6) и MRSE (n = 6), изолированные из ран и свищей пациентов с хроническим остеомиелитом. Антибактериальное действие лизоцима оценивали, используя диско-диффузионный метод. Результаты. Лизоцим проявлял бактерицидное действие в отношении музейных штаммов S. aureus и S. epidermidis, зона задержки роста бактерий составляла 11–12 мм. Чувствительны к лизоциму было 87,5 % клинических штаммов S. aureus, диаметр зоны задержки роста составлял 9–13 мм. В отношении трех штаммов S. aureus, в том числе двух MRSA, отмечено отсутствие бактерицидного эффекта, вокруг диска наблюдали сплошной рост бактерий. Среди штаммов S. epidermidis антибактериальное действие лизоцима наблюдали в отношении 79,2 % изолятов, диаметр задержки роста составлял 8–11 мм. Отмечена устойчивость трех штаммов MRSE к лизоциму. Лизоцим усиливал действие ванкомицина и цефокситина против метициллин-чувствительных штаммов стафилококков и норфлоксацина, и ванкомицина — против метициллин-резистентных стафилококков. Обсуждение. Несмотря на обнаруженный ингибирующий эффект, применение только одного лизоцима может быть ограниченно в связи с возможностью его деградации протеазами, а также некоторой иммуногенностью. В литературе имеются работы о синергизме комбинированного действия лизоцима с различными антибиотиками на грамположительные и грамотрицательные бактерии. Полученные в нашем эксперименте данные показали усиление антибактериального эффекта при совместном действии антибиотиков и лизоцима в отношении ведущих возбудителей остеомиелита. Заключение. Установлено, что лизоцим обладает антибактериальным действием в отношении клинических штаммов S. aureus, S. epidermidis, в том числе и MRSA и MRSE, изолированных из ран пациентов с хроническим остеомиелитом. При совместном действии лизоцима с цефотаксимом, норфлоксацином и ванкомицином наблюдается усиление антибактериального эффекта.
Хронический остеомиелит, лизоцим, резистентность, антимикробные пептиды, антибиотики
Короткий адрес: https://sciup.org/142244810
IDR: 142244810 | УДК: [616.718.5/.6-007.24-089.227.84:004.9]-089.168 | DOI: 10.18019/1028-4427-2025-31-3-334-340
Текст научной статьи Антибактериальное действие лизоцима против возбудителей остеомиелита S. aureus и S. epidermidis
Чаще всего остеомиелит вызывают бактерии рода Staphylococcus, преимущественно S. aureus и S. epidermidis (включая метициллин-устойчивые штаммы MRSA и MRSE ), которые демонстрируют высокую степень резистентности к традиционным антибиотикам. Это делает лечение пациентов с остеомиелитом сложным и требует поиска новых, более эффективных препаратов [1–4].
Как альтернатива или в дополнении к существующим антибактериальным средствам, актуальным направлением может стать использование лизоцима в качестве бактерицидного агента против ведущих возбудителей хронического остеомиелита. Лизоцим — это антимикробный фермент, который содержится в различных биологических жидкостях, таких как слюна, слезы и грудное молоко [5, 6]. Лизоцимы подразделяются на три основных семейства: куриный тип (c-тип), гусиный тип (g-тип) и беспозвоночный тип (i-тип). Также известны лизоцимы фагового типа, бактериального типа и растительного типа. Куриный и человеческий являются лизоцимами c-типа. Куринный состоит из 129 аминокислотных остатков (14,3 кДа), человеческий — из 130 аминокислотных остатков (14,7 кДа). Между последовательностью человеческих и куриных лизоцимов существует идентичность 59 %, но антибактериальная активность куриного лизоцима в три раза ниже, чем антибактериальная активность человеческого, однако его использование ограничено из-за доступности ресурсов [5, 7, 8].
Поскольку лизоцим является естественным компонентом организма, он обычно хорошо переносится и имеет низкий риск токсичности, поэтому его используют в медицинских целях. Лизоцим разрушает пептидогликаны, которые составляют клеточную стенку бактериальных клеток, что приводит к осмотическому разрушению и гибели бактерий [8]. Комбинация лизоцима с антибактериальными препаратами может усиливать их действие [9, 10]. Лизоцим также способен модулировать иммунный ответ организма [7, 8]. В настоящее время лизоцим уже используется как консервант и антисептик [6, 8]. Перспектива использования лизоцима в качестве антибактериального агента против ведущих возбудителей остеомиелита может расширить область его применения в медицине.
Цель работы — оценить антибактериальное действие лизоцима в отношении клинических штаммов Staphylococcus aureus и Staphylococcus epidermidis .
МАТЕРИАЛЫ И МЕТОДЫ
В качестве тест-культур использовали музейные штаммы Staphylococcus aureus (АТСС 25923), Staphylococcus epidermidis (АТСС 14990) и клинические штаммы ( n = 48), в том числе MRSA ( n = 486) и MRSE ( n = 486), изолированные из ран и свищей пациентов с хроническим остеомиелитом.
Идентификацию бактерий осуществляли на бактериологическом анализаторе BactoScreen (ООО НПФ «Литех»). Чувствительность микроорганизмов к антибактериальным препаратам определяли дискодиффузионным методом. Оценку результатов проводили, используя критерии EUCAST (2017–2022 гг.). Выявление генов метициллин-резистентных стафилококков в биологическом материале осуществляли с использованием набора реагентов для выявления и количественного определения ДНК MSSA и MRSA, MSSE и MRSE методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс MRSA-скрин-титр-FL».
Антибактериальное действие лизоцима оценивали, используя диско-диффузионный метод. На поверхность плотной питательной среды (агар Мюллера – Хинтона), засеянной газоном суточной культуры S. aureus или S. epidermidis , помещали диски из картона фильтровального технического (ГОСТ 6722–75) и диски с антибиотиками, пропитанные лизоцимом (CAS–№ 9001-63-2, 20000 U/mg, AppliChem) в концентрации 30 мкг/мл. Чашки Петри с посевами инкубировали в термостате при температуре 37 °С. Через 24 ч. фиксировали результаты, измеряя зону задержки роста вокруг диска. Действие лизоцима на музейные штаммы проводили в шести повторах.
Проанализированы профили резистентности бактерий S. aureus , S. epidermidis к четырем тестируемым АМП (антимикробным препаратам): цефокситин (FOX), гентамицин (GEN), норфлоксацин (NOR), ванкомицин (VAN).
Для статистической обработки полученных данных использовали программы Gnumeric 1.12.17 и электронные таблицы LibreOffice (версия: 5.4.1.2). Проверку выборок на соответствие определённому закону распределения проводили с помощью критерия Андерсона – Дарлинга. Учитывая, что данные в выборках подчинялись нормальному распределению, для проверки гипотезы о равенстве средних значений применяли критерий Стьюдента. Цифровые данные представлены в виде среднего арифметического значения ( М ) и стандартного отклонения (SD). Различия считали значимыми при р < 0,05.
Микробиологические исследования проведены в лаборатории микробиологии НМИЦ ТО имени академика Г.А. Илизарова.
РЕЗУЛЬТАТЫ
Музейные культуры S. aureus и S. epidermidis были чувствительны к действию лизоцима (рис. 1). Среди клинических изолятов бактерий встречались как чувствительные, так и не чувствительные к лизоциму штаммы.
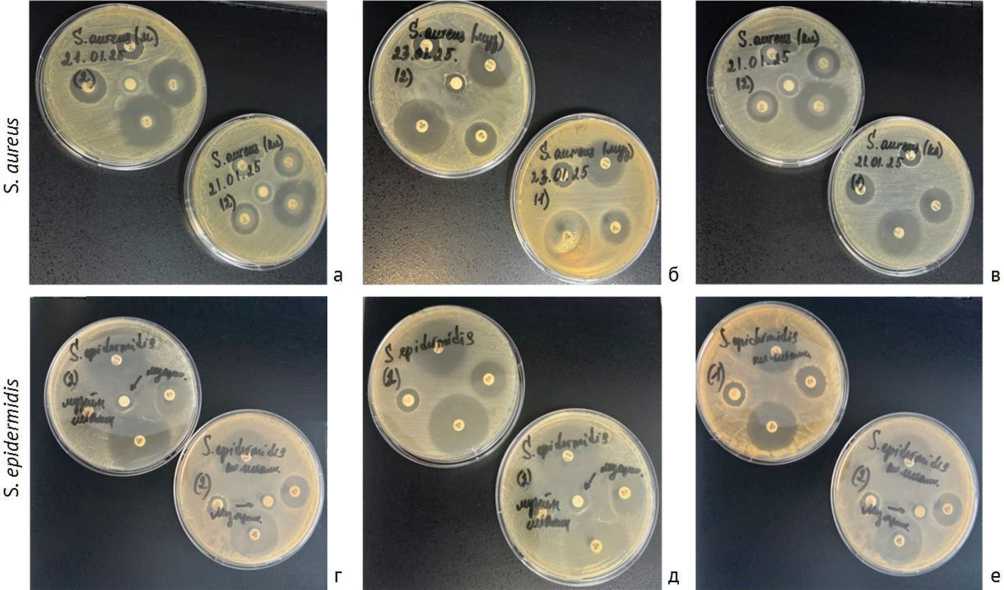
Рис. 1. Антибактериальное действие лизоцима совместно с антибиотиками и без антибиотиков на музейные и клинические штаммы бактерий S. aureus , S. epidermidis : а, г — музейные и клинические штаммы; б, д — музейные штаммы, в, е — клинические штаммы
Значимых различий в диаметре задержки роста между музейными и клиническими штаммами не наблюдали (табл. 1).
Лизоцим в концентрации 30 мкг/мл проявлял бактерицидное действие в отношении музейных штаммов S. aureus и S. epidermidis , зона задержки роста бактерий составляла 11–12 мм. Среди клинических штаммов S. aureus чувствительность к лизоциму выявлена в 87,5 %, диаметр зоны задержки роста составлял 9–13 мм. В отношении
Таблица 1
Зона задержки роста бактерий S. aureus и S. epidermidis после воздействия лизоцима (30 мкг/мл)
|
Микроорганизм |
Диаметр зоны задержки роста, мм |
|
S. aureus АТСС 25923 ( n = 6) |
11,3 ± 0, 47 |
|
S. aureus ( n = 24) |
11,2 ± 1,10 |
|
S. epidermidis АТСС 12228 ( n = 6) |
10,0± 0,43 |
|
S. epidermidis ( n = 24) |
10,5 ± 1,05 |
трех штаммов S. aureus , в том числе двух MRSA , отмечено отсутствие бактерицидного эффекта, вокруг диска наблюдали сплошной рост бактерий.
Среди штаммов S. epidermidis антибактериальное действие лизоцима наблюдали в отношении 79,2 % изолятов, диаметр задержки роста составлял 8–11 мм. Отмечена устойчивость трех штаммов MRSE к лизоциму.
Штаммы S. aureus ( n = 18) и S. epidermidis ( n = 18) были чувствительны к действию тестируемых антибактериальных препаратов. Лизоцим усиливал действие антибиотиков, что выражалось в увеличении зоны задержки роста бактерий вокруг дисков. Значимые отличия наблюдали для ванкомицина и це-фокситина (табл. 2).
В отношении метициллин-резистентных стафилококков лизоцим не усиливал действие цефокситина и гентамицина. Значимые отличия наблюдали только для норфлоксацина и ванкомицина (табл. 3).
Таблица 2
Зона задержки роста метициллин-чувствительных стафилококков, выделенных из ран пациентов с хроническим остеомиелитом под воздействием лизоцима
|
Препарат (мкг) |
Диаметр зоны задержки роста, мм |
|||
|
MSSA , ( n = 18) |
MSSE , ( n = 18) |
|||
|
– |
+ лизоцим (30) |
– |
+ лизоцим (30) |
|
|
Цефокситин (30) |
23,3± 0,47 |
26,5 ± 0,81* p = 0,02476 |
33,3 ± 2,10 |
35,7 ± 1,90 |
|
Норфлоксацин (10) |
29,0 ± 0,82 |
30,0 ± 0,79 |
31,3 ± 0,83 |
32,0 ± 1,40 |
|
Гентамицин (10) |
19,0 ± 1,40 |
19,7 ±1,24 |
20,8 ± 6,60 |
22,3 ± 1,80 |
|
Ванкомицин (5) |
13,7 ± 0,94 |
15,8 ± 0,47* p = 0,0404 |
15,0 ± 0,51 |
17,3 ± 1,10* p = 0,0216 |
Примечание : * — уровень значимости различий между группами, р < 0,05.
Таблица 3
Зона задержки роста метициллин-резистентных стафилококков, выделенных из ран пациентов с хроническим остеомиелитом под воздействием лизоцима
|
Препарат (мкг) |
Диаметр зоны задержки роста, мм |
|||
|
MSSA , ( n = 6) |
MSSE , ( n = 6) |
|||
|
– |
+ лизоцим (30) |
– |
+ лизоцим (30) |
|
|
Цефокситин (30) |
20,3 ± 0,84 |
20,0 ± 0,82 |
19,5 ± 1,10 |
20,0 ±0,80 |
|
Норфлоксацин (10) |
27,3 ± 1,25 |
30,2 ± 0,61* p = 0,0248 |
29,8 ± 1,03 |
32,2 ±0,62* p = 0,0242 |
|
Гентамицин (10) |
18,8 ± 0,24 |
18,5 ± 0,20 |
10,7 ±0,94 |
12,0 ± 0,41 |
|
Ванкомицин (5) |
14,3 ± 0,47 |
14,2 ± 0,62 |
14,7 ±0,47 |
17,5 ± 0,72* p = 0,025 |
Примечание : * — уровень значимости различий между группами, р < 0,05.
ОБСУЖДЕНИЕ
Клинически значимым патогеном при хроническом остеомиелите считается S. аureus , который, взаимодействуя с клетками организма посредством варианта малых колоний (SCV), образованием биопленок и секрецией токсина, индуцирует воспалительную реакцию, вызывая гибель клеток путем апоптоза и некроза [1]. Важная роль в развитии инфекций при хроническом остеомиелите принадлежит и бактериям S. epidermidis [3, 11]. В последнее десятилетие отмечается увеличение числа бактерий с множественной лекарственной устойчивостью, что приводит к неэффективности традиционных подходов в лечении пациентов с хроническим остеомиелитом и определяет необходимость поиска новых препаратов [2, 4].
Перспективным направлением считается использование антимикробных пептидов системы врожденного иммунитета [12]. Известно, что пептиды, полученные в результате расщепления лизоцима, проявляют антимикробную активность, в первую очередь, против грамположительных бактерий [13]. Они могут действовать напрямую (литический эффект) или косвенно (модулировать иммунную систему). Антибактериальный механизм лизоцима обусловлен его мурамидазной активностью, которая гидролизует β -l,4-гликозидную связь пептидогликанов, способностью связываться с нуклеиновыми кислотами микроорганизмов и вызывать мутацию или распад бактериального генетического материала [5, 14, 15].
Из-за различий в механизмах устойчивости бактерий к антибиотикам и антимикробным пептидам клиническое применение лизоцима имеет меньший риск развития резистентности у микроорганизмов. Считается, что устойчивость к пептидогликанразлагающим ферментам у бактерий развивается редко, являясь результатом горизонтального переноса детерминант устойчивости, а не мутацией de novo [16].
По данным литературы, обнаружен ингибирующий эффект лизоцима, полученного из яичного белка, на лекарственно-устойчивые бактерии, в том числе на MRSA [17]. В нашем исследовании 87,5 % MSSA , 79,2 % MSSE и 50 % штаммов MRSA и MRSE были чувствительны к действию лизоцима.
Применение только одного лизоцима может быть ограничено в связи с возможностью его деградации протеазами, присутствующими в жидкостях организма, а также некоторой иммуногенностью, которая при повторном использовании может вызывать иммунные реакции [18, 19]. Вопрос о лизоциме как аллергене остаётся спорным. Одни исследователи считают, что лизоцим, являясь компонентом иммунной системы человека, не вызывает аллергической реакции [20]. В других исследованиях показано, что он действует как слабый аллерген [21, 22]. Кроме того, при нанесении непосредственно на поверхность раны лизоцим может легко смываться экссудатом. В связи с этим разрабатывают новые методы доставки лизоцима в очаг инфекции для повышения эффективности его воздействия и уменьшения побочных эффектов [23]. К ним относятся гидрогели, нанопленки, волокнистые мембраны и композитные системы с модифицированным лизоцимом, что позволит улучшить стабильность лизоцима и снизить его иммуногенность [24, 25].
Одним из видов альтернативного использования пептидов является применение их в сочетании с традиционными антибиотиками для лечения пациентов с остеомиелитом [26]. Полученные в нашем эксперименте данные показали усиление действия антибиотиков в отношении всех чувствительных микроорганизмов, однако значимые различия были установлены для комбинации лизоцима с ванкомицином и цефокситином. В отношении метициллин-резистентных штаммов стафилококков усиление антимикробной активности отмечали только для комбинации лизоцима с ванкомицином и норфлоксацином.
При изучении комбинированного действия лизоцима, полученного из яичного белка, с различными антибиотиками (гентамицин, офлоксацин, оксациллин, рифампицин, полимиксин B, ванкомицин, ципрофлоксацин и тетрациклин) на грамположительные и грамотрицательные бактерии, включая чувствительные и устойчивые к лекарственным препаратам штаммы, установлен синергетический механизм действия, снижающий устойчивость микробов [9, 26, 27]. Антибактериальные пептиды изменяют проницаемость клеточной мембраны, позволяя большему количеству антибиотика проникать в клетку и связываться с внутриклеточными мишенями, усиливая его действия и снижая побочные эффекты высоких концентраций [9, 10].
Исследователями показано, что бактерицидный эффект от совместного действия лизоцима и антибиотика в отношении планктонных клеток и биоплёнок, полученных in vitro , более выражен по сравнению с применением препаратов по отдельности [28].
В то же время, необходимо учитывать тот факт, что у всех бактерий имеются как общие, так и специфические механизмы защиты от факторов врожденного иммунитета. К механизмам устойчивости, используемым грамположительными бактериями, в том числе S. aureus , относятся изменения заряда и состава клеточной стенки. Чувствительность грамположительных бактерий к антимикробным пептидам зависит от: содержания отрицательно заряженных тейхоевых кислот в клеточной стенке, которые связывают лизоцимы и снижают их ферментативную активность [8, 19]; инактивации пептидов за счет связывания их поверхностными или секретируемыми белками и полисахаридами; расщепления антимикробных пептидов бактериальными протеазами; адаптации бактерий к воздействию антимикробных пептидов; вытеснения антимикробных пептидов эффлюксными насосами и транспортными системами [16, 29, 30].
ЗАКЛЮЧЕНИЕ
Установлено, что лизоцим обладает антибактериальным действием в отношении клинических штаммов S. aureus , S. epidermidis , в том числе и MRSA и MRSE , изолированных из ран пациентов с хроническим остеомиелитом. При совместном действии лизоцима с цефотаксимом, норфлоксацином и ванкомицином наблюдается усиление антибактериального эффекта.


