Антибиотикорезистентность штаммов стафилококков, выделенных при заболеваниях мочевыделительной системы у кошек
Автор: Пашинина О.А., Кочкина Е.Е., Сычева М.В., Пашкова Т.М., Морозова Н.В., Карташова О.Л.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 4 (48), 2022 года.
Бесплатный доступ
Цель исследования - охарактеризовать антибиотикорезистентность штаммов стафилококков, выделенных из мочи кошек с патологией мочевыделительной системы, на уровне фено- и генотипа. Исследуемый материал - стафилококки, выделенные из мочи 22 кошек с заболеваниями мочевыделительной системы путем ее посева на желточно-солевой агар. Вид микроорганизмов оценивали методом MALDI-TOF масс-спектрометрии. Резистентность к 10 антибиотикам (амоксиклав, цефазолин, цефтриаксон, цефепим, цефотаксим, энрофлоксацин, ципрофлоксацин, азитромицин, гентамицин, тилозин) 12 штаммов Staphylococcus aureus, 6 Staphylococcus sciuri, 7 Staphylococcus intermedius определяли диско-диффузионным методом. Гены резистентности к антибиотикам ( mecA ; blaZ ; aac(6')-аph (2'') ; ant(4')-Ia ; аph(3')-IIIa ; gyrA , grlA, ermA, ermB, ermC ) обнаруживали с помощью полимеразной цепной реакции (ПЦР) с использованием подобранных праймеров. Установлена высокая чувствительность стафилококков к цефазолину, цефепиму, амоксиклаву и резистентность к азитромицину. S. aureus и S. intermedius характеризовались умеренной резистентностью к фторхинолонам, а все изученные виды - к тилозину. С помощью ПЦР установлено наличие в геноме изученных штаммов стафилококков генетических детерминант резистентности к пенициллинам и β-лактамам ( mecA ; blaZ ), у S. aureus - к аминогликозидам ( ant (4')-Ia ) и макролидам ( ermA ), у S. intermedius - к фторхинолонам ( gyrA ) . Установленная резистентность к азитромицину штаммов стафилококков разных видов, выделенных из мочи кошек с заболеваниями мочевыделительной системы, свидетельствует о необходимости контроля за его применением. Для эффективной антибактериальной терапии необходимо проводить региональный мониторинг устойчивости микроорганизмов к антибиотикам. В качестве препаратов выбора при эмпирической терапии животных с заболеваниями мочевыделительной системы стафилококковой этиологии могут рассматриваться цефазолин, цефепим, амоксиклав, гентамицин.
Стафилококки, заболевания мочевыделительной системы, кошки, антибиотикорезистентность, молекулярно-генетическое исследование
Короткий адрес: https://sciup.org/142236102
IDR: 142236102 | УДК: 579.62 | DOI: 10.48136/2222-0364_2022_4_156
Текст научной статьи Антибиотикорезистентность штаммов стафилококков, выделенных при заболеваниях мочевыделительной системы у кошек
Патология мочевыделительной системы среди домашних плотоядных является одной из самых часто встречающихся. В течение последних двух десятилетий заболеваемость неуклонно растет [1], ситуация осложняется частыми рецидивами болезни [2].
Лечение пациентов с рецидивирующими заболеваниями мочевыделительной системы является серьезной проблемой, поскольку требует применения противомикроб-ных препаратов в ветеринарии, что способствует развитию резистентности микроорганизмов [3]. Для проведения действенной антибактериальной терапии необходимы достоверные данные об изменении чувствительности патогенов к антибиотикам в каждом регионе. При этом для повышения эффективности лечения мало определить антибио-тикорезистентность бактерий на фенотипическом уровне. Имея одинаковые фенотипы, но реализуя разные механизмы антибиотикорезистентности, микроорганизмы могут существенно отличаться по чувствительности к применяемым антибактериальным препаратам. Для организации тактики эффективного антибактериального лечения на на-
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY циональном и региональном уровнях нужны данные о распространенности бактериальных генетических детерминант резистентности [4].
Установлено преобладание разных видов стафилококков в составе микрофлоры, выделенной из мочи кошек при заболеваниях мочевыделительной системы [5].
В связи с этим, с одной стороны, представляет интерес фенотипическое исследование антибиотикорезистентности клинических изолятов стафилококков, которые преимущественно инфицируют мочевой пузырь при цистите и мочекаменной болезни, для оценки риска формирования устойчивости к антибактериальным препаратам, а с другой – молекулярно-генетическое исследование антибиотикорезистентности изолятов.
Объекты и методика исследования
В работе были использованы Staphylococcus spp . разных видов, выделенные из мочи 22 кошек с патологией мочевыделительной системы (мочекаменная болезнь и цистит), находящихся на лечении в ветеринарных клиниках г. Оренбурга.
При первичном обследовании пробы мочи из мочевого пузыря с помощью катетера отбирали в стерильные пробирки с соблюдением правил асептики и доставляли в лабораторию в течение одного-двух часов для проведения бактериологического исследования.
Изолировали уроштаммы классическим бактериологическим методом. Для выделения Staphylococcus spp . использовали желточно-солевой агар, куда засевали исследуемый материал. Чашки с посевами культивировали при 37°С в течение 18–24 ч.
Видовую принадлежность микроорганизмов определяли с помощью масс-спектрометра MALDI-TOF серии Microflex (Bruker Daltonics, Германия) с расчетом коэффициента достоверности при использовании программного обеспечения Maldi BioTyper 3,0.
Определение чувствительности микроорганизмов к антибактериальным препаратам осуществляли диско-диффузионным способом согласно [6]. В исследовании применяли стандартные диски промышленного производства, пропитанные следующими антибактериальными препаратами: азитромицин, амоксициллин/клавулановая кислота, цефазолин, цефтриаксон, цефепим, цефотаксим, энрофлоксацин, ципрофлоксацин, гентамицин, тилозин. Учет результатов проводили по диаметру зоны задержки роста тестируемых урокультур.
Молекулярно-генетическому исследованию было подвергнуто 25 штаммов стафилококков: 12 – Staphylococcus aureus, 6 – Staphylococcus sciuri, 7 – Staphylococcus in-termedius .
ДНК экстрагировали из суточной агаровой культуры стафилококков с применением набора реактивов «ДНК-экспресс» («Литех», Россия), согласно рекомендации производителя.
Амплификацию проводили на многоканальном амплификаторе «Терцик МС-2» («ДНК-технология», Россия) по стандартному протоколу. Для выявления генетических детерминант резистентности применяли специфические олигонуклеотидные праймеры, описанные в научных источниках [7; 8] и синтезированные фирмой «Синтол» (Россия) (таблица).
Продукты амплификации анализировали путем электрофоретического разделения (рис. 1).
Vestnik of Omsk SAU, 2022, no. 4(48) VE TE RIN A R Y A ND Z OOTE C HNY
Праймеры, используемые для обнаружения детерминант антибиотикорезистентности микроорганизмов
|
№ |
Антимикробный препарат |
Ген |
Праймер |
Нуклеотидная п осл е д ов а тельнос ть праймеров |
Размер продукта (пн) |
|
1 |
Метициллин (оксациллин), цефалоспорины |
mecA |
mecAQF2 |
GGG A TC A T A GC GTCA TTA T TC C |
163 |
|
mecAQR2 |
C G A TGC C TA TC TC A T A TGC |
||||
|
2 |
Ампициллин, амоксиклав |
blaZ |
blaZ- F |
ACTTCAACACCTGC TGC TT TC |
170 |
|
blaZ-R |
TGACCACTTT TA TC A GCA AC C |
||||
|
3 |
Аминогликозиды: гентамицин тобрамицин, амикацин, канамицин канамицин |
aac(6') aph(2'') |
aac-aph-F |
T TGGGAA G A TGAAGTT T TTA GA |
160 |
|
aac-aph-R |
C C TT TA C TC CAA TAA TT T GGC T |
||||
|
ant(4')-Ia |
ant(4')-1-F |
CAAAC TGC TAAA TC GGTA G AAG C C |
294 |
||
|
ant(4')-1-R |
GG AAA GTTGA C CAG ACAT TA C G AAC T |
||||
|
аph(3')-IIIa |
aph(3')-IIIa-F |
GGC TAAAA TG A G AA T A T CA CC GG |
523 |
||
|
aph(3')-IIIa-R |
C T T TAAAAAA TCA TACA G C TC GC G |
||||
|
4 |
Фторхинолоны |
gyrA |
tnpR-F |
A TGA TT T T TGGC TA TGC T C G |
382 |
|
tnpR-R |
TA A G ACCA G AGT TA GTTCGT TC |
||||
|
grlA |
tnpA-F |
ACAAC TTCT T TCTG TA G AC CAC |
604 |
||
|
tnpA-R |
GTC T T T TA GC CAA G C G AG |
||||
|
5 |
Макролиды |
ermA |
ermAF |
TA TCT TA TC GT TGA G AA G GG A T T |
139 |
|
ermAR |
C TA CAC TTGGC TGA TGAAA |
||||
|
ermB |
ermBF |
C TA TC TGA T TG T TGAA G AA G CA TT |
141 |
||
|
ermBR |
GT T TA C TC T TGG T T TA GG A TCAAA |
||||
|
ermС |
ermCF |
AA TC GTCAA TTC C TGC A TGT |
299 |
||
|
ermCR |
TA A TC GTGGAA T A C G GG T T TG |
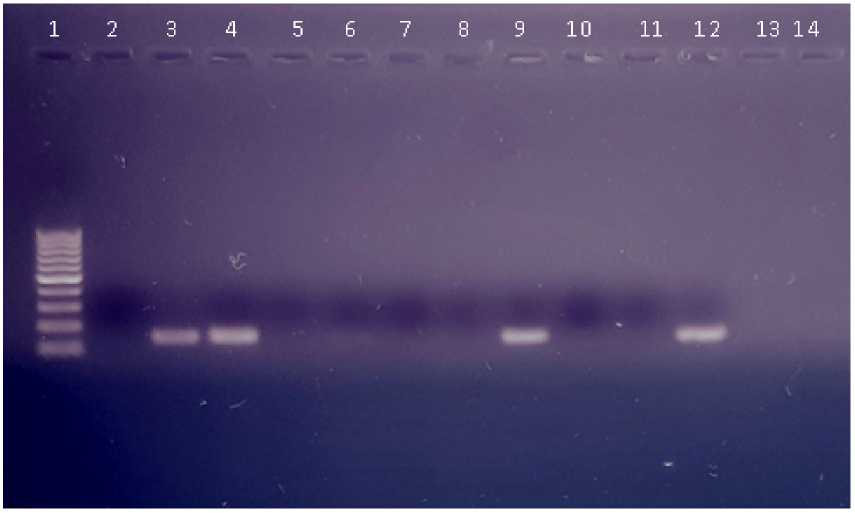
Рис. 1. Электрофореграмма ПЦР-продуктов при определении гена me c A . Дорожки: 1 – маркер молекулярной массы; 2 – от рица тельный контрол ь; 3–14 – тестируемые штаммы
Vestnik of Omsk SAU, 2022, no. 4(48)
VETERINARY AND ZOOTECHNY
Полученные результаты обработаны статистически [9]. Чтобы изучить взаимосвязь между расматриваемыми характеристиками, с помощью программы Microsoft Office Excel 2007 была определена величина коэффициента парной корреляции Пирсона анализируемых величин. Статистически значимым принимали значение коэффициента корреляции более 0,75.
Результаты исследования и обсуждение
При изучении эффективности действия антибактериальных препаратов, относящихся к разным группам по механизму действия, на стафилококки установлена абсо- лютная чувствительность данных микроорганизмов к полусинтетическим пенициллинам, коагулазоположительных штаммов (S. aureus и S. intermedius) – к аминогликозидам, S. intermedius – к цефалоспоринам и S. sciuri – к фторхинолонам и макролидам. По отношению к цефалоспоринам, фторхинолонам и аминогликозидам стафилококки разных видов характеризовались не только чувствительностью, но и умеренной рези-
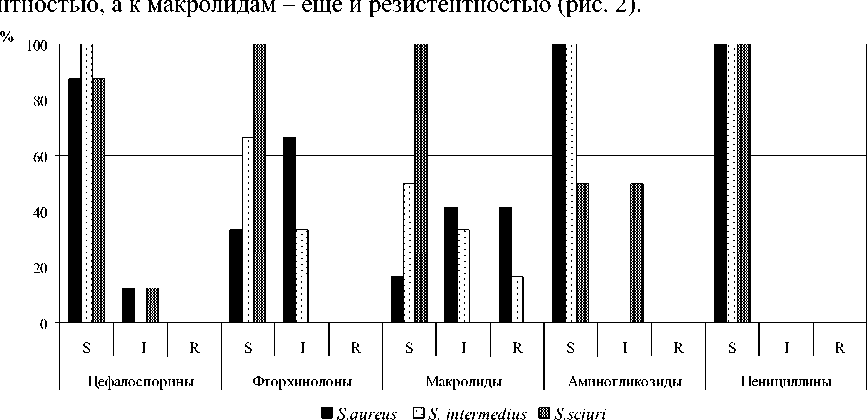
Рис. 2 . Чувствительность стафилококков к антимикробным препаратам разных групп: S – чувствительный; I – умеренно устойчивый; R – резистентный
Спектр чувствительности штаммов S. aureus к отдельным антибиотикам характеризовался следующими особенностями: все изученные культуры были чувствительны к цефазолину, цефепиму, амоксиклаву и гентамицину; умеренно резистентны к ципрофлоксацину и в 66,7 ± 13,6% случаев – к тилозину. Среди изолятов золотистых стафилококков 16,7 ± 10,8% были умеренно резистентны к цефотаксиму; процент умеренно резистентных культур к цефтриаксону и энрофлоксацину был одинаков – 33,3 ± 13,6%. Установлена выраженная резистентность штаммов S. aureus к азитромицину (83,3 ± 10,8%), умеренная резистентность к данному антибактериальному препарату определена в 16,7 ± 10,8% случаев.
Высокий процент чувствительных штаммов S. intermedius и S. sciuri отмечен к цефазолину, цефепиму, амоксиклаву – 100%. Уровень чувствительности изолятов S. intermedius к цефтриаксону, цефотаксиму, гентамицину также составлял 100%, к эн-рофлоксацину, ципрофлоксацину и тилозину – 66,7 ± 17,8%, остальные штаммы были умеренно резистентными к данным антибиотикам. Штаммы S. intermedius по отношению к азитромицину характеризовались чувствительностью, умеренной резистентностью и резистентностью (33,3 ± 17,8%). Все изоляты S. sciuri характеризовались чувст-
Vestnik of Omsk SAU, 2022, no. 4(48)
VETERINARY AND ZOOTECHNY
вительностью к энрофлоксацину, ципрофлоксацину, азитромицину и к антибиотикам, указанным выше; 50 ± 20,4% культур – к цефтриаксону и гентамицину; в 100% случаев были умерено резистентными к тилозину и цефотаксиму.
Тот факт, что имеющиеся генетические детерминанты у микроорганизмов не всегда фенотипически проявляются, дает основание изучить распространение генетических детерминант, кодирующих антибиотикоустойчивость, среди выделенных штаммов Staphylococcus sp ., и сопоставить результаты с фенотипическим профилем уроизо-лятов (рис. 3).
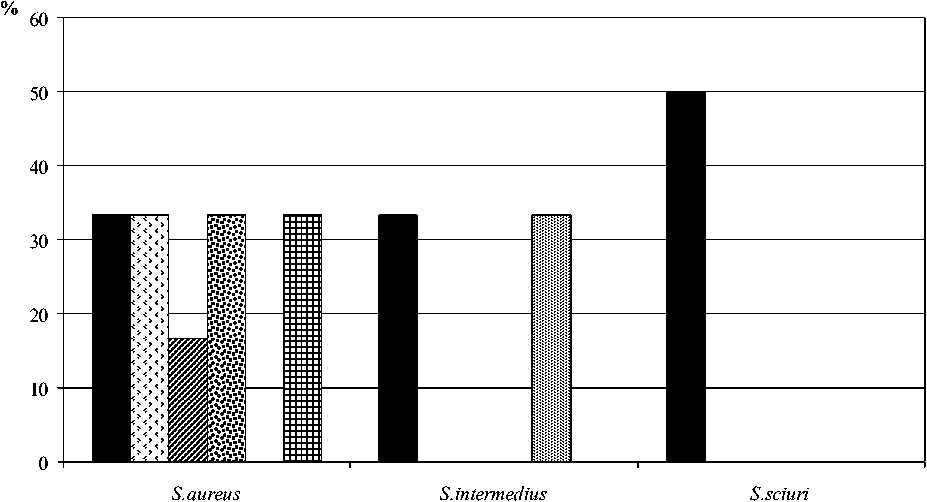
■ mecA и blaZ й aac(6')-аph (2'') и ant (4/)-Ia ЕЛ gyrA В ermC
Рис. 3. Генетическая характеристика антибиотикорезистентности выделенных стафилококков mecA – ген устойчивости к метициллину; blaZ – ген устойчивости к ампициллину;
aac(6')-аph (2'') – ген устойчивости к гентамицину; ant(4')-Ia – ген устойчивости к аминогликозидам (тобрамицину, амикацину и канамицину); gyrA , grlA – гены устойчивости к фторхинолонам;
ermA , ermC – гены устойчивости к макролидам
У всех изученных видов стафилококков регистрировали наличие гена mecA , причем у изолятов S. aureus и S. intermedius в 33,3 ± 17,8% случаев, а у штаммов S. sciuri – в 50 ± 20,4% случаев. Ген gyrA , кодирующий устойчивость к фторхинолонам, выявлен только у изолятов S. intermedius , тогда как гены blaZ , aac(6')-аph (2''), ant(4')-Ia , ermC – только у культур S. aureus . Гены аph(3')-IIIa , grlA , ermA , ermB у изученных штаммов не обнаружены.
У 2 изолятов S. aureus зафиксировано сочетание четырех генов ( mecA , blaZ , ant(4')-Ia , ermC ) и пяти генов ( mecA , blaZ , ant(4')-Ia , aac(6')-аph(2'') , ermC ).
Проведенный корреляционный анализ между исследованными признаками на уровне фено- и генотипа не выявил значимых показателей коэффициента корреляции.
Таким образом, полученные результаты показали высокую чувствительность выделенных стафилококков разных видов к ряду изученных антибиотиков: цефазолину, цефепиму, амоксиклаву. Эффективным в отношении коагулазоположительных стафи-
Vestnik of Omsk SAU, 2022, no. 4(48) VETERINARY AND ZOOTECHNY лококков оказался также гентамицин, несмотря на то, что изучение резистентности к аминогликозидам на генетическом уровне позволило обнаружить у золотистых стафилококков не только ген aac(6')-аph(2'') , но и ген ant(4')-Ia , который обуславливает устойчивость стафилококков к более широкому спектру аминогликозидных препаратов. На несоответствие между генетическими и фенотипическими паттернами устойчивости к аминогликозидам у изолятов стафилококков указывают L.X. Zhu et al. [10].
Особое значение имеет распространение стафилококков, резистентных к метициллину (или к оксациллину) [11]. Некоторые исследователи приводят данные о наличии резистентности к β-лактамным антибиотикам более чем у 50% клинических изоля-тов коагулазонегативных стафилококков [12], что может быть опосредовано экспрессией гена mecA , кодирующего пенициллинсвязывающий белок 2а (PBP2a или PBP2). Необходимо отметить, что полученные нами данные о чувствительности стафилококков, в частности S. sciuri , к амоксиклаву и ряду цефалоспоринов несколько отличались от результатов, опубликованных в некоторых зарубежных и отечественных источниках [13]. Выявленная нами абсолютная чувствительность к амоксиклаву всех изученных штаммов стафилококков, несущих гены mecA и blaZ , объясняется тем, что клаву-лановая кислота является ингибитором и обладает способностью инактивировать широкий спектр β-лактамаз, обычно обнаруживаемых у микроорганизмов, устойчивых к пенициллинам и цефалоспоринам.
Однако исследование генетических детерминант антибиотикорезистентности выявило наличие гена mecA у 33,3 ± 17,8% изолятов S. aureus и S. intermedius , а также у 50,0 ± 20,4% штаммов S. sciuri , что указывает на устойчивость бактерий ко всем β-лактамным антибиотикам (пенициллины, цефалоспорины, карбапенемы) и непредсказуемую клиническую эффективность [14].
Наряду с геном mecA , способствует приобретению и распространению устойчивости бактерий к пенициллинам ген blaZ , кодирующий β-лактамазу и зарегистрированный нами у культур S. aureus .
В настоящее время стафилококки считаются умеренно чувствительными по отношению к фторхинолонам [15]. В нашем исследовании была оценена активность эн-рофлоксацина и ципрофлоксацина и показано, что по отношению к первому проявляли умеренную резистентность 33,3 ± 17,8% S. aureus и S. intermedius , а по отношению к ципрофлоксацину – все штаммы S. aureus и 33,3 ± 17,8% изолятов S. intermedius. Полученные нами результаты и наличие гена устойчивости gyrA у изолята S. intermedius свидетельствуют о том, что фторхинолоны должны использоваться для терапии пациентов с заболеваниями мочевыделительной системы только после определения чувствительности коагулазоположительных стафилококков к антибиотикам данной группы.
Выявленную нами резистентность стафилококков разных видов к азитромицину подтверждают результаты, полученные [16; 17], которые установили продолжающуюся тенденцию повышения устойчивости к данному препарату, что говорит о необходимости контроля за его применением и постоянного мониторинга резистентности клинических штаммов.
Выводы
У выделенных стафилококков установлена резистентность к азитромицину.
Полученные данные свидетельствуют о целесообразности проведения регионального мониторинга антибиотикорезистентности.
При эмпирической терапии животных с заболеваниями мочевыделительной системы стафилококковой этиологии в качестве препаратов выбора могут использоваться цефазолин, цефепим, амоксиклав, гентамицин.
Vestnik of Omsk SAU, 2022, no. 4(48)
Список литературы Антибиотикорезистентность штаммов стафилококков, выделенных при заболеваниях мочевыделительной системы у кошек
- Белозеров Е.С., Четвериков А.В. Инфекционный компонент мочекаменной болезни // Научный медицинский вестник. 2016. № 2(4). С. 17-27.
- Kaul E. et al. Recurrence rate and long-term course of cats with feline lower urinary tract disease. Journal Feline Med. Surg. 2020;22(6):544-556. DOI 10.1177/1098612X19862887.
- Dorsch R., Teichmann-Knorrn S., Lund H.S. et al. Urinary tract infection and subclinical bacteriuria in cats: A clinical update. Journal Feline Med. Surg. 2019;21(11): 1023-1038. DOI 10.1177/1098612X19880435.
- Шкурат М.А., Покудина И.О., Батталов Д.В. Резистентность микроорганизмов к антимикробным препаратам // Живые и биокосные системы. 2014. № 10. URL: http://jbks.ru/archive/issue10/ article-1.
- Морозова Н.В., Сычева М.В., Сорокин В.И. Биопрофиль микроорганизмов, выделенных из мочи кошек при патологии мочевыделительной системы // Вестник Ульяновской государственной сельскохозяйственной академии. 2020. № 3(51). С. 142147. DOI 10.18286/1816-4501-2020-3-142-147.
- Определение чувствительности микроорганизмов к антибактериальным препаратам : методические указания. М. : Федеральный центр Госсанэпиднадзора Минздрава России, 2004. 91 с.
- Gostev V. et al. Molecular epidemiology and antibiotic resistance of methicillin-resistant Staphylococcus aureus circulating in the Russian Federation. Infection, Genetics and Evolution. 2017;53:189-194. DOI 10.1016/j.meegid.2017.06.006.
- Bahraminia F. et al. A high prevalence of ty-losin resistance among Staphylococcus aureus strains isolated from bovine mastitis. Veterinary Research Forum. 2017;8(2):121-125.
- Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. Л. : Гос. изд-во мед. лит., 1962. 180 с.
- Zhu L.X. et al. Use of a DNA microarray for simultaneous detection of antibiotic resistance genes among staphylococcal clinical isolates. Journal Clin. Microbiol. 2007;45:3514-3521. DOI 10.1128/ JCM.02340-06.
- Шаркова В.А., Лайман Е.Ф., Мазур М.Е. Генетически обусловленная патогенность и анти-биотикорезистентность штаммов Staphylococcus spp. // Тихоокеанский медицинский журнал. 2014. № 3. С. 46-49.
- Chon J.-W. et al. Virulence Characteristics of mecA-Positive Multidrug-Resistant Clinical Coagu-lase-Negative Staphylococci. Microorganisms. 2020; 8(5):659. DOI 10.3390/microorganisms8050659/.
- Becker K., Heilmann C., Peters G. Coagu-lase-negative staphylococci. Clin Microbiol Rev. 2014;27(4):870-926. DOI 10.1128/CMR.00109-13.
- Карпов И.А., Качанко У.Ф. Внебольнич-ные инфекции, обусловленные метициллинрезистентным стафилококком: подходы к антибактериальной терапии // Медицинские новости. 2006. № 10. С. 28-32.
- Яковлев В.П. Антимикробные препараты группы фторхинолонов // Consilium Medicum. 2012. Т. 14. № 4. С. 8-14. URL: https://consihum.orscien-ce.ru/2075-1753/article/view/93558.
- Хараева З.Ф. и др. Антибиотикочувстви-тельность и антилизоцимная активность штаммов Staphylococcus aureus выделенных из крови больных сепсисом // Антибиотики и химиотерапия. 2020. Т. 65. № 11-12. С. 11-15. DOI 10.37489/02352990-2020-65-11-12-11-15.
- Алиева К.Н. и др. Комбинированная терапия как путь к предотвращению антибиотикоре-зистентности бактерий: линезолид-даптомицин против Staphylococcus aureus // Антибиотики и химиотерапия. 2019. Т. 64. № 9-10. С. 8-13. DOI 10.24411/0235-2990-2019-10050.


