Антибиотикорезистентность штаммов Staphylococcus aureus, выделенных из молока высокопродуктивных коров
Автор: Артемьева О.А., Никанова Д.А., Котковская Е.Н., Гладырь Е.А., Доцев А.В., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, микробиология, паразитология
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Развитие резистентности микроорганизмов к антибиотикам во многом определяет результативность ветеринарных мероприятий. Изучение антибиотикорезистентности, мониторинг стад и правильно разработанные схемы лечения - меры, которые помогут уменьшить риск распространения патогенных и условно-патогенных микроорганизмов. Мастит высокопродуктивных коров (основной возбудитель Staphylococcus aureus ) - одно из наиболее изученных заболеваний, однако эффективность борьбы с ним в молочном животноводстве остается низкой. Целью нашей работы стало изучение развития резистентности штаммов S. aureus, выделенных из молока клинически здоровых молочных коров, на фоне применения антибиотиков разных групп. Объектом исследования были высокопродуктивные коровы черно-пестрой голштинизированной породы ( n = 1321, Калужская обл., 2016 год), предварительно двукратно вакцинированные противомаститным препаратом мастивак («Ovejero», Испания). В период лактации индивидуально от каждой коровы отбирали пробы молока. Видовую идентификацию штаммов S. aureus проводили по следующим критериям: оценка морфологии и результатов микроскопии колоний, выросших на среде Baird Parker Agar («HiMedia Laboratories Pvt., Ltd», Индия); наличие зон гемолиза на среде Azide Blood Agar Pronadisa («Conda», Испания) с добавлением 5 % дефибринированной бараньей крови; положительный результат плазмокоагуляции с использованием плазмы кроличьей цитратной сухой (ЗАО «ЭКОлаб», Россия); результаты биохимической идентификации с использованием микробиологических сред («ФБУН ГНЦ прикладной микробиологии и биотехнологии», Московская обл.) и панели API 20 STAPH («BioMerieux», Франция). В качестве референтного штамма использовали S. aureus ATCC 25923. Чувствительность выделенных микроорганизмов к десяти антибактериальным препаратам (ЗАО «Научно-исследовательский центр фармакотерапии», Россия) - пенициллину (PEN, 10 ED), оксациллину (OX, 10 мкг), гентамицину (GN, 10 мкг), эритромицину (ER, 15 мкг), линкомицину (LN, 15 мкг), рифампицину (RF, 5 мкг), ципрофлоксацину (CP, 5 мкг), ванкомицину (VA, 30 мкг), фузидину (FZ, 10 мкг), новобиоцину (NB, 5 мкг) определяли диско-диффузионным методом. Из 155 выделенных штаммов 104 (67,1 %) проявляли резистентность к одному и более антибиотикам. Наибольшее число штаммов оказались резистентными к новобиоцину (49,7 %), наименьшее - к ванкомицину (2,6 %). Следует отметить наличие антибиотикорезистентности к широко используемым в современной медицине препаратам нового поколения новобиоцину и ванкомицину. Наибольшей эффективностью из исследованных антибиотиков обладали гентамицин (81,9 %), рифампицин (86,5 %) и ванкомицин (97,4 %). Для оценки результативности антибиотикотерапии сформировали выборку коров, у которых были детектированы штаммы S. aureus ( n = 87). Животных разделили на четыре группы: I ( n = 26) - лечение гентамицином, II ( n = 22) - эритромицином, III ( n = 12) - рифампицином, IV (n = 27) - пенициллином и амоксициллином. Вылеченными считали животных, у которых при повторном исследовании не обнаружили S. aureus. Наиболее эффективной оказалась схема на основе рифампицина (излечение 91,7 %), самым низким был результат применения гентамицина (53,8 %). Выявлена тенденция к развитию полирезистентности (55,6-61,5 % полирезистентных штаммов после лечения против 33,3-43,8 % до лечения).
Высокопродуктивные молочные коровы, антибиотикорезистентность, мастит, антибиотики
Короткий адрес: https://sciup.org/142213991
IDR: 142213991 | УДК: 636.2:637.12.04/.07:579.62:[579.861.2+615.33 | DOI: 10.15389/agrobiology.2016.6.867rus
Текст научной статьи Антибиотикорезистентность штаммов Staphylococcus aureus, выделенных из молока высокопродуктивных коров
В последние годы во всем мире отмечается значительный рост устойчивости возбудителей острой и хронической форм бактериальных инфекций к антимикробным препаратам. При проведении антибиотикоте-рапии возникают две проблемы: увеличение частоты выделения резистентных штаммов микроорганизмов и недостаток антибиотиков, способных подавлять их развитие и распространение (1). С 2013 по 2015 год чувствительность микроорганизмов к фторхинолонам уменьшилась на 27 %, в группе аминогликозидов это снижение достигло 42 %, тетрациклинов — 67 % (2-4).
Исследования выполнены при поддержке Российского научного фонда, проект ¹ 15-16-00020.
Антибиотикорезистентностью — устойчивостью штамма возбудителей инфекции к действию одного или нескольких антимикробных препаратов (АМП) — во многом определяется результативность ветеринарных мероприятий. При этом только совместные действия по сдерживанию роста антибиотикорезистентности в каждой стране смогут дать положительный эффект в решении этой общей проблемы.
Выделяют несколько уровней резистентности к АМП — глобальный, региональный и локальный (5). Примером стремительной глобализации антибиотикорезистентности может служить изменение свойств у штаммов и изолятов стафилококков, пневмококков, сальмонелл, других условно-патогенных микроорганизмов, выделенных у человека и животных. Типичный представитель антибиотикорезистентных штаммов — Staphylococcus aureus , который в 42-73 % случаев становится основной причиной возникновения маститов и эндометритов у высокопродуктивных молочных коров (6, 7). Мастит — одно из наиболее изученных заболеваний, однако эффективность борьбы с ним в молочном животноводстве остается низкой (8-12). Экономические потери, связанные с маститом, складываются из снижения удоев и качества молока, потери молочной продуктивности и преждевременной выбраковки коров (до завершения генетически заложенного лактационного периода и срока продуктивного использования) (13, 14). Маститы также представляют серьезную опасность для здоровья людей в связи с возможным попаданием в молоко патогенных микроорганизмов и их токсинов (15-18).
Несоблюдение санитарно-гигиенических мероприятий, нерегулярное проведение массовых обследований животных на скрытый мастит, обусловленное значительными затратами труда и времени на диагностику, бессистемный выбор схем лечения ветеринарными препаратами провоцируют развитие локальной антибиотикорезистентности в хозяйстве (19, 20). В настоящее время для профилактики и терапии мастита у крупного рогатого скота применяются вакцины, химиотерапевтические препараты и антибиотики разных поколений (21-23).
У грамположительных бактерий, к которым принадлежит S. aureus, детоксикационная резистентность к антибиотическим препаратам менее эффективна в связи с отсутствием в клеточной стенке периплазматическо-го пространства (24). Все клетки популяции могут иметь генетическую информацию о резистентности, которая кодируется геном mecA , но только у небольшого их числа проявляется фенотип резистентности в условиях in vitro. Этот феномен обозначают как гетерорезистентность (25). Эффективность лечения клинической формы мастита зависит от иммунитета животного, продолжительности инфицирования и бактериальных генотипов возбудителя (26). Для выбора схемы лечения и мер борьбы с маститами коров важно изучить механизм антибиотикорезистентности и распространения инфекции, вызванной S. aureus (27-30) .
Одна из альтернатив применения антибиотикотерапии — использование различных препаратов природного происхождения, а также вирулентных бактериофагов (31). Перспективы применения бактериофагов для лечения и профилактики заболеваний молочной железы и органов мочеполового аппарата у коров обусловлены безопасностью применения, санирующей активностью бактериофагов, нормализацией микробного баланса организма и укреплением иммунитета в целом (32). Но пока что при лечении мастита приоритетным остается выбор за антибиотикотерапией. Для оценки ее эффективности как в отдельно взятом молочном стаде, так и на национальном уровне необходимы исследования чувствительности штаммов 868
S. aureus к антибиотикам in vitro.
Нами впервые изучен спектр антибиотикорезистентности штаммов S. aureus, ассоциированных с субклиническими формами маститов у высо-копродуктивых молочных коров.
Целью работы было изучение развития резистентности штаммов Staphylococ aureus , выделенных из молока клинически здоровых молочных коров, на фоне применения антибиотиков разных групп.
Методика. Опыты проводили в 2016 году. Объектом исследования были высокопродуктивные клинически здоровые коровы черно-пестрой голштинизированной породы ( n = 1321), которые находились на беспривязном содержании в хозяйстве Калужской области (Центральный регион России) и были предварительно 2-кратно вакцинированы противомастит-ным препаратом мастивак («Ovejero», Испания).
Пробы молока отбирали при доении индивидуально от каждого животного. Образцы молока засевали в соотношении 1:9 в Salt Meat Broth («HiMedia Laboratories Pvt., Ltd», Индия) и выдерживали в термостате при температуре 37±1 ° С в течение 18-24 ч. Затем методом штриха делали пересев на дифференциально-диагностические среды. Видовую идентификацию штаммов S. aureus проводили по следующим критериям: оценка морфологии и результатов микроскопии колоний, выросших на среде Baird Parker Agar («HiMedia Laboratories Pvt., Ltd», Индия); наличие зон гемолиза на среде Azide Blood Agar Pronadisa («Conda», Испания) с добавлением 5 % дефибринированной бараньей крови; положительный результат плаз-мокоагуляции с использованием плазмы кроличьей цитратной сухой (ЗАО «ЭКОлаб», Россия); результаты биохимической идентификации на микробиологических средах («ФБУН ГНЦ прикладной микробиологии и биотехнологии», Московская обл.) и панели API 20 STAPH («BioMerieux», Франция). После идентификации штаммы хранились в пробирках с Tryptic Soy Broth («Merck», Германия) с добавлением 30 % стерильного глицерина («Sigma», США) при температуре - 18 ° С.
Чувствительность выделенных микроорганизмов к десяти антибактериальным препаратам (ЗАО «Научно-исследовательский центр фармакотерапии», Россия) — пенициллину (PEN, 10 ED), оксациллину (OX, 10 мкг), гентамицину (GN, 10 мкг), эритромицину (ER, 15 мкг), линкомицину (LN, 15 мкг), рифампицину (RF, 5 мкг), ципрофлоксацину (CP, 5 мкг), ванкомицину (VA, 30 мкг), фузидину (FZ, 10 мкг), новобиоцину (NB, 5 мкг) определяли диско-диффузионным методом (33). Чашки с инокулированными культурами инкубировали в аэробных условиях при температуре 37±1 ° С в течение 18-24 ч. Чувствительность оценивали по диаметрам зон задержки роста (ДЗЗР) в соответствии с рекомендациями (ЗАО НИЦ фармакотерапии, г. Санкт-Петербург, Россия). При контроле качества определения чувствительности использовали штамм S. aureus ATCC 25923 (Государственная коллекция патогенных микроорганизмов и клеточных культур, Россия).
Для оценки результативности антибиотикотерапии сформировали выборку коров, в молоке которых, согласно полученным в работе данным, были детектированы S. aureus ( n = 87), распределив их по группам. В каждой группе в соответствии с разработанной схемой животным давали антибиотики одного класса из тех, к которым были чувствительны штаммы, выявленные в молоке. Вылеченными считали животных, у которых при повторном исследовании не обнаружили S. aureus .
Биометрическую обработку проводили с использованием компью- терных программ Microsoft® Office Excel 2010, SAS версия 6.12 («SAS Institute», США). На диаграммах представлены процентные соотношения резистентных штаммов S. aureus, в таблице — средние (X) и ошибка (x). Различия считали достоверными при p < 0,05.
Результаты. Исследование молока от 1321 коровы без клинических признаков патологии молочной железы показало наличие 155 (у 11,7 % от общего числа животных) гемолитических штаммов, идентифицированных как S . aureus . Из 155 исследованных штаммов 104 (67,1 %) проявляли резистентность к антибиотикам (одному и более) (табл. 1).
Наибольшее число штаммов оказались резистентными к новобио-цину (49,7 %), наименьшее — к ванкомицину (2,6 %) (рис. 1).
1. Характеристика изолятов Staphylococcus aureus ( n = 155) , выделенных из молока клинически здоровых коров черно-пестрой голштинизированной породы, по резистентности и чувствительности к антибиотикам ( X ± x , Калужская обл., 2016 год)
|
Антибиотик |
Доза |
Распределение, % |
||
|
резистентные |
умеренно резистентные |
чувствительные |
||
|
NB |
5 мкг/диск |
49,7±4,0 |
50,3±4,0 |
|
|
PEN |
10 ED/диск |
32,3±3,8 |
27,7±3,6 |
40,0±3,9 |
|
LN |
15 мкг/диск |
30,3±3,7 |
29,0±3,6 |
40,7±3,9 |
|
FZ |
10 мкг/диск |
27,1±3,6 |
40,0±3,9 |
32,9±3,8 |
|
OX |
10 мкг/диск |
25,2±3,5 |
7,1±2,1 |
67,7±3,8 |
|
GN |
10 мкг/диск |
18,1±3,1 |
81,9±3,1 |
|
|
ER |
15 мкг/диск |
14,2±2,8 |
43,9±4,0 |
41,9±4,0 |
|
CP |
5 мкг/диск |
11,6±2,6 |
34,2±3,8 |
54,2±4,0 |
|
RF |
5 мкг/диск |
8,4±2,2 |
5,1±1,8 |
86,5±2,7 |
|
VA |
30 мкг/диск |
2,6±1,3 |
97,4±1,3 |
|
П р и м еч а ни е. NB — новобиоцин, PEN — пенициллин, LN — линкомицин, FZ — фузидин, OX — оксациллин, GN — гентамицин, ER — эритромицин, CP — ципрофлоксацин, RF — рифампицин, VA — ванкомицин. Прочерки означают отсутствие умеренно резистентных штаммов.
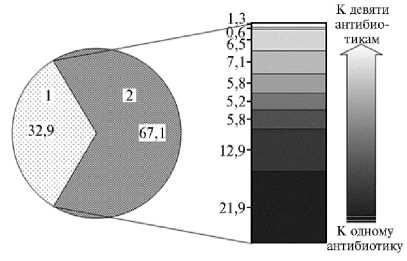
Рис. 1. Распределение изолятов Staphylococcus aureus ( n = 155) , выделенных из молока клинически здоровых коров черно-пестрой голштинизирован-ной породы, по резистентности к антибиотикам. Слева (круговая диаграмма) показано распределение (%) чувствительных (1) и устойчивых хотя бы к одному из исследованных антибиотиков (2) штаммов S. aureus ; диаграмма справа иллюстрирует распределение (%) штаммов по резистентности к разному числу антибиотиков в порядке его увеличения (снизу вверх) (Калужская обл., 2016 год).
Следует особо отметить наличие антибиотикорезистентности к широко используемым в современной медицине препаратам нового поколения новобиоцину и ванкомицину. Максимальной эффективностью из исследованных антибиотиков обладали гентамицин (81,9 %), рифампицин (86,5 %) и ванкомицин (97,4 %).
Детальный анализ антиби-отикорезистентности выделенных штаммов (см. рис. 1) показал, что 45,2 % были устойчивы к двум и более препаратам. Обращает на себя внимание относительно высокая доля штаммов (21,3 % от общего числа изученных), которые были резистентны к пяти и более антибиотикам.
При оценке результатив- ности антибиотикотерапии были сформированы 4 группы коров (n = 87), лечение которых осуществляли антибиотиками разных классов: аминогликозидами (I группа, n = 26, гентамицин), макролидами (II группа, n = 22, эритромицин), ансамицинами (III группа, n = 12, рифампицин), пеницил- линами (IV группа, n = 27, амоксициллин и пенициллин). Наиболее эффективным оказалось применение рифампицина (91,7 % вылеченных животных), наименее эффективным был гентамицин (53,8 %) (табл. 2).
2. Сравнительная эффективность схем применения антибиотиков разных групп при лечении коров черно-пестрой голштинизированной породы, в молоке которых обнаружены штаммы Staphylococcus aureus (Калужская обл., 2016 год)
|
Показатель |
Группа антибиотиков |
|||
|
миногликозид |
макролиды |
ансамицины |
пенициллины |
|
|
Группа коров I II III IV Число коров, n 26 22 12 27 Антибиотик Гентамицин Эритромицин Рифампицин Амоксициллин Пенициллин Доза 3 мг/кг массы 20 мл/гол. 0,2 мл/кг массы 0,1 мл/кг масс 1 мл/25 кг массы Кратность 3 раза (через 3 раза (через 4 раза (дважды 2 раза (через 2 раза (через применения 24 ч) 24 ч) в сутки, через 24 ч) 48 ч) 24 ч) Вылечено коров, % 53,9±9,8a 59,1±10,5b 91,7±8,0a, b, c, d 63,0±9,3c 53,9±9,6d П р и м е ч а н и е. Различия между группами, отмеченными одинаковыми буквами, достоверны: для a, d — при p < 0,01, для b, c — при p < 0,05. |
||||
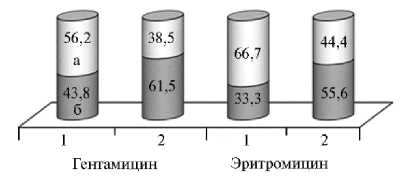
Рис. 2. Доля (%) резистентных и умеренно резистентных (а) и чувствительных (б) к гентамицину и эритромицину штаммов Staphylococcus aureus в молоке коров черно-пестрой голштинизированной породы при применении антибиотикотерапии: 1 — до лечения, 2 — после лечения (Калужская обл., 2016 год). Схему лечения см. в таблице 2.
С целью выявления возможных причин отрицательного эффекта антибиотикотерапии из молока коров I и II групп после лечения были получены изоляты и исследованы на резистентность к антибиотикам. У таких вновь выделенных штаммов S. aureus мы обнаружили тенденцию к развитию полирезистентности (рис. 2), но изменения устойчивости к действующему веществу того препарата, который применяли в схеме лечения, не наблюдали. После ле- чения эритромицином общая резистентность увеличилась на 22,3 %, после применения гентамицина — на 17,7 % (см. рис. 2).
За последние годы предприняты попытки создания новых комплексных противомикробных препаратов для лечения клинических и субклинических форм мастита у крупного рогатого скота в различные перио- ды лактации. Получены российские патенты на изобретения, подтверждающие положительные результаты лечения. Однако немногие авторы изучали процессы развития антибиотикорезистентности возбудителей после проведения терапевтических мероприятий и оценивали возникновение устойчивости к группам антибиотиков (34, 35). Решение этой задачи должно стать неотъемлемой частью разработки эффективных программ борьбы с развитием маститов у высокопродуктивных молочных коров.
Таким образом, исследования изолятов Staphylococcus aureus, выде- ленных из молока клинически здоровых коров, показали относительно высокую долю штаммов, характеризующихся резистентностью к одному и более антибиотикам. На фоне применения антимикробных препаратов для лечения субклинических маститов у S. aureus развивалась полирезистентность. Для повышения эффективности мероприятий по лечению маститов у высокопродуктивных молочных коров необходимо проводить планомерный мониторинг антибиотикорезистентности персистирующих в стадах штаммов S. aureus для предотвращения их распространения с локального (хозяйство) на региональный уровень.
Л И Т Е Р А Т У Р А
ФГБНУ Всероссийский НИИ животноводства
Поступила в редакцию 9 сентября 2016 года
им. академика Л.К. Эрнста,
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2016, V. 51, ¹ 6, pp. 867-874
ANTIBIOTIC-RESISTANCE PROFILE OF Staphylococcus aureus STRAINS ISOLATED FROM MILK OF HIGH YIELD COWS IN CENTRAL RUSSIA
O.A. Artem’eva, D.A. Nikanova, E.N. Kotkovskaya, E.A. Gladyr’, A.V. Dotsev, N.A. Zinovieva
Acknowledgements:
Supported by Russian Science Foundation (project ¹ 15-16-00020)
Научные собрания
26th INTERNATIONAL CONFERENCE OF THE WORLD ASSOCIATION FOR THE ADVANCEMENT OF VETERINARY PARASITOLOGY (WAAVP 2017)
(4-8 September 2017, Kuala Lumpur, Malaysia)
Organization: Malaysian Society of Parasitology & Tropical Medicine (MSPTM) and Department of Veterinary Services (DVS)
Disciplines: Life Science, Health Science
The World Association for the Advancement of Veterinary Parasitology (WAAVP) is the largest international veterinary parasitology organization in the world, which is affiliated with the World Veterinary Association, cooperates with various national, international and affiliated organizations, such as WHO and FAO, in all matters concerning veterinary parasitology. WAAVP conferences are held bi-annually in various major cities around the world for the past 52 years.
The Conference theme is: Combating Zoonoses: Strength in East–West Partnerships.
The Conference provides an opportunity for scientists who study the parasites of animals, encompassing helminthology, protozoology and entomology to meet with each other to discuss the matters of common interest and benefit from a comprehensive and ambitious scientific programme designed by the organising committee, which will include presentations by a range of knowledgeable speakers from within and beyond the region.
The Conference will also provide maximum opportunity for discussion, networking and informal engagement to promote exchange of information and material amongst researchers, veterinary practitioners and animal health investigators. It is intended that a number of priority recommendations and strategies will emerge and that these will be endorsed by the Conference for intended action by individual member states.
Contacts:
Information:
Список литературы Антибиотикорезистентность штаммов Staphylococcus aureus, выделенных из молока высокопродуктивных коров
- Tanzin T., Nazir K.H.M.N.H., Zahan M.N., Parvej M.S., Zesmin K., Rahman M.T. Antibiotic resistance profile of bacteria isolated from raw milk samples of cattle and buffaloes. Journal of Advanced Veterinary and Animal Research, 2016, 3(1): 62-67 ( ) DOI: 10.5455/javar.2016.c133
- Щепёткина С.В. Решение проблемы антибиотикорезистентности в условиях производства. Сельскохозяйственные вести, 2016, 2: 55-57.
- Thaker H.C., Brahmbhatt M.N., Nayak J.B. Isolation and identification of Staphylococcus aureus from milk and milk products and their drug resistance patterns in Anand, Gujarat. Veterinary World, 2013, 6(1): 10-13 ( ) DOI: 10.5455/vetworld.2013.10-13
- Anueyiagu K.N., Isiyaku A.W. Isolation, identification of Staphylococcus aureus from bovine milk and its antibiotics susceptibility. International Journal of Livestock Production, 2015, 6(6): 74-77 ( ) DOI: 10.5897/IJLP2015.0248
- Лысенко В.А., Орлова Е.В., Литвинова Т.И., Бабич М.В. Практическое значение исследования антибиотикорезистентности. Бюллетень физиологии и патологии дыхания, 2004, 18: 17-20.
- Talukder A.A., Rahman H.H., Jamil Mahmud S.M., Alam F., Dey S.K. Isolation, identification and resistance pattern of microorganisms associated with mastitis in Buffalo. J. Microbiol., 2013, 30(1-2): 1-5.
- Sayed R.H., Salama S.S., Soliman R.T. Bacteriological evaluation of present situation of mastitis in dairy cows. Global Veterinaria, 2014, 13(5): 690-695.
- Hussain R., Javed M.T., Khan A., Muhammad G. Risks factors associated with subclinical mastitis in water buffaloes in Pakistan. Trop. Anim. Health Prod., 2013, 45: 1723-1729 ( ) DOI: 10.1007/s11250-013-0421-4
- Srinivasan P., Jagadeswaran D., Manoharan R., Giri T., Balasubramaniam G.A., Balachandran P. Prevalence and etiology of subclinical mastitis among buffaloes in Namakkal, India. Pakistan J. Biol. Sci., 2013, 16: 1776-1780.
- Крюков Н.И. От профилактики болезней молочной железы у коров к благополучию по воспроизводству стада. Эффективное животноводство, 2016, 2(123): 22-24.
- Модин А.Н., Климов Н.Т., Ефанова Л.И. Профилактика мастита у коров в сухостойный период. Зоотехния, 2010, 10: 27-28.
- Abeer A.M., Zakia A.M., Muna E.A., Sabiel1 Y.A. Bacteriological and pathological studies of mammary glands affections in сamels (Camelus dromedarius) at Tumbool Abattoir, Sudan. British Microbiology Research Journal, 2016, 15(5): 1-8 ( ) DOI: 10.9734/BMRJ/2016/25966
- Ashfaq M., Razzaq A., Shamsheer-ul-Haq, Muhammad G. Economic analysis of dairy animal diseases in Punjab: a case study of Faisalabad district. J. Anim. Plant Sci., 2015, 25(5): 1482-1495.
- Singh D., Kumar S., Singh B., Bardhan D. Economic losses due to important diseases of bovines in central India. Veterinary World, 2014, 7(8): 579-585 ( ) DOI: 10.14202/vetworld.2014.579-585
- Rola J.G., Czubkowska A., Korpysa-Dzirba W., Osek J. Occurrence of Staphylococcus aureus on farms with small scale production of raw milk cheeses in Poland. Toxins, 2016, 8(3): 62 ( ) DOI: 10.3390/toxins8030062
- Hennekinne J.A., de Buyser M.L., Dragacci S. Staphylococcus aureus and its food poisoning toxins: characterization and outbreak investigation. FEMS Microbiol. Rev., 2012, 36: 815-836 ( ) DOI: 10.1111/j.1574-6976.2011.00311.x
- Rola J.G., Korpysa-Dzirba W., Osek J. Prevalence of Staphylococcus aureus and staphylococcal enterotoxins at different stages of production of raw milk cheeses -preliminary results. Bulletin of the Veterinary Institute in Pulawy, 2013, 57: 341-345 ( ) DOI: 10.2478/bvip-2013-0059
- Bianchi D.M., Gallina S., Bellio A., Chiesa F., Civera T., Decastelli L. Enterotoxin gene profiles of Staphylococcus aureus isolated from milk and dairy products in Italy. Lett. Appl. Microbiol, 2014, 58: 190-196 ( ) DOI: 10.1111/lam.12182
- Tassew A., Negash M., Demeke A., Feleke A., Tesfaye B., Sisay T. Isolation, identification and drug resistance patterns of methicillin resistant Staphylococcus aureus from mastitis cow's milk from selected dairy farms in and around Kombolcha, Ethiopia. J. Vet. Med. Anim. Health, 2016, 8(1): 1-10 ( ) DOI: 10.5897/JVMAH2015.0422
- Hezil N., Baazize-Ammi D., Kebbal S., Saadaoui R., Brahim E.M., Guetarni D. Principal germs causing clinical mastitis in dairy cattle farms in governorate of Blida (Algeria). Journal of Animal Science Advances, 2013, 3(1): 19-26
- Sankar P. New therapeutic strategies to control and treatment of bovine mastitis. Vet. Med. Open J., 2016, 1(2): e7-e8 ( ) DOI: 10.17140/VMOJ-1-e004
- Gomes F., Henriques M. Control of bovine mastitis: old and recent therapeutic approaches. Curr. Microbiol., 2016, 72: 377-382 ( ) DOI: 10.1007/s00284-015-0958-8
- Sun H., Xue F., Qian K., Zhang X., Yin Z. Intramammary expression and therapeutic effect of a human lysozyme-expressing vector for treating bovine mastitis. J. Zhejiang Univ. -Sci. B, 2006, 7: 324-330 ( ) DOI: 10.1631/jzus.2006.B0324
- Supotnitskiy М.V. Mechanisms of antibiotics resistance in bacteria. Biopreparats (Biopharmaceuticals), 2011, 2: 4-11.
- Al-Ashmony A.L., Al-Sawy A.A.F., Torky H.A. Genotypic molecular detection of certain genes encoding virulence determinates and atibiotic resistance in Staphylococcus aureus isolates from mastitis cows. Alexandria Journal of Veterinary Sciences (AJVS), 2016, 49(2): 90-98 ( ) DOI: 10.5455/ajvs.230403
- Maram A., Mamu G., Birhanu T. Prevalence and antibiotic resistance of Staphylococcus aureus mastitis in Holeta area, Western Ethiopia. Global Veterinaria, 2016, 16(4): 365-370.
- Villanueva San Martin M., Jousselin A., Baek K.T., Prados J., Andrey D.O., Renzoni A., Ingmer H., Frees D. Rifampicin resistance rpoB alleles or multicopy thioredoxin/thioredoxin reductase suppresses the lethality of disruption of the global stress regulator spx in Staphylococcus aureus. J. Bacteriol., 2016, 198(19): 2719-2731 ( ) DOI: 10.1128/JB.00261-16
- Jousselin A., Manzano C.S., Biette A., Reed P., Pinho M.G., Rosato A.E., Kelley W.L., Renzoni A.M. The Staphylococcus aureus chaperone prsA is a new auxiliary factor of oxacillin resistance affecting penicillin-binding protein 2A. Antimicrob. Agents Chemother., 2016, 60(3): 1656-1666 ( ) DOI: 10.1128/AAC.02333-15
- Artem'eva O.A., Pereselkova D.A., Fomichev Yu.P. Dihydroquercetin, the bioactive substance, to be used against pathogenic microorganisms as an alternative to antibiotics. Agricultural Biology, 2015, 50(4): 513-519 ( ) DOI: 10.15389/agrobiology.2015.4.513eng
- Artem'eva O.A., Pereselkova D.A., Vinogradova I.V., Kotkovskaya E.N., Gladyr'E.A., Sivkin N.V., Zinovieva N.A. Screening of dairy cows' herd for presence in milk of hemolytic microorganisms in relation to somatic cell content. Agricultural Biology, 2015, 50(6): 810-816 ( ) DOI: 10.15389/agrobiology.2015.6.810eng
- Mašlaňová I., Doška J., Varga M., Kuntová L., Mužík J., Malúšková D., Růžičková V., Pantůček R. Bacteriophages of Staphylococcus aureus efficiently package various bacterial genes and mobile genetic elements including SCCmec with different frequencies. Environ. Microbiol. Reports, 2013, 5: 66-73 ( ) DOI: 10.1111/j.1758-2229.2012.00378.x
- Verstappen K.M., Tulinski P., Duim B., Fluit A.C., Carney J., van Nes A. The effectiveness of bacteriophages against methicillin-resistant staphylococcus aureus ST398 nasal colonization in pigs. PLoS ONE, 2016, 11(8): e0160242 ( ) DOI: 10.1371/journal.pone.0160242
- Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. МУК 4.2.1890-04 (утв. Главным государственным санитарным врачом РФ 04.03.2004). Режим доступа: http://docs.cntd.ru/document/1200038583. Без даты.
- Комаров В.Ю., Белкин Б.Л. Заболеваемость коров маститом и применение нового эффективного препарата для лечения его субклинической формы. Вестник Орловского ГАУ, 2015, 3(53): 100-102.
- Комаров В.Ю., Белкин Б.Л. Использование нового препарата «Адимаст» для одномоментного запуска коров в сухостойный период и профилактики мастита. Вестник Алтайского государственного аграрного университета, 2015, 5(127): 107-110.


