Антифунгальная активность против патогенов зерновых культур и изучение антибиотика штамма Streptomyces sp. К-541, выделенного из экстремальных экосистем Казахстана
Автор: Треножникова Л.П., Балгимбаева А.С., Ултанбекова Г.Д., Галимбаева Р.Ш.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агробиология зерновых культур
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
Необходимое свойство биопрепаратов - сохранение биологической активности в изменяющихся природных условиях, в почвах разного физико-химического состава, с разной степенью плодородия и значениями рН. Актиномицеты из экстремальных мест обитания способны вырабатывать биологически активные вещества не только в нейтральных условиях, но также в соленой, щелочной и кислой среде, чем определяется их значимость в составе биопрепаратов, разрабатываемых для растениеводства. Нашей целью было исследование антагонистических свойств штамма Streptomyces sp. К-541, выделенного из экстремальных экосистем в Казахстане, против грибных патогенов зерновых культур в разных экологических условиях и групповая идентификация полученного антибиотика. Штамм К-541 выращивали в нейтральных и альтернативных условиях (25,0 г/л NaCl, рН 7,2; 2,5 г/л Na2CO3, рН 8,0). Антифунгальные свойства определяли методом агаровых блоков в отношении возбудителей основных грибных заболеваний пшеницы и риса: фузариоза - Fusarium solani (Mart.) Sacc., F. oxysporum Schlecht., F. heterosporum Nees, F. sporotrichiella Sherb., пирикуляриоза - Piricularia oryzae Cavara, альтернариоза - Alternaria triticina Prasada & Prabhu, A. alternate (Fr.) Keissl., биполяриоза - Bipolaris sorokiniana (Sacc.) Shoemaker, аспергиллеза - Aspergillus niger van Tieghem. После культивирования штамма К-541 на трех вариантах глюкозо-дрожжевого агара вырезали блоки растущей культуры буром (диаметр 7 мм), переносили их на чашки Петри, предварительно засеянные тест-культурами фитопатогенных грибов, и культивировали при 25 °С. Об антагонистической активности судили по диаметру зоны лизиса грибных тест-культур, которую измеряли через 72 ч культивирования. Антифунгальные свойства штамма при совместном культивировании с фитопатогенными грибами исследовали на агаре Чапека-Докса (рН 7,0) при внесении 2,0 % NaCl (рН 7,0) и 0,2 % Na2CO3 (рН 8,0). Результаты учитывали на 10-е сут культивирования при 25 °С, измеряя диаметр колоний фитопатогенных грибов. Биосинтез антибиотика А-541 осуществляли на круговой качалке (180-200 об/мин) при температуре 28 °С в течение 120 ч. Антибиотик извлекали экстракцией органическими растворителями и изучали с использованием тонкослойной хроматографии и спектрофотометрии. Проведенные исследования показали, что штамм К-541 может быть перспективным агентом для биоконтроля грибных инфекций у зерновых культур, так как обладает высокой антифунгальной активностью. В отношении грибов рода Fusarium она проявлялась формированием зоны лизиса диаметром 30-45 мм в нейтральных условиях, 40-48 мм - при засолении, 20-33 мм в щелочных условиях; в отношении грибов рода Alternaria - соответственно 32-35, 36-37, 20-22 мм; рода Bipolaris - 36-38, 38-40, 30 мм; рода Piricularia - 40, 56, 50 мм. Показана возможность использования штамма для интродукции в почвенные биоценозы с целью биоконтроля грибных патогенов зерновых культур. При совместном культивировании штамма К-541 и фитопатогенных грибов диаметр колоний грибов уменьшался в 1,8-2,7 раза. Высокая степень ингибирования роста фитопатогенных грибов наблюдалась также в условиях засоления и в щелочной среде. Антибиотик, образуемый штаммом К-541, отнесен к группе полиенов, подгруппе гексаенов. Таким образом, штамм К-541 признан перспективным для разработки нового биопрепарата с фунгицидным действием в отношении возбудителей грибных инфекций зерновых культур в разных экологических условиях.
Экстремофильный стрептомицет, антибиотик, антифунгальная активность, фитопатогенные грибы, фузариоз, пирикуляриоз, альтернариоз, биполяриоз, аспергиллез, зерновые культуры
Короткий адрес: https://sciup.org/142214126
IDR: 142214126 | DOI: 10.15389/agrobiology.2018.1.96rus
Текст научной статьи Антифунгальная активность против патогенов зерновых культур и изучение антибиотика штамма Streptomyces sp. К-541, выделенного из экстремальных экосистем Казахстана
В последнее время резко возросло распространение токсиногенных грибов — возбудителей болезней зерновых культур. Грибы, вызывающие фузариозы, пирикуляриозы, альтернариозы и аспергиллезы, приводят к потере более 40 % урожая зерновых (1). Поражая растения, микромицеты наносят значительный экономический ущерб сельскому хозяйству и оказывают вредное воздействие на окружающую среду. Вместе с тем широкое использование химических средств для защиты растений от грибных заболеваний представляет особую опасность, причем негативное влияние фунгицидов со временем возрастает. Ситуация ухудшается из-за развития устойчивости грибов к фунгицидам с последующей необходимостью увеличения дозы применения препаратов. В системах интегрированной защиты растений особое место занимают биометоды, в частности использование микроорганизмов и их вторичных метаболитов для создания эффективных, экологически безопасных фунгицидов с разными механизмами действия, а также для повышения устойчивости растений к абиотическим стрессам. При этом актуально выявление новых микроорганизмов, образующих соединения с широким спектром биологической активности, для поиска которых представляют интерес различные экосистемы, включая малоизученные экстремальные (2-4).
Актиномицеты — продуценты вторичных метаболитов с антибактериальными, антифунгальными, инсектицидными и другими свойствами (57). Они служат важным компонентом микробоценозов, а их количественный и качественный состав признан фактором, характеризующим экологическое состояние природных экосистем (8). Многие виды актиномицетов, в том числе принадлежащие к роду Streptomyces , известны как антимикотические агенты, которые ингибируют патогенные грибы (9-11). Способность акти-номицетов колонизировать поверхность корней растений, осуществлять биосинтез антибиотиков и внеклеточных ферментов обеспечивает их высокую эффективность в качестве инструментов биоконтроля в системе защиты растений от заболеваний (12-14).
Зерновое хозяйство — основная отрасль растениеводства Казахстана, при этом на засоленные земли в республике приходится 15,2 % от всей площади сельскохозяйственных угодий. Остальные почвы также в разной степени засолены, неоднородны по составу и характеризуются низким содержанием гумуса (15). Разработка биопрепаратов для применения в таких сложных условиях должна основываться на использовании микроорганизмов, сохраняющих биологическую активность в разных экологических нишах. Засоления почвы и рН мешают проявлению защитного и стимулирующего действия микроорганизмов. Актиномицеты, выделенные из экстремальных мест обитания, могут расти и вырабатывать биологически активные вещества при засолении, в щелочной и кислой среде (16, 17). Несмотря на обилие информации о биологических свойствах актиномицетов, их способность регулировать рост патогенных микроорганизмов, в том числе фитопатогенных грибов, в условиях сильной засоленности, высоких и низких значений рН мало изучена (18, 19).
В настоящей работе мы впервые использовали биотехнологический потенциал экстремофильных актиномицетов для разработки антифунгаль-ного биопрепарата с универсальным действием.
Нашей целью было изучение антагонистических свойств штамма Streptomyces sp. К-541 в отношении грибов — возбудителей болезней зерновых культур в разных экологических условиях и групповая идентификация полученного антибиотика.
Методика. Объектом исследований был штамм Streptomyces sp. К541, выделенный в экстремальной экосистеме (соровый солончак, Костанайская обл., Республика Казахстан). Штамм выращивали на трех вариантах глюкозо-дрожжевого агара. Состав питательных сред (г/л) был следу- ющим: среда 1 — глюкоза (2,0), дрожжевой экстракт (1,0), пептон (2,0), агар (20,0), рН 7,2; среда 2 — глюкоза (2,0), дрожжевой экстракт (1,0), пептон (2,0), NaCl (25,0), агар (20,0), рН 7,2; среда 3 — глюкоза (2,0), дрожжевой экстракт (1,0), пептон (2,0), Na2CO3 (2,5), агар (20,0), рН 8,0. Значение рН изменяли 0,1 н. раствора NaOH, используя рН-метр MP220 («Mettler-Toledo International, Inc.», США).
Штамм К-541 рассевали на три варианта агара и культивировали 7 сут при температуре 28 ° C. Антифунгальные свойства определяли методом агаровых блоков (20). Антифунгальную активность штамма, выросшего на нейтральной, засоленной и щелочной среде, оценивали в отношении представителей пяти родов фитопатогенных грибов, которые служат возбудителями основных грибных заболеваний пшеницы и риса: фузариоза — Fusarium solani (Mart.) Sacc., F. oxysporum Schlecht., F . heterosporum Nees, F. sporotrichiella Sherb., пирикуляриоза — Piricularia oryzae Cavara, альтер-нариоза — Alternaria triticina Prasada & Prabhu, A. alternate (Fr.) Keissl., бипо-ляриоза — Bipolaris sorokiniana (Sacc.) Shoemaker, аспергиллеза — Aspergillus niger van Tieghem. В расплавленную и остуженную до 40-50 ° С среду Чапека-Докса вносили суспензию конидий фитопатогеных грибов (108 КОЕ/мл) из расчета 1 мл на 100 мл среды и разливали в чашки Петри. После культивирования штамма К-541 на трех вариантах глюкозо-дрожжевого агара вырезали блоки растущей культуры буром (диаметр 7 мм), переносили их на чашки Петри, предварительно засеянные тест-культу-рами фитопато-генных грибов, и оставляли на 72 ч при температуре 25 ° С. Контролем служили блоки, вырезанные из чистых агаровых сред. Об антагонистической активности судили по диаметру зоны лизиса тест-культур, которую измеряли с точностью до 1 мм.
Антифунгальные свойства штамма при совместном культивировании с фитопатогенными грибами исследовали на агаре Чапека-Докса (среда А, рН 7,0), при внесении в агар 2,0 % NaCl (среда Б, рН 7,0) и 0,2 % Na2CO3 (среда С, рН 8,0). В контрольном варианте фитопатогенные грибы выращивали на агаровых средах индивидуально. Результаты учитывали на 10-е сут культивирования при 25 ° С, измеряя диаметр колоний фитопатогенных грибов в контрольном и опытном вариантах.
Для накопления спорового материала штамм К-541 выращивали в течение 7 сут при температуре 28 ° С на минеральном агаре 1 Гаузе. Готовили инокулюм спор смывом с поверхности растущей культуры (109 КОЕ/мл) и засевали в жидкую питательную среду с овсяной мукой (1 мл инокулюма на 100 мл питательной среды). Состав среды с овсяной мукой (г/л) был следующим: глюкоза (15,0), овсяная мука (15,0), CaCO3 (2,5), NaCl (5,0), pH 7,0-7,2.
При получении антибиотика штамм К-541 культивировали в колбах Эрленмейера (750 мл) в овсяной среде (объем 100 мл) на круговой качалке (180-200 об/мин) в течение 120 ч при температуре 28 ° С. Биомассу, отжатую до 70 % влажности, взвешивали и экстрагировали 96 % этанолом (из расчета 3 мл этанола на 1 г биомассы). Экстракцию антибиотика А-541 проводили с использованием механической мешалки с верхним приводом RW 20 digital («IKA», Германия) в течение 2 ч при комнатной температуре в вытяжном шкафу, затем в течение 3 ч в холодильнике. Экстракт концентрировали в вакууме на ротационном испарителе RV 10 basic («IKA», Германия) при 35-40 ° С. Из культуральной жидкости антибиотик извлекали экстракцией н-бутанолом (рН 7,0). Экстракт отделяли на делительной воронке, упаривали в вакууме и реэкстрагировали этиловым спиртом.
Этанольные препараты, полученные из культуральной жидкости и биомассы штамма К-541, хроматографировали на пластинах Silufol марок R и UV 254 («Cavalier», Чехия), Sorbfil («Сорбполимер», Россия) и DC-Alu-folien Kieselgel 60 («Merck», США). При выборе оптимальных условий хроматографирования использовали системы растворителей хлороформ—эта-нол (20:1, 20:7), н-бутанол—уксусная кислота—вода (2:1:1, 3:1:1), хлоро-форм—этилацетат (1:1), этанол—бутанол—вода (4:1:1).
Антибиотик обнаруживали на хроматограммах визуально по свечению в УФ-свете (облучатель УФС-254/365, «ЗАО НПО Техноком», Россия) и биоавтографическим методом с использованием в качестве тест-организма Fusarium oxysporum . Зоны, соответствующие положению отдельных компонентов на хроматограмме, вырезали и накладывали на поверхность агара, засеянного тест-организмом. Для накопления компонентов активные зоны с пластинок снимали вместе с основой, элюировали этанолом, фильтровали, экстракт выпаривали до сухого остатка. Спектры поглощения антибиотика в суммарном препарате и его индивидуальных фракциях в УФ и видимой областях измеряли в 96 % этаноле на спектрофотометре Cary 60 UV-Vis («Agilent Technologies», США).
Статистическую обработку результатов проводили согласно описанию В.Ю. Урбах (21). В таблицах приведены средние значения (M ) и стандартные ошибки средних (±SEM).
Результаты. Штамм Streptomyces sp. К-541 проявил высокое фунгицидное действие против всех изученных фитопатогенных грибов (табл. 1). Его антибиотическая активность в отношении грибов рода Fusarium составляла 30-45 мм в нейтральных условиях, 40-48 мм — при засолении, 20-33 мм в щелочных условиях; в отношении грибов рода Alternaria — соответственно 32-35, 36-37, 20-22 мм; рода Bipolaris — 36-38, 38-40, 30 мм; рода Piricularia — 40, 56, 50 мм. Следует отметить, что стрептомицеты широко распространены в почвах разных типов, и для кислых почв также описаны виды, способные подавлять развитие фитопатогенных грибов при низких значениях рН (22, 23).
1. Антифунгальные свойства штамма Streptomyces sp. К-541 в отношении возбудителей основных грибных заболеваний пшеницы и риса в зависимости от условий культивирования ( M ±SEM)
|
Вид гриба |
Диаметр зоны подавления роста, мм |
||
|
среда 1 |
среда 2 1 |
среда 3 |
|
|
Fusarium oxysporum |
31±0,3 |
42±0,2 |
20±0,2 |
|
F. heterosporum |
40±0,3 |
45±0,1 |
28±0,4 |
|
F. solani |
45±0,2 |
48±0,4 |
33±0,2 |
|
F. sporotrichiella |
40±0,1 |
45±0,1 |
32±0,3 |
|
Aspergillus niger |
46±0,3 |
50±0,3 |
30±0,4 |
|
Piricularia oryzae |
40±0,5 |
56±0,1 |
50±0,6 |
|
Alternaria alternata |
32±0,3 |
36±0,4 |
20±0,1 |
|
A. triticina |
35±0,3 |
37±0,2 |
22±0,3 |
|
Bipolaris sorokiniana |
38±0,1 |
40±0,5 |
30±0,6 |
|
Контроль (без тест-культуры) |
0 |
0 |
0 |
П р и м е ч а н и е. Состав использованных для культивирования вариантов глюкозо-дрожжевого агара (среды 1-3) см. в разделе «Методика».
Для выявления возможности интродукции в почвенные биоценозы экстремофильного стрептомицета К-541 как агента биоконтроля грибных инфекций было проведено совместное культивирование этого штамма и фитопатогенных грибов на агаровой среде Чапека-Докса (табл. 2, рис.). При таком культивировании наблюдалось значительное ингибирование роста грибов: диаметр колоний Fusarium oxysporum уменьшался в 2,2-2,1 раза, Piricularia oryzae — в 1,8-2,7 раза, Alternaria alternata — в 2,2-2,4 раза, Bipolaris sorokiniana — в 2,0-2,2 раза, Aspergillus niger — 2,4-2,5 раза. Пока-99
зана высокая степень ингибирования роста фитопатогенных грибов не только на исходной среде, но также в условиях засоления (2,0 % NaCl, среда Б) и при щелочном значении pH (0,2 % Na2CO3, среда С).
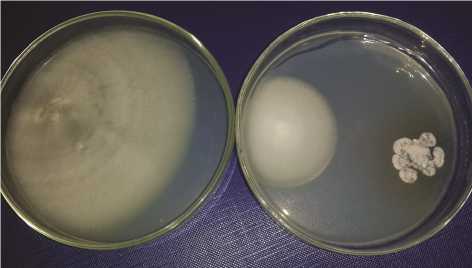
2. Антифунгальное действие штамма Streptomyces sp. К-541 на фитопатогенные грибы — возбудители заболеваний пшеницы и риса при совместном культивировании ( M ±SEM)
|
Вид гриба Вариант |
Диаметр колоний, мм среда А среда Б среда С |
|
Fusarium oxysporum Контроль Опыт Piricularia oryzae Контроль Опыт Alternaria alternata Контроль Опыт Bipolaris sorokiniana Контроль Опыт Aspergillus niger Контроль Опыт |
116±0,3 112±0,2 100±0,2 52±0,1 50±0,3 48±0,2 64±0,2 66±0,3 60±0,3 36±0,1 30±0,1 22±0,1 88±0,4 88±0,5 86±0,3 40±0,2 38±0,2 36±0,2 48±0,1 44±0,4 42±0,4 22±0,3 22±0,1 20±0,1 114±0,3 114±0,2 112±0,5 48±0,5 46±0,1 44±0,3 |
Прим еч ани е. Среда А — агар Чапека-Докса; среда Б — агар Чапека-Докса + 2 % NaCl; cреда С — агар Чапека-Докса + 0,2 % Na2CO3, рН 8,0.
Ингибирование роста у Fusarium ox-ysporum при совместном культивировании со штаммом Streptomyces sp. К-541: слева — контроль, справа — опыт (10-е сут роста; среда Чапека-Докса, 2 % NaCl, рН 7,0).
Тонкослойная хроматография показала, что антибиотик А-541 представляет собой комплексный препарат. Была установлена иден- тичность состава компонен- тов препаратов, полученных из культуральной жидкости (А-541-1) и из биомассы (А-541-2). Наилучшее разделение на компоненты наблюдалось при использовании системы н-бу-танол—уксусная кислота—вода (3:1:1), которая позволила обнаружить 8 индивидуальных химических соединений; все компоненты показали свечение в УФ-свете. Далее эту систему применили для препаративного выделения антибиотически активных фракций на пластинах с закрепленным слоем силикагеля.
Методом биоавтографии с использованием Fusarium oxysporum в качестве тест-организма было установлено, что биологической активностью обладает только один компонент (IV компонент) с Rf в системе н-бута-нол—уксусная кислота—вода (3:1:1) соответственно 0,52 (антибиотик А-541-1) и 0,46 (антибиотик А-541-2). При тонкослойной хроматографией в системе н-бутанол—уксусная кислота—вода (2:1:1, 3:1:1) IV компонент, имеющий биологическую активность, проявлял себя как однородное вещество. Активный компонент выделяли для антибиотического препарата А-541-2 из зоны с Rf = 0,46. Спектры поглощения комплексного антибиотика А-541 и IV компонента были идентичны и имели основные максимумы в УФ-области при λ 317, 330, 354 и 376 нм. В ультрафиолетовом спектре присутствовали максимумы, характерные для полиеновых антибиотиков, наиболее близкие к таковым у представителей подгруппы гекса-енов (при λ 330, 354, 376 нм) (24).
Таким образом, штамм Streptomyces sp. К-541 может рассматривать- ся как перспективный агент против вредоносных грибных инфекций зерновых культур (пшеницы и риса) благодаря высокой антифунгальной активности в отношении всех изученных фитопатогенов. Показана возможность его использования для интродукции в почвенные биоценозы для биоконтроля возбудителей фузариозов зерновых культур в разных экологических условиях (нейтральных, щелочных и при засолении). Это свойство особенно ценно для растениеводства Казахстана, где почвенный покров неоднороден по составу и характеризуется высоким засолением. Выделенный антибиотик А-541 предварительно отнесен к группе полиенов, сделан вывод о его принадлежности к антибиотикам гексаенового типа.
Список литературы Антифунгальная активность против патогенов зерновых культур и изучение антибиотика штамма Streptomyces sp. К-541, выделенного из экстремальных экосистем Казахстана
- Logrieco A., Rizzo A., Ferracane R., Ritieni A. Occurrence of beauvericin and enniatins in wheat affected by Fusarium avenaceum head blight. Appl. Environ. Microb., 2002, 68(1): 82-85 ( ) DOI: 10.1128/AEM.68.1.82-85.2002
- Монастырский O.A. Нужны ли биопрепараты и биологическая Защита растений мировому сельскому хозяйству. Защита растений, 2006, 11: 6.
- Elad Y., Freeman S. Biological control of fungal plant pathogens. In: Agricultural applications. The Mycota (a comprehensive treatise on fungi as experimental systems for basic and applied research). V. 11/F. Kempken (ed.). Springer, Berlin, Heidelberg, 2002, 11: 93-109 ( ) DOI: 10.1007/978-3-662-03059-2_6
- Lord J.C. From Metchnikoff to Monsanto and beyond: The path of microbial control. J. Invertebr. Pathol., 2005, 89(1): 19-29 ( ) DOI: 10.1016/j.jip.2005.04.006
- Prabavathy V.R., Vijayanadraj V.R., Malarvizhi K., Mathivanan N., Mohan N., Murugesan K. Role of actinomycetes and their metabolites in crop protection. In: Agriculturally important microorganisms/G.G. Khachatourians, D.K. Arora, T.P. Rajendran, A. Srivastava (eds.). Academic World International, Bhopal, 2009: 243-255.
- Bressan W. Biological control of maize seed pathogenic fungi by use of actinomycetes. BioControl, 2003, 48: 233-240 ( ) DOI: 10.1023/A:1022673226324
- Дегтярева Е.А., Виноградова К.А., Александрова А.В., Филоненко В.А., Кожевин П.А. Почвенные актиномицеты как потенциальные биофунгициды. Вестник Московского университета, 2009, 17(2): 22-26.
- Sajid I., Fotso Fondja Yao C.B., Shaaban K.A., Hasnain S., Laatsch H. Antifungal and antibacterial activities of indigenous Streptomyces isolates from saline farmlands: prescreening, ribotyping and metabolic diversity. World J. Microb. Biot., 2008, 25(4): 601-610 ( ) DOI: 10.1007/s11274-008-9928-7
- Goodfellow M., Williams S.T. Ecology of Actinomycetes. Annu. Rev. Microbiol., 1983, 37: 189-216 ( ) DOI: 10.1146/annurev.mi.37.100183.001201
- Sharma М. Actinomycetes: source, identification, and their applications. International Journal of Current Microbiology and Applied Sciences, 2014, 3(2): 801-832.
- Wellington B., Figueiredo J.E.F. Efficacy and dose-response relationship in biocontrol in Fusarium disease in maize by Streptomyces spp. Eur. J. Plant Pathol., 2008, 120(3): 311-316 ( ) DOI: 10.1007/s10658-007-9220-y
- Kaur T., Sharma D., Kaur A., Manhas R.K. Antagonistic and plant growth promoting activities of endophytic and soil actinomycetes. Archives of Phytopathology and Plant Protection, 2013, 46(14): 1756-1768 ( ) DOI: 10.1080/03235408.2013.777169
- Sharma H., Parihar L. Antifungal activity of extracts obtained from actinomycetes. Journal of Yeast and Fungal Research, 2010, 1(10): 197-200.
- Priya C.S., Kalaichelvan P.T. Strategies for antagonistic activity of local actinomycete isolates against rice fungal pathogens. Asian Journal of Experimental Biological Sciences, 2011, 2(4): 648-653.
- Мониторинг земель в Республике Казахстан (состояние и перспективы развития)/Под ред. Б.С. Оспанова, З.Д. Дюсенбекова. Астана, 2001.
- Fujiwara S. Extremophiles: Developments of their special functions and potential resources. J. Biosci. Bioeng., 2002, 94(6): 518-525 ( ) DOI: 10.1016/S1389-1723(02)80189-X
- Phoebe C.H., Combie J., Albert F.G., Van Tran K., Cabrera J., Correira H.J., Guo Y., Lindermuth J., Rauert N., Galbraith W., Selitrennikoff C.P. Extremophilic organisms as an unexplored source of antifungal compounds. J. Antibiot., 2001, 54(1): 56-65 ( ) DOI: 10.7164/antibiotics.54.56
- Mokrane S., Bouras N., Sabaou N., Mathieu F. Actinomycetes from saline and non-saline soils of Saharan palm groves: Taxonomy, ecology and antagonistic properties. Afr. J. Microbiol. Res., 2013, 7(20): 2167-2178 ( ) DOI: 10.5897/AJMR2013.5656
- Sathyanarayana T., Raghukumar C., Shivaji S. Extremophilic microbes: diversity and perspectives. Current Science, 2005, 89: 78-90.
- Егоров Н.С. Основы учения об антибиотиках. М., 2004.
- Урбах В.Ю. Статистический анализ в биологических и медицинских исследованиях. М., 1975.
- Xu С., Wang L., Cui Q., Huang Y., Liu Z., Zheng G., Goodfellow M. Neutrotolerant acidophilic Streptomyces species isolated from acidic soils in China: Streptomyces guanduensis sp. nov., Streptomyces paucisporeus sp. nov., Streptomyces rubidus sp. nov. and Streptomyces yanglinensis sp. nov. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 1109-1115 ( ) DOI: 10.1099/ijs.0.63959-0
- Рябова О.В., Широких И.Г. Рост и антифунгальная активность стрептомицетов на фоне повышенной кислотности среды. Сельскохозяйственная биология, 2014, 3: 100-107 ( ) DOI: 10.15389/agrobiology.2014.3.100rus
- Ветлугина Л.А., Никитина Е.Т. Противогрибковые полиеновые антибиотики. Алма-Ата, 1980.


