Антикластогенная активность аминоселетона при воздействии циклофосфамида на костный мозг мышей
Автор: Шабунин С.В., Востроилова Г.А., Паршин П.А., Шабанов Д.И., Хохлова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Тканевые биостимуляторы
Статья в выпуске: 4 т.56, 2021 года.
Бесплатный доступ
Тканевый препарат аминоселетон, разработанный во Всероссийском научно-исследовательском ветеринарном институте патологии, фармакологии и терапии, получен из селезенки крупного рогатого скота методом криогенного фракционирования. Ранее были показаны адаптогенные, мембраностабилизирующие, стресс-протекторные, антиоксидантные и иммуномодулирующие свойства аминоселетона. В настоящей работе впервые выявлено антикластогенное действие тканевого препарата аминоселетон по отношению к клеткам костного мозга мышей, подвергнутых воздействию экспериментального мутагена. Кроме того, было показано сохранение цитогенетической стабильности и митотической активности в клетках костного мозга здоровых животных при применении исследуемого препарата. Цель работы - оценка влияния аминоселетона на цитогенетическую стабильность клеток костного мозга здоровых и подвергнутых действию экспериментального мутагена мышей, а также выявление антимутагенного свойства препарата применительно к генотоксическому эффекту циклофосфамида с использованием микроядерного теста. Эксперименты проводили на беспородных белых мышах ( Mus albus officinarum ), которые были разделены на группы, подвергшиеся следующим воздействиям: введение внутримышечно стерильного изотонического раствора хлорида натрия в объеме 0,2 мл (негативный контроль, n = 12); инъекция внутрибрюшинно 0,2 мл циклофосфамида (ЦФ, «Baxter Oncology GmbH», Германия) в дозе 20,0 мг/кг массы тела (позитивный контроль, n = 12); внутримышечное однократное введение 0,2 мл аминоселетона в терапевтической дозе 0,5 мл/кг ( n = 12); внутримышечная однократная инъекция 0,2 мл аминоселетона в 10-кратной терапевтической дозе 5,0 мл/кг ( n = 12); внутримышечное однократное введение 0,2 мл аминоселетона в дозе 0,5 мл/кг, через 72 ч внутрибрюшинное введение 0,2 мл ЦФ в дозе 20,0 мг/кг ( n = 6); внутримышечное введение 0,2 мл аминоселетона в дозе 0,5 мл/кг 5-кратно с интервалом 24 ч, через 72 ч после пятой инъекции внутрибрюшинное введение ЦФ аналогично животным других групп ( n = 6). Для определения количества хромосомных аберраций в костном мозге за 2,5 ч до эвтаназии мышам делали внутрибрюшинную инъекцию 0,025 % колхицина («ПанЭко», Россия). Из бедренных костей с помощью буферного раствора Хенкса (рН 7,4) вымывали клетки костного мозга, инкубировали суспензию клеток в 0,075 молярном гипотоническом растворе KCl, затем фиксировали клетки с помощью охлажденного до 4 °C ацетоалкоголя и окрашивали по Романовскому-Гимзе. Оценивали митотический индекс (МИ) по числу делящихся клеток на 1000 клеток костного мозга. Подсчитывали число клеток с хромосомными аберрациями в 100 метафазных пластинках на каждое животное. Учитывали одиночные и парные фрагменты, обмены и ахроматические пробелы (гепы), а также клетки с множественными патологиями. Для изучения частоты микроядер (микроядерный тест) полихроматофильных эритроцитов (ПХЭ) полученные клетки костного мозга добавляли к 1 % раствору альбумина в буферном растворе Хенкса (рН 7,4) и наносили на предметные стекла, далее препараты высушивали, фиксировали метанолом и окрашивали по Романовскому-Гимзе. Определяли частоту микроядер на 1000 ПХЭ, всего изучали 2000 ПХЭ на животное. Также учитывали долю ПХЭ на 500 нормохромных эритроцитов (НЭ) и ПХЭ. Частота хромосомных аберраций и микроядер при введении препарата в исследуемых дозах статистически значимо не отличалась от таковой у животных из группы негативного контроля, которая составила соответственно 1,0±0,40 и 0,2±0,06 %. Введение аминоселетона также не оказывало влияния на митотический индекс клеток костного мозга экспериментальных животных. Курсовое введение аминоселетона снижало кластогенное действие циклофосфамида, оцениваемое по количеству микроядер в ПХЭ костного мозга, с 2,3±0,21 % у мышей из группы позитивного контроля до 1,0±0,40 % у животных после курса инъекций аминоселетона. То есть наблюдалось снижение кластогенной активности циклофосфамида на 51,3 %, что, вероятно, было связано с коррекцией исследуемым препаратом прооксидантно-а
Аминоселетон, циклофосфамид, мутагенность, антикластогенные свойства, микроядра, хромосомные аберрации, костный мозг, белые мыши, полихроматофильные эритроциты
Короткий адрес: https://sciup.org/142231382
IDR: 142231382 | УДК: 619:615.36:575.224.46 | DOI: 10.15389/agrobiology.2021.4.763rus
Текст научной статьи Антикластогенная активность аминоселетона при воздействии циклофосфамида на костный мозг мышей
Снижение негативного влияния стресс-факторов на организм животных посредством использования препаратов-адаптогенов — одно из направлений исследований в ветеринарной медицине (1). Среди лекарственных средств такого класса можно выделить группу препаратов, имеющих в составе вытяжки экстракты органов и тканей животных. Поскольку селезенка служит источником значительного количества цитокинов различных типов, она стала основой для нескольких отечественных и зарубежных органопрепаратов (2). Для многих из них показаны иммуномодулирующие и адаптогенные свойства (3, 4). Однако видовые и возрастные параметры животных, от которых получены органы, а также технологические особенности обработки сырья при производстве препарата могут в некоторой степени изменить конечный химический состав лекарственного средства и, следовательно, повлиять на его биологическую активность и терапевтическую эффективность (4).
Во Всероссийском научно-исследовательском ветеринарном институте патологии, фармакологии и терапии был разработан новый тканевый препарат аминоселетон, получаемый методом криогенного фракционирования селезенки крупного рогатого скота. Ранее были показаны адаптогенные, стресс-протекторные, антиоксидантные и иммуномодулирующие свойства аминоселетона (5, 6).
Оценка генотоксических свойств новых лекарственных средств — один из обязательных этапов доклинических исследований при их разработке (7). Химические мутагены широко распространены в окружающей среде и могут становиться причиной возникновения наследственных и врожденных заболеваний, канцерогенеза, старения и митохондриальных болезней (8, 9). Мутагенное и канцерогенное действие различных генотоксических веществ также включает образование свободных радикалов, которые перегружают эндогенные системы антиоксидантной защиты, сдерживающие окислительный стресс — одну из причин повреждения ДНК. В целом все антиоксидантные агенты можно рассматривать как потенциальные ингибиторы мутагенеза и канцерогенеза (10).
К веществам, потенциально обладающим антимутагенным действием, относятся препараты растительного или животного происхождения, использование которых связано с их меньшей токсичностью, сродством биологически активных веществ, входящих в состав препаратов и присутствующих в организме животных, доступностью с экономической точки зрения. Однако влияние средств природного происхождения на наследственный аппарат клеток недостаточно изучено. Накопление данных об оценке кластогенных и антимутагенных свойств препаратов, используемых в ветеринарной практике, представляет научный интерес и имеет важное практическое значение. Согласно нашим данным, аминоселетон индуцировал снижение количества малонового диальдегида и метаболитов оксида азота, а также увеличение общей антиокислительной активности сыворотки крови животных. Препарат модулировал ферментативное и неферментативное звено антиоксидантной защиты, например возрастала активность глутатионпероксидазы и каталазы, концентрация витаминов А и Е (11). В связи с этим целесообразно оценить не только безопасность аминоселетона, но и его потенциальные антимутагенные свойства на модели индуцированного циклофосфамидом (ЦФ) мутагенного действия в клетках костного мозга мышей (7). ЦФ — алкилирующий препарат, применяемый в онкологии. Это вещество активируется цитохромом P-450 в печени, образуя азотистый иприт, который через цепь реакций оказывает алкилирующее действие на ДНК и вызывает образование перекрестных сшивок между цепями ДНК по гуаниновому азотистому основанию, что может быть причиной возникновения мутаций и гибели клеток (12).
В настоящей работе впервые было выявлено антикластогенное действие тканевого препарата аминоселетона по отношению к клеткам костного мозга мышей, подвергнутых воздействию экспериментального мутагена. Кроме того, было показано сохранение цитогенетической стабильности и митотической активности в клетках костного мозга здоровых животных при применении исследуемого препарата.
Цель работы — оценка влияния аминоселетона на цитогенетическую стабильность клеток костного мозга здоровых и подвергнутых действию экспериментального мутагена мышей, а также выявление антимутагенного свойства препарата применительно к генотоксическому эффекту циклофосфамида с использованием микроядерного теста.
Методика. Эксперименты проводили на беспородных белых мышах ( Mus albus officinarum ) ( n = 60) согласно руководству по доклиническим испытаниям препаратов (7). Подопытных животных содержали в стандартных условиях вивария (температура воздуха 18-23 ° C, относительная влажность 45-60 %). Доступ к воде и корму был свободным. Манипуляции в рамках эксперимента проводили в соответствии с положениями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986 год, подтверждена в 2006 году). Аминоселетон был получен посредством криофракционирования в виде жидкой суспензии.
Животных разделили на следующие группы: I группа (негативный контроль, n = 12) — введение внутримышечно стерильного изотонического раствора натрия хлорида в объеме 0,2 мл; II группа (позитивный контроль, n = 12) — инъекция внутрибрюшинно 0,2 мл ЦФ («Baxter Oncology GmbH», Германия) в дозе 20,0 мг/кг массы тела (15); III группа ( n = 12) — внутримышечное однократное введение 0,2 мл аминоселетона в терапевтической дозе 0,5 мл/кг; IV группа ( n = 12) — внутримышечная однократная инъекция 0,2 мл аминоселетона в 10-кратной терапевтической дозе 5,0 мл/кг; V группа ( n = 6) — внутримышечное однократное введение 0,2 мл аминоселетона в дозе 0,5 мл/кг, через 72 ч внутрибрюшинное введение 0,2 мл ЦФ в дозе 20,0 мг/кг; VI группа ( n = 6) — внутримышечное введение 0,2 мл аминоселетона в дозе 0,5 мл/кг 5-кратно с интервалом 24 ч, через 72 ч после пятой инъекции внутрибрюшинное введение ЦФ аналогично животным из V группы. Эвтаназию животных всех групп проводили посредством передозировки углекислого газа через 24 ч после финальной инъекции.
Для определения количества хромосомных аберраций в костном мозге за 2,5 ч до эвтаназии мышам делали внутрибрюшинную инъекцию 0,025 % колхицина («ПанЭко», Россия). Далее из бедренных костей с помощью буферного раствора Хенкса (рН 7,4) шприцем на 5 мл вымывали клетки костного мозга, инкубировали суспензию клеток в 0,075 молярном гипотоническом растворе KCl (25 мин при 37 ° C), затем фиксировали клетки с помощью охлажденного до 4 ° C ацетоалкоголя (метанол:уксусная кислота — 3:1) и окрашивали по Романовскому-Гимзе. Оценивали митотический индекс (МИ) по числу делящихся клеток на 1000 клеток костного мозга в исследуемых образцах. Подсчитывали число клеток с хромосомными аберрациями в 100 метафазных пластинках на каждое животное (7, 14). Исследовали образцы при увеличении *800 и *1000 с помощью микроскопа Биоскоп-1 (ООО «ЛОМО-Микроанализ», Россия). Учитывали одиночные и парные фрагменты, обмены и ахроматические пробелы (гепы), а также клетки с множественными патологиями (7). Исследовали по 6 животных из каждой группы, за исключением V и VI групп.
Для определения частоты микроядер (микроядерный тест) полихроматофильных эритроцитов (ПХЭ) (15) полученные клетки костного мозга добавляли к 1 % раствору альбумина в буферном растворе Хенкса (рН 7,4) (16) и наносили на предметные стекла, далее препараты высушивали, фиксировали метанолом и окрашивали по Романовскому-Гимзе (15). Препараты костного мозга исследовали при увеличении *800 и *1000. Устанавливали частоту микроядер на 1000 ПХЭ, всего изучали 2000 ПХЭ на животное. Также учитывали долю ПХЭ на 500 нормохромных эритроцитов (НЭ) и ПХЭ (7). Исследование проводили на 6 животных из каждой группы
Статистическую обработку полученных результатов проводили в программе STADIA 8.0 (НПО «Информатика и компьютеры», Россия). Вычисляли средние значения ( M) и стандартные ошибки средних (±SEM). Использовали непараметрический критерий Ван дер Вардена. Различия считались статистически значимыми при p < 0,05.
Результаты. Мы проанализировали метафазные пластинки клеток костного мозга мышей исследуемых групп (табл. 1).
1. Частота хромосомных аберраций в клетках костного мозга у беспородных белых мышей ( Mus albus officinarum ), подвергнутых воздействию различных доз аминоселетона ( n = 12, M ±SEM)
|
Группа |
Метафазы, шт. |
Доля патологий на 100 исследованных клеток, % |
Общая доля клеток с патологиями, % |
||||
|
гепы, % |
одиночные фрагменты, % |
парные фрагменты, % |
обмены, % |
МП, % |
|||
I
II iii
IV
600 0,5±0,37 0,2±0,18
600 0,5±0,24 12,7±0,92*
600 0,7±0,23 0,2±0,18
600 1,0±0,40 0
0 0,2±0,18
2,8±0,34* 2,0±0,49*
0 0,8±0,44
0 0,5±0,24
0,2±0,18 1,0±0,40
0,3±0,23 11,2±0,52*
0 1,7±0,46
0,5±0,24 2,2±0,59
Примечание. МП — множественные патологии (более пяти на клетку). Описание групп см. в разделе «Методика».
* Различие с негативным контролем (I группа) статистически значимо при p < 0,05.
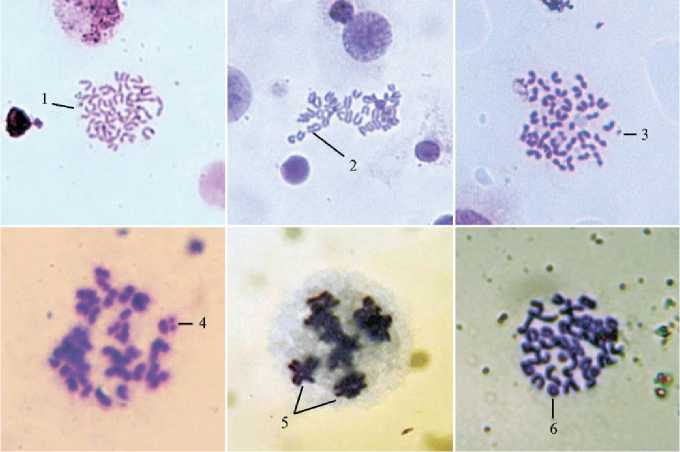
Рис. 1. Микрофотографии метафазных пластинок костного мозга беспородных белых мышей ( Mus albus officinarum ) при введении внутримышечно стерильного изотонического раствора натрия хлорида в объеме 0,2 мл (негативный контроль): 1 — хромосомы без патологий, 2 — ахроматический пробел (геп), 3 — одиночный фрагмент, 4 — парный фрагмент, 5 — хромосомные и хроматидные обмены, 6 — кольцевая хромосома (1-3 — увеличение *800, 4-6 — *1000, Био-скоп-1, ООО «ЛОМО-Микроанализ», Россия).
Однократное внутримышечное введение аминоселетона как в тера- певтической (0,5 мл/кг), так и в 10-кратной (5 мл/кг) дозе не индуцировало статистически значимого увеличения доли клеток с хромосомными аберрациями (рис. 1) относительно группы негативного контроля (I группа) через 24 ч (см. табл. 1). Кластогенное действие ЦФ (20 мг/кг), напротив, приводило к 10-кратному повышению частоты клеток с патологиями. Введение аминоселетона также не оказывало влияния на МИ в препаратах костного мозга: в I-IV группах он составлял соответственно 4,0±0,73; 3,1±0,41; 3,5±0,79 и 3,6±0,75 %.
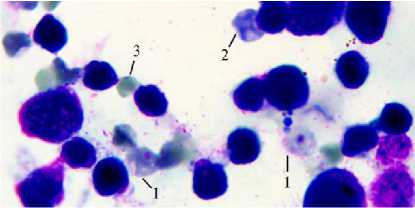
Рис. 2. Микрофотография препарата костного мозга беспородной белой мыши ( Mus albus officinarum ) при введении внутримышечно стерильного изотонического раствора натрия хлорида в объеме 0,2 мл (негативный контроль): 1 — полихроматофильный эритроцит с микроядром, 2 — полихроматофильный эритроцит, 3 — нормохромный эритроцит (увеличение *1000, Биоскоп-1, ООО «ЛОМО-Микроанализ», Россия).
Введение аминоселетона в дозах 0,5 и 5 мл/кг массы тела мышей не приводило к изменению частоты микроядер ПХЭ (рис. 2) относительно негативного контроля (0,23±0,06 %) (табл. 2). В то же время инъекция ЦФ индуцировала статистически значимое повышение частоты микроядер в ПХЭ у мышей из II, V и VI групп соответственно до 2,2±0,21, 2,1±0,26 и 1,1±0,09 %. Вместе с тем нами было обнаружено антикласто-генное действие аминоселетона, который применяли до введе ния ЦФ 5-кратно в дозе 0,5 мл/кг массы тела (VI группа). Так, частота микроядер в ПХЭ у мышей из VI группы была на 51,3 % (р < 0,003) ниже, чем у животных из II группы, получивших только ЦФ. Однократное введе ние аминоселетона (V группа) не приводило к статистически значимому снижению частоты микроядер. Также нами была оценена доля ПХЭ в костном мозге мышей, которая может выступать индикатором токсического действия ксенобиотиков (7). Мы не обнаружили статистически значимой разницы в этом показателе между животными всех исследуемых групп, в том числе разницы с позитивным контролем.
2. Частота полихроматофильных эритроцитов (ПХЭ) с микроядрами в костном мозге здоровых беспородных белых мышей ( Mus albus officinarum ) и животных, получивших инъекцию циклофосфамида, при предварительном введении препарата аминоселетон в различных дозах ( M ±SEM)
|
Группа |
I Доля ПХЭ |
с микроядрами на 1000 ПХЭ, % |
I Доля ПХЭ от (НЭ+ПХЭ), % |
|
I ( n = 12) 0,2±0,06 49,9±0,93 II ( n = 12) 2,3±0,21a 49,0±1,57 III ( n = 12) 0,2±0,07 48,9±0,65 IV ( n = 12) 0,3±0,11 49,5±1,43 V ( n = 6) 2,1±0,26a 48,2±1,79 VI ( n = 6) 1,1±0,09a , b 50,9±1,86 Примечание. НЭ — нормохромные эритроциты. Описание групп см. в разделе «Методика». a, b Различия соответственно c негативным (I группа) и позитивным (II группа) контролями статистически значимы при р < 0,05. |
|||
Ряд препаратов, содержащих экстракт селезенки, применяют в клинической практике в качестве иммуномодуляторов или лекарств для снижения побочных эффектов противоопухолевой терапии (4, 17). Полученные нами данные согласуются с информацией об отсутствии мутагенных свойств у других лекарственных средств, имеющих в своей основе селезенку животных. Например, рекомендованный для клинического использования препарат Polyerga™ («HorFerVit Pharma GmbH», Германия) не проявлял геноток- сического действия в тесте Эймса (18). В отличие от полученных нами данных об отсутствии влияния аминоселетона на долю ПХЭ в костном мозге мышей, результаты W. Lu с соавт. (17) свидетельствуют о защитном действии экстракта селезенки новорожденных телят по отношению к мышам с индуцированным циклофосфамидом угнетением кроветворной активности в костном мозге. Это может объясняться значительно большей дозой ЦФ (100 мг/кг массы тела), использованной авторами в модели циклофосфа-мид-индуцированной супрессии гемопоэза (17).
Обнаруженное нами антикластогенное действие аминоселетона и отсутствие у него мутагенных свойств в некоторой степени подтверждается исследованиями К.А. Дычко с соавт. (19), которые продемонстрировали снижение числа микроядер в эритроцитах при введении экстракта селезенки мышам, подвергшимся воздействию рентгеновских лучей. Авторы полагают, что радиопротекторные эффекты экстракта селезенки были обусловлены его мембраностабилизирующим действием на клетки мышей, которое также было показано нами для аминоселетона (20).
В настоящее время выявлены различные механизмы антимутаген-ного действия (21). Генотоксичность и цитотоксичность, вызванная ЦФ, в отношении клеток костного мозга может частично нивелироваться за счет антиоксидантной активности (22). Вероятно, антикластогенное действие аминоселетона обусловлено входящим в состав препарата комплексом биологически активных веществ (аминокислоты, фосфолипиды, витамины, олигопептиды, микроэлементы, нуклеиновые кислоты) (20), обладающих антиоксидантным действием (21). Так, аскорбиновая кислота, снижает частоту ПХЭ с микроядрами, индуцированными ЦФ в клетках костного мозга (23). Кроме того, мы показали, что введение аминоселетона увеличивает активность глутатионпероксидазы и приводит к повышению содержания восстановленного глутатиона, количество которого снижается при введении ЦФ и играет важную роль в антиоксидантной защите организма (11, 24). Однако антимутагенное действие одних и те же веществ может реализовываться посредством разных механизмов (25).
Поскольку в наших исследованиях аминоселетон проявлял себя как иммуномодулятор клеточного и гуморального звена иммунной системы (6), его антимутагенное действие могло быть обусловлено индукцией синтеза эндогенных цитокинов, обладающих генопротекторным действием, таких как интерферон (8). Так, в ряде работ показано антикластогенное и антиканцерогенное действие интерферонов и их индукторов, по-видимому, за счет активации пострепликативной репарации ДНК (26, 27). В исследовании D. Jia с соавт. (28) введение мышам с индуцированной ЦФ иммуносупрессией экстракта селезенки новорожденных телят приводило к увеличению содержания ИНФ- а и ИНФ- y в сыворотке крови, что может свидетельствовать в пользу нашего предположения.
Чувствительность клеток к действию генотоксикантов зависит от поступления в организм витаминов группы В, обладающих антиоксидантными свойствами, микронутриентов и других микроэлементов (таких как магний или цинк), участвующих в репаративных процессах, поддержании клеточного гомеостаза и антиоксидантной защите (8). Их восполнение может оказать системный эффект на антиоксидантую защиту организма. Пролонгированное антикластогенное действие аминоселетона даже спустя 72 ч после финального введения обусловлено длительной активацией антиоксидантной системы при введении препарата (11).
Таким образом, тканевый препарат аминоселетон, получаемый методом криофракционирования из селезенки крупного рогатого скота, в те- рапевтической (0,5 мл/кг) и высокой (5,0 мл/кг) дозах не оказал дестабилизирующего воздействия на цитогенетические характеристики клеток, которое оценивалось по количеству полихроматофильных эритроцитов с микроядрами и хромосомных аберраций в клетках костного мозга беспородных белых мышей. Препарат не повлиял на активность деления клеток, оцениваемую по митотическому индексу. При этом аминоселетон проявил анти-кластогенный эффект при совместном применении с генотоксикантом циклофосфамидом, снизив частоту встречаемости полихроматофильных эритроцитов с микроядрами в клетках костного мозга мышей на 51,3 % относительно группы положительного контроля.
Список литературы Антикластогенная активность аминоселетона при воздействии циклофосфамида на костный мозг мышей
- Учасов Д.С., Ярован Н.И., Сеин О.Б. Эффективность применения пробиотика «Проваген» при технологическом стрессе у свиней. Вестник Орловского государственного аграрного университета, 2013, 1(40): 129-131.
- Пленина Л.В., Сорока Н.Ф., Чудаков О.П., Третьяк С.И., Быкадорова Л.Г., Митьковская Н.П., Голынский А.Б., Максимович А.В., Евсеенко В.М., Ивановский Г.Л., Аликевич И.Н., Дражина Л.С., Грак Н.Н., Скуратовская Л.И. Новый отечественный иммуномодулятор Диасплен®. Рецепт, 2008, 1(57): 104-106.
- Федулова Л.В., Василевская Е.Р. Перспективные источники природных стимуляторов иммунитета. Мясные технологии, 2016, 12(168): 37-39.
- Черненкова М.Л., Стяжкина С.Н., Валинуров А.А. Изучение специфической активности и иммуногенности препарата спленопид. Журнал научных статей здоровье и образование в XXI веке, 2017, 19(8): 161-163.
- Востроилова Г.А., Хохлова Н.А., Паршин П.А., Ческидова Л.В., Брюхова И.В., Сашнина Л.Ю., Канторович Ю.А., Карташов С.С. Изучение эффективности аминоселетона при технологическом стрессе на свиноводческих комплексах. Ветеринарный фармакологический вестник, 2018, 2(3): 37-41 (doi: 10.17238/issn2541-8203.2018.2.37).
- Шабунин С.В., Востроилова Г.А., Паршин П.А., Хохлова Н.А., Сашнина Л.Ю., Михайлов Е.В., Тюрина Е.В. Изучение иммуномодулирующего действия аминоселетона при антибактериальной терапии сальмонеллеза поросят. Ветеринарная патология, 2018, 3(65): 39-46 (doi: 10.25690/VETPAT.2018.65.20143).
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая /Под ред. А.Н. Миронова. М., 2012.
- Дурнев А.Д. Антимутагенез и антимутагены. Физиология человека, 2018, 44(3): 116-137 (doi: 10.7868/S013116461803013X).
- Genetic toxicology: principles and methods /J.M. Parry, E.M. Parry (eds.). Springer, New York, 2012 (doi: 10.1007/978-1-61779-421-6).
- Delarmelina J.M., Dutra J.C.V., Batitucci Mdo C. Antimutagenic activity of ipriflavone against the DNA-damage induced by cyclophosphamide in mice. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association, 2014, 65: 140-146 (doi: 10.1016/j.fct.2013.12.028).
- Шабунин С.В., Шахов А.Г., Востроилова Г.А., Паршин П.А., Ермолова Т.Г., Хохлова Н.А., Близнецова Г.Н. Влияние аминоселетона на состояние прооксидантной и антиоксидантной систем крови у свиноматок. ДостижениянаукиитехникиАПК,2019, 33(7): 71-74 (doi: 10.24411/0235-2451-2019-10716).
- Emadi A., Jones R.J., Brodsky R.A. Cyclophosphamide and cancer: golden anniversary. Nature reviews. Clinical Oncology, 2009, 6(11): 638-647 (doi: 10.1038/nrclinonc.2009.146).
- Nau H., Spielmann H., Lo Turco Morter C.M., Winckler K., Riedel L., Obe G. Mutagenic, teratogenic and pharmacokinetic properties of cyclophosphamide and some of its deuterated derivatives. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1982, 95(2-3): 105-118 (doi: 10.1016/0027-5107(82)90250-0).
- Preston R.J., Dean B.J., Galloway S., Holden H., McFee A.F., Shelby M. Mammalian in vivo cytogenetic assays Analysis of chromosome aberrations in bone marrow cells. Mutation Research/Genetic Toxicology, 1987, 189(2): 157-165 (doi: 10.1016/0165-1218(87)90021-8).
- Hayashi M. The micronucleus test—most widely used in vivo genotoxicity test. Genes and Environment, 2016, 38: 18 (doi: 10.1186/s41021-016-0044-x).
- Agarwal D.K., Chauhan L.K. An improved chemical substitute for fetal calf serum for the micronucleus test. Biotechnic & Histochemistry, 1993, 68(4): 187-188 (doi: 10.3109/10520299309104695).
- Lu W., Jia D., An S., Mu M., Qiao X., Liu Y., Li X., Wang D. Calf Spleen Extractive Injection protects mice against cyclophosphamide-induced hematopoietic injury through G-CSF-mediated JAK2/STAT3 signaling. Scientific Reports, 2017, 7(1): 8402 (doi: 10.1038/s41598-017-08970-3).
- Hartleb M., Leuschner J. Toxicological profile of a low molecular weight spleen peptide formulation used in supportive cancer therapy. Arzneimittel-Forschung, 1997, 47(9): 1047-1051.
- Дычко К.А., Рыжова Г.Л., Кравцова С.С., Кирьянова Н.Л., Кувшинов Н.Н., Гриднева В.И. Способ получения средства с адаптогенным и противолучевым действием. Патент RU 2142284 C1 (РФ) МПК6 A 61 K 35/28. Томский государственный университет (РФ). № 95110155/14. Заявл. 14.06.1995. Опубл. 10.12.1999.
- Хохлова Н.А., Лободина Т.Е., Григорьева Н.А., Топольницкая А.В., Федорова Н.М., Панина Т.А. Изучение биологической активности аминоселетона в тесте на Рarameсium caudatum. Ветеринарный фармакологический вестник, 2018, 1(2): 25-30 (doi: 10.17238/issn2541-8203.2018.1.25).
- Гончарова Р.И., Кужир Т.Д. Молекулярные основы применения антимутагенов в качестве антиканцерогенов. Экологическая генетика, 2005, 3(3): 19-32.
- Hosseinimehr S.J., Karami M. Chemoprotective effects of captopril against cyclophosphamide-induced genotoxicity in mouse bone marrow cells. Archives of Toxicology, 2005, 79(8): 482-486 (doi: 10.1007/s00204-005-0655-7).
- Vijayalaxmi K.K., Venu R. In vivo anticlastogenic effects of L ascorbic acid in mice. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 1999, 438(1): 47-51 (doi: 10.1016/s1383-5718(98)00161-2).
- Manda K., Bhatia A.L. Prophylactic action of melatonin against cyclophosphamide-induced oxidative stress in mice. Cell Biology and Toxicology, 2003, 19(6): 367-372 (doi: 10.1023/b:cbto.0000013342.17370.16).
- De Flora S., Ramel C. Mechanisms of inhibitors of mutagenesis and carcinogenesis. Classification and overview. Mutation Research, 1988, 202(2): 285-306 (doi: 10.1016/0027-5107(88)90193-5).
- Bolzán A.D., Lacunza Е., Bianchi M.S. Effect of recombinant interferon-alpha on streptonigrin-induced chromosome aberrations and sister-chromatid exchanges in hamster cells. Mutation Research, 2003, 522(1-2): 127-134 (doi: 10.1016/s0027-5107(02)00304-4).
- Новицкий В.В., Хлусова М.Ю., Терновая С.В., Саратиков А.С. Антимутагенное средство. Патент RU 2189232 C2 (РФ) МПК7 A 61 K 31/415, A 61 P 43/00. НИИ фармакологии Томского научного центра РАМН (РФ). Сибирский медицинский университет (РФ). № 2000118409/14. Заявл. 10.07.2000. Опубл. 20.09.2002.
- Jia D., Lu W., Wang C., Sun S., Cai G., Li Y., Wang G., Liu Y., Zhang M., Wang D. Investigation on immunomodulatory activity of calf spleen extractive injection in cyclophosphamide-induced immunosuppressed mice and underlying mechanisms. Scandinavian Journal of Immunology, 2016, 84(1): 20-27 (doi: 10.1111/sji.12442).


