Антимикробная активность перевязочного материала, импрегнированного коллоидным серебром
Автор: Серова А.Н., Пехенько В.Г., Тихонова И.Н., Глазкова Е.А., Бакина О.В., Лернер М.И., Псахье С.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.27, 2012 года.
Бесплатный доступ
Представлены результаты изучения антимикробной активности перевязочного материала на основе полимерной матрицы с иммобилизованными частицами оксигидроксида алюминия, импрегнированного коллоидным серебром. Установлено, что разработанный материал обладает антимикробной активностью в отношении ряда микроорганизмов - E. coli 7935, S. aureus 209, P. aeruginosa 27583 и т.д. Показано, что при многократных пассажах E. coli 7935 с перевязочным материалом не наблюдается изменения свойств микроорганизмов и образования резистентных штаммов.
Перевязочный материал, оксигидроксид алюминия, коллоидное серебро, антимикробная ак# тивность, резистентные штаммы
Короткий адрес: https://sciup.org/14919760
IDR: 14919760 | УДК: 579;
Текст научной статьи Антимикробная активность перевязочного материала, импрегнированного коллоидным серебром
Широкое применение лекарственных препаратов и снижение иммунологического статуса организма привело к тому, что ведущую роль при инфекционно-воспалительных заболеваниях стали играть лекарственно-устойчивые формы патогенных и условно-патогенных микроорганизмов [8]. В связи с этим возникла необходимость создания и внедрения в медицинскую практику антимикробных материалов и изделий из них, не содержащих антибиотики. Сущность этого направления состоит в создании материалов, содержащих антимикробные компоненты пролонгированного действия [10]. Кроме того, получили распространение повязки для ран, импрегни-рованные антимикробными компонентами, такими как серебро, йод, оксид меди и др. [1, 13]. Действие указанных материалов основано на выделении бактерицидных компонентов в рану, что может приводить к патологическим изменениям в тканях.
Более перспективными представляются материалы, действие которых основано на сорбции микроорганизмов из раны и последующей их инактивации в объеме повязки. Одним из таких материалов является сорбционный материал, представляющий собой микроволокни-стую полимерную матрицу с иммобилизованными частицами оксигидроксида алюминия [6]. Перевязочный материал за счет действия оксигидроксида алюминия эффективно сорбирует и удерживает микроорганизмы. Однако частицы оксигидроксида алюминия не оказывают бактерицидного действия, что может привести к размножению микроорганизмов в объеме материала повязки и опасности повторного заражения.
Цель работы: исследование in vitro влияния коллоидного серебра, адсорбированного на частицах оксигидроксида алюминия, на жизнеспособность микроорганизмов в объеме перевязочного материала и изучение возможности возникновения резистентности микроорганизмов к антимикробному агенту, входящему в состав перевязочного материала.
Материал и методы
В качестве объектов исследования использовали образцы перевязочного материала (ПМ) с иммобилизованными частицами оксигидроксида алюминия, импрегни-рованного коллоидным серебром, и образцы ПМ без серебра [3].
Количественную оценку антимикробной активности образцов ПМ с различным содержанием коллоидного серебра проводили на культуре E. coli 7935 in vitro тест-методом AATCC 100–2004 [11]. Содержание оксигидроксида алюминия на всех образцах ПМ составляло 34%. Содержание коллоидного серебра варьировало в пределах от 0,38 до 3,65 мкг/см2. На образцы ПМ диаметром 47 мм наносили 1 мл культуры микроорганизма E. coli 7935 концентрацией 1,0х105 КОЕ/мл до полного поглощения суспензии. Образцы инкубировали при температуре (37±1) °C в течение 24 ч. Затем бактерии с перевязочного материала элюировали встряхиванием во флаконах со 100 мл физиологического раствора (с pH, равным 7,2) и высевали 1 мл суспензии на питательный агар (Эндо ГРМ) в чашки Петри. Посевы инкубировали при температуре (37±1) °C в течение суток, подсчитывали число выросших колоний и рассчитывали процент убыли микроорганизмов в контаминированном образце. В качестве контроля использовали взвесь микроорганизмов в физиологическом растворе.
Для определения антибактериального спектра ПМ использовали штаммы бактерий S. aureus 209, P. vulgaris 4175, E. coli 7935, K. pneumoniae 2482 , P. aeruginosa 27583, С. albicans Y-3108, представляющие споровые и вегетативные, грамположительные и грамотрицательные, кокковые и палочковидные, капсульные и бескапсульные формы микроорганизмов. Для проведения исследования за основу брали метод А.А. Ворошиловой и Е.В. Диановой [4].
Из указанных штаммов бактерий готовили по 5 мл суспензий суточных агаровых культур бактерий в стерильном физиологическом растворе в концентрации 2,0х103 КОЕ/мл (6 опытных пробирок для каждого микроорганизма). В каждую опытную пробирку помещали образец исследуемого стерильного ПМ размером 20х20 мм. В качестве контроля использовали стерильную марлю соответствующего размера и взвесь бактерий в физиологическом растворе. Опытные и контрольные образцы помещали в термостат при температуре (37±1) °C. Через 24 и 48 ч из всех пробирок производили посев 0,1 мл бактериальной взвеси на питательную среду в чашках Петри.
Исследования антимикробного действия ПМ на культурах микроорганизмов E. coli 7935 и S. aureus 209 проводили, взяв за основу метод Кирби–Бауэра [12]. Образцы ПМ диаметром 47 мм помещали на газон растущего соответствующего микроорганизма в чашках Петри и инкубировали в термостате при температуре (37±1) °C. Для получения роста бактерий в виде газона использовали бактериальные суспензии с концентрацией 1,0х107 КОЕ/мл. Через 24 ч инкубации образцы удаляли с поверхности газона, а выросшие под образцами бактерии отбирали с помощью тампонов и засевали на мясопептонный агар (МПА).
Для изучения возможного возникновения резистентности культуры E. coli 7935 при многократном контакте с ПМ [7] использовали образцы с коллоидным серебром и без коллоидного серебра размером 20х20 мм. Стерильные образцы ПМ помещали в пробирки c 5 мл мясопептонного бульона (МПБ), в который инокулировали культуру E. coli 7935 в конечной концентрации 1,0х103 КОЕ/ мл и инкубировали при температуре (37±1) °C. Через сутки пробирки тщательно встряхивали, высевали по 1 мл бульона на питательную среду МПА и инкубировали в те- чение суток при температуре (37±1) °C. На следующий день учитывали количество выросших колоний, готовили из них суспензию с концентрацией бактерий 1,0х103 КОЕ/мл и помещали в приготовленную суспензию новый образец ПМ. Таким образом, проводили 10 последовательных пассажей штамма E. coli 7935 в присутствии образцов ПМ. Далее проводили изучение пассированной культуры кишечной палочки по морфологическим, культуральным и биохимическим свойствам и сравнивали с исходной (до пассажа) культурой E. coli 7935 [7, 9, 14]. В качестве контроля использовали взвесь бактерий без образцов ПМ.
Статистическую обработку результатов осуществляли с применением пакета статистических программ STATISTICA for Windows (версия 5.0) с предварительной оценкой нормальности распределения и использованием t-критерия Стьюдента. Результаты представлены в виде среднего значения (M) и ошибки среднего (m). Для всех видов анализа статистически значимыми считали значения p менее 0,05.
Результаты и обсуждение
Результаты исследования антимикробной активности ПМ (рис. 1) показали, что снижение концентрации бактерий E. coli 7935 зависит от времени контакта образцов ПМ с бактериальной суспензией и содержания коллоидного серебра. При контакте образца ПМ 1 (без серебра) с бактериальной суспензией не наблюдалось изменения концентрации микроорганизмов во всем временном интервале. При содержании коллоидного серебра 0,38 мкг/см2(образец ПМ 2) заметное сокращение количества жизнеспособных микроорганизмов отмечено после 2 ч контакта ПМ с бактериальной суспензией, но полной потери жизнеспособности бактерий не удавалось достичь даже после 24 ч контакта. При увеличении концентрации коллоидного серебра и времени контакта количество жизнеспособных микроорганизмов снижалось, причем полная потеря жизнеспособности микроорганизмов наблюдалась на образцах ПМ, содержащих 0,70 (образец ПМ 3)и 3,65 мкг/см2 серебра (образец ПМ 4) через 24 ч контакта.
Проведенные исследования показали, что в смыве образца ПМ 1 обнаруживаются бактерии в концентрации 1,0х104КОЕ/мл, что свидетельствовало об отсутствии антимикробного действия ПМ без коллоидного серебра. В смыве с образца ПМ 2 присутствовали единичные живые микробные клетки E. coli 7935, что, возможно, обусловлено недостаточной дозой коллоидного серебра для обеспечения полного бактерицидного эффекта. В смыве с образцов ПМ 3 и ПМ 4 жизнеспособных микрооганиз-мов не обнаружено, что могло быть связано с антимикробным действием коллоидного серебра.
Таким образом, минимальное количество коллоидно-
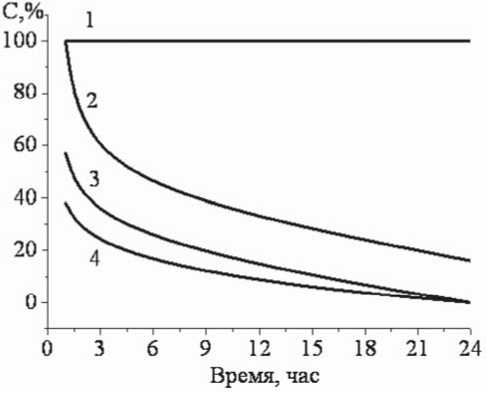
Рис. 1. Антимикробные свойства перевязочного материала в зависимости от содержания коллоидного серебра: 1 – без серебра; 2 – 0,38 мкг/см2; 3 – 0,70 мкг/см2, 4 – 3,65 мкг/см2
Таблица 1
Антимикробный спектр перевязочного материала (образец ПМ 4)
достижения полного бактерицидного эффекта в объеме Эффективность антимикробного действия ПМ с кол-
а) б)

в)

г)
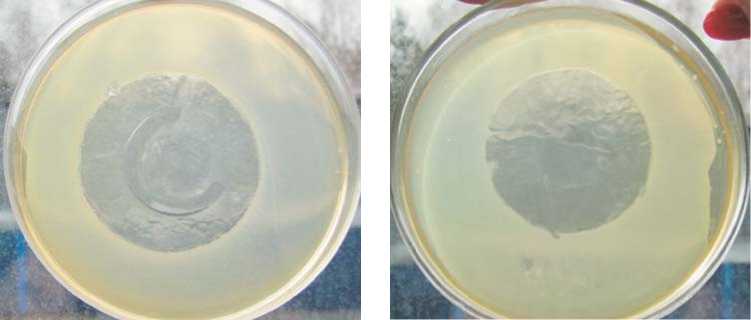
Рис. 2. Состояние газона E. coli 7935 (а, б) и S. aureus 209 (в, г) после удаления диска ПМ: без серебра (а, в), с коллоидным серебром (б, г)
лоидным серебром (табл. 1) зависела от вида микроорганизмов, времени контакта и строения клеточной стенки микроорганизма и снижалось в ряду: Р.vulgaris 4175 – S.aureus 209 – E. coli 7935 – K. pneumoniae 2482 – P. aeruginosa 27583 – C. albicans Y-3108. Наиболее устойчивой к действию коллоидного серебра оказалась культура C. albicans Y-3108, что, вероятно, обусловлено строением клеточной стенки и наличием спор (бластоспор, хламидиоспор).
Изучение антимикробного действия ПМ (концентрация коллоидного серебра – 3,65 мкг/см2) показало, что через сутки на поверхности мясопептонного агара под образцами с серебром концентрация микроорганизмов уменьшилась на три порядка и составила 104КОЕ/ мл, тогда как под образцами без серебра – на два порядка, составив 105 КОЕ/ мл (рис. 2).
Следует отметить, действие материала распространялось только на об-
Таблица 2
Резистентность культуры E.coli 7935 к действию антимикробного агента перевязочного материала
|
Свойства |
E. coli 7935 и ПМ без коллоидного серебра |
E. coli 7935 и ПМ с коллоидным серебром |
E. coli 7935 (исходная культура) |
|
Культуральные Морфологические Биохимические Заключение |
На среде Эндо красные колонии с металлическим блеском, на среде Левина – темнофиолетовые колонии Грамотрицательные палочки, не образуют спор Цитохромоксидаза “–” каталаза “+” уреаза “–” индолообразование “+” образование сероводорода “–” утилизация цитрата Симмонса “–” подвижность “+” ферментация глюкозы и лактозы до кислоты и газа Все свойства соответствуют культуре E. coli 7935 (исходная культура) |
На среде Эндо красные колонии с металлическим блеском, на среде Левина – темнофиолетовые колонии Грамотрицательные палочки, не образуют спор Цитохромоксидаза “–” каталаза “+” уреаза “–” индолообразование “+” образование сероводорода “–” утилизация цитрата Симмонса “–” подвижность “+” ферментация глюкозы и лактозы до кислоты и газа Все свойства соответствуют культуре E. coli 7935 (исходная культура) |
На среде Эндо красные колонии с металлическим блеском, на среде Левина – темнофиолетовые колонии Грамотрицательные палочки, не образуют спор Цитохромоксидаза “–” каталаза “+” уреаза “–” индолообразование “+” образование сероводорода “–” утилизация цитрата Симмонса “–” подвижность “+” ферментация глюкозы и лактозы до кислоты и газа E. coli |
Примечание: “+” – наличие признака, “–” – отсутствие признака.
ласть под образцом, о чем свидетельствовало отсутствие зоны лизиса вокруг дисков ПМ. Следовательно, из образцов ПМ не происходило диффузии антимикробного компонента в агар с тестируемыми микроорганизмами, а действие ПМ обусловлено поглощением и сорбцией микроорганизмов, а также антибактериальным действием коллоидного серебра в объеме ПМ.
Многочисленные исследования подтверждают [2, 5], что микроорганизмы, в силу ряда причин, могут стать резистентными к различным химическим веществам, антибиотикам и т.д., а также изменять свои морфологические, культуральные и биохимические свойства. Полученные результаты (табл. 2) свидетельствуют о том, что все исследуемые показатели многократно пассированной культуры не изменились по сравнению с исходной контрольной культурой бактерий E. coli 7935.
Таким образом, многократное воздействие ПМ с адсорбированным коллоидным серебром в концентрации 3,65 мкг/см2 на суспензию бактерий E. coli 7935 не приводило к изменению свойств тестируемого микроорганизма.
Выводы
-
1. Перевязочный материал на основе микроволокнис-той полимерной матрицы с иммобилизованными частицами оксигидроксида алюминия, импрегнирован-ный коллоидным серебром, обладает антибактериальной активностью и сорбционной способностью. Перевязочный материал без серебра обладает только сорбционной активностью, а адсорбированные микроорганизмы сохраняют жизнеспособность. Коллоидное серебро в концентрации выше 0,70 мкг/см2 придает перевязочному материалу бактерицидные свойства.
-
2. Перевязочный материал, содержащий коллоидное серебро в концентрации 3,65 мкг/см2, обладает широким спектром антимикробной активности, которая зависит от вида микроорганизма и времени его контакта с перевязочным материалом.
-
3. При многократном воздействии антимикробного агента, входящего в структуру перевязочного материала, на микробные клетки E. coli 7935 не происходит изменений их морфологических, культуральных и биохимических свойств, что является одним из показателей безвредности перевязочного материала.
Работа выполнена при финансовой поддержке ГК 14.527.12.0001 и Программы V.37.3.
Список литературы Антимикробная активность перевязочного материала, импрегнированного коллоидным серебром
- Абаев Ю.К. Хирургическая повязка. -Минск: Беларусь, 2005. -150 с.
- Бриан Л.Е. Бактериальная резистентность и чувствительность к химиопрепаратам/пер. с англ. -М.: Медицина, 1984. -272 с.
- Бакина О.В., Глазкова Е.А., Ложкомоев А.С. и др. Модифицирование наноструктурного оксигидроксида алюминия частицами коллоидного серебра//Перспективные материалы. -2011. -№ 6. -С. 47-52.
- Ворошилова А.А., Дианова Е.В. Окисляющие нефть бактерии -показатели интенсивности биологического окисления нефти в природных условиях//Микробиология. -1952. -Т. 21, вып. 4. -С. 408-415.
- Ланчини Д., Паренти Ф. Антибиотики/пер. с англ. -М.: Медицина, 1985. -272 с.
- Лернер М.И., Бакина О.В., Глазкова Е.А. и др. Высокопроизводительный фильтр для очистки воды от коллоидных и микробиологических загрязнений//Экология и промышленность. -2010, сент. -С. 4-7.
- Пяткин К.Д., Кривошеин Ю.С. Микробиология с вирусологией и иммунологией: учебник для мед. ин-тов. -4-е изд., перераб. и доп. -М.: Медицина, 1980. -512 с.
- Руденко А.В., Багдасарова И.В., Брудько А.П. Сорбционное действие Энтеросгеля в отношении различных видов микроорганизмов//Провизор. -2005. -№ 10. -С. 42-43.
- Методы лабораторных исследований и испытаний дезин# фекционных средств для оценки их эффективности и безопасности [Электронный ресурс]: руководство Р 4.2.2643 10//ФМБА России. -2010. -URL: http://ru58.fmbaros.ru/2502/3313/item/2567 (дата обращения 19.04.2012).
- Стрилец О.П., Дикий И.Л., Стрельников Л.С. и др. Изучение антимикробных свойств новой лекарственной формы в виде антисептического перевязочного средства на основе декаметоксина и этакридина лактата//Провизор. -1999. -№ 7. -С. 46-47.
- Antibacterial finishes on textile materials: assessment of developed from American Association of Textile Chemists and Colorists//AATCC Technical Manual. -2006. -P. 149-151.
- Bauer A.W., Kirby W.M.M., Sherris J.C. et al. Antibiotic susceptibility testing by a standartized single disk method//Am. J. Clin. Pathol. -1966. -Vol. 36. -P. 493-496.
- Borkow G., Okon#Levy N., Gabbay J. Copper. Oxide impregnated wound dressing: biocidal and safety studies//Wounds. -2010. -Vol. 22 (12). -P. 301-310.
- Jorgensen J.H., Turnidge J.D. Susceptibility test methods: dilution and disk diffusion methods//Manual of Clinical Microbiology. -9th ed. -Washington: ASM Press, 2007. -P. 1152-1172.


