Антиоксидантные свойства экстрактов растений семейства Lamiaceae, произрастающих в Республике Коми
Автор: Володин В.В., Безматерных К.В., Смирнова Г.В., Октябрьский О.Н., Алексеева Л.И., Канев В.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 1 (17), 2014 года.
Бесплатный доступ
С использованием биохимических методов и микробных тест-систем исследована антиоксидантная активность экстрактов растений семейства Lamiaceae, произрастающих в Республике Коми. Показано, что антиоксидантное действие экстрактов проявляется за счет прямого ингибирования активных форм кислорода, хелатирования ионов железа и индукции антиоксидантных генов. На моделях генно-иженерных штаммов Escherichia coli впервые показано, что существенный вклад в антиоксидантное действие вносит их способность активировать гены OxyR-регулона и влиять на активность RpoS-контролируемой системы в условиях окислительного стресса.
Антиоксидантная активность, экспрессия генов, экстракты растений
Короткий адрес: https://sciup.org/14992657
IDR: 14992657 | УДК: 57.083.138.4
Текст научной статьи Антиоксидантные свойства экстрактов растений семейства Lamiaceae, произрастающих в Республике Коми
В настоящее время все большее внимание уделяется поиску природных антиоксидантов для защиты организма человека от активных форм кислорода (АФК). Хорошо известны растения с высокой антиоксидантной активностью, такие как розмарин лекарственный (Rosmarinus officinalis), шалфей лекарственный (Salvia officinalis), тимьян обыкновенный (Thymus vulgaris), душица обыкновенная (Origanum vulgare), базилик благородный (Ocimum basilicum) – все они из семейства Lamiaceae и относятся к растениям южных широтных групп [1]. В последние годы актуальным направлением ботанического ресурсоведения является поиск растений -антиоксидантов, произрастающих на ранее не изученных северных территориях России, в том числе и в Республике Коми. При проведении выборочного исследования антиоксидантной активности экстрактов представителей сем. Lamiaceae, насчитывающего во флоре европейского Северо-Востока России 26 видов из 16 родов, представляет интерес оценить антиоксидантную активность экстрактов как ранее не исследованных видов, так и изученных, образцы которых отбирались в более южных местах произрастания. Кроме практического интереса эти исследования могли бы дать ответ на вопрос о связи между условиями среды обитания растений и антиоксидантной активностью, обусловленной варьирующим в растениях содержанием полифенолов [2, 3]. Эти соединения обладают способностью прямо нейтрализовать свободные радикалы [4] и хелатировать ионы металлов, включая железо [5]. В то же время известно, что в определенных условиях полифенолы могут участвовать в генерации АФК и действовать как прооксиданты [6, 7]. В исследованиях на животных показано антиму-тагенное и антиканцерогенное действие полифенолов, а также их положительный эффект при лечении многих заболеваний сердечно-сосудистой и нервной системы, в профилактике рака и старения [8]. Для изучения антиоксидантной активности экс- трактов и их компонентов используются два основных подхода. В первом случае применяют физикохимические методы, во втором – живые организмы от млекопитающих до микробных тест-систем. В последнем случае микроорганизмы могут быть использованы как относительно простые и недорогие тест-системы [9, 10]. В настоящей работе нами исследована антиоксидантная активность экстрактов выборочных видов растений сем. Lamiaceae с использованием генно-инженерных штаммов бактерий Escherichia coli и трех широко используемых химических методов.
Материалы и методы
Получение экстрактов . Метанольные экстракты получали из растений, принадлежащих к видам семейства Lamiaceae. Надземную часть растений высушивали при комнатной температуре и измельчали до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм. Навески 0,1 г экстрагировали 10 мл 96%-ного метанола в круглодонной колбе при нагревании с обратным холодильником на водяной бане 1 час. После охлаждения экстракт фильтровали и выпаривали досуха.
Определение радикалсвязывающей активности (РСА) с ДФПГ•. Способность растительных экстрактов к связыванию свободного радикала ДФПГ• определялась, как описано в работе [11]. Радикалсвязывающую активность (РСА) рассчитывали по формуле:
РСА (%) = (1 – поглощение образца / поглощение контроля) х 100.
IC 50 – концентрация субстрата, при которой 50% радикалов связывается с тестируемым образцом. Для расчета IC 50 выбирали отрезок между двумя точками на прямолинейном участке графика «доза–эффект».
Определение хелатирующей способности. Способность экстрактов к хелатированию ионов железа определяли по методу, описанному в работе [12]. Хелатирующую способность вычисляли по формуле:
ХС (%) = (1 – поглощение образца / поглощение контроля) х 100.
EC 50 – концентрация субстрата, при которой ионы металлов хелатируются на 50%, рассчитывалась, как указано выше, для IC 50 .
Определение общего содержания растительных полифенолов. Содержание полифенолов определяли с реактивом Фолина-Чикольте [13], результаты выражали в мг эквивалентах галловой кислоты/ г сухого веса экстракта.
Определение антиоксидантной активности (АОА) c помощью микробных тест-систем. Использованные в работе генно-инженерные штаммы Escherichia coli NM3021 и NM3041 были сконструированы путем трансформации бактерий дикого типа BW25113 (штамм получен из CGSC E. coli Genetic Stock Center) плазмидами pKT1033 ( katG::lacZ ) (получена от проф. K. Tao, Япония) и pRS 415 katF5 ( rpoS::lacZ ) (получена от проф. A. Eisenstark, США).
Плазмиды несут слияние промоторов генов katG и rpoS со структурным геном β-галактозидазы, что позволяет судить о степени экспрессии этих генов по уровню активности β-галактозидазы. Ген katG кодирует каталазу HPI, которая индуцируется в ответ на повышение концентрации эндогенной и экзогенной перекиси водорода. Ген rpoS кодирует σS субъединицу РНК-полимеразы (RpoS), контролирующую экспрессию большого числа генов общего стрессового ответа, индуцируется при замедлении роста и обеспечивает устойчивость ко многим стрессам.
Бактерии культивировали на минимальной среде М9 [14] с глюкозой (0.15%), казаминовыми кислотами (0.2%) и тиамином (10 мкг/мл). Ночную культуру выращивали в термостате при 37°С. Клетки из ночной культуры центрифугировали и переносили в колбы объемом 250 мл, содержащие 100 мл среды М9, до начальной OD 600 = 0.1 и выращивали на качалках при скорости вращения 140 об/мин и температуре 37°С до OD 600 = 0.6. Далее культуру центрифугировали и ресуспендировали в 8 мл среды M9. В ячейки иммунологического планшета добавляли 5 мкл исследуемых экстрактов, 5 мкл концентрированных клеток (до конечной OD 600 = 0.1) и среду M9 до общего объема 200 мкл. OD 600 измеряли до и после добавления клеток, чтобы учесть цветность экстракта. Планшеты культивировали на качалках (140 об/мин, температура 37°С) 20 мин, измеряли OD 600 и в опытные ячейки вносили Н 2 О 2 до концентрации 0.1 и 4 мМ. Культивирование продолжали в течение 30 мин, после чего измеряли OD 600 на микропланшетном спектрофотометре BioRad xMark. Полученные значения использовали для подсчета удельной скорости роста (µ).
µ = ∆ln OD 600 /∆t, где t – время, час.
Антиоксидантную активность определяли, как способность экстракта защищать клетки от действия перекиси водорода и количественно выражали как отношение µ в присутствии экстракта к значению µ без экстракта.
Определение β-галактозидазы на планшетах. Активность β-галактозидазы вычисляли по методу Миллера (Miller 1972) [14], модифицированному нами для измерения на планшетах. По 30 мкл культуры из каждой ячейки первого планшета (для определения АОА) переносили на второй с 90 мкл восстановительного буфера в каждой ячейке, добавляли 1 мкл толуола и 1 мкл дезоксихолата. Инкубировали 30 мин при 37°С и 140 об/мин. Затем добавляли 30 мкл 2-нитрофенил β-D-галактопира-нозида (ОНФГ), инкубировали 1 час, останавливали реакцию добавлением 30 мкл K 2 CO 3 и измеряли OD 420 и OD 550 . Каждое измерение дублировали контролем без ОНФГ (вместо ОНФГ добавляли 30 мкл восстановительного буфера). Активность β-галакто-зидазы выражали в единицах Миллера, рассчитанных по формуле:
(OD420 - 1.75 × OD550 / OD600) × 100, где OD420 и OD550 – оптическая плотность образцов, OD600 – оптическая плотность бактериальной культуры, 100 – коэффициент, учитывающий продолжи- тельность экспозиции с ОНФГ и разведение исходной культуры.
Статистическая обработка данных. Экспериментальные данные обрабатывали, вычисляя стандартную ошибку и доверительный интервал. Каждый результат показан как среднее значение из не менее, чем трех независимых экспериментов ± стандартная ошибка среднего. Достоверность различий оценивали согласно t -критерию Стьюдента, различия считались значимыми при р < 0.05.
Результаты исследований
Радикалсвязывающая активность испытанных экстрактов варьировала в широких пределах, от высоких значений у тимьяна обыкновенного (2.8) и тимьяна Талиева (2.8) и пикульника двунадрезно-го (3.5) до низкого – у будры плющевидной (31.9) (таблица). Для сравнения, Тролокс (водорастворимый аналог витамина Е, используемый в качестве общепринятого стандарта) в наших условиях имел показатель – 0.01. Наиболее высокой хелатирующей способностью обладали экстракты змееголовника Рюйша и яснотки стеблеобъемлющей. Следует иметь в виду, что чем ниже абсолютное значение IC 50 и EC 50 , тем выше, соответственно, ради-калсвязывающая и хелатирующая активности. Наиболее высокое содержание полифенолов обнаружено в экстрактах тимьяна обыкновенного и тимьяна Талиева. Отмечена положительная корреляция между содержанием полифенолов в экстрактах и их радикалсвязывающей активностью (r = 0.8; P < 0.01).
Указанные в таблице значения параметров получены при содержании 1.67 мг сухого веса в
1 мл ДМСО. Добавление всех экстрактов в этой концентрации к растущим культурам бактерий E. coli NM3021, несущим слияние katG::lacZ , вызывало снижение удельной скорости роста (µ), величина которого зависела от вида растений. Наибольшим эффектом в этом отношении обладали экстракты тимьяна обыкновенного и тимьяна Талиева, снижавшие скорость роста на 41 и 28%, соответственно.
Окислительный стресс, вызванный обработкой бактерий 4 мМ пероксида, приводил к снижению скорости роста E. coli NM3021 с 0.97 до 0.17 час-1. Добавление всех экстрактов в среду культивирования существенно снижало бактериостатическое действие пероксида. Наибольшим эффектом обладали экстракты змееголовника Рюйша и тимьяна обыкновенного, повышавшие скорость роста в присутствии пероксида в 6.1 и 5.6 раза (рис. 1). Присутствие в среде экстрактов оказывало также стимулирующее действие на экспрессию антиоксидантного гена katG , который играет существенную роль в защите E. coli от пероксидного стресса. Обработка бактерий экстрактами в условиях нормального роста (отсутствие пероксида) вызывала заметное повышение экспрессии katG::lacZ. Наибольшее повышение этого показателя отмечено у экстрактов яснотки пурпурной и будры плющевидной, обработка которыми приводила к повышению экспрессии слияния в 2.5 раза по сравнению с необработанными клетками (рис. 1). Поскольку katG является Н 2 О 2 -индуцибельным геном, то добавление 4 мМ Н 2 О 2 вызывало, как и следовало ожидать, повышение экспрессии katG :: lacZ . Предобработка клеток экстрактами заметно стимулировала Н 2 О 2 -индуцируемую экспрессию слияния на 30–50 %.
Радикал-связывающая активность (РСА), хелатирующая способность (ХС) и содержание полифенолов в экстрактах
|
Растения |
Места сбора |
Время сбора |
РСА IC 50 мг/мл |
ХС EC 50 , мг/мл |
Полифенолы мг/г сух. в. |
|
Thymus serpillum Тимьян обыкновенный |
г. Сыктывкар |
2008 |
2.8±0.05 |
49.6±5.4 |
1.9±0.01 |
|
Thymus talijevii |
Интинский |
||||
|
Тимьян Талиева |
р-н |
2008 |
2.8±0.04 |
32.2±0.7 |
2.1±0.04 |
|
Galeopsis bifida Пикульник двунадрезный |
c. Выльгорт |
2011 |
3.5±0.05 |
28.8±0.5 |
1.5±0.02 |
|
Galeopsis bifida Пикульник двунадрезный |
г. Сыктывкар |
2010 |
14.9±0.37 |
39.3±0.35 |
0.35±0.02 |
|
Galeopsis speciosa Пикульник красивый |
с. Выльгорт |
2011 |
4.7±0.13 |
20.0±2.3 |
1.2±0.01 |
|
Prunella vulgaris Черноголовка обыкновенная |
с. Выльгорт |
2010 |
4.9±0.04 |
49.7±1.5 |
0.99±0.01 |
|
Dracocephalum ruyschiana Змееголовник Рюйша |
Усть-Цилемский р-н |
2011 |
5.1±0.14 |
13.7±0.7 |
1.0±0.02 |
|
Lamium purpureum Яснотка пурпурная |
с. Выльгорт |
2011 |
9.0±0.25 |
29.6±0.7 |
0.6±0.008 |
|
Lamium amplexicaule Яснотка стеблеобъемлющая |
c. Выльгорт |
2011 |
14.0±0.32 |
15.4±0.7 |
0.38±0.003 |
|
Glechoma hederaceа Будра плющевидная |
г. Сыктывкар |
2011 |
31.9±1.6 |
30.6±1.2 |
0.21±0.01 |
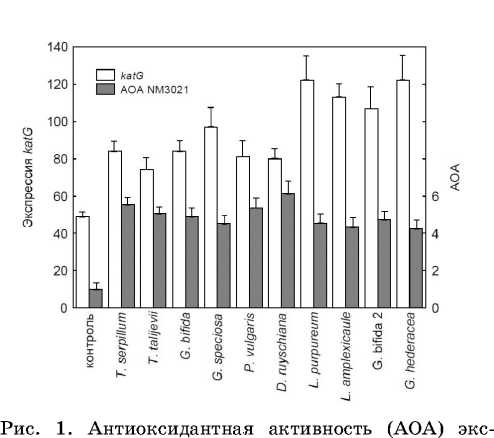
трактов и экспрессия слияния katG::lacZ в клетках
E. coli NM3021.
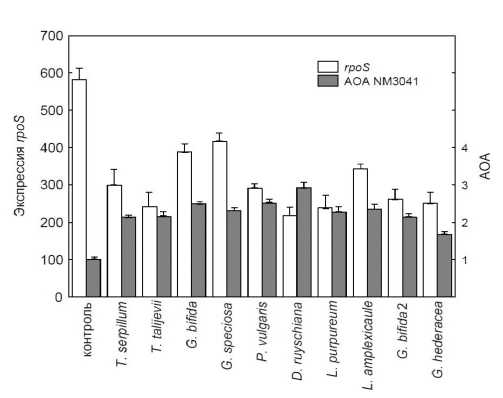
Рис. 2. Антиоксидантная активность (АОА) экстрактов и экспрессия слияния rpoS::lacZ в клетках
E. coli NM3041.
Выявлены прямая зависимость между антиоксидантной активностью экстрактов (АОА) и содержанием в них полифенолов (r = 0.6; P < 0.05) и обратная зависимость между АОА и степенью ингибирования роста бактерий экстрактами (r = - 0.7; P < 0.05). Кроме того, обнаружена прямая зависимость между экспрессией katG::lacZ (в отсутствии пероксида) и РСА (r = 0.76; P < 0.01).
При снижении концентрации экстрактов в пробах в 10 раз не отмечено ингибирования роста E. coli NM3021. В то же время, в этих условиях сохранялось как антиоксидантное действие всех экстрактов, так и способность к стимуляции экспрессии katG::lacZ. Предобработка экстрактами увеличивала скорость роста в условиях окислительного стресса в 1.7–2.9 раза и экспрессию katG::lacZ (в отсутствии пероксида) в 1.4–1.9 раза по сравнению с клетками, не обработанными экстрактами. Отмечена положительная корреляция между этими двумя параметрами (r = 0.66; P < 0.05).
Другой использованный нами в этой работе штамм E. coli NM3041 несет слияние rpoS::lacZ . В отличие от E. coli NM3021, только четыре экстракта вызывали заметное ингибирование роста клеток NM3041. Из них наибольший эффект оказывали экстракты тимьяна обыкновенного и тимьяна Та-лиева, ингибирующие рост на 28 и 27%, соответственно. Хотя все экстракты защищали E. coli NM3041 от пероксидного стресса, защитный эффект был значительно ниже, чем в культурах NM3021 (рис. 2).
Влияние экстрактов на экспрессию rpoS::lacZ значительно отличалось от их действия на katG::lacZ. Так, добавление экстрактов в среду культивирования в отсутствии пероксида не только не стимулировало экспрессию rpoS::lacZ, но даже наблюдалось небольшое ингибирование на 5–18% от уровня в необработанных клетках. Эта тенденция сохранялась и в клетках, обработанных последовательно экстрактами и пероксидом. Экспрессия rpoS::lacZ в этом случае была в среднем в два раза ниже, чем в клетках, не обработанных экстрактами (рис. 2).
При снижении концентрации экстрактов в пробах в 10 раз наблюдалась небольшая стимуляция роста бактерий E. coli NM3041 (в среднем на 5%). В этих условиях экстракты сохраняли способность к защите бактерий от пероксидного стресса, увеличивая скорость роста в 1.7–2.6 раза по сравнению с необработанными клетками. Экспрессия rpoS::lacZ в клетках, обработанных последовательно экстрактами и пероксидом, была на 12-30% ниже, чем в клетках, не обработанных экстрактами.
Обсуждение результатов
Результаты настоящей работы свидетельствуют о том, что исследуемые экстракты могли оказывать одновременное антиоксидантное действие на бактерии несколькими разными путями. Наличие радикалсвязывающей активности у части экстрактов, выявленное в тесте с ДФПГ•, указывает на возможность прямого взаимодействия компонентов экстрактов с АФК [4]. Способность к хелатированию ионов железа также может вносить вклад в антиоксидантное действие экстрактов благодаря ингибированию образования АФК в реакции Фентона [5]. В то же время полученные данные указывают на то, что экстракты могли защищать растущие E. coli от пероксидного стресса не только прямо, но и косвенно, стимулируя экспрессию антиоксидантных генов, в частности, гена katG, кодирующего катала-зу-гидропероксидазу HPI. Ген katG входит в состав регулона, контролируемого транскрипционным фактором OxyR. Активация OxyR происходит при взаимодействии низких концентраций H2O2 с его ре-докс-чувствительными сайтами [15]. Одной из возможных причин наблюдаемого увеличения экспрессии katG может быть продукция пероксида компонентами экстрактов, в первую очередь, полифенолами. Известно, что в определенных условиях полифенолы могут участвовать в генерации АФК и действовать как прооксиданты [6, 7]. Ранее нами установлено, что ряд растительных экстрактов и полифенолов способны генерировать пероксид в количествах, достаточных для активации OxyR [7, 9]. Суммируя приведенные выше данные, можно предположить, что исследуемые экстракты могли активировать антиоксидантные системы бактерий, действуя как прооксиданты.
Нами также проверено влияние исследуемых экстрактов на экспрессию гена rpoS, кодирующего σS субъединицу РНК-полимеразы (RpoS), которая контролирует экспрессию большого числа генов общего стрессового ответа и обеспечивает устойчивость ко многим стрессам. Полученные данные свидетельствуют о том, что в условиях нормального роста экстракты исследованных растений не стимулировали экспрессию rpoS . При пероксидном стрессе присутствие экстрактов вызывало даже снижение экспрессии rpoS . Вероятно, в условиях высокой активности генов OxyR-регулона, обеспечивающей достаточный уровень защиты от пероксида, отпадает необходимость для индукции RpoS-регулона [16].
Следует отметить, что из-за высокой стоимости тестов с применением животных к настоящему времени для первичного скрининга растительных экстрактов на АОА наиболее широко используются стандартные химические методы in vitro. Данная работа показывает, что генно-инженерные штаммы бактерий E. coli могут быть использованы для указанных выше целей как относительно простые и недорогие биологические тест-системы. В то же время исследование действия экстрактов на бактерии имеет и другое более фундаментальное значение. Все более широкое признание получает взгляд на совокупную кишечную микрофлору человека и животных как отдельный орган, нормальное функционирование которого имеет важное значение для поддержания здоровья. У E. coli важная ступень в жизненном цикле связана с пребыванием в кишечнике. В процессе переваривания пищи эти бактерии могут прямо контактировать с компонентами экстрактов медицинских растений и принимать участие в их метаболизме [17].
Работа выполнена при финансовой поддержке гранта Программы интеграционных исследований УрО РАН № 12-И-4-2072 и частичной поддержке гранта РФФИ-Урал №10-04-96017.
Список литературы Антиоксидантные свойства экстрактов растений семейства Lamiaceae, произрастающих в Республике Коми
- Matkowski A., Piotrowska M. Antioxidant and free radical scavenging activities of some medicinal plants from the Lamiaceae//Fitoterapia. 2006. №77. Р. 346-353
- Bettaieb I., Hamrouni-Sellami I., Bourgou S. et al. Drought effects on polyphenol composition and antioxidant activities in aerial parts of Salvia officinalis L.//Acta Physiol Plant. 2011. №33. Р.1103-1111
- Pietta P.G. Flavonoids in medicinal plants. In: Flavonoids in Health and Disease. N.Y.: Dekker, 1998. P. 61-110
- Rice-Evans C.A., Miller N.J., Bolwell P.G. et al. The relative antioxidant activities of plantderived polyphenolic flavonoids//Free Radical Res., 1995. Vol. 22, № 4. P. 375-383
- Sestili P., Diamantini G., Bedini A. et al. Plantderived phenolic compounds prevent the DNA single-strand breakage and cytotoxicity induced by tert-butyl-hydroperoxide via an iron-chelating mechanism//Biochem. J. 2002. Vol. 364. P. 121-128
- Smith A.H., Imlay J.A., Mackie R.I. Increasing the oxidative stress response allows Escherichia coli to overcome inhibitory effects of condensed tannins//Appl. Environ. Microbiol. 2003. Vol. 69. P. 3406-3411
- Smirnova G.V., Samoylova Z.Y., Muzyka N.G., Oktyabrsky O.N. Influence of polyphenols on Escherichia coli resistance to oxidative stress//Free Radical Biology and Medicine. 2009. Vol. 46, № 6. P. 759-768
- Nijveldt R.J., van Nood E., van Hoorn DEC. et al. Flavonoids: a review of probable mechanisms of action and potential applications//Am. J. Clin. Nutr. 2001. Vol. 74. P. 418-425
- Oktyabrsky O., Vysochina G., Muzyka N. et al. Assessment of antioxidant activity of plant extracts using microbial test systems//J. Appl. Microbiol. 2009. Vol. 106, № 4. P. 1175-1183
- Smirnova G., Vysochina G., Muzyka N. et al. Evaluation of antioxidant properties of medicinal plants using microbial test systems//World J. Microbiol. Biotechnol. 2010. Vol. 26, № 12. P. 2269-2276
- Shyur L-F, Tsung J-H, Chen J-HН. et al. Antioxidant properties of extracts from medicinal plants popularly used in Taiwan//Inter. J. Appl. Sci. Eng. Technol. 2005. Vol. 3. P. 195-202
- Kim H-J, Chen F et al. Evalution of antioxidant activity of Vetiver (Vetiveria zizanioides L.) oil and identification of its antioxidant constituents//J. Agric. Food Chem. 2005. Vol. 53. P. 7691-7695
- Миллер Дж. Эксперименты в молекулярной генетике. М.: Мир, 1976. 436 с
- Zheng M., Aslund F., Storz G. Activation of the OxyR transcription factor by reversible disulfide bond formation//Science. 1998. Vol. 279. P. 1718-1721
- Zhang A., Altuvia S., Tiwavi A. et al. The OxyR regulatory RNA represses rpoS translation and binds the Hfq (HF-I) protein//EMBO J. 1998. Vol. 17, №. 20. P. 6061-6068
- Halliwell B., Rafter J. Jenner A. Health pro-motion by flavonoides, tocopherols, tocotrienols, and other phenols: direct or indirect effects? Antioxidant or not?//Am. J. Clin. Nutr. 2005. Vol. 81. P. 268S-276S
- Wu L.-C., Hsu H.-W., Chen Y.-C. et al. Antioxidant and antiproliferative activities of red pitaya//Food Chem. 2006. Vol. 95. P. 319-327


