Антипсихотическая активность производного бензимидазола РУ-31 на моделях психоза у крыс
Автор: Калитин К.Ю., Муха О.Ю.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.40, 2025 года.
Бесплатный доступ
Шизофрения представляет собой сложное психическое расстройство, характеризующееся нарушениями когнитивных функций, эмоциональной регуляции и поведения. Особый интерес представляют селективные антагонисты 5-HT2A-рецепторов как потенциальные антипсихотические средства, обладающие более благоприятным профилем безопасности по сравнению с традиционными нейролептиками. Цель: исследование нейрофизиологических и поведенческих эффектов селективного антагониста 5-HT2A-рецепторов РУ-31 в сравнении с клозапином на моделях шизофреноподобных нарушений, индуцированных кетамином и неонатальным повреждением вентрального гиппокампа (ГПК). Материал и методы. В экспериментах использовались половозрелые белые крысы-самцы массой 250–290 г. Локальные полевые потенциалы (LFP) регистрировались в медиальной префронтальной коре (мПФК) и ГПК после введения кетамина (20 мг/кг) с последующим введением клозапина (7,5 мг/кг) или соединения РУ-31 (10 мг/кг). Выполнялся спектральный анализ сигналов. Для оценки функциональной связанности между мПФК и ГПК рассчитывался взвешенный индекс фазовой задержки (wPLI). Поведенческие нарушения оценивались в тестах апоморфин-индуцированной стереотипии, предпочтения сахарозы и отсроченного чередования в T-образном лабиринте у крыс с неонатальным разрушением вентрального ГПК. Результаты. Инъекция кетамина вызывала выраженные изменения нейрофизиологических параметров, включая гиперсинхронизацию в мПФК (увеличение мощности в дельта-, тета-, альфаи гамма-частотных диапазонах, p < 0,05) и десинхронизацию в ГПК (снижение мощности альфаи бета-частотных диапазонов, p < 0,05), а также функциональной связанности между этими областями (p < 0,05). В отличие от клозапина соединение РУ-31 проявляло нормализующее действие на спектральные характеристики сигналов и функциональную коннективность. Поведенческие тесты показали, что оба соединения уменьшали выраженность стереотипии, ангедонии и когнитивных нарушений. Заключение. Селективный антагонист 5-HT2A-рецепторов РУ-31 оказался эффективным в восстановлении нейрофизиологических и поведенческих изменений, связанных с шизофреноподобными состояниями. Его влияние на функциональную связанность и когнитивные параметры подчеркивает важность серотонинергической модуляции в патогенезе и терапии психотических расстройств.
Шизофрения, кетамин, неонатальное повреждение вентрального гиппокампа, функциональная коннективность, LFP, 5-HT2A-рецепторы, когнитивные нарушения
Короткий адрес: https://sciup.org/149148590
IDR: 149148590 | УДК: 547.785.51:615.214-092.9 | DOI: 10.29001/2073-8552-2025-40-2-133-141
Текст научной статьи Антипсихотическая активность производного бензимидазола РУ-31 на моделях психоза у крыс
Калитин К.Ю., Муха О.Ю. Антипсихотическая активность производного бензимидазола РУ-31 на моделях психоза у крыс. Сибирский журнал клинической и экспериментальной медицины. 2025;40(2):133–141.
Шизофрения и другие психотические расстройства сопровождаются выраженными изменениями нейрональной активности [1], которые проявляются в нарушении функциональной связанности между медиальной префронтальной корой (мПФК), гиппокампом (ГПК) и другими структурами лимбической системы [2, 3]. Указанные области мозга играют ключевую роль в в регуляции высших когнитивных функций и эмоций [4]. Несмотря на значительные достижения в области психофармакологии, разработка новых терапевтических стратегий, направ- ленных на коррекцию психических нарушений, остается актуальной задачей.
Современные представления о патогенезе психотических расстройств основываются на гипотезе нарушения баланса между возбуждающей и тормозной нейротрансмиссией. Глутаматергическая гипотеза шизофрении предполагает, что гипофункция рецепторов N-метил-D-аспартата (NMDA) приводит к дисбалансу в работе нейрональных сетей и нарушению нейропластичности [5]. В этой связи антагонисты NMDA-рецепторов, такие как кетамин, широко используются для моделиро- вания психоза у экспериментальных животных. Применение таких моделей позволяет не только исследовать патофизиологические механизмы, но и тестировать потенциал новых фармакологических соединений для лечения психотических расстройств. В качестве альтернативной модели выполнялась неонатальная деструкция вентрального гиппокампа, которая приводила к нарушениям поведения, аналогичным тем, что наблюдаются при шизофрении. Это подтверждается данными о вовлеченности ГПК в патогенез заболевания [6].
Важным аспектом современных исследований является разработка соединений с высокой избирательностью к отдельным нейротрансмиттерным системам. В частности, антагонисты 5-HT2A-рецепторов, такие как РУ-31, представляют интерес как перспективные агенты для коррекции психотических нарушений. Препарат клозапин, относящийся к группе атипичных антипсихотиков, уже доказал свою эффективность в устранении ряда симптомов шизофрении, однако его клиническое применение связано с высоким риском побочных эффектов [7]. В этой связи поиск новых соединений, оказывающих сравнимые с клозапином механизмы нейролептического действия, но обладающих более благоприятным профилем побочных эффектов, остается важным направлением.
Электрофизиологические методы исследования важны для понимания нейробиологических механизмов шизофрении и действия антипсихотических препаратов [8]. Основными подходами являются регистрация вызванных потенциалов (ERP), электроэнцефалография (ЭЭГ) и магнитоэнцефалография (МЭГ) [9]. Исследования показывают, что при шизофрении наблюдаются характерные изменения в компонентах P50, N100 и P300-вызванных потенциалов, что отражает нарушения в обработке сенсорной информации и когнитивных процессах [10]. Особое внимание уделяется негативности рассогласования (MMN); этот параметр значительно снижен у пациентов с шизофренией и может служить потенциальным биомаркером заболевания [11]. Регистрация локальных полевых потенциалов (LFP) в различных областях мозга позволяет детально исследовать нарушения осцилляторной активности при шизофрении. Важными маркерами заболевания являются изменения в гамма- (30–80 Гц) и тета-(4–8 Гц) ритмах, которые также связаны с когнитивными нарушениями [12]. Анализ функциональной коннективности между различными областями мозга позволяет отслеживать нарушения в синхронизации нейронных сетей.
В данной работе проводили регистрацию LFP и анализ функциональной связанности на основе взвешенного индекса фазовой синхронизации (wPLI). С помощью данных методов выполняли оценку влияния исследуемых соединений на нейрональные процессы в мПФК и ГПК, играющих критическую роль в реализации когнитивных функций.
Дополнительную оценку эффектов осуществляли с помощью комплекса поведенческих тестов, включающих исследование апоморфин-индуцированной стереотипии, предпочтения сахарозы и отсроченного чередования. Выбор данных поведенческих тестов обусловлен необходимостью комплексной оценки влияния исследуемого соединения РУ-31 на различные аспекты психопатологии, релевантные шизофрении. Апоморфин-индуцирован-ная стереотипия моделирует позитивную симптоматику, а именно двигательные нарушения, позволяя оценить антипсихотический потенциал соединения. Предпочтение сахарозы используется для оценки ангедонии, ключевого негативного симптома, связанного со снижением мотивации и удовольствия. Отсроченное чередование, в свою очередь, характеризует когнитивные функции, в частности рабочую память, которая часто нарушена при шизофрении. Интеграция электрофизиологических и поведенческих методов исследования позволяет не только подтвердить терапевтический потенциал соединения РУ-31, но также уточнить специфические механизмы его действия, что создает основу для разработки инновационных терапевтических стратегий в области психофармакологии.
Цель исследования: изучение влияния соединения РУ-31 и клозапина на нейрофизиологические, поведенческие и когнитивные нарушения, индуцированные кетамином и путем неонатального повреждения вентрального ГПК (NLVH).
Материал и методы
Электрофизиологические эксперименты, включающие регистрацию LFP, проводили на половозрелых белых крысах-самцах ( n = 20) в возрасте 4–5 мес. с массой тела 250–290 г. Моделирование психоза осуществляли на крысах-самцах ( n = 35), отобранных на 7-е сутки постнатального развития. Животных содержали в стандартных условиях вивария с 12-часовым световым циклом и температурным режимом 22 ± 2 °С, обеспечивая свободный доступ к полнорационному гранулированному корму (ГОСТ Р 50258-92) и воде. Все эксперименты выполняли в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для научных целей, а также с принципами надлежащей лабораторной практики (GLP) (ГОСТ 33044-2014, 2021).
Имплантацию электродов из нержавеющей стали (ø 0,1 мм) проводили под хлоралгидратным наркозом (400 мг/кг, в/б). После исчезновения роговичного рефлекса крыс фиксировали в стереотаксическом аппарате, стоматологическим буром в черепе проделывались отверстия (ø 1 мм), электроды размещали в соответствии со стереотаксическим атласом в правое полушарие мозга: мПФК – AP = +3,2 мм, ML = +0,6 мм, DV = 3,0 мм; ГПК – AP = –4,9 мм, ML = +4,8 мм, DV = 6,0 мм. Электроды фиксировали к черепу самоотвердевающей пластмассой (Белакрил-Э ХО, Россия) и двумя винтами из нержавеющей стали.
В данном исследовании были изучены особенности влияния клозапина ( n = 10) и соединения РУ-31 ( n = 10) на кетамин-индуцированные нейрофизиологические нарушения (рис. 1).
Перед введением фармакологических агентов регистрировали фоновую электрокортикографическую активность на протяжении 10 мин. Затем внутрибрюшинно вводили кетамин (20 мг/кг; ФГУП «Московский эндокринный завод», Россия) и через 20 мин регистрировали мозговую активность (10 мин). После этого вводили внутрибрюшинно клозапин (7,5 мг/кг; Органика, Россия) или соединение РУ-31 (10 мг/кг; НИИ физической и органической химии, ЮФУ, Россия) и через 20 мин фиксировали биоэлектрическую активность на протяжении 10 мин. Запись сигналов осуществляли с использованием лабораторного электроэнцефалографа NVX-36 (МКС, Россия) монополярным монтажом, импеданс электродов < 5 кОм.
Обработку сигналов и расчет спектральных характе-
Таймлайн эксперимента
• Введение вещества ■ Опытные вещества
Рисунок 1. Схема электрофизиологических исследований. Точками показано время введения веществ, цветными линиями отмечены периоды регистрации биоэлектрической активности мозга крыс
Figure 1. Timeline of electrophysiological experiments. Dots indicate substance administration times; colored lines represent periods of brain activity recording in rats ристик, а также взвешенного индекса фазовой задержки (wPLI) проводили с использованием Python (v.3.11.3) и пакета MNE Python (v.1.6.1). Для фильтрации сигнала применяли FIR-фильтр с полосой пропускания от 0,5 до 50 Гц, а для удаления артефактов – метод независимых компонент. Спектральный анализ осуществляли методом прямого дискретного преобразования Фурье для частотных диапазонов: дельта (0,5–4 Гц), тета (4–8 Гц), альфа (8–12 Гц), бета (12–30 Гц), гамма (30–50 Гц). Для анализа wPLI использовали те же диапазоны частот.
Чтобы оценить функциональную связанность между сигналами с мПФК и ГПК использовали взвешенный индекс фазовой задержки (wPLI). Расчет wPLI между электродами проводили с использованием пакета программного обеспечения MNE Python v.1.6.1 (BSD-3-Clause license) для следующих частотных диапазонов: дельта (0,5–4 Гц), тета (4–8 Гц), альфа (8–12 Гц), бета (12–30 Гц) и гамма (30–50 Гц).
При моделировании психоза методом неонатальной деструкции вентрального ГПК (NLVH) на 7-е сутки постнатального развития крыс распределяли на опытные группы и группу ложного оперативного вмешательства (ЛО). Животных подвергали гипотермии на влажном льду в течение 15 мин, после чего наносили лидокаин и выполняли разрез для обнажения черепа. В рамках модели NLVH в вентральный ГПК вводили 1,5 мкг иботеновой кислоты (ИК) (Sigma, США) в 0,3 мкл искусственной спинномозговой жидкости (ACSF) со скоростью 0,15 мкл/мин. После процедуры животных согревали и возвращали в клетки, а на 25-й день проводили отлучение от самки.
С 35-го дня на протяжении 21 дня крысы получали исследуемые соединения или физиологический раствор. В зависимости от этого животные были разделены на следующие группы: 1-я группа (n = 10) – крысы получали ИК + физиологический раствор (10 мл/кг, в/б); 2-я группа (n = 9) – ИК + РУ-31 (10 мг/кг, в/б); 3-я группа (n = 8) – ИК + клозапин (7,5 мг/кг, в/б); 4-я группа (n = 8) – ЛО + физиологический раствор (10 мл/кг, в/б). С 56-го дня поведенческие реакции оценивали в тестах апоморфиновой стереотипии, предпочтения сахарозы и отсроченного чередования в T-образном лабиринте. Предпочтение сахарозы рассчитывали как процентное отношение объема потребленного раствора сахарозы к общему объему потребляемой жидкости. Стереотипные реакции (принюхивание, грызение, лизание) определяли по 3-балльной шкале: 1 балл – слабая, 2 балла – умеренная, 3 балла – интенсивная стереотипия. Точность выполнения задачи в T-образном лабиринте оценивали в процентах по формуле:
количество правильных выборов / среднее количество правильных выборов в контрольной группе × 100.
Анализ спектральных характеристик и показателя взвешенного индекса фазовой задержки (wPLI) проводили с использованием однофакторного дисперсионного анализа (ANOVA) для повторных измерений. Рассматривали зависимые выборки, включающие три состояния: фоновую активность, активность после введения кетамина и активность после введения исследуемого препарата. Анализ осуществляли отдельно для двух групп: животных, получавших клозапин, и животных, получавших соединение РУ-31. В качестве показателей рассматривали спектральные характеристики (мощность в диапазонах дельта, тета, альфа, бета и гамма) и wPLI. Данные представлены как mean ± SEM .
Поведенческие данные, полученные в модели психоза, анализировали с использованием однофакторного дисперсионного анализа (ANOVA) с апостериорным тестом Даннетта для параметрических данных и критерия Краскела – Уоллиса с последующим апостериорным тестом Данна – для непараметрических данных. Данные представлены как mean ± SEM для параметрических и Me (IQR) – для непараметрических данных.
Статистический анализ данных проводили в программе GraphPad Prism (v.10.3.0). Нормальность распределения данных проверяли с использованием критерия Шапиро – Уилка. Уровень статистической значимости во всех тестах был установлен как p < 0,05.
Результаты и обсуждение
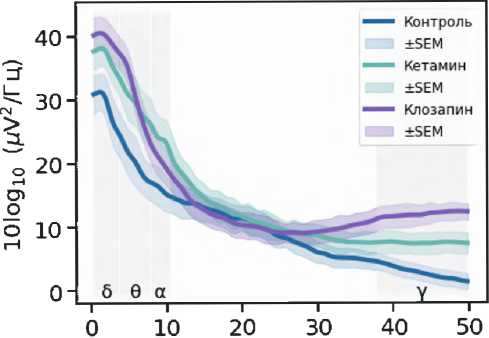
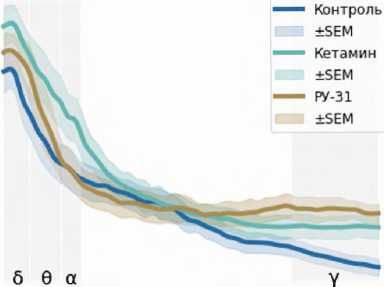
Введение кетамина (рис. 2) приводило к значительным изменениям нейрональной активности в мПФК и ГПК. Это проявлялось увеличением мощности в частотных диапазонах дельта, тета, альфа и гамма в мПФК, а также к снижением мощности альфа- и бета-частот в ГПК ( p < 0,05).
Эффекты атипичного антипсихотического препарата клозапина и антагониста 5-HT2A рецепторов РУ-31 были исследованы для понимания их роли в модуляции изменений, вызванных кетамином. Показано, что клозапин незначительно повышал мощность в диапазонах дельта и тета, а также статистически значимо увеличивал мощность гамма-частот, зарегистрированных в префронтальной коре. В ГПК клозапин снижал мощность альфа- мПФК
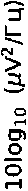
0 10 20 30 40 50
Частота, Гц
Частота, Гц
ГПК
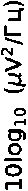
О 10 20 30 40 50
Частота, Гц
Частота, Гц
Рисунок 2. Спектральная плотность мощности LFP-сигналов в медиальной префронтальной коре и гиппокампе. Фоновая активность (первые 10 мин. записи) показана линией синего цвета. Спектральная плотность мощности сигналов под действием кетамина (20 мг/кг) отмечена зеленой линией. Фиолетовым и желто-коричневым цветами показана спектральная плотность мощности сигнала после введения атипичного нейролептика клозапина (7,5 мг/кг, в/б) и соединения РУ-31 (10 мг/кг, в/б). Серым цветом отмечены частотные диапазоны, в которых кетамин вызывал статистически значимые изменения ( p < 0,05)
Figure 2. Power spectral density of LFP signals in the medial prefrontal cortex (mPFC) and hippocampus (Hipp). Baseline activity (first 10 min of recording) is depicted by the blue line. Power spectral density of signals following ketamine administration (20 mg/kg) is shown by the green line. Power spectral density of the signals after administration of the atypical neuroleptic clozapine (7.5 mg/kg, i.p.) and compound RU-31 (10 mg/kg, i.p.) is shown in purple and yellowbrown colors. Frequency ranges in which ketamine caused statistically significant changes ( p < 0.05) are highlighted in grey
( p < 0,05) и бета-частотного ( p > 0,05) диапазонов по сравнению с сигналами, полученными после введения кетамина.
Селективный антагонист 5-HT2A рецепторов РУ-31 незначительно снижал вызванное кетамином увеличение мощности в мПФК в нескольких частотных диапазонах (дельта, p > 0,05; тета, p > 0,05; альфа, p < 0,05) и подобно клозапину повышал мощность гамма-частот ( p < 0,05). В ГПК соединение РУ-31 вызывало дополнительное снижение мощности альфа-частот ( p < 0,05) и значимое повышение мощности в бета-диапазоне ( p < 0,05).
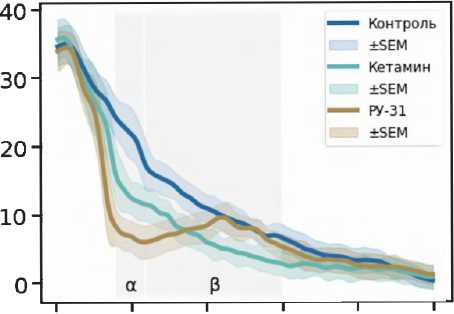
При изучении коннективности (рис. 3) в контрольной группе наблюдали наиболее выраженный пик wPLI на частоте около 10 Гц с последующим монотонным снижением показателя по мере увеличения частоты до пика меньшей величины на 32 Гц. Под действием кетамина происходило уменьшение wPLI по сравнению с контролем, особенно заметное на частотах выше 10 Гц. Введение клозапина и соединения РУ-31 вызывало дополнительное снижение wPLI в диапазоне 8–15 Гц. При этом соединение РУ-31 приводило к частичному восстановлению коннективности на частотах выше 30 Гц. В целом, данные указывают на значительное влияние кетамина и экспериментальных соединений на фазовую задержку между префронтальной корой и ГПК, что может иметь важное значение для понимания их нейрофизиологических эффектов.
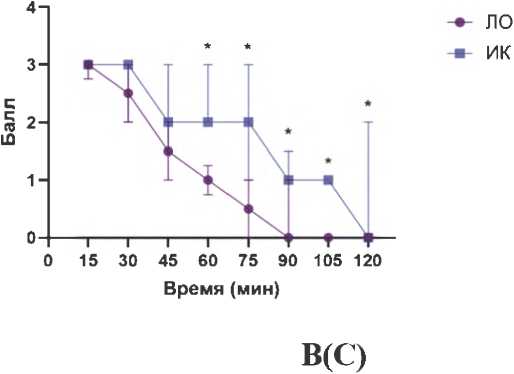
Стереотипное поведение, индуцированное введением апоморфина, оценивали у крыс с неонатальным повреждением вентрального ГПК и ЛО в течение 120 мин тестирования. В группе, где животные получали ИК, отмечено статистически значимое ( p < 0,05) усиление стерео-
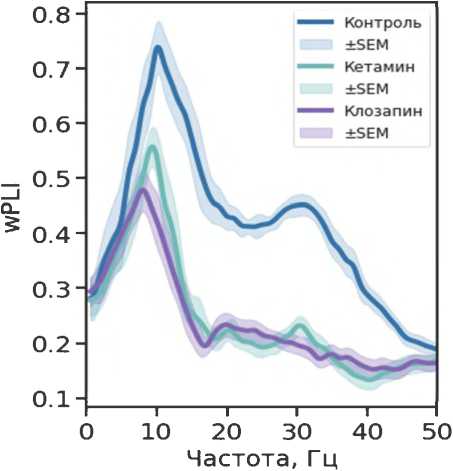
Рисунок 3. Нормализованные спектры (z-оценки) с изменениями взвешенного индекса фазовой задержки между LFP-сигналами медиальной префронтальной коры и гиппокампа под действием кетамина 20 мг/кг (зеленый), после введения клозапина 7,5 мг/кг (фиолетовый) и соединения РУ-31 10 мг/кг (желто-коричневый)
Figure. 3. Normalized spectra (z-scores) with changes in the weighted phase lag index between LFP signals of the medial prefrontal cortex and hippocampus under the influence of ketamine 20 mg/kg (green), after administration of clozapine 7.5 mg/kg (purple) and compound RU-31 10 mg/kg (yellow-brown)
Частота, Гц
А(А)
Б(В)
О 15 30 45 60 75 90 105 120
-■ ИКИК+клозапин
Время (мин)
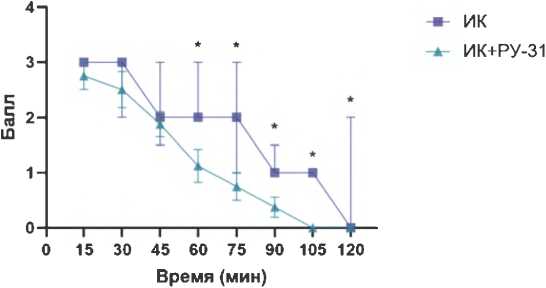
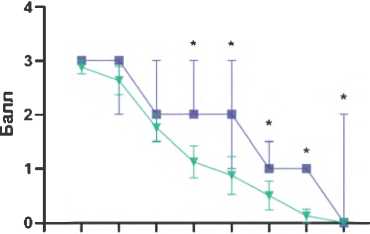
Рисунок 4. Влияние исследуемых соединений на апоморфин-индуцированное стереотипное поведение у крыс с неонатальным разрушением вентрального гиппокампа: А – динамика стереотипного поведения у ложнооперированных животных и крыс с повреждением вентрального гиппокампа; Б – влияние соединения РУ-31 (10 мг/кг) на стереотипное поведение у крыс с повреждением вентрального гиппокампа; В – влияние клозапина (7,5 мг/кг) на стереотипное поведение у крыс с повреждением вентрального гиппокампа. Данные представлены как Me (IQR), * – статистически значимые различия по сравнению с группой, получавшей иботеновую кислоту, p < 0,05.
Figure 4. Effect of the studied compounds on apomorphine-induced stereotyped behavior in rats with neonatal lesion of the ventral hippocampus: A – dynamics of stereotyped behavior in sham-operated animals and rats with NVHL; B – effect of compound RU-31 (10 mg/kg) on stereotyped behavior in rats with NVHL; C – effect of clozapine (7.5 mg/kg) on stereotyped behavior in rats with NVHL. Data are presented as Me (IQR), * – statistically significant differences compared to the ibotenic acid group, p < 0.05.
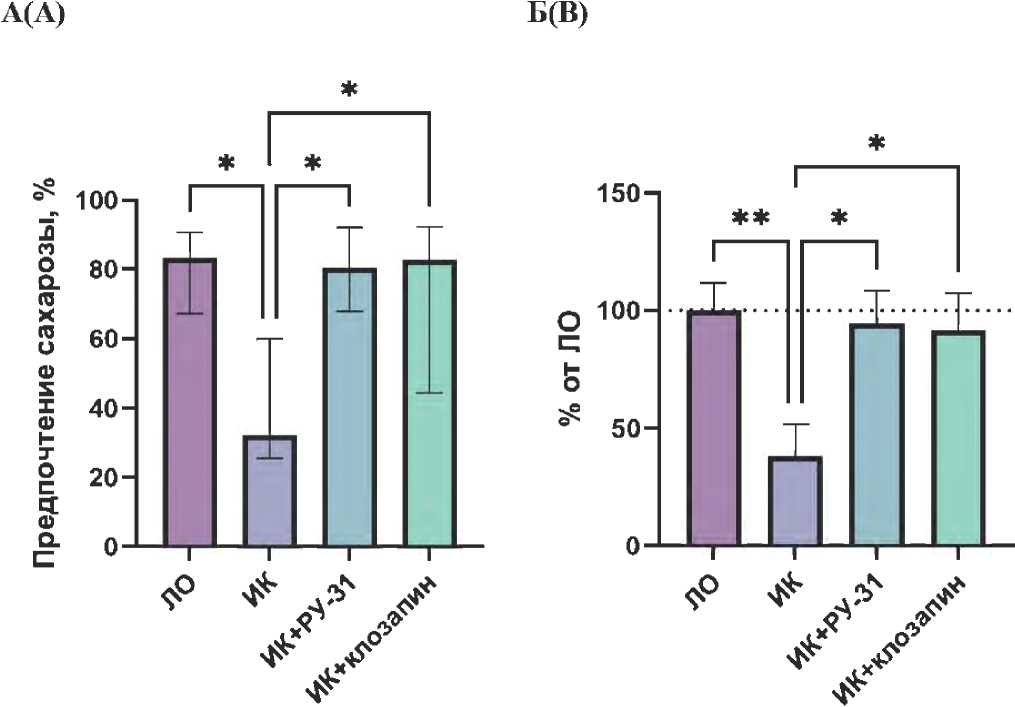
Рисунок 5. Влияние соединения РУ-31 (10 мг/кг) и клозапина (7,5 мг/кг) на поведение у крыс с неонатальным разрушением вентрального гиппокампа в тестах: А – предпочтение сахарозы, Me (IQR); Б – отсроченное чередование в T-образном лабиринте, M ± SEM . * – статистически значимые различия по сравнению с группой, получавшей иботеновую кислоту, p < 0,05; ** – статистически значимые различия по сравнению с группой, получавшей иботеновую кислоту, p < 0,01
Figure 5. Effect of RU-31 (10 mg/kg) and clozapine (7.5 mg/kg) on behavior of rats with neonatal ventral hippocampus lesions in the following tests: A – sucrose preference, Me (IQR); B – delayed alternation in the T-maze, M ± SEM . * – statistically significant differences compared to the ibotenic acid group, p < 0.05; ** – statistically significant differences compared to the ibotenic acid group, p < 0.01.
типного поведения по сравнению с группой ЛО, начиная с 60-й мин тестирования (рис. 4А). Введение соединения РУ-31 (рис. 4Б) и клозапина (рис. 4В) животным, получавшим ИК, привело к статистически значимому снижению выраженности стереотипного поведения, начиная с 60-й мин тестирования ( p < 0,05), что свидетельствует об эффективности этих соединений в коррекции поведенческих нарушений, вызванных апоморфином.
На рисунке 5А представлены результаты теста на предпочтение сахарозы у животных с неонатальным разрушением вентрального ГПК. Анализ с использованием критерия Краскела – Уоллиса показал наличие статистически значимых различий между группами ( H = 10,61; p = 0,014). У животных с неонатальным повреждением вентрального ГПК показатель предпочтения сахарозы был статистически значимо ниже по сравнению с ЛО группой ( Me = 32,2; IQR = 34,39; p < 0,05), что указывает на развитие ангедонического состояния. Введение соединения РУ-31 восстанавливало показатель предпочтения сахарозы до уровня, близкого к ЛО ( Me = 80,4; IQR = 24,36; p < 0,05). Аналогичный эффект наблюдался при введении клозапина ( Me = 82,7; IQR = 47,96; p < 0,05).
Показатели каждой группы в тесте на отсроченное чередование в T-образном лабиринте были выражены в процентах относительно среднего значения ЛО группы и проанализированы для выявления межгрупповых различий. Дисперсионный анализ (ANOVA) продемонстрировал наличие статистически значимых различий между группами (F (3,31) = 4,598, p = 0,0089) (рис. 5Б). У животных с неонатальным повреждением вентрального ГПК, получавших физиологический раствор, количество правильных чередований было существенно ниже по сравнению с ЛО группой (p < 0,01). Введение соединения РУ-31 приводило к значительному улучшению показателей чередования (p < 0,05), при этом введение препарата сравнения клозапина также увеличивало количество правильных чередований (p < 0,05).
Результаты настоящего исследования подтверждают значительное влияние кетамина на нейрофизиологические и поведенческие параметры, что согласуется с ранее описанными данными о его способности индуцировать шизофреноподобные состояния у животных. Наблюдаемые изменения спектральной мощности сигналов и снижение функциональной коннективности между мПФК и ГПК могут отражать ключевые механизмы патогенеза психотических состояний.
Необходимо отметить, что клозапин и соединение РУ-31 оказывали различное влияние на нейрофизиоло- гические параметры. Клозапин, являясь представителем атипичных антипсихотиков, фактически не проявил способности восстанавливать спектральные характеристики, однако частично нормализовал коннективность в кортико-гиппокампальной сети. Это согласуется с исследованиями, показавшими, что значительная часть пациентов, получающих клозапин, демонстрируют изменения в ЭЭГ [13]. Сообщается, что у 50–65% пациентов наблюдаются такие отклонения, как развитие эпилептиформной активности. Исследования продемонстрировали, что клозапин может модулировать колебательную активность в различных областях мозга [14]. Например, в исследованиях с участием грызунов было установлено выраженное влияние клозапина на высокочастотные колебания (HFO) в таких областях, как префронтальная кора и прилежащее ядро [14].
Селективный антагонист 5-HT2A рецепторов РУ-31 проявил более избирательное воздействие на спектральные параметры. В нашем исследование вещество РУ-31 показало способность восстанавливать функциональную коннективность в диапазоне высоких частот. Наблюдаемая нормализация осцилляторной активности согласуется с данными о критической роли 5-HT2A рецепторов в модуляции кортикальных ритмов [15, 16]. Более того, было установлено, что нарушение сигнализации через 5-HT2A рецепторы приводит к дезорганизации крупномасштабных нейронных сетей, что может быть одним из механизмов когнитивной дисфункции при шизофрении [17].
Важно отметить, что наблюдаемые эффекты РУ-31 на функциональную коннективность могут иметь и более долгосрочные последствия в аспекте нейропластичности. Исследования подтверждают, что модуляция 5-HT2A рецепторов влияет на экспрессию нейротрофических факторов и синаптическую пластичность [18]. В условиях гиперсеротонинергической активации, характерной для шизофрении, возможны вторичные нарушения нейротрансмиссии, поскольку активация 5-HT2A рецепторов в префронтальной коре головного мозга приводит к длительной синаптической депрессии (LTD) в глутаматерги-ческих пирамидальных нейронах слоя V. Это открывает перспективы использования селективных антагонистов 5-HT2A рецепторов не только для симптоматического лечения, но и для потенциальной модификации течения заболевания.
Результаты поведенческих исследований демонстрируют способность вещества РУ-31 и клозапина уменьшать выраженность ангедонии и когнитивных нарушений. Это корреспондирует с данными о том, что селективная блокада 5-HT2A рецепторов улучшает социальное поведение и когнитивные функции, представляя особую значимость при шизофрении [19]. Важно отметить, что улучшение показателей предпочтения сахарозы под действием РУ-31 соответствует данным о ключевой роли серотонинергической системы в регуляции системы вознаграждения и эмоционального поведения [20].
Интересным аспектом, требующим дальнейшего изучения, является потенциальное влияние РУ-31 на глу-таматергическую систему. Учитывая тесную взаимосвязь между серотониновой и глутаматной нейротрансмиссией в префронтальной коре, можно предположить, что наблюдаемые эффекты, возможно, опосредованы модуляцией NMDA-рецепторов. Это особенно актуально в контексте кетаминовой модели шизофрении, где первичное нару- шение глутаматергической передачи приводит к каскаду нейрохимических изменений. Дальнейшие исследования с использованием специфических маркеров глутаматер-гической активности могли бы прояснить этот механизм действия.
Отдельного внимания заслуживает временная динамика наблюдаемых эффектов. В настоящем исследовании мы фокусировались на относительно краткосрочных изменениях, однако остается открытым вопрос о долгосрочных последствиях блокады 5-HT2A рецепторов. Существует вероятность, что продолжительное применение селективных антагонистов может быть сопряжено с дополнительными фармако-терапевтическими свойствами.
В целом, наши данные, подкрепленные результатами предыдущих исследований, свидетельствуют о перспективности дальнейшей разработки селективных антагонистов 5-HT2A рецепторов как потенциальных антипсихотических средств. Особенно важным представляется их возможное преимущество в отношении когнитивных нарушений и негативной симптоматики – аспектов заболевания, которые остаются недостаточно скорректированными существующей терапией.
Заключение
В ходе проведенного исследования показана способность селективного антагониста 5-HT2A-рецепторов – соединения РУ-31 модифицировать нейрофизиологические и поведенческие изменения, вызванные кетамином и неонатальным повреждением вентрального ГПК. Производное бензимидазола РУ-31 оказалось эффективным в нормализации спектральных характеристик биоэлектрической активности мозга, восстановлении функциональной коннективности между мПФК и ГПК, а также в улучшении когнитивных функций и снижении выраженности негативной симптоматики. Полученные результаты расширяют представления о терапевтическом действии антагонистов 5-HT2A-рецепторов и укрепляют методическую основу для разработки инновационных фармакологических средств лечения расстройств психотического спектра.


