Антитела к бензо[а]пирену, эстрадиолу и прогестерону у больных раком молочной железы в постменопаузе
Автор: Глушков Андрей Николаевич, Поленок Елена Геннадьевна, Магарилл Юрий Абрамович, Аносова Татьяна Петровна, Антонов Александр Викторович, Вержбицкая Наталья Евгеньевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.15, 2016 года.
Бесплатный доступ
Выявление женщин с высоким риском возникновения рака молочной железы является ключевым зве- ном в химиопрофилактике этого заболевания селективными модуляторами эстрогеновых рецепторов. Цель исследования - изучить специфические иммунные реакции на химические канцерогены и по- ловые стероидные гормоны, ассоциированные с раком молочной железы, у женщин в постменопаузе. Материал и методы. С помощью полуколичественного иммуноферментного анализа были изучены сывороточные антитела класса А, специфичные к бензо[a]пирену, эстрадиолу и прогестерону, у 203 здоровых некурящих женщин и 469 некурящих больных раком молочной железы (125 женщин с ER- и 344 с ER+ статусом опухоли). Результаты. Низкие уровни всех трех антител были обнаружены у 53,2 % здоровых женщин, 47,2 % больных раком молочной железы с ER- статусом опухоли и 40,7 % с ER+. Высокие уровни всех трех антител встречались в 12,3 %, 18,4 %, 26,5 % случаев соответственно. Во всех группах уровни антител к эстрадиолу и прогестерону коррелировали с уровнями антител к бензо[a]пирену (rs=0,54-0,7, p
Рак молочной железы, антитела, бензо[а]пирен, эстрадиол, прогестерон
Короткий адрес: https://sciup.org/140254080
IDR: 140254080 | УДК: 616-097.3:618.19-006 | DOI: 10.21294/1814-4861-2016-15-6-28-34
Текст научной статьи Антитела к бензо[а]пирену, эстрадиолу и прогестерону у больных раком молочной железы в постменопаузе
Проблема профилактики рака молочной железы (РМЖ) остаётся актуальной в связи с повсеместным ростом заболеваемости [1]. В настоящее время для первичной профилактики РМЖ применяются тамоксифен, ралоксифен и другие селективные модуляторы рецепторов эстрогенов (ER) [2]. Для повышения их эффективности необходимо определить риск возникновения ER+ РМЖ у здоровой женщины. В геноме человека обнаружены локусы (12q24, rs1292011 и 21q21, rs2823093), ассоциированные с ER+ РМЖ, однако соответствующие белковые продукты не идентифицированы [3]. Анализ полиморфных вариантов генов BRCA [4], ферментов метаболизма ксенобиотиков и стероидных гормонов [5–7], ферментов репарации ДНК [8, 9] не позволяет определить индивидуальный риск возникновения ER+ РМЖ.
Ведутся экспериментальные разработки новой стратегии профилактики онкологических заболеваний, основанной на использовании канцероген-специфических антител (АТ). In vitro доказано, что АТ способны тормозить канцерогенез за счёт ограничения проникновения химических канцерогенов из окружающей среды в клетки поверхностного эпителия и угнетения метаболической активации канцерогенов [10, 11]. In vivo иммунизация животных конъюгатами химических канцерогенов с белками или ДНК сопровождается угнетением их проникновения из окружающей среды в организм и торможением возникновения индуцированных опухолей [12–19]. Кроме того, активная иммунизация животных против эстрогенов приводит к изменениям их концентрации в крови и тормозит рост эстроген-чувствительных опухолей [20, 21].
Между тем знания об особенностях образования АТ к химическим канцерогенам окружающей среды и эндогенным стероидным гормонам в естественных условиях у человека крайне ограничены. Ранее АТ против полициклических ароматических углеводородов и их аддуктов с ДНК были обнаружены в сыворотке крови человека [22–25]. АТ к этим канцерогенам и половым стероидам обнаружены у больных РМЖ [26, 27]. Одновременное повышение уровней АТ класса G, специфичных к бензо[a]пирену (БП), эстрадиолу (ЭС) и прогестерону (ПГ), встречалось значительно чаще у больных РМЖ, чем у здоровых женщин [28]. Однако взаимосвязи АТ с ER+ РМЖ не было выявлено. В то же время предполагается, что АТ класса А способны стимулировать трансформацию ER+ клеток за счет связывания канцерогенов и ЭС и усиления их транспорта в эпителиальные клетки [29].
Цель исследования – изучение ассоциации АТ класса А, специфичных к БП, ЭС и ПГ с ER+ РМЖ.
Материал и методы
В исследование включены 672 некурящие женщины в постменопаузе, из них у 469 была диагностирована инвазивная карцинома молочной железы, эти пациентки получали лечение в условиях Областного клинического онкологического диспансера г. Кемерово. Диагноз РМЖ в каждом случае был подтвержден морфологически. Информация о гормон-рецепторном статусе опухолей была взята из протоколов патоморфологического отделения. Средний возраст больных РМЖ составил 62,6 ± 8,7 года. В группу сравнения были включены 203 здоровые женщины без патологии молочной железы (средний возраст – 58,9 ± 5,8 года).
Забор периферической крови осуществлялся согласно этическим стандартам в соответствии с Хельсинкской декларацией 1975 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003. Все лица, участвовавшие в исследовании, дали на это информированное письменное согласие.
Исследование АТ класса А к БП, ЭС и ПГ проводили с помощью неконкурентного иммунофер-ментного анализа в собственной модификации [22]. В качестве антигена на полистирольные иммунологические планшеты были иммобилизованы конъюгаты БП, ЭС и ПГ с бычьим сывороточным альбумином (БСА). Конъюгат ЭС-БСА был синтезирован путем присоединения БСА к эстрадиолхи-нонам, полученным окислением ЭС солью Фреми. Конъюгат ПГ-БСА был получен путем конъюгации гемиглутарата 21-гидроксипрогестерона и БСА карбодиимидным способом. Иммунологические планшеты сенсибилизировали в течение ночи при комнатной температуре. Образцы сыворотки крови в разведении 1:20 вносили по 100 мкл в лунки планшета в дублях, инкубировали 1 ч при 37°С на шейкере. Cвязавшиеся АТ выявляли с помощью козьих АТ против IgA человека, меченных пероксидазой хрена (Novex, США), разведение конъюгата 1:10000. Регистрацию адсорбированных на планшете АТ проводили с помощью субстратного буфера, содержащего тетраметилбензидин (TMB, США), на фотометре (Пикон, Россия) при длине волны 450 нм. Уровни АТ к гаптенам выражали в относительных единицах и вычисляли по отношению связывания АТ с конъюгатом гаптен-БСА (за вычетом фонового связывания с БСА) к БСА.
Статистическую обработку результатов проводили с использованием Statistica 6.0 (StatSoft Inc., USA). Ненормальный характер распределения показателей определили с помощью критерия Шапиро–Уилка и в дальнейшем статистически значимые различия между группами выявляли с помощью U-критерия Манна–Уитни при уровне значимости p<0,05 и непараметрического критерия χ2 с поправкой Йейтса на непрерывность вариации. При расчете критерия χ2 исследуемые признаки группировались в четырехпольную таблицу (d.f.=1). За критический уровень значимости принималось значение p<0,05. Ассоциации исследуемых АТ с РМЖ оценивали с помощью величины отношения шансов (ОR) с доверительным интервалом (CI) при 95 % уровне значимости. Для выявления пороговых значений уровней АТ (cutoff) был проведен ROC-анализ [30]. Взаимосвязи между уровнями исследуемых АТ были оценены с помощью ранговой корреляции Спирмена.
Результаты и обсуждение
Пограничные значения уровней IgA-БП, IgA-ЭС и IgA-ПГ, по которым здоровые женщины и больные РМЖ имели наиболее значимые различия, были определены с помощью ROC-анализа. Высокие уровни IgA-БП (>3) и IgA-ЭС (>3) в общей группе больных РМЖ (40,3 % и 43,1 %) обнаруживались значительно чаще, чем у здоровых (22,2 % и 29,9 % соответственно). При этом OR возрастал до 2,4 и 1,8 соответственно. Пограничное значение IgА-ПГ оказалось равным 3, однако статистически значимой разницы между сравниваемыми группами по этому показателю выявить не удалось, и OR оставался в пределах 0,7–1,5.
Принимая во внимание то, что в каждом индивидуальном случае образование АТ одной специфичности может происходить при отсутствии АТ другой специфичности, был выполнен анализ 8 возможных сочетаний высоких и низких уровней АТ к БП, ЭС и ПГ у здоровых женщин и больных РМЖ (таблица). Выяснилось, что отсутствие или низкие уровни IgA ко всем трём исследуемым гаптенам (комбинация 1) при РМЖ встречается значимо реже, чем в группе сравнения, – 42,4 % против 53,2 %, OR снижается до 0,6. Далее сопоставляли число случаев с высокими уровнями таблица
Частота встречаемости высоких уровней антител к бензо[a]пирену (igа-БП), эстрадиолу (igа-Эс) и прогестерону (igа-ПГ) у здоровых женщин и больных рМж в зависимости от рецепторного статуса
|
Комбинации антител |
Здоровые женщины (n=203) |
Больные РМЖ (n=469) |
Больные РМЖ ER– (n=125) |
Больные РМЖ ER+ (n=344) |
|
1. IgА-БП ≤3 |
108 (53,2 %) |
199 (42,4 %) |
59 (47,2 %) |
140 (40,7 %) |
|
IgА-ЭС ≤3 |
p=0,01 |
p=0,35 |
p=0,005 |
|
|
IgА-ПГ ≤3 |
0,6 (0,5–0,9) |
0,6 (0,4–0,9) |
||
|
2. IgА-БП >3 |
7 (3,4 %) |
29 (6,2 %) |
9 (7,2 %) |
20 (5,8 %) |
|
IgА-ЭС ≤3 |
0,09 |
p=0,17 |
p=0,11 |
|
|
IgА-ПГ ≤3 |
||||
|
3. IgА-БП ≤3 |
10 (4,9 %) |
41 (8,7 %) |
13 (10,4 %) |
28 (8,1 %) |
|
IgА-ЭС >3 |
p=0,04 |
p=0,08 |
p=0,06 |
|
|
IgА-ПГ ≤3 |
2,2 (1,1–4,6) |
|||
|
4. IgА-БП ≤3 |
20 (9,9 %) |
21 (4,5 %) |
5 (4,0 %) |
16 (4,7 %) |
|
IgА-ЭС ≤3 |
0,13 |
p=0,19 |
p=0,24 |
|
|
IgА-ПГ >3 |
||||
|
5. IgА-БП >3 |
5 (2,5 %) |
28 (6,0 %) |
8 (6,4 %) |
20 (5,8 %) |
|
IgА-ЭС >3 |
p=0,03 |
p=0,11 |
0,04 |
|
|
IgА-ПГ ≤3 |
3,0 (1,1–8,1) |
3,1 (1,1–8,5) |
||
|
6. IgА-БП >3 |
8 (3,9 %) |
18 (3,8 %) |
4 (3,2 %) |
14 (4,1 %) |
|
IgА-ЭС ≤3 |
0,81 |
p=0,86 |
p=0,67 |
|
|
IgА-ПГ >3 |
||||
|
7. IgА-БП ≤3 |
20 (9,9 %) |
19 (4,1 %) |
4 (3,2 %) |
15 (4,4 %) |
|
IgА-ЭС >3 |
0,07 |
p=0,11 |
p=0,18 |
|
|
IgА-ПГ >3 |
||||
|
8. IgА-БП >3 |
25 (12,3 %) |
114 (24,3 %) |
23 (18,4 %) |
91 (26,5 %) |
|
IgА-ЭС >3 |
p=0,0004 |
p=0,15 |
p=0,0001 |
|
|
IgА-ПГ >3 |
2,5 (1,5–4,0) |
2,8 (1,7–4,7) |
исследуемых АТ в различных комбинациях (2–8) с комбинацией 1. Не было выявлено значимых различий между здоровыми женщинами и больными РМЖ по частоте встречаемости высоких уровней IgA-БП (комбинация 2) или IgA-ПГ (комбинация 4). Высокие уровни IgA-ЭС (комбинация 3) у больных РМЖ (8,7 %) встречались чаще, чем у здоровых (4,9 %, р=0,04), при этом значение OR возрастало до 2,2. Одновременное повышение уровней IgA-БП и IgA-ЭС (комбинация 5) у больных РМЖ (6,0 %) встречалось значимо чаще, чем у здоровых (2,5 %, р=0,03). По частоте обнаружения IgA-БП или IgA-ЭС совместно с IgA-ПГ (комбинации 6 и 7) сравниваемые группы не отличались. Индивидуальное сочетание высоких уровней всех трех исследуемых АТ (комбинация 8) обнаружено с большей частотой у больных РМЖ (24,3 %), чем у здоровых (12,3 %). В сравнении с комбинацией 1 – р=0,0004, OR=2,5. Сравнение частоты обнаружения указанных комбинаций (1–8) у больных ER– РМЖ со здоровыми женщинами не выявило значимых различий. В то же время отсутствие всех трех исследуемых АТ (комбинация 1) у больных ER+ РМЖ (40,7 %) встречалось значимо реже, чем у здоровых (53,2 %), с р=0,005 и OR=0,6. Одновременное повышение уровней IgA-БП и IgA-ЭС (комбинация 5), а также IgA-БП, IgA-ЭС и IgA-ПГ (комбинация 8) у больных ER+ РМЖ обнаружено с большей частотой, чем у здоровых (5,8 % против
2,5 % и 26,5 % против 12,3 % соответственно). В последнем случае р=0,0001, OR=2,6. Больные ER– и ER+ РМЖ не отличались друг от друга по частоте обнаружения в комбинациях 1–7. В то же время одновременное повышение уровней всех трех исследуемых АТ (комбинация 8) обнаруживали чаще у больных ER+ (26,5 %), чем у ER– РМЖ (18,4 %), с р=0,0001 и OR=2,8.
Таким образом, отсутствие АТ класса А, специфичных к БП, ЭС и ПГ, ассоциировано с пониженным риском ER+ (OR=0,6), но не ER– РМЖ. Одновременное повышение уровней IgA-БП и IgA-ЭС или IgA-БП, IgA-ЭС и IgA-ПГ ассоциировано с высоким риском ER+ (OR=3,1 и 2,8 соответственно), но не ER– РМЖ. Иммуноанализ указанных АТ может оказаться полезным в определении показаний для превентивного использования селективных ингибиторов эстрогеновых рецепторов с целью профилактики РМЖ у женщин в постменопаузе.
Обращает на себя внимание тот факт, что каждое исследуемое АТ по отдельности (комбинации 2–4) встречается в небольшом количестве случаев как у здоровых, так и у больных РМЖ (не более 10 %). Вместе с тем одновременное повышение уровней АТ всех трех специфичностей (комбинация 8) у больных ER+ РМЖ достигает 26,5 %. Это свидетельствует о том, что индукция IgA-БП может быть взаимосвязана с индукцией IgA-ЭС и IgA-ПГ.
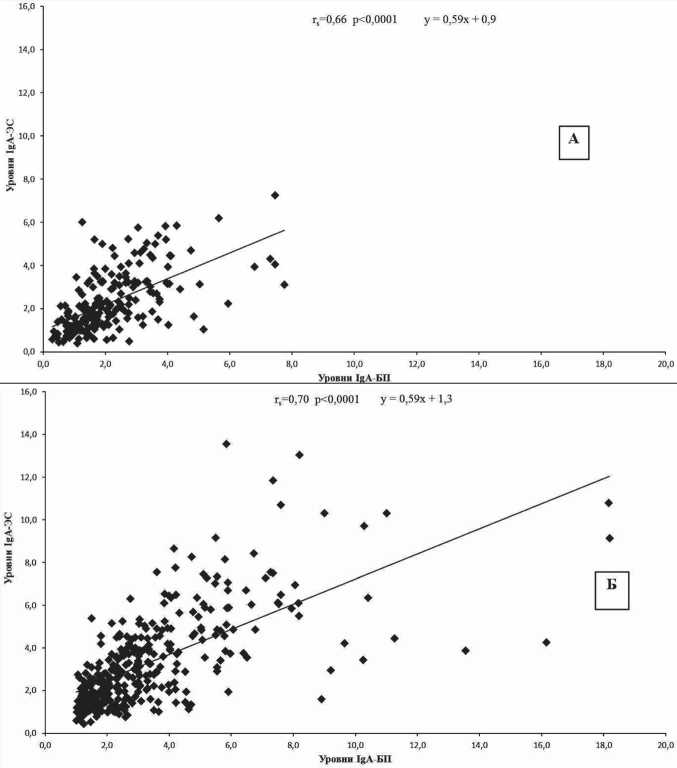
Рис. 1. Взаимосвязи уровней IgA-ЭС (у) и IgA-БП (х) у здоровых женщин (А) и больных ER+ РМЖ (Б)
И действительно, между уровнями IgA-БП, с одной стороны, и IgA-ЭС и IgA-ПГ, с другой стороны, обнаружены прямые линейные корреляционные связи средней силы как у здоровых женщин, так и у больных РМЖ (и ER+ и ER–) с коэффициентами корреляции rs=0,54–0,7 с р<0,0001. На рис. 1 приведен пример обнаруженных корреляций между IgA-ЭС (у) и IgA-БП (х) у здоровых женщин (А) и больных ER+ РМЖ (Б).
Таким образом, при стимуляции синтеза секреторных IgA против БП с профилактической целью вполне вероятно может повышаться уровень сывороточных IgA-БП. В свою очередь, это может повлечь за собой индукцию IgA-ЭС и IgA-ПГ, которые в комбинации с IgA-БП могут не тормозить, а стимулировать возникновение ER+ РМЖ. Поэтому стратегия активной иммунопрофилактики рака у человека за счет стимуляции антиканцерогенного иммунитета, предлагаемая некоторыми авторами [15-17, 19, 31], нуждается в дополнительной проверке. В частности, при иммунизации животных конъюгатами химических канцерогенов с макромолекулярными носителями необходимо контролировать синтез АТ, специфичных не только к канцерогенам, но и к эндогенным стероидам.
Заключение
В канцерогенезе рака молочной железы принимают участие две основные группы факторов: внешние – химические канцерогены (в том числе полициклические ароматические углеводороды, БП) и внутренние – стероидные гормоны. Поэтому в разработке информативных методов определения риска РМЖ необходимо учитывать их совместное воздействие на клетки-мишени. Этому условию соответствует исследование специфических иммунных реакций на указанные химические соединения.
В работе показано, что образование АТ, специфичных к БП, ЭС и ПГ, – взаимосвязанные процессы. Уровни IgA-ЭС и IgA-ПГ коррелируют с уровнями IgA-БП с высокой статистической значимостью (p<0,0001). Одновременное повышение уровней указанных АТ ассоциировано с ER+ РМЖ (p<0,0001; OR=2,8), но не с ER– РМЖ. Таким образом, комплексный иммуноанализ АТ против химических канцерогенов окружающей среды и половых стероидных гормонов можно рассматривать как перспективный метод в определении показаний для превентивного назначения тамоксифена и других селективных модуляторов эстрогеновых рецепторов. В то же время активная стимуляция антиканцерогенного иммунного ответа с целью профилактики РМЖ может сопровождаться повышением уровня АТ, специфичных к стероидным гормонам, и возрастанием риска возникновения РМЖ. Очевидно, для защиты человека от воздействия химических канцерогенов потребуются иные методические подходы.
Список литературы Антитела к бензо[а]пирену, эстрадиолу и прогестерону у больных раком молочной железы в постменопаузе
- Писарева Л.Ф., Чойнзонов Е.Л., Гурина Л.И., Одинцова И.Н., Шойхет Я.Н., Лазарев А.Ф., Юдин С.В., Косых Н.Э. Онкоэпидемиологические исследования в регионе Сибири и Дальнего Востока. Дальневосточный медицинский журнал. 2005; 1: 51-55.
- Sestak I. Preventative therapies for healthy women at high risk of breast cancer. Cancer Manag Res. 2014 Oct 17; 6: 423-30. DOI: 10.2147/CMAR.S55219
- Ghoussaini M., Fletcher O., Michailidou K., Turnbull C., Schmidt M.K., Dicks E., Dennis J., Wang Q., Humphreys M.K., Luccarini C., Baynes C., Conroy D., Maranian M., Ahmed S., Driver K., Johnson N., Orr N., dos Santos Silva I., Waisfisz Q., Meijers-Heijboer H., Uitterlinden A.G., Rivadeneira F. Genome-wide association analysis identifies three new breast cancer susceptibility loci. Nat Genet. 2012 Jan 22; 44 (3): 312-8. DOI: 10.1038/ng.1049
- Имянитов Е.Н. Наследственный рак молочной железы. Практическая онкология. 2010; 11 (4): 258-266.
- Бурденный А.М., Казубская Т.П., Брага Э.А., Носиков В.В., Логинов В.И. Ассоциация полиморфных маркеров генов биотрансформации ксенобиотиков с раком молочной железы у женщин Московского региона. Молекулярная медицина. 2012; 5: 30-34.

![Антитела к бензо[а]пирену, эстрадиолу и прогестерону у больных раком молочной железы в постменопаузе Антитела к бензо[а]пирену, эстрадиолу и прогестерону у больных раком молочной железы в постменопаузе](/file/cover/140254080/antitela-k-benzo-a-pirenu-jestradiolu-i-progesteronu-u-bolnyh-rakom-molochnoj.png)
