Аортокоронарное шунтирование в лечении больных инфарктом миокарда после тромболитической терапии
Автор: Чернявский А.М., Марков В.А., Шипулин В.М., Чернов В.И., Гольцов С.Г., Гарганеева А.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 1 т.2, 1998 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142233282
IDR: 142233282
Текст статьи Аортокоронарное шунтирование в лечении больных инфарктом миокарда после тромболитической терапии
Широкое внедрение в клиническую практику тромболитической терапии (ТЛТ) позволило у значительного количества больных восстановить коронарный кровоток и существенно расширить перспективы лечения инфаркта миокарда (ИМ) [4, 15, 17]. Ранее проведенные исследования доказали, что ТЛТ при ИМ существенно уменьшает раннюю летальность, но этот эффект нивелируется повышенной летальностью при длительном наблюдении, так как от 10 до 43% этих больных переносят повторную реокклюзию инфаркт - связанной коронарной артерии (ИСКА) с расширением зоны ИМ, что усугубляет течение заболевания и нивелирует положительный эффект тромболизиса [10, 11,17].
По данным наших предшествующих исследований, проведенных под руководством профессора В.А.Маркова [4], в 42.6% случаев успешной реканализации КА сохранялся остаточный стеноз сосуда более 75%. У 42.3% этих больных при выполнении контрольной ангиографии на 3-й неделе заболевания была выявлена реокклюзия КА, а при мониторировании размера очага поражения миокарда у 71.4% пациентов выявлены эпизоды рецидивирования ИМ. Учитывая, что реокклюзии возникают вследствие повторного тромбообразования и напрямую связаны со степенью остаточного стеноза коронарной артерии (КА), среди возможных путей решения этой проблемы наиболее достойное место в обсуждении занимают хирургические методы лечения [3, 6, 9, 16].
Материал и методы
В нашей работе анализируются результаты лечения 156 больных, которые поступили в клиники НИИ кардиологии ТНЦ СО РАМН с диагнозом: острый инфаркт миокарда в период 1990-1996 годы. В соответствии с принятой тактикой лечения этим пациентам проводилась ТЛТ по следующей схеме. Внутривенный (системный) тромболизис выполнялся на догоспитальном этапе методом быстрого введения 500 тыс. Ед стрептокиназы (Авелизин, AWD, Германия) на 20 мл изотонического раствора в сочетании с 10000 Ед гепарина. Достижение реканализации КА подтверждалось данными коронарографического исследования, выполненного через 1.5-3 часа при поступлении больного в стационар. При неэффективном системном тромболизисе проводили интракоронарный лизис тромба посредством суперселективного введения 250 тыс. Ед стрептокиназы в устье ИСКА. При успешной ТЛТ остаточный стеноз ИСКА в среднем составлял 82.4±1.2%.
106 больным в возрасте 49.2±4.6 лет в среднем через 19.2±4.6 дней после тромболизиса было проведено АКШ. 50 больных составили контрольную группу медикаментозного лечения. Показаниями для раннего аортокоронарного шунтирования (АКШ) были следующие: ^документированный ИМ по ЭКГ; 2) успешная реперфузия ИСКА; 3) наличие стеноза одной из артерий >75%; 4) документированная ишемия миокарда: наличие постинфарктной стенокардии и/или низкая ТФН (менее 50 Вт). В зависимости от степе ни поражения коронарного русла наложено от 1 до 6 коронарных шунтов (в среднем 3, 4).
Всем пациентам, кроме общеклинических, проводились специальные инструментальные и рентгенорадиологические исследования: ЭКГ; проба с дозированной физической нагрузкой для определения толерантности (ТФН); показатели центральной гемодинамики (ударный объем — УО, минутный объем — МО, сердечный индекс — СИ) оценивались посредством тетраполярной грудной реографии; ко-ронаровентрикулография с определением степени поражения КА, оценкой сегментарной сократимости левого желудочка (ЛЖ) проводили по методу Judkins (1967); до операции, а также в ранние и отдаленные сроки после операции выполнялась плоскостная сцинтиграфия миокарда с 199Т1-хлоридом в сочетании с дипиридамоловой пробой, проводимой по стандартной методике. Полученные результаты заносились в специализированные базы данных на основе PC IBM и обрабатывались с помощью прикладных программ.
Результаты и обсуждение
Анализируя результаты исследований нагрузочных проб у больных ИМ после ТЛТ до и после операции (рис. 1), следует отметить исходно низкую ТФН (39.2±9.3), обусловленную выраженной коронарной недостаточностью и изменениями показателей центральной гемодинамики: УО, МО, СИ, которые на 40-50% были ниже нормальных показателей. Возрастание МО и СИ, при отсутствии адекватного прироста УО, происходило за счет увеличения ЧСС, что указывает на снижение функции ЛЖ, множественность поражения коронарного русла и повышенный риск осложнений в раннем постинфарктном периоде, что подтверждается и другими исследованиями [7].
В раннем послеоперационном периоде ТФН возросла до 73.4±4.9 Вт. В состоянии покоя параметры гемодинамики
ЯТЛТ+АКШ
100 ПТЛТ

До Перед Через операции выпиской 6 мес.
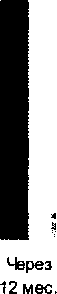
Рис. 1. Изменение ТФН в течение 1 года у больных в постинфарктном периоде
ПАТОЛОГИЯ КРОВООБРАШЕМИЯ И КАРДИОХИРУРГИЯ Г98
Группа II (п=14) ' эффективный тромболизис 60 ■
54 50 пз 8 40 CL
ХО а 30 К
3 20 Cl fr 10
о
■ 1 мес.
D12 мес.

Общая Локальная

Общая Локальная
Рис. 2. Общая и локальная сократительная функция ЛЖ после ТЛТ в раннем и отдаленном постинфарктном периоде при медикаментозном лечении (группы I и II)
существенно не изменялись, но на высоте пороговой нагрузки УО и СИ возрастали в 1.5 раза, МО - более чем в 2 раза, достоверно превышая исходные значения. К концу первого года после операции у обследованных больных при возрастании ТФН (110.2±12.5 Вт), наблюдались значительные положительные сдвиги во всех изучаемых показателях. Несмотря на то, что в состоянии покоя УО, МО, СИ выросли незначительно, при выполнениии пороговой физической нагрузки УО возрастал в 2 раза, МО - в 3 раза, СИ - в 2.5 раза. При этом показатели гемодинамики на этом этапе наблюдения возрастали высокодостоверно в сравнении со всеми предыдущими исследованиями. Улучшение параметров центральной гемодинамики говорит о нормализации функции миокарда, инактивации симпато-адреналовой и нейрогумораЛьной систем и играет положительную роль в устранении ишемической дисфункции миокарда ЛЖ в постинфарктном периоде, которая влечет за собой прогрессирующую сердечную недостаточность [5]. К концу года 26% больных после операции вернулись к своей прежней работе.
Целесообразность применения хирургических методов лечения у больных ИМ мы обосновываем не только устранением угрозы повторных нарушений коронарного кровообращения, но и улучшением сократительной функции ЛЖ. Для исследования этих показателей мы провели сравнительную оценку локальной и общей сократительной функции ЛЖ у больных передним крупноочаговым ИМ в ближайшем (1 месяц) и отдаленном (12 месяцев) постинфарктном периодах в зависимости от эффективности ТЛТ и тактики лечения (терапевтической или хирургической).
Сравнительный анализ показал, что у больных, леченных медикаментозно, независимо от эффективности ТЛТ, в отдаленном периоде не происходило достоверного улучшения общей и локальной сократимости ЛЖ при остаточном стенозе ИСКА более 75% (рис. 2).
Таким образом, при сохраняющемся дефиците коронарного кровотока даже при успешной ТЛТ не происходит восстановления функции миокарда, и сохраняются предпосылки для развития и прогрессирования постинфарктного кардиосклероза и постинфарктной сердечной недостаточноости [14].
У больных после АКШ наблюдалась положительная динамика сократительной функции ЛЖ (рис. 3). При этом у больных с неэффективной ТЛТ в отдаленном периоде происходило улучшение общей фракции выброса (р<0.05) при отсутствии положительной динамики в зоне пораженных сегментов. Это является результатом уменьшения ишемической дисфункции участков миокарда, расположенных вне области необратимого ишемического
повреждения [8,12]. Наилучшие отдаленные результаты наблюдались у больных с эффективной ТЛТ и АКШ, где анализ функциональных результатов показал увеличение как общей сократительной функции ЛЖ (р<0.05), так и локальной сократимости пораженных сегментов (р<0.001) (рис. 3). В этой группе больных на первом этапе ранний внутривенный тромболизис позволил восстановить антеградный кровоток по ИСКА и ограничить зону инфаркта миокарда, а на втором этапе остаточная ишемия была устранена с помощью хирургической реваскуляризации. Таким образом, в нашем исследовании показано, что при переднем крупноочаговом ИМ ранняя успешная ферментативная и хирургическая реваскуляризация позволяет восстановить сократительную функцию ЛЖ в отдаленном постинфарктном периоде.
Для оценки эффективности проведенного лечения больных ИМ нами были изучены особенности сцинтиграфии миокарда с 199Т1 после ТЛТ в раннем и отдаленном послеоперационном периодах после АКШ. С этой целью нами было обследовано 27 пациентов, которым после успешного тромболизиса была выполнена операция АКШ в раннем постинфарктном периоде (табл. 1).
Анализ результатов сцинтиграмм после ТЛТ показал прямую зависимость общего объема дефектов перфузии (ДП) у обследованных нами больных ИМ от количества пораженных КА. В группе с трехсосудистым поражением коронарного русла суммарный размер зон гипоперфузии был больше, чем в группах с одно- и двухсосудистым поражением (соответственно на 24 и 25%).Средняя величина стабильных ДП миокарда достоверно возрастала пропорционально количеству пораженных КА. Это связано с более глубоким нарушением микроциркуляции вследствие увеличения размеров очага инфаркта и переинфарктной зоны, которая увеличивается вследствие слабых коллатеральных перетоков из других артериальных бассейнов из-за низкого перфузионного давления [2]. В дальнейшем эти участки ишемического повреждения при продолжающейся гипоперфузии и хронической ишемии постепенно трансформируются в зону необратимого кардиосклероза, что в 20-40% случаев приводит к развитию аневризм [10]. Величина преходящих ДП при этом не зависела от количества пораженных КА.
После АКШ средняя величина преходящих ДП миокарда уменьшилась через 3-4 недели после АКШ в среднем по группе на 53% и в течение 6-12 месяцев более не изменялась. При этом у 42% больных преходящие ДП исчезли. Эти пациенты, как правило, не требовали дополнительной медикаментозной терапии.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ CEPOUA
о
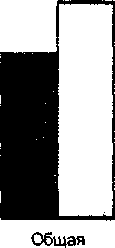
■ 1 мес.
В12 мес.

Локальная
§ 30 =г
£20

Общая Локальная
Рис. 3. Общая и локальная сократительная функция ЛЖ после ТЛТ и ранней хирургической реваскуляризации в раннем и отдаленном постинфарктном периоде (группы III и IV), * - р<0.05, ** - р<0.01
Полученные результаты дают основания предполагать, что в раннем постинфаркгном периоде (2-4 недели) после ТЛТ в зоне острого ишемического повреждения миокарда сохраняется достаточно большое количество жизнеспособных кардиомиоцитов, которые при критической ишемии со временем погибают и замещаются соединительной тканью. Сформировавшиеся области постинфарктного кардиосклероза при эффективной хирургической реваскуляризации реже претерпевают обратное развитие. Именно поэтому эффективное восстановление микроциркуляции в участках хронической стабильной ишемии миокарда происходит в меньшей степени.
Анализ результатов прямой реваскуляризации миокарда в зависимости от размера ИМ показал достоверное уменьшение среднего размера общих и стабильных ДП как у больных мелкоочаговым, так и крупноочаговым ИМ после АКШ. Снижение нарушений микроциркуляции миокарда у больных крупноочаговым ИМ после АКШ подтверждает обоснованность преимуществ хирургического подхода к лечению этой категории больных.
Анализ периоперационных осложнений у больных после ТЛТ и АКШ показал, что хирургическое лечение этой категории больных не сопровождалось повышенным риском. По частоте и структуре послеоперационных осложнений и летальности показатели не превышали таковые у больных хронической ИБС (табл. 2). Индивидуальный подход к определению показаний к операции с учетом функции сердца и нарушений перфузии миокарда позволил снизить риск операции и получить хорошие функциональные результаты.
Ретроспективный анализ результатов дооперационного клинико-инструментального обследования и аутопсий позволил нам сделать заключение, что при безуспешной ТЛТ и сохраняющемся стабильном ДП миокарда более 30% с признаками формирования острой аневриз
Таблица 1
Сцинтиграфические показатели у больных ОИМ до и после АКШ
|
Стабильный ДП (%) |
Преходящий ДП (%) |
|
|
До АКШ, п-27 |
14.512.5 |
11.811.7 |
|
Через 3-4 нед, п=25 ' |
9.612.1 * |
5.511.3** |
|
Через 6-12 мес, п-12 |
9.312.0* |
4.812.3** |
Примечание: * — р<0.05, ** — р<0.01 — показатель достоверности изменений по отношению к дооперационному значению.
мы хирургическое вмешательство в раннем постинфарктном периоде противопоказано, так как не улучшает коронарное кровообращение и может повлечь за собой усугубление нарушения функции ЛЖ. Этими причинами и обусловлена летальность в периоперационном периоде, все случаи которой произошли в начальном периоде освоения хирургического лечения больных ИМ. В такой ситуации мы считаем целесообразной выжидательную тактику и повторную госпитализацию больного через 4-6 месяцев для повторного обследования и решения вопроса о тактике лечения.
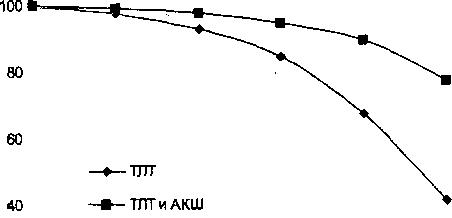
Отдаленные результаты лечения больных инфарктом миокарда оценивались построением актуарных кривых выживаемости больных за пятилетний период наблюдения через годовые промежутки времени (рис. 4). Всего было прослежено 102 пациента. Отдаленная выживаемость, рассчитанная актуарным методом, в целом по группе больных инфарктом миокарда после успешной ТЛТ и АКШ (п=102) составила 77,8%. Всего за пятилетний период наблюдения было 4 летальных исхода. Все они описывались как внезапная смерть на фоне общего удовлетворительного состояния.
Для сравнения отдаленных результатов нами была изучена выживаемость, рассчитанная актуарным методом, в контрольной группе больных инфарктом миокарда после успешной ТЛТ и медикаментозного лечения (п=50), которая составила только 41.7%. В этой группе больных за пятилетний период наблюдения было 7 летальных исходов. Двое больных погибли от прогрессирующей сердечной недостаточности, двое - от повторных инфарктов и у трех пациентов описана картина внезапной смерти. Обращает на себя внимание зависимость выживаемости в отдаленном периоде от локализации ИМ. При ИМ передней локализации актуарная выживаемость за пятилетний период составила 66.7%, при ИМ задней локализации — 83.3%.
В отдаленном периоде погибло трое больных из группы с передним ИМ (у всех больных был повторный крупноочаговый передний ИМ) и один больной с задним ИМ. Таким образом, по нашим данным, неблагоприятный исход в отдаленном послеоперационном периоде обусловлен исходным размером и локализацией ИМ. Перенесенный крупноочаговый передний ИМ является фактором риска летальности как в периоперационном периоде, так и в отдаленном пос-
ПАТОЛОГИЯ КРОВООБРАЩЕНИЯ И КАРДИОХИРУРГИЯ 1*98
Таблица 2
Частота периоперационных осложнений и летальность у больных ИМ после ТЛТ при аортокоронарном шунтировании
|
Вид осложнений |
Количество осложнений(п=106) |
|
|
абс. |
% |
|
|
Острая сердечная недостаточность |
15 |
14,2 ' |
|
Периоперационный ИМ |
3 ’ |
2,8 |
|
Кровотечения |
5 |
4,8 |
|
Медиастенит |
4 |
3,8 |
|
Летальность |
4 |
3,8 , |
|
Всего |
31 . |
■ 29,4 ■ |
О 1 2 Годы 3 4 5
Рис.4. Актуарные кривые выживаемости больных инфарктом миокарда после ТЛТ и АКШ (п=102) и после ТЛТ и медикаментозного лечения (п=50)
леоперационном периоде. Эти пациенты требуют тща-теьного амбулаторного наблюдения и медикаментозной коррекции резидуальной коронарной недостаточности и нарушений ритма сердца.
Таким образом, необходимо подчеркнуть, что больные ИМ после ТЛТ в зависимости от степени поражения КА, клинического проявления коронарной недостаточности, нарушений перфузии миокарда требуют дифференцированного подхода к хирургическому лечению. Обоснованное и своевременно выполненное АКШ после ТЛТ у больных инфарктом миокарда позволяет снизить количество осложнений в постинфарктном периоде, улучшить функциональные результаты лечения больных ИМ.
Выводы
-
1. АКШ является эффективным методом лечения больных ИМ после ТЛТ и не сопровождается повышенным риском увеличения частоты послеоперационных осложнений и летальности.
-
2. АКШ у больных инфарктом миокарда после успешной ТЛТ в отдаленном постинфарктном периоде позволяет устранить ишемию миокарда, улучшить показатели гемодинамики и толерантность к физической нагрузке.
-
3. Ранняя комбинированная реваскуляризация при остром инфаркте миокарда (тромболитическая терапия и АКШ) позволяет предотвратить последствия реок-клюзионных осложнений (рецидив инфаркта), устранить стенокардию, восстановить сократительную функцию миокарда и предотвратить развитие постинфарктной сердечной недостаточности.
-
4. Ранняя хирургическая реваскуляризация у больных ИМ после ТЛТ обеспечивает улучшение качества и продолжительности жизни в постинфарктном периоде: 5летняя выживаемость, рассчитанная актуарным методом, у оперированных больных составила 77.8%, унеоперированных - 41.7%.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ CEPOUA
-
2. Веснина Ж. В. Сцинтиграфическая оценка результатов прямой и непрямой реваскуляризации миокарда у больных ишемической болезнью сердца: Автореф. дис. ... канд. мед. наук. Томск, 1995.
-
3. Иоселиани Д.Г., Работников В.С., Алшибая М.М. //Кардиология. 1992. №7-8. С.6-9.
-
4. Марков В.А. Тромболитическая терапия острого инфаркта миокарда на догоспитальном эта-пе: Автореф.дис. ...докт.мед.наук. Томск, 1991.
-
5. Ольбинская Л.И., Литвицкий П.Ф. Коронарная и миокардиальная недостаточность. М., 1986.
-
6. Barbash G.I., White H.D., Modan М. et al. //Arch. Intern. Med. 1994. Oct. 10. 154(19). P.2237-2242.
-
7. Beurrier D., Danchin N. //Presse-Med. 1994. Feb 26; 23(8). P. 380-384.
-
8. Dilsizian V., Perrone-Filardi P., Cannon R. //Am. J. Card. 1991. V.68. N.4. P.320-328.
-
9. Elami A., Merin G., Bhushan Y. // Cardiovasc.Surg. 1993 Jun; 1(3). P.276-279.
-
10. Erbel R., Pop T„ Heinrichs K. //J. Am. Coll. Cardiol. 1986. Vol.8. P.485-495.
-
11. Gold H.K., Leinbach R.C., Garabedian H.D., Yasuda T. //Circulation. 1986. Vol. 73. P.347-352.
-
12. Hausmann H., Warnecke H., Ennker J. et al. //Helv.Chir.Acta. 1992. Vol.58(4). P.495-501.
-
13. Judkins M. Selective coronary arteiography //Radiology. 1967. V.89. P.815-824.
-
14. Meeter K., Honkoop P, Verhage A.H. //Ned.Tijdschr.Geneeskd. 1993. Sep 18; 137(38). P. 1922-1926.
-
15. Rogers W.J., Bairn D.S., Gore J.M. //Circulation. 1990. P.81. P. 1457-1466.
-
16. Sharp T.G., Kesler K.A //Chest. 1993. Vol.104(4). P.1063-1069.
-
17. Volpi A., De Vita C., Franzosi M.G. //Circulation. 1993, Aug; 88(2). P.416-429.
Список литературы Аортокоронарное шунтирование в лечении больных инфарктом миокарда после тромболитической терапии
- Аптекарь В.Д. Оценка эффективности восстановительного лечения больных, перенесших инфаркт миокарда и подвергшихся аортокоронарному шунтированию: Автореф. дис.... канд. мед. наук. -Томск, 1994.
- Веснина Ж. В. Сцинтиграфическая оценка результатов прямой и непрямой реваскуляризации миокарда у больных ишемической болезнью сердца: Автореф. дис.... канд. мед. наук. -Томск, 1995.
- EDN: ZKNBKZ
- Иоселиани Д.Г., Работников B.C., Алшибая М.М.//Грудная и сердечно-сосудистая хирургия. -1992. №7-8. С.6-9.
- EDN: ZWZHJL
- Марков В.А. Тромболитическая терапия острого инфаркта миокарда на догоспитальном этапе: Автореф.дис....докт.мед.наук. -Томск, 1991.
- Ольбинская Л.И., Литвицкий П.Ф. Коронарная и миокардиальная недостаточность. -М., 1986.


