Апоптоз в опухолевых клетках, подвергнутых сочетанному действию гипертермии и облучения: исследование молекулярных механизмов и мишеней
Автор: Кабаков А.Е., Кудрявцев В.А., Хохлова А.В., Макарова Ю.М., Лебедева Т.В.
Рубрика: Научные статьи
Статья в выпуске: 2 т.27, 2018 года.
Бесплатный доступ
В данной работе мы изучали молекулярную природу радиосенсибилизирующего действия гипертермии на раковые клетки. Исследовались клеточные линии, происходящие из карцином (HeLa, MCF-7), фибросаркомы (НТ 1080) и Т-лимфомы (Jurkat) человека. Культуры клеток выдерживали в условиях гипертермии (42-44 оС) и/или облучали g-фотонами (2-6 Гр), после чего оценивались такие параметры как интенсивность и тип клеточной гибели, клоногенность, количество двунитевых разрывов в ядерной ДНК и динамика их репарации, локализация белков теплового шока (БТШ) и пр. Нами показано, что (1) вызываемое гипертермией усиление пострадиационной гибели клеток в основном обусловлено стимуляцией каспазазависимого апоптоза, (2) запускание такого апоптотического механизма происходит, по-видимому, в результате нарушения клеточной реакции на радиационное повреждение генома, когда белковые компоненты системы репарации ДНК не работают после теплового стресса, (3) экспрессия и распределение белков теплового шока БТШ90, БТШ70 и БТШ27 могут быть важными детерминантами, определяющими дальнейшую судьбу (выживание или «самоубийство») злокачественной клетки, испытавшей воздействие гипертермии и облучения. Обсуждается, что такие факторы как тепловой стресс-ответ, уровень агрегированного клеточного белка и функциональная активность БТШ могут существенно влиять на эффективность радиосенсибилизации опухолей посредством прогревания. Рассматриваются новые подходы и мишени для усиления радиосенсибилизирующего действия гипертермии на раковые клетки.
Радиосенсибилизация, g-излучение, gh2ax фокусы, репарация днк, тепловой стресс, каспаза, белки теплового шока, протеотоксичность, денатурация белков, опухоли, радиобиологические эффекты, лучевая терапия
Короткий адрес: https://sciup.org/170170348
IDR: 170170348 | УДК: 616-006.04-092.18:615.832.8:612.014.482 | DOI: 10.21870/0131-3878-2018-27-2-62-75
Текст научной статьи Апоптоз в опухолевых клетках, подвергнутых сочетанному действию гипертермии и облучения: исследование молекулярных механизмов и мишеней
Гипертермическое воздействие используется в клинической онкологии с целью повышения эффективности лучевой и лекарственной терапии [1-4]. Для создания локальной гипертермии в зоне опухолевого роста в основном применяются наведённые электромагнитные поля сверхвысокочастотного, ультравысокочастотного или высокочастотного диапазона [4]. Несмотря на определённые проблемы, иногда осложняющие проведение гипертермии у больных, в различных клиниках накоплено достаточно большое количество данных, свидетельствующих о пользе применения этого метода в комбинированной противоопухолевой терапии [2-6]. Эти же данные одновременно указывают на необходимость дальнейшего изучения биологических эффектов гипертермии, что способствовало бы разработке новых подходов в лечении пациентов с различными злокачественными новообразованиями.
Хотя противоопухолевое действие гипертермии известно уже давно, и его молекулярные механизмы довольно подробно изучались [7, 8], терморезистентность и радиорезистентность некоторых опухолей по-прежнему остаются актуальными проблемами для терапии, поэтому важной задачей является поиск клинически применимых способов термо- и радиосенсибилиза-
Кабаков А.Е.* – зав. лаб., к.б.н.; Кудрявцев В.А . – научн. сотр.; Хохлова А.В. – мл. научн. сотр.; Макарова Ю.М. – научн. сотр.;
Лебедева Т.В. – в.н.с., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ции таких опухолей. В данном исследовании мы старались прояснить некоторые критические моменты в тепловом стресс-ответе раковых клеток и выявить взаимосвязь между клеточными реакциями на гипертермию и облучение.
Материалы и методы
Были использованы 4 охарактеризованные клеточные линии, происходящие из карцином молочной железы (MCF-7) или шейки матки (HeLa), фибросаркомы (НТ 1080) и Т-лимфомы (Jurkat) человека. Клетки выращивали в среде DMEM с 10% телячьей фетальной сывороткой, 2 моль/л L-глютамином и 10000 IU/мл пенициллин/стрептомицином (Hyclone, США) в инкубаторе с 5% СО 2 при 37 °C.
Гипертермическую обработку проводили, погружая герметично закрытые чашки Петри с клеточными культурами в термостатированную водяную баню с заданной температурой (42, 43, или 44 оС) на 20, 30 или 60 мин.
Пластиковые чашки Петри с клетками подвергали прямому воздействию γ-излучения на радиотерапевтической установке «Луч-1» (Латвия) с γ-источником 60Со и интенсивностью 0,9-1 Гр/мин.
Фракции апоптотических и некротических клеток определяли на проточном цитофлуориметре «FACS Vantage» (Becton Dickinson, США) после окрашивания ФИТЦ-меченным аннекси-ном V и йодистым пропидием [9]. Параллельно, интенсивность апоптоза оценивали иммуноблоттингом, выявляя активацию каспаз в образцах клеток [9] с помощью антител к каспазе-3, антител к поли-АДФ-рибоза полимеразе (ПАРП), вторых антител, конъюгированных с пероксидазой, и реагентов для проявления методом усиленной хемилюминесценции (Amersham, Великобритания). Выживание облучённых опухолевых клеток оценивали по вырастанию клеточных колоний (тест на клоногенность) [9].
Сайты фосфорилирования H2AX гистона (так называемые «γH2AX фокусы») выявляли с помощью антител к γH2AX и вторых антител с флуорохромом alexa-fluor 488 (Millipor, США) [10]. Препараты окрашенных клеток анализировали на конфокальном микроскопе (Leica TCS SPE, Германия).
Протеотоксические (т.е. приводящие к повреждению клеточных белков) эффекты гипертермии оценивали двумя разными способами: 1) по изменённой динамике ренатурации фермента люциферазы, инактивированного в прогретых клетках [11]; 2) по спровоцированному стрессом увеличению уровня агрегированного (неэкстрагируемого Тритоном Х-100) клеточного белка [12, 13].
Изменения содержания БТШ90, БТШ70 и БТШ27 в цитозольной и ядерно-цитоскелетной (Тритон Х-100-нерастворимой) фракциях оценивали с помощью иммуноблоттинга после сканирования проявленных блотов [11-13].
Все количественные результаты представлены как усреднённые данные (± разброс) 4-6 независимых экспериментов с 3-мя параллелями для каждой точки. Статистическую обработку результатов проводили по критерию Манна-Уитни с помощью программы «Statistica 6.0» («Microcal Softcare, Inc.»). Различия между усреднёнными величинами считались значимыми при р<0,05.
Результаты и обсуждение
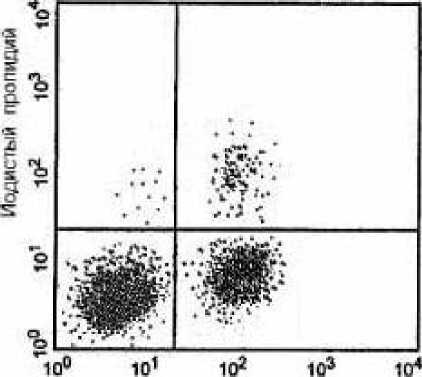
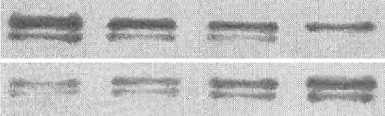
Радиосенсибилизирующая гипертермия стимулирует каспазазависимый апоптоз в облучённых опухолевых клетках. Наши эксперименты показали, что гипертермическая обработка, которая сама по себе не убивала опухолевые клетки, может значительно усилить их апоптотическую гибель, если применяется в сочетании с облучением γ-фотонами (рис. 1-3, табл. 1). Во всех 4-х исследованных опухолевых линиях такое сочетанное воздействие стимулировало «классический» апоптоз с ранней транслокацией аннексин V-тропного лиганда (фосфатидилсерин) на клеточную поверхность (рис. 1 и [9]) и летальной активацией прокаспазы-3 в терминальной фазе (рис. 2 и [9]).
Контроль (37 оС, 0 Гр)
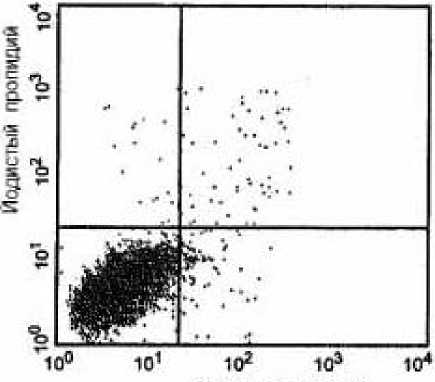
ФИТЦ-аннексим V
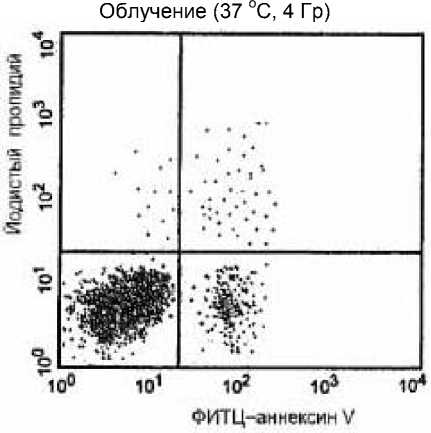
44 оС + 4 Гр
43 оС + 4 Гр
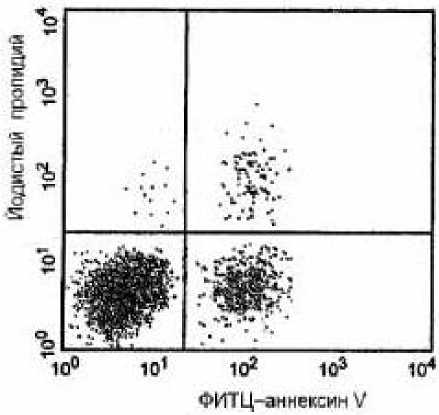
Рис. 1. Усиление апоптоза в клетках Т-лимфомы Jurkat, испытавших действие гипертермии перед облучением. Клетки прогревали при 43 оС или 44 оС в течение 60 или 30 мин соответственно, и затем облучали (4 Гр). Здесь хорошо заметно увеличение апоптотической фракции в прогретых образцах. Похожие результаты получали и на других опухолевых культурах (см. рис. 3 и табл. 1).
ФИТЦ-анмексин V
Интенсивность этого апоптоза ожидаемо коррелировала с температурой прогрева и падением выживаемости и клоногенности прогретых клеток (рис. 1-3, табл. 1). Увеличение временного периода между гипертермией и облучением приводило к снижению цитотоксичности комбинированного воздействия (данные не приводятся). Таким образом, усиление апоптотиче-ской гибели в прогретых и облучённых опухолевых клетках, как и снижение их клоногенности, является проявлением радиосенсибилизирующего действия гипертермии.
A
12 3 4
gg^ Прокаспаза-3 (32 кДа)
17 кДа фрагмент
12 кДа фрагмент

(116 кДа)
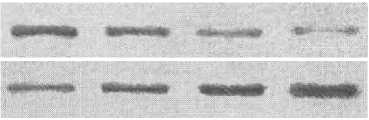
Рис. 2. Иммуноблоттинг, показывающий усиленную активацию каспазы-3 в опухолевых клетках MCF-7, облучённых после гипертермии.
А: (1) только неактивная прокаспаза-3 (85 кДа) присутствует в контроле; (2) активные фрагменты каспазы-3 (17 кДа и 12 кДа) появляются после облучения при дозе 4 Гр; (3 и 4) гиперактивация каспазы-3 происходит в клетках, которые перед облучением прогревались 60 мин при 43 оС (3) или 30 мин при 44 оС (4). Б: в результате активации каспазы-3 происходит сайт-специфичный протеолиз её терминального субстрата – ПАРП (116 кДа), легко определяемый по появлению характерного фрагмента с массой 85 кДа. Более интенсивные полосы 85 кДа в образцах 3 и 4 свидетельствуют об усилении пострадиационного апоптоза в прогретых клетках. Похожие результаты получали с культурами HeLa, HT 1080 и Jurkat (данные не приводятся).
85 кДа фрагмент
То, что относительно мягкий тепловой стресс стимулирует апоптоз в облучённых клетках фибросаркомы (НТ 1080) и карцином (MCF-7, HeLa), на наш взгляд, заслуживает внимания. Не удивительно, когда апоптотическая гибель усиливается в прогретых перед облучением клетках лимфомы Jurkat, поскольку именно каспазазависимый апоптоз является типичной и основной формой клеточной гибели в опухолях лимфатической системы. Однако известно, что апоптоз не характерен для облучённых клеток сарком и карцином, которые погибают в основном из-за митотической катастрофы или некроза [14, 15]. Судя по нашим результатам, использование гипертермии в комбинации с облучением иногда позволяет не только усиливать радиационный ответ опухоли-мишени, но и кардинально изменять сам механизм пострадиационной гибели злокачественных клеток. Стоит отметить, что in vivo массивная некротическая гибель клеток часто сопровождается литическим разрушением окружающих тканей, развитием острого воспаления и другими опасными осложнениями, негативно влияющими на организм пациента. Напротив, апоптотическое «самоубийство» повреждённых клеток происходит без сопутствующих патологических реакций, и потому апоптоз считается наиболее предпочтительным способом элиминации раковых клеток в процессе цитотоксической терапии [16]. Мы установили, что комбинация гипертермии и облучения даёт возможность реализовать этот желательный механизм (апоптоз) даже в тех типах опухолей, которым он обычно не свойственен (т.е. в карциномах и саркомах).
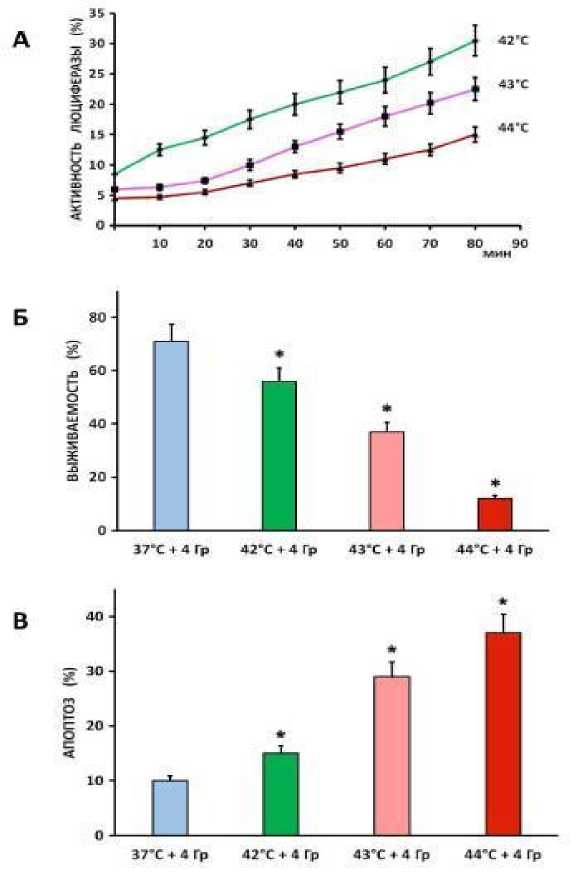
Рис. 3. Корреляция между температурой гипертермии, её протеотоксичностью, определённой по замедлению реактивации денатурированной люциферазы (А), и её радиосенсибилизирующими эффектами, снижающими выживаемость (Б) и усиливающими апоптоз (В) в облучённых клетках HeLa (см. табл. 1). * – значимое отличие от значений, полученных при 37 оС, p<0,05.
Таблица 1
Усиление пострадиационного апоптоза и увеличение значений ФИД в культуре опухолевых клеток HeLa, подвергнутых гипертермии и облучению
|
Условия обработки |
% апоптоза |
ФИД |
|
37 оС (контроль) |
1 – 4 |
-- |
|
37 оС + 4 Гр |
10 – 12 |
-- |
|
42 оС, 90 мин + 4 Гр |
15 – 18 |
1,48 |
|
43 оС, 60 мин + 4 Гр |
20 – 24 |
1,72 |
|
44 оС, 20 мин + 4 Гр |
26 – 29 |
2,05 |
Примечание: ФИД – фактор изменения дозы.
Гипертермия нарушает реакцию облучённых опухолевых клеток на повреждение ядерной ДНК. Принято считать, что на молекулярном уровне радиосенсибилизирующие эффекты гипертермии обусловлены усилением повреждения ДНК и денатурацией термолабильных клеточных белков, которые нужны для восстановления облучённых клеток; в первую очередь, к таким белкам относятся ферменты, участвующие в процессах репарации радиационных повреждений ДНК [8]. А
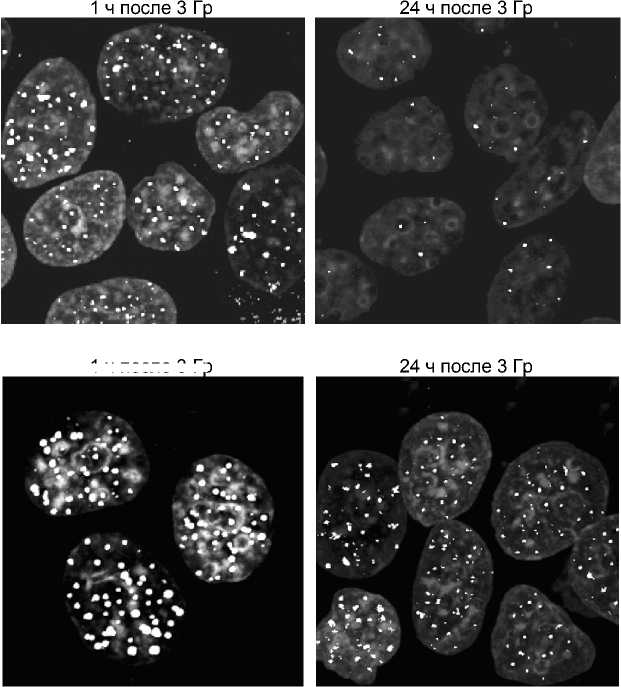
Рис. 4. Вызванное гипертермией изменение динамики формирования и исчезновения γH2AX фокусов в ядрах облучённых клеток MCF-7.
А: нормальный радиационный ответ непрогретых (растущих при 37 оС) клеток, показывающий завершение репарации двойных разрывов ядерной ДНК за 22-24 ч после облучения (3 Гр). Б: эффект гипертермической предобработки (43 оС, 60 мин), приводящий к нарушению процесса репарации разрывов ядерной ДНК (см. текст и табл. 2).
37 оС 0 Г

Б
43 оС 0 Г
1 ч после 3 Гр
Мы анализировали динамику образования и исчезновения фосфо-гистоновых (γH2AX) фокусов в ядрах карциномных MCF-7 клеток после их облучения (рис. 4, табл. 2), что отражало эффективность репарации двунитевых разрывов ДНК [10]. Согласно нашим наблюдениям, предварительный прогрев (43 оС, 60 мин) МСF-7 клеток вызывал образование ядерных γH2AX фокусов ещё до облучения (рис. 4Б, табл. 2). На ранних сроках (1-2 ч) после облучения ядра прогретых клеток содержали заметно больше γH2AX фокусов по сравнению с ядрами непрогре-тых облучённых клеток. В непрогретых образцах через 24 ч после облучения уровень γH2AX фокусов возвращался к контрольному, что означает завершение репарации двойных разрывов ядерной ДНК (рис. 4А, табл. 2). Напротив, через 24 ч после облучения в ядрах прогретых клеток всё ещё оставались γH2AX фокусы (рис. 4Б, табл. 2) – это свидетельствует о нарушении радиационного ответа и замедлении (или блокировке) пострадиационной репарации ядерной ДНК.
Таблица 2
Среднее количество фокусов γH2AX на ядро в культуре опухолевых клеток MCF-7, подвергнутых гипертермии и облучению
|
Градусы, время |
Среднее количество фокусов γ H2AX на ядро клетки |
||
|
до облучения |
через 1 ч после облучения (3 Гр) |
через 24 ч после облучения (3 Гр) |
|
|
37 оС (контроль) |
3 ± 2 |
27 ± 6,2 |
4,3 ± 2,5 |
|
42 оС, 90 мин |
14,5 ± 4,1* |
44 ± 9* |
22 ± 5,6** |
|
43 оС, 60 мин |
17 ± 4,6* |
49 ± 11* |
26,4 ± 6** |
|
44 оС, 20 мин |
23,2 ± 5,5** |
54,5 ± 12,1* |
30,2 ± 7** |
* – значимое отличие от соответствующего контроля (37 оС), p<0,05;
** – значимое отличие от соответствующего контроля (37 оС), p<0,01.
Следовательно, незаконченная вовремя репарация ДНК в прогретых и облучённых опухолевых клетках может быть причиной стимуляции их апоптотической гибели, поскольку запускание «самоубийственного» (р53-зависимого) механизма апоптоза является естественным клеточным ответом на сильное повреждение генома [17]. Важный вопрос: как тепловой стресс препятствует нормальной пострадиационной репарации ДНК? Появление γH2AX фокусов в ядрах прогретых клеток ещё до облучения можно объяснить, например, тем, что гипертермия сама вызывает разрывы ДНК (это возможно в условиях сильного прогрева клеток [18]), или тем, что тепловой стресс приводит к аномальной активации киназы АТМ, которая из-за этого начинает фосфорилировать H2AX гистоны также и в тех местах, где нет двунитевых разрывов ДНК, таким образом, увеличивая число «ложных» фокусов (такой механизм тоже описан [18]). Очевидно, что всё это будет замедлять процесс пострадиационной репарации ДНК. Кроме того, согласно опубликованным данным, в опухолевых клетках гипертермия инактивирует основанную на гомологической рекомбинации систему репарации разрывов ДНК, вызывая падение экспрессии и деградацию такого ключевого компонента этой системы как BRCA2 [19].
По нашим наблюдениям, сочетание прогрева и невысоких доз (2-4 Гр) γ-излучения не убивало абсолютно все обработанные клетки, и даже после сильной (44 оС) и продолжительной гипертермии иногда выживало несколько колоний. Это говорит о том, что существует и термо-резистентая система репарации ДНК, которая даёт шанс прогретой и облучённой опухолевой клетке избежать гибели и восстановить пролиферативную активность. Мы полагаем, что такую действующую в злокачественных клетках терморезистентную систему репарации стоит рассматривать как важную терапевтическую мишень, поскольку её ингибирование помогло бы усилить противоопухолевые эффекты гипертермии и облучения. Недавние сообщения других исследователей, где с целью большего воздействия на опухоль предлагается комбинировать гипертермию с ингибиторами участвующих в репарации разрывов ДНК ферментов RAD51, ПАРП [20] и DNA-PKcs [21], говорят в пользу нашего предположения.
Протеотоксичность радиосенсибилизирующей гипертермии коррелирует с интенсивностью пострадиационного апоптоза. Разумеется, помимо инактивации ферментов, непосредственно вовлечённых в репарацию ДНК, гипертермическая обработка клеток вызывает денатурацию и агрегацию самых разных белков в цитоплазме, ядре и органеллах, что сопровождается угнетением клеточного метаболизма, разборкой цитоскелета, ионным дисбалансом, нарушением транспорта биомолекул и пр. [7, 8, 12]. С целью выявления причинноследственных связей в исследуемом феномене мы старались оценить степень протеотоксич-ности при разных условиях прогрева клеток и проверить, как это соотносится с пострадиационным апоптозом.
Для оценки протеотоксичности нами использовался хорошо известный метод с восстановлением активности (ренатурацией) люциферазы в клетках, испытавших тепловой стресс. По относительной скорости ренатурации люциферазы в восстанавливающихся клетках можно судить о степени протеотоксичности применённого теплового воздействия [11]. Рис. 3А демонстрирует ожидаемую корреляцию между температурой гипертермии и замедлением ренатурации люциферазы в клетках HeLa. Также можно заметить существование позитивной корреляции между уровнями протеотоксичности (рис. 3А) и цитотоксичности, когда падение выживаемости (рис. 3Б) и апоптоз (рис. 3В) тоже усиливаются с увеличением температуры прогрева клеток. Похожие результаты получались и на культурах MCF-7 и HT 1080 (не показано). Принято считать, что, хотя люцифераза не влияет на жизнеспособность трансфектантов, динамика ренату-рации этого фермента должна отражать процесс рефолдинга многих термолабильных внутриклеточных белков, среди которых есть и те, что необходимы для выживания стрессированной клетки [11]. Соответственно, тепловая денатурация таких белков и недостаточно быстрая их реактивация при нормальной температуре могут быть факторами, стимулирующими апоптоз в прогретых и облучённых клетках.
В параллельных экспериментах мы оценивали протеотоксические эффекты гипертермии по увеличению уровня агрегированного клеточного белка (табл. 3). Ещё в 90-е годы [12, 13] было обнаружено, что характерной реакцией клеток на тепловой шок и многие другие стрессы является значительное повышение содержания белка в Тритон Х-100-нерастворимой (т.е. ядер-но-цитоскелетной) фракции. Это происходит из-за образования седиментирующих белковых агрегатов и неспецифической ассоциации денатурированных цитозольных белков с нерастворимыми структурами цитоскелета и ядра. На основе этого феномена были разработаны количественные методики, позволяющие определить протеотоксичность того или иного стресса по приросту Тритон Х-100-нерастворимого клеточного белка [12, 13]. Из результатов, приведённых в табл. 3, видно, что уровень агрегированного белка в прогретых клетках возрастал с повышением градусов гипертермии; аналогичная корреляция имела место при увеличении продолжительности тепловой обработки клеток (данные не приводятся). Кроме того, уровень агрегированного клеточного белка коррелировал с интенсивностью апоптоза и падением клоногенного потенциала (табл. 3). Поскольку агрегаты денатурированных белков в цитоплазме и ядре негативно влияют на жизнеспособность стрессированной клетки и наверняка затрудняют её пострадиационное восстановление, мы полагаем, что вызванная гипертермией агрегация цитозольных и ядерных белков должна быть мощным стимулом к запусканию апоптотического механизма.
Здесь важно подчеркнуть, что агрегацию белков в прогреваемой клетке можно дополнительно усилить, изменяя рН или подавляя энергетический метаболизм [12, 13], а также используя специальные фармакологические агенты, такие как ингибиторы активности и экспрессии БТШ [11]. Кроме того, представляется реальным заблокировать клеточные механизмы избавления от денатурированных белков, применяя ингибиторы деградации белковых молекул в лизосомах и протеасомах, и это тоже приведёт к увеличению уровня агрегированного белка в ци- топлазме. Вероятно, такая искусственная стимуляция белковой агрегации в прогретых опухолях будет усиливать радиосенсибилизирующие эффекты гипертермии, и в будущем мы планируем проверить это экспериментально.
Таблица 3
Агрегация цитозольного белка и вовлечение в нее БТШ90, БТШ70 и БТШ27 в опухолевых клетках HeLa, испытавших гипертермическую обработку
|
Градусы, время |
Относительное содержание белка и отдельных БТШ в Тритон Х-100-нерастворимой фракции |
|||
|
тотальный белок |
БТШ90 |
БТШ70 |
БТШ27 |
|
|
37 оС (контроль) |
1 |
1 |
1 |
1 |
|
42 оС, 90 мин |
1,35 ± 0,07* |
1,65 ± 0,09* |
1,5 ± 0,08* |
1,6 ± 0,08* |
|
43 оС, 60 мин |
1,5 ± 0,09* |
2,8 ± 0,2** |
2,65 ± 0,2** |
2,4 ± 0,18** |
|
4 4 оС, 20 мин |
1,85 ± 0,1** |
3,5 ± 0,28** |
3,1 ± 0,25** |
3,2 ± 0,27** |
* – значимое отличие от соответствующего контроля (37 оС), p<0,05;
** – значимое отличие от соответствующего контроля (37 оС), p<0,01.
Гипертермия, стимулирующая пострадиационный апоптоз, истощает цитозольный пул молекулярных шаперонов. Хорошо известно, что основные молекулярные шапероны эукариот – БТШ90, БТШ70 и БТШ27 – являются эндогенными супрессорами апоптоза, причём эта активность обусловлена, главным образом, их способностью специфически взаимодействовать с компонентами апоптотического сигнального каскада и, тем самым, прерывать его [22]. С другой стороны, БТШ играют ключевую роль в клеточном ответе на протеотоксиче-ский стресс. Соответственно, мы постарались исследовать реакцию БТШ90, БТШ70 и БТШ27 в опухолевых клетках, подвергнутых радиосенсибилизирующей гипертермии.
37 о С 42 о С 43 о С 44 о С
БТШ90
цитозольная фракция ядро/цитоскелет/агрегаты
37 о С 42 о С 43 о С 44 о С
БТШ70
цитозольная фракция ядро/цитоскелет/агрегаты
37 о С 42 о С 43 о С 44 о С
БТШ27
цитозольная фракция ядро/цитоскелет/агрегаты
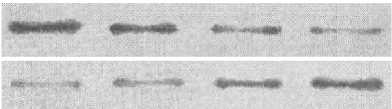
Рис. 5. Фрагменты блотов, показывающие взаимосвязь между температурой гипертермической обработки клеток HeLa и истощением цитозольного пула БТШ90, БТШ70 и БТШ27 из-за их транслокации в ядерно-цитоскелетные компартменты и соагрегации с денатурированными белками. Клетки подвергали 30-минутному прогреву при указанной температуре, после чего фракционировали с помощью Тритон Х-100-содержащего буфера и центрифугирования для последующего анализа иммуноблоттингом (см. также табл. 3).
Данные, приведённые на рис. 5 и в табл. 3, показывают, что гипертермическая обработка клеток приводит к истощению пула шаперонов в цитозольной (Тритон Х-100-экстрагируемой) фракции и соответствующему увеличению их содержания в ядерно-цитоскелетной (Тритон Х-100-неэкстрагируемой) клеточной фракции, где оказываются все крупные белковые агрегаты. Очевидно, это происходит из-за связывания (и соагрегации) шаперонов с их естественными субстратами – термоденатурированными клеточными белками в цитоплазме, ядре и цитоске-летных структурах. По нашим наблюдениям, степень истощения цитозольного пула БТШ90, БТШ70 и БТШ27 (т.е. их «инсолюбилизация») в прогреваемых опухолевых клетках заметно увеличивалась с повышением температуры и позитивно коррелировала с приростом агрегированного белка и интенсивностью пострадиационного апоптоза (рис. 5, табл. 3 и табл. 1). В совокупности, полученные данные дают нам основания рассматривать цитозольный уровень шаперонов как важную детерминанту, от которой может зависеть дальнейшая судьба (выживание или гибель) стрессированной клетки.
Возникают интересные вопросы: почему спровоцированный гипертермией дефицит молекулярных шаперонов в цитозоле способствует пострадиационному апоптозу и возможно ли целенаправленно повлиять на субклеточную локализацию БТШ, чтобы усилить апоптотическую гибель прогретых и облучённых опухолевых клеток? Мы предполагаем, что в испытавшей тепловой стресс клетке возникает своего рода конкуренция между субстратами за связывание с шаперонами. В условиях гипертермии, когда происходит денатурация многих клеточных белков, большая часть шаперонов (БТШ) оказывается рекрутирована в комплексы и агрегаты с этими термоденатурированными белками и, таким образом, уходит из цитозоля. Соответственно, при возникшем дефиците шаперонов их не хватает, чтобы нейтрализовать эффекторы апоптотиче-ского сигнального каскада (например, Apaf-1 или цитохром Ц [22]) и блокировать каспазазави-симый апоптоз, который запускается в облучённой клетке в ответ на повреждения ДНК.
Что касается возможности влияния на уровень цитозольных шаперонов, этот вопрос заслуживает отдельного серьёзного изучения. Ранее, в качестве одного из потенциальных подходов мы описали комбинирование гипертермии с ингибиторами шаперонной активности БТШ90 и ингибиторами индукции БТШ [11]. Наверное, существуют и другие перспективные комбинации, например, с агентами, блокирующими деградацию клеточных белков или усиливающими их агрегацию (см. предыдущий раздел), что приведёт к ещё большей «занятости» цитозольных шаперонов другими субстратами и, следовательно, к снятию БТШ-опосредованной блокады с каскада проапоптотических сигналов. На наш взгляд, всю АТФ-зависимую шаперонную машине-рию злокачественной клетки следует рассматривать как комплексную мишень для противораковой терапии, и необходимы дальнейшие системные и сфокусированные исследования, чтобы разработать клинически применимые способы инактивации опухолевых БТШ.
Заключение
Используя экспериментальные модели с 4-мя линиями опухолевых клеток разного происхождения, мы показали, что (1) радиосенсибилизирующие эффекты гипертермии обусловлены стимуляцией каспазазависимого апоптоза, что наблюдалось даже в карциномных и саркомных клетках, для которых апоптоз не является характерной формой пострадиационной гибели;
-
(2 ) триггером такого апоптотического механизма становится, по-видимому, спровоцированное гипертермией нарушение клеточной реакции на разрывы ядерной ДНК; (3) вызываемая гипертермией агрегация внутриклеточных белков и связанное с этим истощение цитозольного пула БТШ90, БТШ70 и БТШ27 представляются критическими событиями для выживания облучённой раковой клетки.
На основе полученных нами данных и фактов, описанных другими исследователями, мы наметили потенциальные подходы и молекулярные мишени, которые позволили бы усилить радиосенсибилизирующие эффекты гипертермии. По нашему мнению, терморезистентные ферменты репарации ДНК, клеточные системы деградации белков, БТШ и другие компоненты шаперонной машины заслуживают пристального внимания в качестве перспективных мишеней для дополнительного терапевтического воздействия на злокачественную опухоль.
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России за 2015-2016 гг. и первую половину 2017 г., промежуточные итоги выполнения которых нашли отражение в обобщающей публикации [23].
Список литературы Апоптоз в опухолевых клетках, подвергнутых сочетанному действию гипертермии и облучения: исследование молекулярных механизмов и мишеней
- Курпешев О.К. Возможности и перспективы использования гипертермии в медицине//Клиническая медицина. 1996. № 1. С. 14-16.
- Курпешев О.К., Андреев В.Г., Панкратов В.А., Гулидов И.А., Орлова А.В. Сравнительные результаты консервативной химиолучевой и термохимиолучевой терапии местно-распространённого рака гортани//Вопросы онкологии. 2014. Т. 60, № 5. С. 602-606.
- Datta N.R., Ordonez S.G., Gaipl U.S., Paulides M.M., Crezee H., Gellermann J., Marder D., Puric E., Bodis S. Local hyperthermia combined with radiotherapy and-/or chemotherapy: recent advances and promises for the future//Cancer Treat. Rev. 2015. V. 41, N 9. P. 742-753.
- Курпешев О.K., van der Zee J. Локорегионарная гипертермия злокачественных опухолей: методики, термометрия, аппаратура//Медицинская радиология и радиационная безопасность. 2017. № 5. С. 52-63.
- Ohguri T. Current status of clinical evidence for electromagnetic hyperthermia on prospective trials//Thermal Med. 2015. V. 31, N 2. P. 5-12.
- Курпешев О.К., Рагулин Ю.А., Мозеров С.А., Орлова А.В., Лебедева Т.В. Возможности локальной гипертермии при лечении больных отёчной формой рака молочной железы//Вопросы онкологии. 2016. № 5. С. 680-687.
- Курпешев О.К. Закономерности радиосенсибилизирующего и повреждающего эффектов гипертермии на нормальные и опухолевые ткани (экспериментально-клиническое исследование): автореф. дис. … докт. мед. наук. Обнинск, 1989. 35 с.
- Hyperthermic oncology from bench to bedside/Eds.: S. Kokura, T. Yoshikawa, T. Ohnishi. Springer, 2016. 444 p.
- Kabakov A.E., Gabai V.L. Cell death and survival assays//Methods Mol. Biol. 2018. V. 1709. P. 107-127.
- Sharma A., Singh K., Almasan A. Histone H2AX phosphorylation: a marker for DNA damage//Methods Mol. Biol. 2012. V. 920. P. 613-626.
- Кудрявцев В.А., Макарова Ю.М., Кабаков А.Е. Термосенсибилизация опухолевых клеток ингибиторами активности и экспрессии шаперонов//Биомедицинская химия. 2012. Т. 58, № 6. С. 662-672.
- Kabakov A.E., Gabai V.L. Protein aggregation as primary and characteristic cell reaction to various stresses//Experientia. 1993. V. 49, N 8. P. 706-713.
- Kabakov A.E., Gabai V.L. Stress-induced insolubilization of certain proteins in ascites tumor cells//Arch. Biochem. Biophys. 1994. V. 309, N 2. P. 247-253.
- Schmitt C.A. Cellular senescence and cancer treatment//Biochimica et Biophysica Acta (BBA) -Reviews on Cancer. 2007. V. 1775. P. 5-20.
- O’Callaghan-Sunol C., Gabai V.L. Involvement of heat shock proteins in protection of tumor cells from genotoxic stresses. A chapter in: Heat shock proteins in cancer/Eds.: S.K. Calderwood, M.Y. Sherman, D.R. Ciocca. Springer, 2007. P. 169-189.
- Koff J.L., Ramachandiran S., Bernal-Mizrachi L. A time to kill: targeting apoptosis in cancer//Int. J. Mol. Sci. 2015. V. 16. P. 2942-2955.
- Balcer-Kubiczek E.K. Apoptosis in radiation therapy: a double-edged sword//Exp. Oncol. 2012. V. 34, N 3. P. 277-285.
- Pandita T.K., Pandita S., Bhaumik S.R. Molecular parameters of hyperthermia for radiosensitization//Crit. Rev. Eukaryot. Gene Expr. 2009. V. 19, N 3. P. 235-251.
- van den Tempel N., Laffeber C., Odijk H., van Cappelen W.A., van Rhoon G.C., Franckena M., Kanaar R. The effect of thermal dose on hyperthermia-mediated inhibition of DNA repair through homologous recombination//Oncotarget. 2017 DOI: 10.18632/oncotarget.17861
- Takahashi A., Mori E., Nakagawa Y., Kajihara A., Kirita T., Pittman D.L., Hasegawa M., Ohnishi T. Homologous recombination preferentially repairs heat-induced DNA double-strand breaks in mammalian cells//Int. J. Hyperthermia. 2017 DOI: 10.1080/02656736.2016.1252989
- van Oorschot B., Granata G., Di Franco S., Ten Cate R., Rodermond H.M., Todaro M., Medema J.P., Franken N.A. Targeting DNA double strand break repair with hyperthermia and DNA-PKcs inhibition to enhance the effect of radiation treatment//Oncotarget. 2016. V. 7, N 40. P. 65504-65513.
- Kennedy D., Jager R., Mosser D.D., Samali A. Regulation of apoptosis by heat shock proteins//IUBMB Life. 2014. V. 66, N 5. P. 327-338.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований -основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику//Радиация и риск. 2017. Т. 26. № 2. С. 26-40.


