Аппаратура для исследований влияния гипоксии на клеточные культуры в нормотермических и гипертермических условиях
Автор: Лежнев Э.И., Пивоварова О.А., Кудрявцев А.А., Кузьмич М.К.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.14, 2004 года.
Бесплатный доступ
Разработана, сконструирована и изготовлена специальная аппаратура, обеспечивающая исследование действия гипоксии и гипертермии на культуры клеток. Установка позволяет культивировать клетки в заданных условиях (температура, состав газовой фазы, влажность), создавать и поддерживать контролируемую гипоксию, оценивать фазовый состав и дыхательную активность клеточной культуры. В условиях гипоксии предварительно исследовано действие антигипоксанта гипоксена - натриевой соли [поли (2,5-дегидроксифенилен)-4-тиосульфокислоты] (полидигидроксифенилентиосульфонат натрия) - на клеточную культуру 3Т3.
Короткий адрес: https://sciup.org/14264324
IDR: 14264324 | УДК: 57.085.23
Текст научной статьи Аппаратура для исследований влияния гипоксии на клеточные культуры в нормотермических и гипертермических условиях
В настоящей статье приводится описание аппаратуры, предназначенной для исследования влияния гипоксии на культуры клеток. Под гипоксией понимается патологическое состояние организма при дефиците кислорода во внешней среде или нарушениях функций дыхательной, сердечно-сосудистой систем и транспортной функции крови.
Результатом гипоксии является лавинообразное развитие регионарных и тотальных отклонений в организме и его системах от гомеостатических уровней, причем в зависимости от глубины и длительности гипоксии эти отклонения могут принимать необратимый характер с летальным исходом.
Изучение гипоксии с целью эффективного предотвращения ее последствий входит в число актуальных научных направлений биофизики и фундаментальной медицины. Несмотря на различие в типах гипоксии — экзогенная, циркуляторная, гемическая, тканевая, гипероксическая или смешанная — реакция организма при гипоксических состояниях различной этиологии носит неспецифический характер. Существенная роль в этих процессах отводится генерации активных форм кислорода [1, 2, 3]. В целях предупреждения или ослабления гипоксии разрабатываются и применяются природные и синтетические антигипоксан-ты прямого и непрямого действия и антиоксиданты [4, 5, 6].
Исследование на животных действия гипоксии и фармакологических средств, влияющих на развитие патологических процессов, затруднено многофакторностью процессов, адаптивными свойствами целостного организма и косвенным характером проводимых измерений [1]. Представляется
(полидигидроксифенилентиосульфонат натрия) — на перспективным использование для этой цели культур клеток. Однако при этом должны быть учтены известные ограничения в экстраполяции на организм человека данных, полученных с помощью культуральной модели.
При исследовании культур клеток в условиях экзогенной гипоксии должны быть решены следующие вопросы:
-
— выбор культуры, обеспечивающей адекватное ее поведение в условиях гипоксии (соотношение аэробного дыхания и гликолиза);
-
— оценка состояния культуры по кинетическим показателям физиологического состояния (пролиферация, гибель клеток, фазовый состав популяции, окислительная деструкция клеточных элементов);
-
— обеспечение возможности проведения исследований в нормотермических и гипертермических условиях;
— разработка аппаратуры для исследования влияния гипоксии на культуры клеток.
В Институте теоретической и экспериментальной биофизики РАН разработана аппаратура, решающая эти вопросы и обеспечивающая всестороннее исследование действия гипоксии на культуры клеток.
ОПИСАНИЕ И ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ РАЗРАБОТАННОЙ
АППАРАТУРЫ
Аппаратура предусматривает возможность культивирования клеток в заданных условиях (температура, состав газовой фазы и влажность), возможность создания и поддержания контролируемой гипоксии, возможность получения и экспонирования в условиях гипоксии достаточного
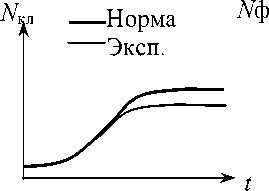
p (O 2 ) — Var t — Var
p (O 2 ) — Var t — Var
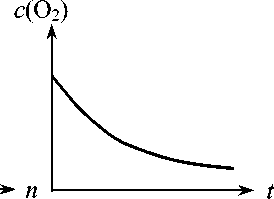
c (O 2 ) — Var t — Var
I
II
III
Кинетические показатели жизнедеятельности культуры
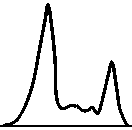
Фазовый состав культуры Дыхательная ак и измерение показателей энер- тивность клеток гетического метаболизма
ЯМР: АТФ, АДФ, АМФ, лактат, глюкоза и др.
Рис. 1. Функциональный состав аппаратуры для исследования гипоксии.
p(O2) — парциальное давление кислорода; с(О2) — концентрация растворенного кислорода; Nкл — концентрация клеток; t — время; n — номер канала проточного цитофлюори-метра (характерный признак: содержание ДНК, объем клетки, количество белка и т. д); Nф — количество клеток с характерным признаком количества клеток для измерения показателей энергетического метаболизма и для оценки фазового состава культуры, возможность оценки дыхательной активности клеток. На рис. 1 представлен функциональный состав аппаратуры.
Для создания и поддержания контролируемых условий культивирования (температура, парциальное давление O 2 в газовой фазе) разработан специальный O 2 -инкубатор, схема которого приведена на рис. 2.
Поддержание температуры в контейнере с точностью до 0.2 % обеспечивается двухступенчатым регулированием и размещением контейнера 4 с культуральными сосудами 6 в термостате 2. Парциальное давление кислорода в диапазоне 1– 100 % от парциального давления в атмосфере воздуха измеряется электролитической ячейкой с электродом Кларка 5. О2-инкубатор дает возможность устанавливать парциальное давление O2 в контейнере в широких пределах, в том числе и на уровне гипоксийных значений. Подсчет клеток осуществляется при помощи стандартного гемоцитометра. Подсчет живых и мертвых клеток — методами флуоресцентной микроскопии с дифференциальным окрашиванием.
Для измерения содержания клеток в фазах клеточного цикла [7] и показателей энергетического метаболизма в зависимости от времени и уровня оксигенации культуры разработан специальный биореактор, схема которого приведена на рис. 3.
В термостатируемом герметичном объеме 1 обеспечивается перемешивание клеточной суспензии с одновременным измерением концентрации растворенного кислорода электродом Кларка 5 при продувке реактора газовой смесью заданного состава.
Плунжер 2 позволяет удалить остатки газа из реактора и периодически отбирать пробы для проточной цитометрии и биохимических анализов без нарушения герметизации.
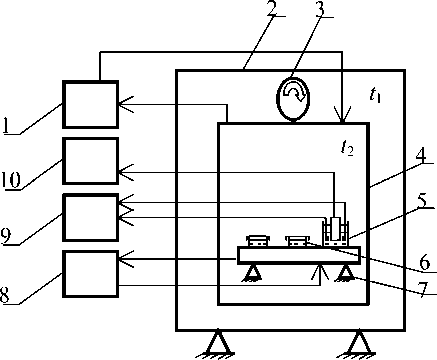
Рис. 2. О2-инкубатор.
1 — устройство продувки контейнера азотом; 2 — воздушный термостат; 3 — вентилятор; 4 — биоконтейнер; 5 — электролитическая ячейка (измерение растворенного О 2 ); 6 — культуральные сосуды; 7 — термостатируемый столик; 8 — ультратермостат; 9 — блок контроля уровня воды в ячейке для измерения О 2 ; 10 — блок измерения р (О 2 )
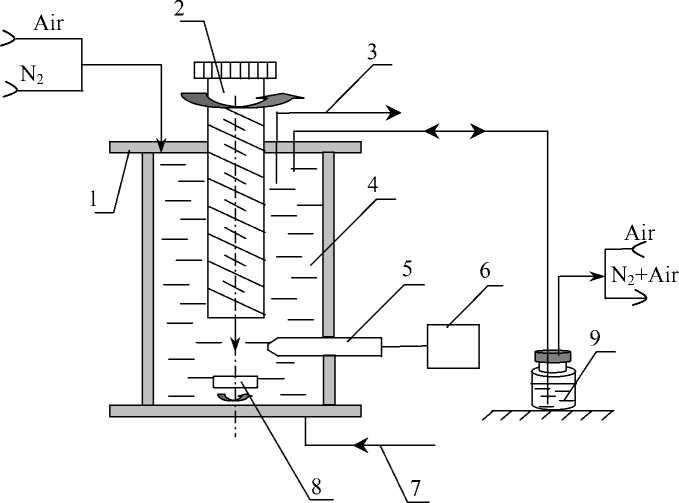
Рис. 3. Биореактор.
1 — корпус биореактора; 2 — плунжер; 3 — отбор среды с клетками; 4 — суспензия; 5 — измерительный электрод; 6 — блок измерения р (О 2 ); 7 — заливка среды; 8 — побудитель перемешивания; 9 — вспомогательный сосуд
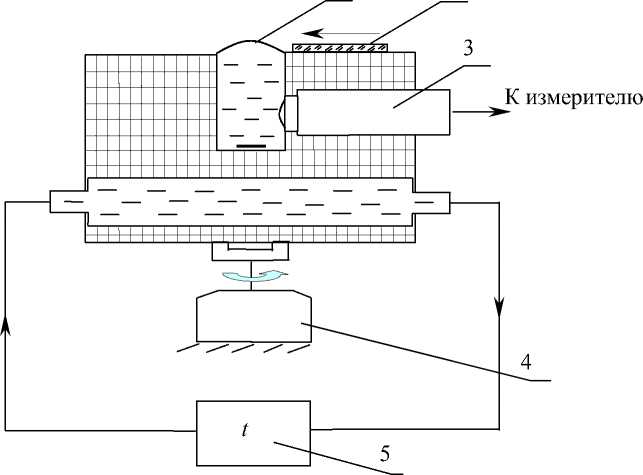
Рис. 4 . Камера для оценки дыхательной активности.
1 — суспензия клеток; 2 — покровное стекло; 3 — электрод; 4 — магнитная мешалка; 5 — ультратермостат
Для измерений потребления клетками кислорода разработана камера, показанная на рис. 4. Рабочий объем камеры 1.5 см3 заполняется средой с клетками до выпуклого мениска. Излишек среды удаляется покровным стеклом, притертым к поверхности камеры. При этом устраняются воздушные пузырьки, которые могут стать источником погрешности, и исключается поступление кислорода в камеру из окружающего воздуха. Температура в камере поддерживается на заданном уровне. Собственное потребление кислорода измерительным электродом в среде U автопотр составляет 0.00045 ммоль/(л∙мин).
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Иллюстрацией работоспособности описанной выше аппаратуры и ее пригодности к исследованиям влияния гипоксии на культуры клеток могут служить некоторые результаты, полученные на клеточной культуре 3Т3 [8] в условиях гипоксии при воздействии на клетки в качестве антигипок-санта гипоксена [9] в терапевтических концентрациях.
Выбор клеточной культуры продиктован необходимостью использования минимально транс- формированной линии, сохраняющей способность к регуляции пролиферации и достаточно изученной в условиях длительного культивирования. Для того чтобы исключить сложности, связанные с необходимостью использования многокомпонентной газовой смеси — O2, N2, CO2 — для поддержания необходимого значения рН, была применена среда L-15, допускающая рост клеток в атмосфере воздуха [10, 11].
Потребление кислорода определялось по формуле
Uп = ((С1 – С2) – Uавтопотр∙∆t) /(∆t∙Nкл), где С1 — начальная концентрация кислорода в камере; С2 — конечная концентрация кислорода в камере; ∆t — время измерения потребления кислорода; Nкл — концентрация клеток в камере.
Экспериментальное определение собственного потребления кислорода измерительным электродом:
С 1 , ммоль/л — 0.197
С 2 , ммоль/л — 0.188
Δ С , ммоль/л — 0.009
∆ t , мин — 20
U автопотр , ммоль/(л∙мин) — 0.00045
Распределение клеток по фазам клеточного цикла
|
Фаза Условия |
G1, % |
S, % |
G2+M, % |
|
Норма (N) |
51 ± 3 |
32 ± 5 |
17 ± 3 |
|
Гипоксия (H) |
50.5 ± 1 |
39.5 ± 2 |
10 ± 1 |
Измерение дыхания клеток линии NIH 3Т3:
Объем среды в камере, мл — 1.5
Nкл , млн —2.25
At, мин —30
С1, ммоль/л —0.197
С2, ммоль/л —0.136
U п , ммоль/(кл.∙мин) — 7.03∙10–10
При этом установлено:
-
— удельная скорость роста культуры клеток в условиях гипоксии составляет 20 % от нормы;
-
— потребление кислорода клетками при инкубировании с гипоксеном снижается по сравнению с инкубированием без гипоксена в среднем на 30 %;
-
3. Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции // Бюлл. эксп. биол. и мед. 1997. Т. 124, № 9. С. 244–254.
-
4. Мануйлов С.Е., Нестеров Л.А., Орлов Е.И. и др. Действие цитохрома С, галактозы и уридинтрифосфата на рост прививаемых опухолей // Вопросы онкологии. 1973. Т. 19, № 7. С. 62– 65.
-
5. Кулинский В.И., Колесниченко Л.С. Биологическая роль глутатиона // Успехи совр. биол. 1990. Т. 110, вып. 1. С. 20–32.
-
6. Пальмина Н.П., Мальцева Е.Л., Курнакова Н.В. и др. Влияние а -токоферола в широком спектре концентраций (10–2–10–17 М) на активность протеинкиназы С. Связь с пролиферацией и опухолевым ростом // Биохимия. 1994. Т. 59, вып. 2. С. 134–200.
-
7. Лежнев Э.И., Кудрявцев А.А. и др. Сравнительное изучение цитотоксического действия гипертермии на культивируемые клетки на разных фазах клеточного цикла в непрерывном и периодическом режимах гипертермических воздействий // Клеточные культуры: Ин-фор. бюлл. 2002. Вып. 17. С. 4–9.
-
8. Баркан Р.С., Никольский Н.Н. Минимально трансформированные клеточные линии 3Т3 как объект исследования механизмов пролиферации // Цитология. 1985. Т. XXVII, № 1. С. 5–26.
-
9. Смирнов В.С., Кузьмич М.К. Гипоксен. СПб.— М.: ФАР Миндекс, 2001. 104 с.
-
10. Пинаев Г.П. Методы культивирования клеток. Л.: Наука, 1988. 320 с.
-
11. Leibovitz A. The growth and maintenance of tissue-cell cultures in the free gas exchange with the atmosphere // Am. J. Hyg. 1963. V. 78. P. 173–178.
— происходит изменение фазового состава культуры 3Т3 в условиях гипоксии (таблица), так что следствием гипоксии может быть значительное перераспределение клеток в фазах G2+M.
Таким образом, аппаратура в приведенном в настоящей статье составе методически и метрологически позволяет исследовать влияние гипоксии на культуры клеток.
ление липидов и природные антиоксиданты // Успехи химии. 1985. Т. 54, № 9. С. 1540–1558.
Работа поддержана грантом РФФИ № 01-0497035 и грантом "Наукоград 2004" № 04-0497296.
Список литературы Аппаратура для исследований влияния гипоксии на клеточные культуры в нормотермических и гипертермических условиях
- Медведев Ю.В., Толстой А.Д. Гипоксия и свободные радикалы в развитии патологических состояний организма. М.: ООО "Терра-Календер и Промоушн", 2000. 232 с.
- Бурлаков Е.Б., Храпова Н.Г. Перекисное окисление липидов и природные антиоксиданты//Успехи химии. 1985. Т. 54, № 9. С. 1540-1558.
- Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции//Бюлл. эксп. биол. и мед. 1997. Т. 124, № 9. С. 244-254.
- Мануйлов С.Е., Нестеров Л.А., Орлов Е.И. и др. Действие цитохрома с, галактозы и уридинтрифосфата на рост прививаемых опухолей//Вопросы онкологии. 1973. Т. 19, № 7. С. 62-65.
- Кулинский В.И., Колесниченко Л.С. Биологическая роль глутатиона//Успехи совр. биол. 1990. Т. 110, вып. 1. С. 20-32.
- Пальмина Н.П., Мальцева Е.Л., Курнакова Н.В. и др. Влияние α-токоферола в широком спектре концентраций (10-2-10-17 М) на активность протеинкиназы С. Связь с пролиферацией и опухолевым ростом//Биохимия. 1994. Т. 59, вып. 2. С. 134-200.
- Лежнев Э.И., Кудрявцев А.А. и др. Сравнительное изучение цитотоксического действия гипертермии на культивируемые клетки на разных фазах клеточного цикла в непрерывном и периодическом режимах гипертермических воздействий//Клеточные культуры: Инфор. бюлл. 2002. Вып. 17. С. 4-9.
- Баркан Р.С., Никольский Н.Н. Минимально трансформированные клеточные линии 3Т3 как объект исследования механизмов пролиферации//Цитология. 1985. Т. XXVII, № 1. С. 5-26.
- Смирнов В.С., Кузьмич М.К. Гипоксен. СПб.-М.: ФАР Миндекс, 2001. 104 с.
- Пинаев Г.П. Методы культивирования клеток. Л.: Наука, 1988. 320 с.
- Leibovitz A. The growth and maintenance of tissue-cell cultures in the free gas exchange with the atmosphere//Am. J. Hyg. 1963. V. 78. P. 173-178.


