Апробация эффективности нового типа спейсеров для локальной антибиотикотерапии
Автор: Ахтямов И.Ф., Саченков О.А., Шафигулин Р.А., Галяутдинова А.Э., Харин Н.В., Беспалов И.А., Бойчук С.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. В настоящее время, кроме системной терапии, приняты два типа лечения гнойной инфекции костно-суставного аппарата: одноили двухэтапное локальное воздействие на биопленку, причем оба предусматривают использование костного цемента с активным веществом, как правило, антибиотиком. Цель работы — в условиях эксперимента оценить качественный и количественный выход из костного цемента антибиотика, внедренного в новый тип спейсера решетчатой структуры. Материалы и методы. Использован новый тип имплантата (спейсера), имеющего решетчатую структуру, изготовленного с помощью аддитивных технологий, и образец сравнения, имитирующий традиционный армированный спейсер из костного цемента + антибиотик. Выход Ванкомицина измеряли методом спектрофотометрии на сроках до 30 дней. Для построения калибровочных кривых использовали регрессионную прямую по данным, полученным из маточных растворов. Результаты. Получен эффективный профиль высвобождения антибиотика из костного цемента в первые дни эксперимента с последующим снижением к концу первой недели и выходом на равномерное плато. Количество зафиксированного антибиотика в растворах не превышало 1 % общей массы костного цемента и активного вещества. Из образцов, имеющих решетчатую структуру, количество выделенного антибиотика было выше, чем в образцах сравнения. Обсуждение. Считается, что высвобождение антибиотика является поверхностным процессом и не зависит от общего объема костного цемента. Возможное увеличение объема лекарственного композиционного состава не приводит к пропорциональному увеличению количества высвобождаемого активного вещества. В данном исследовании это подтверждается тем, что даже при меньшем объеме материала в решетчатых структурах высвобождение антибиотика происходит более интенсивно по сравнению с контрольными образцами, что подчеркивает важность оптимизации геометрии и структуры материала для достижения максимальной эффективности высвобождения активных веществ. Заключение. Решётчатая структура имплантатов количественно влияет на выделение антибиотика из костного цемента в окружающую среду.
Инфекция костной ткани, костный цемент, имплантат, элюция антибиотика, аддитивные технологии
Короткий адрес: https://sciup.org/142244814
IDR: 142244814 | УДК: 616.728.48-007.248-089.881-001.5-089.227.84 | DOI: 10.18019/1028-4427-2025-31-3-372-379
Текст научной статьи Апробация эффективности нового типа спейсеров для локальной антибиотикотерапии
Гнойная инфекция является одним из наиболее грозных осложнений в хирургии костно-суставной системы [1–3]. Общепринятая системная терапия эффективно сопровождается локальным воздействием на патологический очаг [4–7]. В большинстве исследований методом купирования инфекционного осложнения является двухэтапное ревизионное хирургическое вмешательство: первичная установка спейсера из костного цемента (КЦ) с активным веществом (избранным антибиотиком) с последующей имплантацией ревизионной конструкции. Это касается как суставной патологии, так и патологии длинных костей [8].
Разработано немало технологий повышения сроков и количества выхода антибиотика в окружающую среду. Известным фактом является то, что элюция активного вещества происходит лишь из поверхностного слоя спейсера (в пределах 2–3 мм). Это предопределяет возможность повышения степени элюции увеличением площади соприкосновения лечебного композитного слоя (костный цемент + антибиотик) с окружающей средой [9]. Кроме того, влияние антибиотика (АБ) на окружающие ткани распространяется не более чем на 20–25 мм. Таким образом, технологически распределение лечебного композитного слоя (ЛКС) лишь по поверхности спейсера ограничено локацией инфекционного очага и затратно с точки зрения использования и перераспределения больших объемов АБ [10]. Нельзя забывать и о прочностных характеристиках формируемого спейсера, они должны обеспечить функциональные возможности пациента и служить при необходимости основой остеосинтеза [11, 12].
Использование решетчатых структур при изготовлении базовых имплантатов могло бы увеличить площадь соприкосновения композитного слоя с окружающей средой, улучшить элюцию АБ из КЦ. Предварительный расчет прочностных характеристик позволяет минимизировать изменения конструкции имплантата, заданные изготовителем. Сочетание объемной решетчатой конструкции с ЛКС формируют так называемый метаматериал, что могло бы стать одним из вариантов решения данной научно-практической проблемы [13]. Создание объемной решетчатой конструкции, как части имплантата (спейсера), осуществляется с использованием аддитивных технологий. Это достижимо в ходе проектирования элементарных ячеек, которые заполняют объем изделия. В тематических публикациях отмечено влияние распределения элементарной ячейки на прочность конструкции [14]. Иным методом является применение топологической или структурной оптимизации. N. Kladovasilakis et all. [15] оптимизировали конструкции для тазобедренных имплантатов, благодаря чему достигли 50 %-ной пористости с сохранением прочностных требований. Имплантаты на основе решетчатых структур могут выступать в роли преформированной базы с заранее заданными параметрами, что позволит снизить или вовсе исключить необходимость кустарного изготовления армированных спейсеров.
Цель работы — в условиях эксперимента оценить качественный и количественный выход из костного цемента антибиотика, внедренного в новый тип спейсера решетчатой структуры.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве базы для костного цемента с антибиотиком выбран цилиндр, имеющий решетчатую структуру (рис. 1, а), копирующий фрагмент предполагаемого имплантата под номером I и образец сравнения II (рис. 1, б), то есть фрагмент штифта, на поверхность которого сплошным слоем наносят мантию из КЦ толщиной 2 мм.

Рис. 1. Виды исследуемых образцов: а — образец решетчатого имплантата I; б — образец сравнения II
Образец I представляет собой компоновку внутреннего стержня диаметром 6 мм и слоя внешних ребер под углом в 45°, с внешним диаметром 12 мм. В качестве образца сравнения взят цилиндр с внешним диаметром 8 мм. Характеристики исследуемых образцов представлены в табл. 1.
Таблица 1
Сравнительные параметры исследуемых образцов
|
№ |
Диаметр, мм |
Длина, мм |
Диаметр стержня, мм |
Диметр ребра, мм |
Пористость, % |
Объем цемента, мм3 |
Площадь поверхности, мм2 |
|
I |
12 |
60 |
6 |
1 |
61,9 |
3702 |
2261 |
|
II |
8 |
60 |
– |
– |
0 |
3769 |
2261 |
Исследуемые образцы
Для исследования выхода антибиотика из ЛКС методом лазерной стереолитографии с последующим дополнительным укреплением при помощи ультрафиолета изготовлено по четыре образца каждой структуры. Для производства образцов выбран фотополимерный принтер с фотополимерной смолой.
Исследование проведено на костном цементе Synycem (Франция). Для приготовления ЛКС каждого испытуемого образца использовано по 4,0 г сухого составляющего костного цемента и 0,2 г антибиотика Ванкомицин. Выбор АБ обусловлен термостабильностью, активным применением в клинической практике и научных исследованиях по данной проблеме. Порошковое составляющее КЦ смешивали с антибиотиком до гомогенного состояния, далее к смеси добавляли 2 мл мономера, замешивали до гомогенного пластичного состояния. Нанесение ЛКС на исследуемые образцы осуществляли при помощи одноразового шприца объёмом 5 мл с внутренним диаметром 12 мм, который служил в качестве формы. На рис. 2 представлены исследуемые образцы.

Рис. 2. Внешний вид изготовленных образцов (а — образцы I, б — образцы II)
Решетчатые структуры покрывали ЛКС так, чтобы он не выступал за торцы образца. Внешний диаметр образцов составил 12 мм. Каждый образец помещали в пробирку Falcon, заполненную 30 мл фосфатно-солевого буферного раствора Дульбекко (DPBS) без Ca2+ и Mg2+ при температуре 37 °C. Погружение образцов осуществляли для обеспечения полного контакта с DPBS.
Оценка выхода антибиотика из лекарственного композитного состава
Количественное определение антибиотика в растворах проводили с помощью спектрофотометрического метода на спектрофотометре BioMate 3S UV-Visible (США), позволяющего получить зависимости оптической плотности растворов от концентрации АБ. Измерения выполняли в диапазоне волн от 190 до 230 нм. В полученных спектрах оценивали пик измерений, соответствующий антибиотику. В качестве калибровочных эталонов использовали несколько маточных растворов АБ: Ванкомицин в концентрациях 0, 0,00005, 0,0001, 0,00025, 0,0005, 0,00075, 0,001, 0,002, 0,003, 0,004 мг/мл. Объем образца в кювете для проведения измерения был равен 1000 мкл. Ванкомицин в объеме 0,5 г растворялись в 5 мл DPBS для получения концентрации 1 мг/мл.
Таблица 2
Расчеты концентраций для построения калибровочных кривых Ванкомицина с помощью маточных растворов
|
Кол-во маточного раствора, мкл |
Кол-во DPBS, мкл |
Концентрация, мг/мл |
|
400 из концентрации 0,01 |
600 |
0,004 |
|
300 из концентрации 0,01 |
700 |
0,003 |
|
200 из концентрации 0,01 |
800 |
0,002 |
|
500 из концентрации 0,01 |
4500 |
0,001 |
|
750 из концентрации 0,001 |
250 |
0,00075 |
|
500 из концентрации 0,001 |
500 |
0,0005 |
|
250 из концентрации 0,001 |
750 |
0,00025 |
|
200 из концентрации 0,001 |
1800 |
0,0001 |
|
500 из концентрации 0,0001 |
500 |
0,00005 |
Для построения калибровочных кривых использовали регрессионную прямую по данным, полученным из маточных растворов. Для оценки достоверности различий в высвобождении АБ между исследуемыми структурами применяли непараметрический критерий Манна – Уитни для сравнения двух независимых выборок и определения статистически значимых различий между ними.
Измерение кинетики элюции антибиотиков
Измерения элюции АБ осуществляли через 1, 3, 7, 15 и 29 дней соответственно. Определяли общее количество Ванкомицина в растворе в каждой точке измерения согласно расписанию. Для каждого дня концентрацию оценивали по следующей формуле:
где p — значение спектрометра во взятой пробе в заданный день, k — коэффициент регрессии, с — коэффициент, связанный с разбавлением пробы в кювете, d — длительность экспозиции в днях.
Стоит отметить, что коэффициент, связанный с разбавлением пробы в кювете, также зависел от дня измерения. Это связано с тем, что концентрация со временем возрастала. Для определения кинетики антибиотика использовали производную по времени, скорость высвобождения антибиотика определяли по формуле:
иш =
^■a^i) ^a(^i-l)
где d i — длительность экспозиции i-ой съемки.
Вычисление массы выделенного антибиотика при заданной длительности экспозиции (d) осуществляли умножением соответствующей концентрации антибиотика в пробе на общий объем во флаконе V:
^aW = CaW ■ V-
РЕЗУЛЬТАТЫ
Анализ пиков для спектров поглощения показал, что для Ванкомицина длина волны составляла 271–280 нм, что соответствует данным фармакопеи препарата.
Определен коэффициент регрессии и построена регрессионная кривая (0). Значение регрессионного коэффициента k для Ванкомицина — 405,9. Линейная зависимость для АБ показала высокий коэффициент детерминации R2 ≥ 0,986 (рис. 3). По показаниям концентрации в один день съемки вычисляли средние значения для обеих структур. Средние значения элюции для опытного образца I были выше, чем для образца сравнения II на всех этапах экспозиции (рис. 4). Оценивали попарную достоверность отличий средних величин.
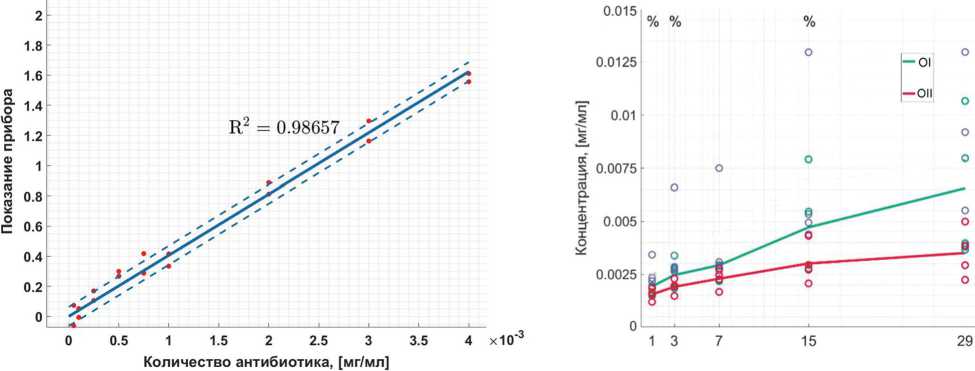
Рис. 3. Регрессионная кривая Ванкомицина: сплошная линия — регрессионная кривая, штрих-пунктирная линия — доверительный интервал, красные точки значения спектрофотометра
Рис. 4. Сравнительная кривая концентрации антибиотика
В средних значениях концентрации Ванкомицина значимой разницы по ходу исследования между образцами не выявлено. Контрольный образец II показывает наименьшую скорость высвобождения антибиотика, но и наименьший разброс (рис. 5). Отдельно рассчитана общая масса выделенного АБ Ванкомицина — 0,1969 мг в образце I и 0,1051 мг в образце II соответственно (рис. 6). Среднее значение высвобождения АБ в опытном образце II на 97 % лучше, чем в контрольном.
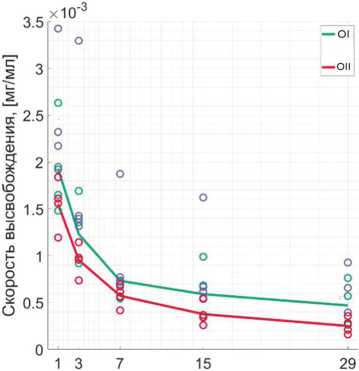
Рис. 5. Кинетика Ванкомицина
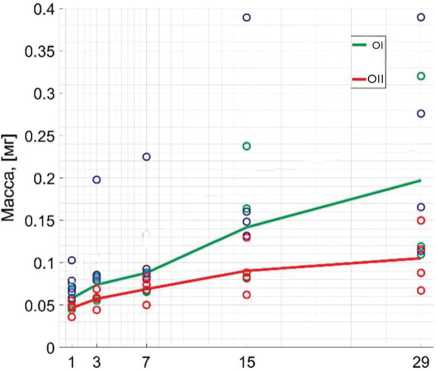
Рис. 6. Масса выделенного антибиотика
В результате многодневного эксперимента, получены изменения массы выделенного АБ в зависимости от сроков контроля (табл. 3).
Таблица 3
Выход антибиотика из ЛКС
|
№ |
Количество Ванкомицина, мкг |
||||
|
1 |
3 |
7 |
15 |
29 |
|
|
I |
57,8 ± 15,2 |
73,8 ± 21,9 |
87,8 ± 31,6 |
141,5 ± 74,4 |
196,9 ± 101 |
|
II |
46,5 ± 8,0 |
57,2 ± 10,0 |
68,6 ± 13,9 |
90,3 ± 28,4 |
105,1 ± 35,8 |
Для описания сравнительной характеристики образцов вводится коэффициент, — отношение сво- бодной поверхности образца к объему заполняемого ЛКС. Данный параметр позволяет оценивать эффективность высвобождения АБ в зависимости от геометрических особенностей каждого образца.
Кроме того, для количественной оценки процесса элюции рассчитано процентное отношение выделенного АБ к начально заложенному (табл. 4).
Таблица 4
Относительные характеристики образцов
|
№ |
Площадь / Объем |
Ванкомицин, % |
|
I |
0,61 |
0,07 ± 0,05 |
|
II |
0,6 |
0,05 ± 0,0179 |
В данном случае можно сказать, что введенный коэффициент, суть которого отношение свободной поверхности образца к объему КЦ, показывает зависимость от выделяемого количества АБ.
ОБСУЖДЕНИЕ
Данное исследование проведено с целью выявления влияния решетчатой структуры на элюцию антибиотика из лекарственного композитного слоя, то есть костного цемента, импрегнированного антибиотиком.
Во всех образцах получен характерный профиль элюции АБ из КЦ, а именно значимое высвобождение в первые дни эксперимента с последующим угасанием (седьмой день) и с выходом на равномерное плато (15-ый день), что соотносится с результатами аналогичных исследований [16–20]. Количество высвобождаемого АБ оказалось не более 1 % от массы импрегнированного препарата.
Отмечена существенная разница между исследуемыми образцами в количестве выделенного Ванкомицина. Так, в образцах, имеющих решетчатую структуру, количество выделенных АБ выше, несмотря на относительно большее изначальное содержание ЛКС в образцах сравнения.
Как известно, основная часть антибиотика элюируют с поверхностного слоя костного цемента из микропор и трещин [21–25], что подтверждается нашими результатами. Больший уровень выхода Ванкомицина, вероятно, объясняется наличием ребер решетчатых структур. Деление единой структуры ЛКС на мелкие участки повышает зону контакта с омывающим раствором и увеличивает диффузию АБ по сравнению с контрольным образцом. Это явление особенно важно при локальной антибиотикоте-рапии, где контролируемое и продолжительное высвобождение активных веществ является ключевым фактором эффективности [26].
Считается, что высвобождение антибиотика является поверхностным процессом и не зависит от общего объема КЦ [27, 28]. Возможное увеличение объема ЛКС не приводит к пропорциональному увеличению количества высвобождаемого АБ. В данном исследовании это подтверждается тем, что даже при меньшем объеме материала в решетчатых структурах высвобождение антибиотика более интенсивно по сравнению с контрольными образцами. Это подчеркивает важность оптимизации геометрии и структуры материала для достижения максимальной эффективности высвобождения активных веществ [29, 30].
Ограничения исследования заключаются в том, что исследован лишь один, хотя и наиболее востребованный, вид антибиотика. Требуется сравнительный анализ элюции комбинаций активных веществ из ЛКС, вариантов решетки, исследования на металлических образцах, то есть большой объем последующих экспериментов.
ЗАКЛЮЧЕНИЕ
Исследование показало, что использование решётчатых структур для изготовления имплантатов-спейсеров позволяет увеличить скорость и количество элюированного АБ из ЛКС по сравнению с традиционным вариантом армирования костного цемента.


