Апробация системы высокочувствительной детекции патогенных микроорганизмов в аквакультуре обыкновенного карпа Cyprinus carpio Linnaeus, 1758
Автор: Дзюба Елена Владимировна, Деникина Наталья Николаевна, Кондратистов Юрий Леонидович, Белькова Наталья Леонидовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: фауна
Статья в выпуске: 1-8 т.14, 2012 года.
Бесплатный доступ
Факторами, сдерживающими успешное развитие пресноводного рыбоводства, являются заболевания рыб различной этиологии. С помощью разработанной системы праймеров апробированы высокочувствительные методы детекции патогенных микроорганизмов родов Aeromonas и Flavobacterium в аквакультуре карпа. В язвенных поражениях внешних покровов рыб идентифицированы микроорганизмы Flavobacterium psychrophilum и Aeromonas sp. Обсуждаются возможные пути возникновения комплексных эпизоотий и целесообразность применения разработанных диагностических систем на рыбоводных заводах для мониторинга микробиоты в аквакультуре рыб и своевременной коррекции графика проведения санитарно-эпизоотических мероприятий.
Молекулярно-генетические методы
Короткий адрес: https://sciup.org/148200957
IDR: 148200957 | УДК: 57.083.18:579.843:597.554.3
Текст научной статьи Апробация системы высокочувствительной детекции патогенных микроорганизмов в аквакультуре обыкновенного карпа Cyprinus carpio Linnaeus, 1758
По данным ФАО рыба и рыбопродукты являются одним из главных источников белка для человека, на их долю приходится более 80% общего объема потребляемых морских продуктов. Поскольку вылов рыбы традиционной рыбной ловлей остается постоянным (статистика ФАО по рыбоводству), существующая нехватка в рыбе и рыбопродуктах должна быть восполнена за счет рыбоводства [1]. В настоящее время технология разведения гидробионтов в мари- и аквакультуре превратилась в динамично развивающийся сектор на международном рынке, обеспечивающий около 25% всего мирового потребления рыбы. При этом Российская Федерация по наличию водоемов, отвечающих требованиям культивирования гидробионтов, занимает первое место в мире [2]. Факторами, сдерживающими успешное развитие пресноводного рыбоводства, являются заболевания рыб различной этиологии.
Наиболее широко распространённым и наносящим значительный ущерб предприятиям аквакультуры бактериальным заболеванием является бактериальная геморрагическая септицемия (БГС, аэромоноз) – полиэтиологическое заболевание
рыб [3]. Традиционно работы по эпизоотической оценке рыбоводных предприятий выполняются с проведением бактериологических исследований выращиваемых рыб, кормов и воды. Посевы проводятся непосредственно из биологического материала на селективные питательные среды, культивирование отдельных групп микроорганизмов занимает от 5 до 10 сут. Длительность процедуры постановки диагноза и возможные ошибки, связанные с несвоевременностью получения результатов, нередко приводят к неправильному выбору лекарственных средств и как следствие – к ухудшению эпизоотической ситуации. В связи с этим актуальной является разработка современных чувствительных экспресс-методов детекции патогенных агентов в конкретных водных объектах. Множество исследований посвящены оценке возможности использования молекулярно-генетических методов на основе полимеразной цепной реакции (ПЦР) для детекции и идентификации возбудителей инфекций [4-6]. Прямой анализ маркерных фрагментов геномов позволяет избегать проблем культивирования и неспецифической детекции, а также эффективно и быстро выявлять целевые группы микроорганизмов в пробах биологического материала. Диагностика бактериальных инфекций на основе видо-специфичной амплификации активно развивается и применяется в странах с развитой мари- и аквакультурой (Норвегия, Канада и др.) [7-11].
Рыбное хозяйство занимает существенное значение в экономической инфраструктуре Байкальского региона. В Иркутской области работают Бурдугузский рыбоводный завод на Иркутском водохранилище (ввод в эксплуатацию в 1968 г.) и Бельский – на р. Белой (ввод в 1964 г.). По данным ФГБУ «Иркутская межобластная ветеринарная лаборатория» ранее отмечались случаи возникновения заболеваний молоди карпа в бассейнах Бурдугузского рыбзавода, вызванные Aer-omonas hydrophila (экспертиза № 137 от 24.01. 2003 г.). С 2004 г. предприятие не функционировало и было вновь запущено в 2011 г. в рамках программы «Развитие рыбохозяйственного комплекса региона на 2012-2016 годы». Одна из целей проекта – создание условий для рыборазведения и производства рыбной продукции. Для успешного её достижения необходим мониторинг инфекционных заболеваний объектов культивирования с использованием современных методов детекции патогенных агентов.
Цель работы: разработка методов высокочувствительной детекции патогенных микроорганизмов родов Aeromonas и Flavo-bacterium на внешних покровах карпа Cyprinus carpio .
Материалы и методы . В сентябре 2011 г. на Бурдугузском рыбоводном заводе началась эпизоотия язвенной болезни среди маточного стада карпа. На исследование был взят один экземпляр карпа с множественными обширными язвенными поражениями на внешних покровах тела (рис. 1).

Рис. 1. Обширные поражения внешних покровов карпа: общий вид (А), возле грудных плавников и на жаберных крышках (Б), дорсальная поверхность тела возле спинного плавника (В)
Длина тела (до конца чешуйного покрова) самки карпа составила 540 мм, масса 2870 г. Непосредственно после отлова в лабораторных условиях были взяты соскобы и образцы тканей с пораженных участков тела, выделена суммарная ДНК с использованием коммерческого набора ДНК-сорб В (ФГУН ЦНИИ эпидемиологии Роспотребнадзора, Москва) по протоколу фирмы-производителя. Фрагменты гена 16S рРНК амплифицировали как с разработанными в данном исследовании, так и с опубликованными ранее [12] праймерами, специфичными для представителей родов Aeromonas (АF1 5’-gataagtta gatgtgaaagcccc и AHyd2 5’-ggggctttcacatctaacttatc)
и Flavobacterium (Ff1 5’-tctaccttttacagagggatagc и Fr1 5’-gacgacaaccatgcagcacc). Реакцию амплификации проводили в режиме: 96оС 10’’; 66оС 20’’; 72оС 60’’ 35 циклов. Полученные ампликоны, длиной 544 и 925 п.н., соответственно, лигировали в вектор GeneJETTM (GeneJETTM PCR Cloning Kit, Fermentas, Литва). Нуклеотидные последовательности определяли на автоматическом секвенаторе ABI310A (ABI PRISM 310 Genetic Analyzer) в Новосибирском приборном центре коллективного пользования СО РАН.
Результаты и обсуждение. Результаты ПЦР анализа суммарной ДНК, выделенной из поражений внешних покровов разной степени тяжести, продемонстрировали присутствие в них представителей родов Aeromonas и Flavo-bacte-rium (рис. 2). Секвенирование полученных фрагментов гена 16S рРНК позволило идентифицировать микроорганизмы Flavobacterium psy-chrophilum и Aeromonas sp.
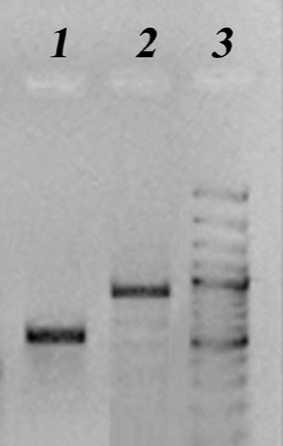
Рис. 2. Результаты амплификации фрагментов гена 16S рРНК суммарной ДНК из язвенных поражений карпа на праймерах, специфичных для Aeromonas (1) и Flavobacterium (2). 3 – маркер молекулярного веса
1500 п.н.1000 п.н.500 п.н.
Использованная в работе система праймеров специфична для одного из наиболее широко распространенных семейств группы Bactero-idetes/Chlorobi класса Flavobacteriia – Flavobacter-iaceae и позволяет амплифицировать до 100% известных представителей рода Flavobacterium , среди которых известен целый спектр патогенных для рыб микроорганизмов ( Flavobacterium psychrophilum, F. columnare, F. branchiophilum ). Обнаруженный в проведенном молекулярногенетическом анализе F. psychrophilum (син.: Cy-tophaga psychrophila , Flexibacter psychrophilus ) первоначально определен как типичный патоген, вызывающий язвы на теле и гниль плавников лососевых рыб при низких температурах
(бактериальная холодноводная болезнь, англ. «visceral myxobacteriosis» и/или «bacterial cold water disease» (BCWD), «coldwater disease» (CWD) [13]). F . psychrophilum выделяет протеолитические ферменты, которые вызывают прямое повреждение тканей и расширение зоны поражения, что является одним из предлагаемых факторов вирулентности бактерии [14, 15]. Инфицированные рыбы, как правило, имеют повреждения внешних покровов тела, приводящие к обнажению мышц и позвоночника [16]. Наиболее восприимчивы к заболеванию искусственно воспроизводимые виды рыб семейств Salmoni-dae, Coregonidae, Cyprinidae и Percidae [17].
Вторая апробированная система праймеров позволяет выявлять представителей рода Aero-monas – одного из типичных для водной микробиоты. Определенные в результате проведенной работы нуклеотидные последовательности идентичны Aeromonas sp. (GenBank: HQ246247), полученной при исследовании микробного сообщества аквакультуры тиляпии [18] и отличаются одной заменой от A. sobria, A. hydrophila , A. cavi-ae и A. jandaei . Необходимо отметить, что последовательность анализированного фрагмента крайне консервативна для рода Aeromonas и идентична для патогенных видов.
Заболевания рыб, вызванные представителями рода Aeromonas в аквакультуре, характеризуются высокой летальностью. Наиболее полно изучен «фурункулез» – системная болезнь лососевых рыб, вызываемая Aeromonas salmonicida subsp. salmonicida [19]. Другие подвиды A. salm-onicida также вызывают системные и язвенные болезни рыб. Мезофильные аэромонады ( A. hy-drophila , A. caviae и A. sobria ), чаще всего поражают прудовых рыб [19].
Смешанные инфекции у рыб возникают при одновременном сочетанном воздействии нескольких возбудителей. Кожа является наиболее восприимчивым органом-мишенью для инфекционных агентов рыб [20]. Инфицирование бактериями, грибами и вирусами способствует возникновению инфекционного язвенного синдрома кожи, которое характеризуется появлением красных пятен и язв на внешних покровах и сопровождается высокой смертностью различных видов рыб [21, 22 и др.]. Целостность кожи играет важную роль в защите рыб от бактериальных инфекций за счет присутствующих в слизи антимикробных продуктов (лизоцим, агглютинины) [23]. Отмечено значительное увеличение численности бактерий в местах отслоения эпителиальных клеток. Только редкие бактериальные клетки были обнаружены на неповрежденной коже или вблизи зон поражений [24]. Гистологические исследования распределения F. psychrophilum на коже рыб выявили его присутствие только на микротравмах, причем интактные участки кожи остаются неинфицированными. Бактерии имеют сродство к коллагену, благодаря чему при попадании в дерму мигрируют в миосепты через соединительную ткань. Впоследствии зоны поражений захватывают основную мускулатуру, что приводит к развитию некротического миозита и формированию открытых язв [25]. Аэромонады же преимущественно поражают ранее поврежденные ткани, как правило, зоны эрозии [24].
Эпизоотия на Бурдугузском рыбоводном заводе началась после перевода маточного стада карпа из рыбохозяйственных прудов в бассейны с проточной водой. Так как регулярно проводимые в условиях аквакультуры манипуляции с рыбами во время отлова и транспортировки часто приводят к травмированию их внешних покровов, это в совокупности с присутствием патогенов в окружающей среде приводит к возникновению заболеваний.
Поскольку разработанная диагностическая система позволяет детектировать присутствие представителей родов Aeromonas и Flavobacterium в любых образцах (как в соскобах внешних покровов, так и в пробах воды), ее применение целесообразно на всех основных этапах технологического процесса для мониторинга микробиоты в аквакультуре рыб и своевременной коррекции графика проведения санитарно-эпизоотических мероприятий.
Работа выполнена при поддержке ГК № 16.512.11.2075 Министерства образования и науки Российской Федерации в рамках Программы фундаментальных исследований Президиума РАН «Живая природа: современное состояние и проблемы развития» проект № 30.13.
Список литературы Апробация системы высокочувствительной детекции патогенных микроорганизмов в аквакультуре обыкновенного карпа Cyprinus carpio Linnaeus, 1758
- The state of world fisheries and agriculture/FAO Fisheries and Aquaculture Department: Food and Agriculture organization of the United Nations. -Rome, 2010. 225 p.
- Богерук, А.К. Аквакультура в России: история и современность//Рыбное хозяйство. 2005. № 4. С. 14-18.
- Бычкова, Л.И. Бактериальная геморрагическая септицемия карпа (БГС) в пресноводной аквакультуре (причины возникновения и меры борьбы)/Л.И. Бычкова, Л.Н. Юхименко//II съезд NACEE «Аквакультура Центральной и Восточной Европы: настоящее и будущее». Кишинев: Pontos, 2011. С. 34-37.
- Altinok, I. Molecular Diagnosis of Fish Diseases: a Review/I. Altinok, I. Kurt//Turk. J. Fish. Aquat. Sci. 2003. Vol. 3. P. 131-138.
- Altinok, I. Multiplex PCR assay for detection of four major bacterial pathogens causing rainbow trout disease//Dis. Aquat. Org. 2011. Vol. 93. Issue 3. P. 199-206.
- Zerihun, M.A. Immunohistochemical and Taqman real-time PCR detection of mycobacterial infections in fish/M.A. Zerihun, M.J. Hjortaas, K. Falk, D.J. Colquhoun//J. Fish Dis. 2011. Vol. 34. P. 235-246.
- Haygood, M.G. Polymerase chain-reaction and 16S-ribosomal-RNA gene-sequences from the luminous bacterial symbionts of 2 deep-sea anglerfishes/M.G. Haygood, D.L. Distel, P.J. Herring//J. Mar. Biol. Assoc. U.K. 1992. Vol. 72. P. 149-159.
- Haygood, M.G. Light organ symbioses in fishes//Crit. Rev. Microbiol. 1993. Vol. 19. P. 191-216.
- Van der Maarel, M.J.E.C. Detection of methanogenic archaea in seawater particles and the digestive tract of a marine fish species/M.J.E.C. Van der Maarel, W. Sprenger, R. Haanstra, L.J. Forney//FEMS Microbiol. Lett. 1999. Vol. 173. P. 189-194.
- Spanggaard, B. The microflora of rainbow trout intestine: a comparison of traditional and molecular identification/B. Spanggaard, I. Huber, T. Nielsen et al.//Aquaculture. 2000. Vol. 182. P. 1-15.
- Buller, N.B. Bacteria from fish and other aquatic animals: a practical identification manual/Oxfordshire: CABI publishing, 2004. 361 p.
- Nielsen, M.E. Is Aeromonas hydrophila the dominant motile Aeromonas species that causes disease outbreaks in aquaculture production in the Zhejiang Province in China?/M.E. Nielsen, L. Høi, A. Schmidt et al.//Dis. Aquat. Org. 2001. Vol. 46. P. 23-29.
- Baudin-Laurencin, F. La myxobactéiose viscérale de la truite arc-en-ciel я R: Une forme nouvelle de la maladie de l’eau froide à Cytophaga psychrophila/F. Baudin-Laurencin//Acad. Vét. de France. 1989. Vol. 62. P. 147-157.
- Madsen, L. Characterization of Flavobacterium psychrophilum; a comparison of proteolytic activity and virulence of strains isolated from rainbow trout (Oncorhynchus mykiss)/In: A.C. Barnes, G.A. Davidson, M.P. Hiney, D. McIntosh (Eds.) Methodology in Fish Diseases Research/L. Madsen, I. Dalsgaard//Fisheries Research Services, Aberdeen, 1998. P. 45-52.
- Madsen, L. Comparative studies of Danish Flavobacterium psychrophilum isolates: ribotypes, plasmid profiles, serotypes and virulence/L. Madsen, I. Dalsgaard//J. Fish Dis. 2000. Vol. 23. P. 211-218.
- Tiirola, M. Diagnosis of flavobacteriosis by direct amplification of rRNA genes/M. Tiirola et al.//Dis. Aquat. Org. 2002. Vol. 51. No 2. P. 93-100.
- Lonnstrom, L.-G. Flavobacterium psychrophilum associated with mortality of farmed perch, Perca fluviatilis L./L.-G. Lonnstrom, M. L. Hoffren, T. Wiklund//J. Fish Dis. 2008. Vol. 31. P. 793-797.
- National Center for Biotechnology Information [Электронный ресурс]: база данных содержит мировую медико-биологическую и геномную информацию. -Bethesda MD, 20894 USA., 2012. Режим доступа: http://www.ncbi.nlm.nih.gov/nucleotide/309261162?report=genbank&log$=nuclalign&blast_rank=1&RID=RJVPTYV0012.
- Austin, B. Taxonomy of bacterial fish pathogens//Vet. Res. 2011. Vol. 42. P. 20.
- Noga, E.J. Fish Disease: Diagnosis and Treatment. -Mosby-Yearbook, St. Louis, MO, 1996. 367 p.
- Frerichs, G.N. Viruses associated with the epizootic ulcerative syndrome (EUS) of fish in South-East Asia//Vet. Res. 1995. Vol. 26. No 5-6. P. 449-454.
- Andrew, T.G. Epizootic ulcerative syndrome affecting fish in the Zambezi river system in southern Africa/T.G. Andrew, K.D. Huchzermeyer, B.C. Mbeha, S.M. Nengu//Vet. Rec. 2008. Vol. 163. No 21. P. 629-631.
- Alexander, J.B. Non-immunoglobulin humoral defense mechanisms in fish/In: Manning, M.J., Tatner, M.F. (eds). Fish immunology. -Academic Press, London, 1985. P. 133-140.
- Gostin, I.N. SEM investigations regarding skin micromorphology and modification induced by bacterial infections in Cyprinus carpio and Salmo trutta fario/I.N. Gostin, A.N. Neagu, V. Vulpe//IJEEE. 2011. Issue 2. Vol. 5. P. 274-281.
- Miwa, S. Pathogenesis of experimentally induced bacterial cold water disease in ayu Plecoglossus altivelis/S. Miwa, C. Nakayasu//Dis. Aquat. Org. 2005. Vol. 67. P. 93-104.


