Аптамеры для диагностики и лечения глиальных опухолей человека
Автор: Замай Т.Н., Дымова М.А., Народов А.А., Кошманова А.А., Грек Д.С., Воронковский И.И., Горбушин А.К., Кичкайло А.С., Кулигина Е.В., Рихтер В.А., Зуков Р.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Цель исследования - оценить возможность использования функциональных аналогов белковых антител - ДНК/РНК-аптамеров в диагностике, лечении и прогнозировании развития глиальных опухолей головного мозга человека. материал и методы. Поиск соответствующих источников литературы проводили в системах Scopus, Web of Science, PubMed, Elibrary с включением публикаций с 2000 по 2023 г. В обзоре представлены данные из 60 статей.
Глиома, глиобластома головного мозга, аптамеры, молекулярная мишень, онкомаркер, таргетная терапия, диагностика
Короткий адрес: https://sciup.org/140303533
IDR: 140303533 | УДК: 616.831-006.484-07:577.2 | DOI: 10.21294/1814-4861-2023-22-5-105-117
Текст научной статьи Аптамеры для диагностики и лечения глиальных опухолей человека
Глиомы головного мозга – первичные опухоли центральной нервной системы, характеризующиеся распространенной инфильтрацией опухолевых клеток, проявляющих цитологические и гистологические особенности глиальной дифференцировки [1, 2]. Границы, размер, форма и локализация опухоли, наличие или отсутствие зоны отека определяют методом магнитно-резонансной томографии, которая позволяет дифференцировать популяции мягких тканей на основе клеточной плотности [3].
Современная классификация глиом основывается на морфологическом описании опухоли и ее молекулярной структуре. Выделяют две основные группы глиальных опухолей – IDH-дикие и IDH-мутантные, которые далее делятся на более узкие подтипы. Согласно новой классификации, степень тяжести глиом может оцениваться внутри каждого типа опухоли. Такой подход улучшает прогноз развития опухолевого процесса [1].
В настоящее время одним из широко используемых методов лечения больных опухолями голов- ного мозга является хирургический. Подсчитано, что глиальная опухоль средних размеров включает в себя примерно 100 млрд клеток. Обычно при оперативном лечении глиобластомы удаляется не более 92 % опухоли, следовательно, в головном мозге человека после операции остается более миллиарда клеток, способных пролиферировать, что может способствовать дальнейшему развитию опухолевого процесса [4]. Исследование на 41 117 больных с глиальными опухолями головного мозга показало, что существует четкая зависимость между радикальностью хирургического удаления опухоли и выживаемостью пациентов [5]. Неполное удаление опухолевого очага с неизбежностью вызывает рецидив заболевания.
При химиотерапии глиобластомы используют темозоломид, стимулирующий апоптоз опухолевых клеток [6]. При рецидивировании глиобластомы рекомендована терапия моноклональными антителами – бевацизумабом. Однако несмотря на появление новых методов диагностики, а также подходов в хирургии, радио- и химиотерапии, показатели смертности от глиобластом остаются вы- сокими. Это делает актуальным разработку новых препаратов для диагностики и таргетного лечения (тераностиков) этого агрессивного заболевания. Основой для тераностиков могут стать аптамеры, короткие РНК- или ДНК-олигонуклеотиды, способные с высокой аффинностью связываться с различными молекулярными мишенями.
Цель исследования – оценить возможности использования функциональных аналогов моноклональных антител – ДНК/РНК-аптамеров в диагностике, лечении и прогнозировании развития глиальных опухолей головного мозга человека.
Поиск соответствующих источников литературы проводили в системах Scopus, Web of Science, PubMed, Elibrary с включением публикаций с 2000 по 2023 г. В обзоре представлены данные из 60 статей.
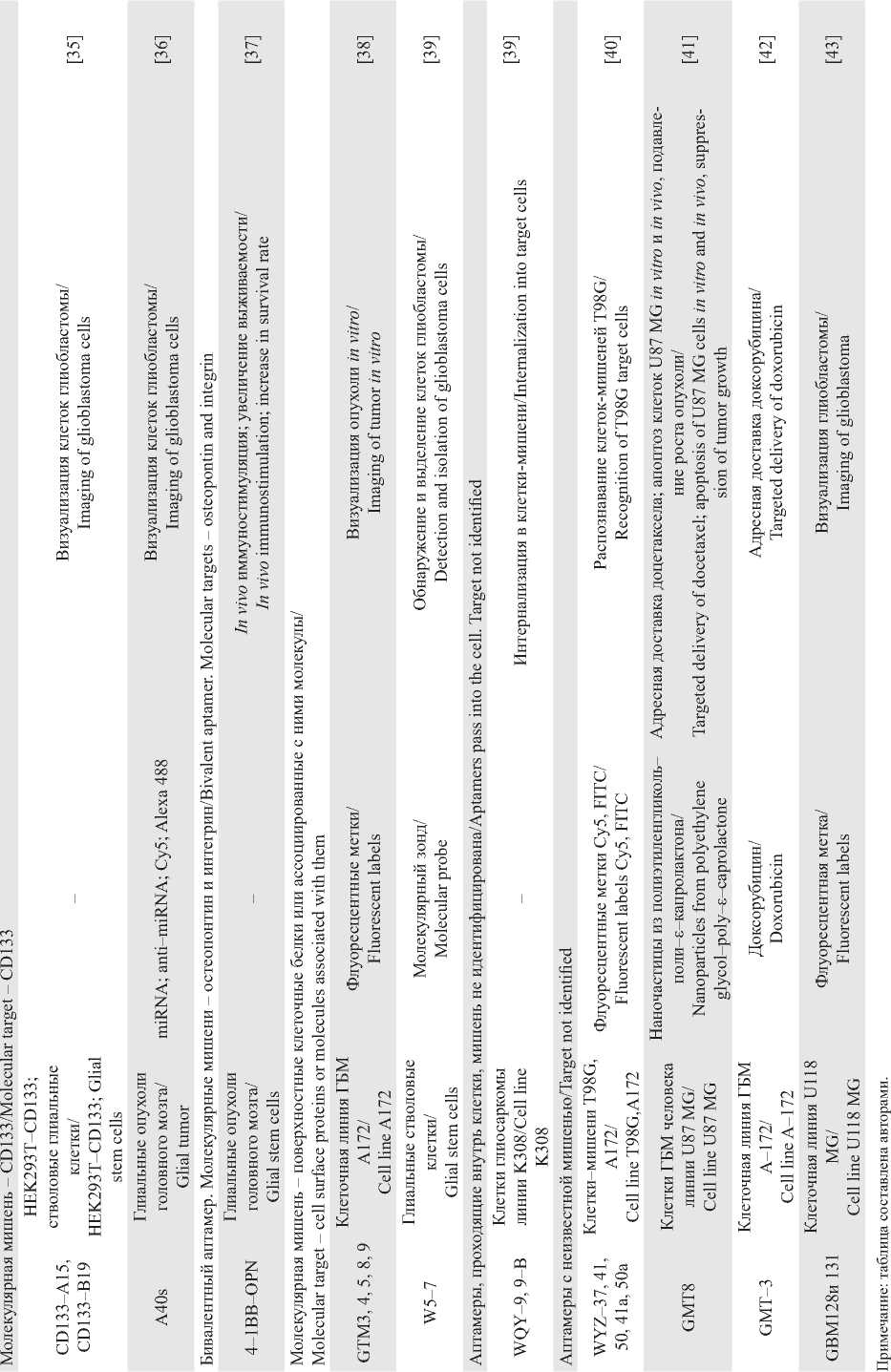
Аптамеры представляют собой молекулярные распознающие элементы на основе ДНК/РНК-олигонуклеотидов, способных связываться с заданными молекулярными мишенями и различать в них даже отдельные функциональные группы. Зачастую при использовании клеточных культур и тканей исследователи ставят перед собой цель выявить особенности патологической клетки, а не получить аптамер к определенному белку, что объясняется отсутствием специфических био- маркеров. В этом случае с помощью аптамеров осуществляется поиск уникальных особенностей, позволяющих отличать патологическую клетку или ткань от нормальной. И уже на следующем этапе с помощью определенных технологий пытаются определить мишень аптамера, которая в последующем может выполнять роль биомаркера. Аптамеры, выбранные к глиальным клеткам головного мозга человека, представлены в таблице.
Молекулярные мишени аптамеров к настоящему времени определены не для всех аптамеров, в частности, при селекции аптамеров к клеткам глиальных опухолей головного мозга человека было получено около 2 десятков олигонуклеотидов (таблица, рис. 1), которые эффективно находят глиальные опухолевые клетки in vitro и in vivo и даже способствуют их гибели, но молекулярная мишень которых неизвестна [38–42].
Все же большинство аптамеров получено к уже известным биомаркерам глиомы головного мозга, селекция к которым осуществлялась с использованием как клеточных культур и послеоперационных материалов, так и рекомбинантных белков. Одним из наиболее хорошо представленных в опухолевых тканях онкомаркеров, в том числе в глиоме головного мозга, является рецептор эпидермального фактора роста (EGFR), представляющий
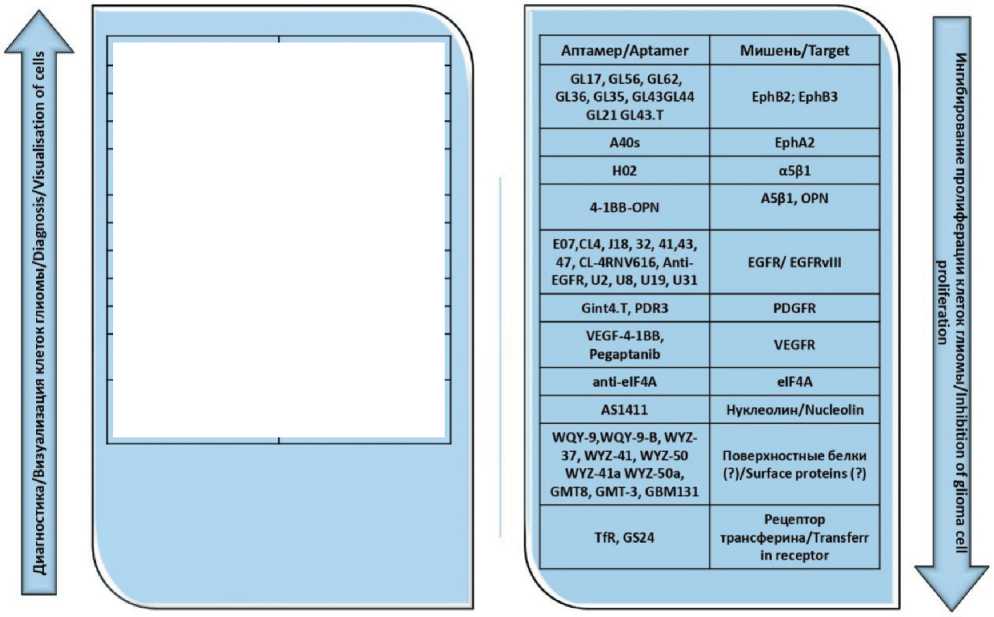
Рис. 1. Аптамеры и их молекулярные клеточные мишени для диагностики и терапии глиальных опухолей головного мозга чело-века.Примечание: рисунок выполнен авторами
Fig. 1. Aptamers and their molecular cellular targets for the diagnosis and therapy of glial tumors of the human brain.
Note: created by the authors
|
Аптамер/Aptamer |
Мишень/Target |
|
GBI-10, ТТА1 |
Тенасцин-C/Tenascin-C |
|
32, 41, 43, 47 |
EGFRvlll |
|
U2,8,19, 31 |
EGFR/EGFRvlll |
|
Anti-VEGFR2, Al, A2, АЗ, A4, AS |
VEGFR |
|
AS1411 |
Нуклеолин/Nucleolin |
|
111.1 |
Пигпен/Pygpene |
|
SA43 |
Ku70/Ku80 |
|
H02 |
aSpl |
|
GIF-233 |
Тубулин/Tubulin |
|
CD133-A15, CD133-B19, A40s |
CD133 |
|
GTM3, GTM4, GTM5, GTM8, GTM9, W5-7 |
Поверхностные белки (?)/Surface proteins (?) |
Таблица /Table
У о
К
й
Pi
S й ё
й 5й
га
Я
ей 2 о ед
)й
Е Z
О
га
id Р
я о
я
го id
0) М О
о я Л я я ю ей
я
2 л я
3 я
)Я о я
у Я §
га И ш
О
-Я §
ед
Я
о
й
Ф
го п о 5
О
О z м о
го
ГО
Е
Ф
О
Ф
О X
о
Е
О
Е
Р^
о
ГО
D)
О
го
Е
ф
S
га
о
й о
га
М 5
• Я ti
о я ед
О й
Й
5 Й
о
id
го Q. Ф
го W W о
ГО
О о
ф
го
о
К
2 ф Е го
Ф S го
я я
О
С
gD
id
У о
я
я
Я Я я Я У ей id
Я у
II
о 3 в
О
Й
ЧЙ
я я ея 3
я я я я ей
S щ о о й .о
м
S й о га
р
s .°
8 м
S
ч о
с
К
га я
id
i
о
у
я о га
Я
га
га
ей
Й
S
z
Я
у id
X
В я л я g
У я id я
3 у я
2 о я g id о
о я га Я
ьо .8
га
й
>я
У id
У
У
о
я ^
сед §-
ей
Й
О 3
S
ей
Я
я я
S
У Я
Я Я я га
га ед о й о га
3 ей
ей
Й
£
Я ед
я я о й я
я р^ рр О
Я Я id я 5
я
я
У я id я -ея я I
й о
га
о
S
Z
3 я 3
5 я й У
I ё I
Q я я я о я я я 8 о
2 и г
Я id у о
о й ей У id
я о
1 я о
я
я
ей У О га И
й я я ей
О
о
о Я
га
о
га й
га й. О S й
й ед ей
о 3 й
® Л- Й
ей
Я Я я Я 1=5
S
я а я
_<Й
S О й g
S id
Я Я я Я у
S
ffl ё
I I
га
ей
.о
m
с
й й о ей У Й
2 О
о
Е
§ й о
m
)Я о Z я р
2 я о я я
s я я I я о ^ я я га
Я
S ffl
о
о
Я id
Е Z
Я
р^
е
га
о У
У
S
я id
я
га
р с га
Е
ед о
Й •
,g
с
3 3 ей
О
Я О га
ей Й
О ед
= e
О й ей
Щ
О у о
id о у
□
S z z z -
о
га
Й
О
Й
z
Я
га я
m
я я о й я ей Я 2 О я
о
о
я я я щ ей Ч о я
о й о
й
о
ffl ей Z Z
2 S
S
о
I й о ей
о ед
о
о
Pi ffl о ffl о
едга
ей
Й
о
S
m
m
О
Б
Я
и о s й й о
^
я Z ей у О й Я ю я
я
^
2^
О я о
■ё
р о
я
3 я
3 У я й §
id
я
Я ;
У
й о
й
° й
S
в
D
га
.о
я
ffl
Рр
и §
ffl ffl
я щ га 5 с
Й
Ы) га
ей
Й
S
Pi ffl о ffl ffl ffl о
z
3 я
5 я й У
I ё I
я л и я У
о 1=5 о
Я id
га
у я й ей У О й я У я й о
я id о
X
о
о
S я и ей 5 Я of й О
я
я я m о й я ю
я я к
я я я S о о & я 3
)Я о я
я
я
I я о я я я id
га
х
5'
2 я В о 3 о я
id У о й я
о
я я я ей
ей
й й о га
О
й
о га
я я о й я
й с
О
■я В
Я
Я ^ о й .д У й и
о 3 о о я У о
У g я У
I я о id О
У id
Рн о
Я id у
у
Я
о га
я 5 й
я
У
о у о
О га id
У S щ S
S
Pi
о о
ед о
о
■Я
я Z ё У ей ГУ О я id" р
я й о га
о у о ей id СО ей
о
У
К
ей й О
S й
ей
S га
о
ей
о ед
о
га
Р Е о
^ я я id
о
о I о й о
О
о я о
о з й
о
О я
О ■
S
о
о
й
О Й РР ед
° 3
о 3
Р^
й
X
z
3 я у га
Р Я о § у я я у
2 я
я
Я
ей ед
о
О
О I о й о
О
id
О
У id
X
Я
I й о X я В 2
я
ей У О ш ей И
ед га
О I ед га
й
S .а
I
Й о
Я
о
о
В
и О й о
я у ей ГУ О я
й
Рн о
р^ Рн о
Pi р-О
р
Я ю я
я
Я id
У
У
о
я
Pi ffl о
s
й
о й о ^ о
й
m
Й
О
Р-н
О
р^ рр о
Я id
о S
id о у
2 О S
pi
Продолжение таблицы /Table
z
га
с
S
S
г
-
S
га
s
о ч о
ед о
3 ~
S ■£
о Е о
О й о
S
S S
е-
Z 2 s'
S га
z
О
О .=
га
о
О Q-□
Z
-
X га 5 С
Z
D
S ю
S
Z
S о S
Z
z
К
Й
О К
-
Z
S ^
Z га
о
)S о
О
^
о га О § р
S
Й
S о о й о
Е й о
о
1S
Он ■ = С
Е
к
S
м g .3 „
га
S р о
я
Е ,й ед "
В ед '
га V
S
о га ед Е й о
о
й
S
К
р ед о Е
В
о Е _Й
о й
га га
а Pi Рн
Q
Pi Q

Продолжение таблицы /Table
гя
MD CM
p
га
g
ra
о s к s m s Й 3 s 2 ra m CL I
GS24 Глиальная опухоль/ tFNA–TMZ Подавление роста опухоли
in vitro, in vivo
/
Glial tumor Suppression of tumor growth
in vitro, in vivo
Окотнчание таблицы /End of Table Note: created by the authors. собой трансмембранный гликопротеин и являющийся членом надсемейства тирозинкиназных рецепторов. Передача сигналов EGFR приводит к внутриклеточной активации пути MAPK и в последующем активирует киназы PI3K и Src и фактор транскрипции STAT3. Нисходящие пути ведут к синтезу ДНК и клеточной пролиферации. EGFR является мощным онкогеном и модифицирован несколькими способами при различных стадиях астроцитомы, глиобластомы, в том числе путем сверхэкспрессии, амплификации, возникновения делеционных мутантов. Изменения EGFR способствуют пролиферации, выживанию, ангиогенезу и инвазии опухолевых клеток [44]. Наиболее распространенным мутантом EGFR является EGFRvIII [45]. Повышенная экспрессия EGFRvIII влияет на выживаемость, пролиферацию клеток, подвижность и инвазивность, а также резистентность к лечению. К настоящему времени подобрано более 10 аптамеров к EGFR/EGFRvIII (таблица, рис. 1), использование которых позволяет не только идентифицировать глиальные клетки головного мозга человека, но и подавлять рост опухоли [12, 13, 46–50].
Другими не менее распространенными онкомаркерами глиобластомы являются рецепторы EphB3, EphB2, EphA2, принадлежащие к семейству тирозинкиназ Eph, которые гиперэкспрессированы в глиомах и вызывают пролиферацию, миграцию и инвазию опухолевых клеток, развитие опухоли, ангиогенез и метастазы [51]. Таким образом, рецепторы Eph могут служить в качестве основы для разработки препарата для терапии глиомы. Полученные к рецепторам Eph аптамеры подавляют пролиферацию и миграцию клеток глиобластомы
in vitro
и рост опухоли
in vivo
[10, 11].
Удобной мишенью для терапии глиобластомы являются также рецепторы с тирозинкиназной активностью, активируемые сигнальным белком VEGF [11, 23–25], представляющим собой фактор роста эндотелия сосудов, вырабатываемый клетками с целью стимуляции ангиогенеза. Проведение клеточных сигналов рецептором VEGFR играет ключевую роль в неопластическом ангиогенезе [52] Глиома часто сопровождается увеличением экспрессии белков PDGFRβ/PDGFRα и усилением передачи сигналов тромбоцитарного фактора роста PDGF. Адресная доставка микроРНК к рецепторам тромбоцитарного фактора роста PDGFRβ/PDGFRα с помощью аптамеров подавляет миграцию и инвазию опухолевых клеток, рост опухоли, ингибирует экспрессию фактора транскрипции STAT3, индуцирует дифференцировку, стимулирует апоптоз [21, 22]. Немаловажное значение в канцерогенезе играют процессы адгезии и миграции клеток, огромную роль в которых играют белки внеклеточного матрикса, в том числе белок тенасцин-С [53]. При глиоме тенасцин-С экспрессируется опухолевыми и стромальными клетками, причем уровень его экспрессии коррелирует с прогрессированием опухоли и неблагоприятным прогнозом. При этом тенасцин-С не только стимулирует рост опухоли, но и влияет на морфологию и функцию ассоциированных с опухолью микроглии и макрофагов. Клинически этот белок может служить биомаркером опухолевой прогрессии. Тенасцин-С действует как онкогенный фактор, способствуя пролиферации и стволовости раковых клеток, ингибируя апоптоз и химиочувствительность к паклитакселу при глиоме посредством модуляции передачи сигналов PI3K/AKT [54], что делает его потенциальной терапевтической мишенью при глиобластоме [55]. Однако аптамеры, выбранные к тенасцину-С, до настоящего времени были использованы только для визуализации опухоли in vitro и in vivo в качестве онкомаркера для идентификации опухоли и прогноза ее развития [56]. Характерным онкомаркером опухолевой клетки является нуклеолин. Нуклеолин – белок ядрышка, принимающий участие в процессе образования рибосом. При этом белок является мультифунк-циональным, универсальность которого заключается в том, что он участвует во многих клеточных процессах, в том числе регулирует эндоцитоз и клеточный цикл. Нуклеолин, находящийся на поверхности клеточной мембраны, управляет дифференцировкой и клеточной адгезией, способствует воспалению, ангиогенезу и развитию опухолей. Однако этот белок оказывается на клеточной мембране только при его сверхэкспрессии и выявляется только в эндотелиальных и злокачественных клетках. Наиболее успешным с точки зрения применения аптамеров в противоопухолевой терапии, в том числе глиомы, является аптамер AS1411 к нуклеолину, прошедший к настоящему времени I и II стадии клинических испытаний [57]. Подобраны аптамеры, специфичные к внутриядерным белкам системы репарации ДНК – Ku 70 и Ku 80, играющим важную роль в прогрессировании опухоли [30]; гепарин-связывающему белку мидкину, способствующему делению и росту клеток и отвечающему за регенерацию поврежденных тканей [30]. Гораздо в меньшем количестве представлены аптамеры к интегрину, представляющему собой трансмембранный гетеродимерный клеточный рецептор, взаимодействующий с внеклеточным матриксом и передающий различные межклеточные сигналы, от которых зависят форма клетки, ее подвижность и др. На данный момент к инте-грину α5β1 глиомы был получен аптамер – Н02 [31], способный лишь идентифицировать опухоль. Интегрин может стать хорошей терапевтической мишенью, поскольку бивалентный аптамер
4-1BB-OPN с двумя мишенями – остеопонтином и интегрином – проявлял хороший терапевтический эффект, увеличивающий выживаемость при внутричерепной глиоме в экспериментах
in vivo
[37]. Белки цитоскелета, контролирующие важные клеточные функции – форму, подвижность, клеточный цикл и т.д., – также являются хорошими потенциальными мишенями для терапии глиомы, в частности, аптамер Gli233, мишенью которого является тубулин [32]. В клетках глиомы тубулин имеет пострансляционные модификации, способствующие онкогенной прогрессии.
В последнее время доказана важная роль железа в процессах развития злокачественной опухоли, поскольку оно не только необходимо для многих клеточных процессов, таких как синтез ДНК и клеточная пролиферация, но и для защиты опухолевых клеток от воздействия естественных киллеров, оно также участвует в ингибировании апоптоза. Рецепторы трансферрина (TfR) обеспечивают транспорт железа через клеточную мембрану путем эндоци-тоза [58]. Их экспрессия в клетках глиобластомы увеличивается, что приводит к активации транскрипционного фактора NF-κB в злокачественных клетках посредством взаимодействия аптамера с ингибитором комплекса киназы NF-κB, тем самым увеличивая выживаемость раковых клеток. На данный момент получено два аптамера к рецептору трансферрина (TfR) [33] – потенциальной мишени для лечения глиобластомы. В развитии глиобластомы важную роль играют стволовые глиальные клетки, маркером которых является белок CD133, его содержание в глиомах
Список литературы Аптамеры для диагностики и лечения глиальных опухолей человека
- Park Y.W., Vollmuth P., Foltyn-Dumitru M., Sahm F., Ahn S.S., Chang J.H., Kim S.H. The 2021 WHO Classification for Gliomas and Implications on Imaging Diagnosis: Part 1-Key Points of the Fifth Edition and Summary of Imaging Findings on Adult-Type Diffuse Gliomas. J Magn Reson Imaging. 2023; 58(3): 677–89. doi: 10.1002/jmri.28743.
- Сергеев Н.И., Ребрикова В.А., Котляров П.М., Солодкий В.А. Магнитно-резонансная томография с перфузионной визуализацией в диагностике глиобластом головного мозга (Обзор литературы). Вестник Российского научного центра рентгенологии. 2021; 2(1): 45–59. [Sergeev N.I., Rebrikova V.A., Kotlayrov P.M., Solodkii V.A. Magnetic resonance imaging with perfusion imaging in the diagnosis of cerebral glioblastomas (literature review). Bulletin of the Russian Scientific Center for Radiology. 2021; 2(1): 45–59. (in Russian)].
- Aquino D., Di Stefano A.L., Scotti A., Cuppini L., Anghileri E., Finocchiaro G., Bruzzone M.G., Eoli M. Parametric response maps of perfusion MRI may identify recurrent glioblastomas responsive to bevacizumab and irinotecan. PLoS One. 2014; 9(3). doi: 10.1371/journal.pone.0090535.
- Розуменко В.Д. Опухоли головного мозга: современное состояние проблемы [Internet]. Алушта: III съезд нейрохирургов Украины, 2003. [Rozumenko V.D. Brain tumors: current state of the problem. Alushta: III Congress of Neurosurgeons of Ukraine, 2003]. [cited 2023 Aug 1]. URL: https://health-ua.com/article/18896-opuholi-golovnogomozga-sovremennoe-sostoyanie-problemy. (in Russian)].
- Brown T.J., Brennan M.C., Li M., Church E.W., Brandmeir N.J., Rakszawski K.L., Patel A.S., Rizk E.B., Suki D., Sawaya R., Glantz M. Association of the Extent of Resection With Survival in Glioblastoma: A Systematic Review and Meta-analysis. JAMA Oncol. 2016; 2(11): 1460–9. doi: 10.1001/jamaoncol.2016.1373.
- Yung W.K., Albright R.E., Olson J., Fredericks R., Fink K., Prados M.D., Brada M., Spence A., Hohl R.J., Shapiro W., Glantz M., Greenberg H., Selker R.G., Vick N.A., Rampling R., Friedman H., Phillips P., Bruner J., Yue N., Osoba D., Zaknoen S., Levin V.A. A phase II study of temozolomide vs. procarbazine in patients with glioblastoma multiforme at first relapse. Br J Cancer. 2000; 83(5): 588–93. doi: 10.1054/bjoc.2000.1316.
- Jacobson O., Yan X., Niu G., Weiss I.D., Ma Y., Szajek L.P., Shen B., Kiesewetter D.O., Chen X. PET Imaging of Tenascin-C with a Radiolabeled Single-Stranded DNA Aptamer. J Nucl Med. 2015; 56(4): 616–621. doi: 10.2967/jnumed.114.149484.
- Gu M.J., Li K.F., Zhang L.X., Wang H., Liu L.S., Zheng Z.Z., Han N.Y., Yang Z.J., Fan T.Y. In vitro study of novel gadolinium-loaded liposomes guided by GBI-10 aptamer for promising tumor targeting and tumor diagnosis by magnetic resonance imaging. Int J Nanomedicine. 2015; 10: 5187–204. doi: 10.2147/IJN.S84351.
- Hicke B.J., Stephens A.W., Gould T., Chang Y.F., Lynott C.K., Heil J., Borkowsk, S., Hilger C.S., Cook G., Warren S., Schmidt P.G. Tumortargeting by an aptamer. J Nucl Med. 2006; 47(4): 668–78.
- Amero P., Esposito C.L., Rienzo A., Moscato F., Catuogno S., de Franciscis V. Identification of an Interfering Ligand Aptamer for EphB2/3 Receptors. Nucleic Acid Ther. 2016; 26(2): 102–10. doi: 10.1089/nat.2015.0580.
- Affinito A., Quintavalle C., Esposito C.L., Roscigno G., Giordano C., Nuzzo S., Ricci-Vitiani L., Scognamiglio I., Minic Z., Pallini R, Pallini R., Berezovski M.V., de Francisis V., Condorelli G. Targeting Ephrin Receptor Tyrosine Kinase A2 with a Selective Aptamer for Glioblastoma Stem Cells. Mol Ther Nucleic Acids. 2020; 20: 176–85. doi: 10.1016/j.omtn.2020.02.005.
- Li N., Nguyen H.H., Byrom M., Ellington A.D. Inhibition of cell proliferation by an anti-EGFR aptamer. PLoS One. 2011; 6(6). doi: 10.1371/journal.pone.0020299.
- Hasan M.R., Hassan N., Khan R., Kim Y.T., Iqbal S.M. Classification of cancer cells using computational analysis of dynamic morphology. Comput Methods Programs Biomed. 2018; 156: 105–12. doi: 10.1016/j.cmpb.2017.12.003.
- Camorani S., Crescenzi E., Colecchia D., Carpentieri A., Amoresano A., Fedele M., Chiariello M., Cerchia L. Aptamer targeting EGFRvIII mutant hampers its constitutive autophosphorylation and affects migration, invasion and proliferation of glioblastoma cells. Oncotarget. 2015; 6(35): 37570–87. doi: 10.18632/oncotarget.6066.
- Wan Y., Tan J., Asghar W., Kim Y.T., Liu Y., Iqbal S.M. Velocity effect on aptamer-based circulating tumor cell isolation in microfluidic devices. J Phys Chem B. 2011; 115(47): 13891–6. doi: 10.1021/jp205511m.
- Wang T., Philippovich S., Mao J., Veedu R.N. Efficient Epidermal Growth Factor Receptor Targeting Oligonucleotide as a Potential Molecule for Targeted Cancer Therapy. Int J Mol Sci. 2019; 20(19): 4700. doi: 10.3390/ijms20194700.
- Wu X., Liang H., Tan Y., Yuan C., Li S., Li X., Li G., Shi Y., Zhang X. Cell-SELEX Aptamer for Highly Specific Radionuclide Molecular Imaging of Glioblastoma In Vivo. PLoS One. 2014; 9(6). doi:10.1371/journal.pone.0090752.
- Tang J., Huang N., Zhang X., Zhou T., Tan Y., Pi J., Pi L., Cheng S., Zheng H., Cheng Y. Aptamer-conjugated PEGylated quantum dots targeting epidermal growth factor receptor variant III for fluorescence imaging of glioma. Int J Nanomedicine 2017; 12: 3899–911. doi:10.2147/IJN.S133166.
- Mahmood M.A.I., Hasan M.R., Khan U.J.M., Allen P.B., Kim Y., Ellington A.D., Iqbal S.M. One-step tumor detection from dynamic morphology tracking on aptamer-grafted surfaces. Technology (Singap World Sci). 2015; 3(4): 194–200. doi: 10.1142/S2339547815500089.
- Peng L., Liang Y., Zhong X., Liang Z., Tian Y., Li S., Liang J., Wang R., Zhong Y., Shi Y., Zhang X. Aptamer-Conjugated Gold Nanoparticles Targeting Epidermal Growth Factor Receptor Variant III for the Treatment of Glioblastoma. Int J Nanomedicine. 2020; 15: 1363–72. doi: 10.2147/IJN.S238206.
- Shi S., Fu W., Lin S., Tian T., Li S., Shao X., Zhang Y., Zhang T., Tang Z., Zhou Y.; Lin Y., Cai X. Targeted and effective glioblastoma therapy via aptamer-modified tetrahedral framework nucleic acid-paclitaxel nanoconjugates that can pass the blood brain barrier. Nanomedicine Nanotechnology, Biol. Med. 2019; 21. doi: 10.1016/j.nano.2019.102061.
- Yoon S., Wu X., Armstrong B., Habib N., Rossi J.J. An RNA Aptamer Targeting the Receptor Tyrosine Kinase PDGFRα Induces Antitumor Effects through STAT3 and p53 in Glioblastoma. Mol Ther Nucleic Acids. 2019; 14: 131–41. doi: 10.1016/j.omtn.2018.11.012.
- Kim Y., Wu Q., Hamerlik P., Hitomi M., Sloan A.E., Barnett G.H., Weil R.J., Leahy P., Hjelmeland A.B., Rich J.N. Aptamer Identification of Brain Tumor–Initiating Cells. Cancer Res. 2013; 73: 4923–36. doi: 10.1158/0008-5472.CAN-12-4556.
- McNamara J.O., Kolonias D., Pastor F., Mittler R.S., Chen L., Giangrande P.H., Sullenger B., Gilboa E. Multivalent 4-1BB binding aptamers costimulate CD8+ T cells and inhibit tumor growth in mice. J Clin Invest. 2008; 118(1): 376–86. doi: 10.1172/JCI33365.
- Verhoeff J.J.C., Stalpers L.J.A., Claes A., Hovinga K.E., Musters G.D., Vandertop P.W., Richel D.J., Leenders W.P.J., van Furth W.R. Tumour control by whole brain irradiation of anti-VEGF-treated mice bearing intracerebral glioma. Eur J Cancer. 2009; 45(17): 3074–80. doi: 10.1016/j.ejca.2009.08.004.
- Luo Z., Yan Z., Jin K., Pang Q., Jiang T., Lu H., Liu X., Pang Z., Yu L., Jiang X. Precise glioblastoma targeting by AS1411 aptamer-functionalized poly (l-γ-glutamylglutamine)–paclitaxel nanoconjugates. J Colloid Interface Sci. 2017; 490: 783–96. doi:10.1016/j.jcis.2016.12.004.
- Alibolandi M., Abnous K., Ramezani M., Hosseinkhani H., Hadizadeh F. Synthesis of AS1411-Aptamer-Conjugated CdTe Quantum Dots with High Fluorescence Strength for Probe Labeling Tumor Cells. J Fluoresc. 2014; 24(5): 1519–29. doi: 10.1007/s10895-014-1437-5.
- Blank M., Weinschenk T., Priemer M., Schluesener H. Systematic evolution of a DNA aptamer binding to rat brain tumor microvessels. selective targeting of endothelial regulatory protein pigpen. J Biol Chem. 2001; 276(19): 16464–8. doi: 10.1074/jbc.M100347200.
- Aptekar S., Arora M., Lawrence C.L., Lea R.W., Ashton K., Dawson T., Alder J.E., Shaw L. Selective Targeting to Glioma with Nucleic Acid Aptamers. PLoS One. 2015; 10(8). doi: 10.1371/journal.pone.0134957.
- Oguro A., Ohtsu T., Svitkin Y.V., Sonenberg N., Nakamura Y. RNA aptamers to initiation factor 4A helicase hinder cap-dependent translation by blocking ATP hydrolysis. RNA. 2003; 9(4): 394–407. doi: 10.1261/rna.2161303.
- Fechter P., Cruz Da Silva E., Mercier M.C., Noulet F., Etienne- Seloum N., Guenot D., Lehmann M., Vauchelles R., Martin S., Lelong- Rebel I.; Ray A.-M., Seguin C., Dontenwill S., Choulier L. RNA Aptamers Targeting Integrin α5β1 as Probes for Cyto- and Histofluorescence in Glioblastoma. Mol Ther Nucleic Acids. 2019; 17: 63–77. doi: 10.1016/j.omtn.2019.05.006.
- Kichkailo A.S., Narodov A.A., Komarova, M.A., Zamay T.N., Zamay G.S., Kolovskaya O.S., Erakhtin E.E., Glazyrin Y.E., Veprintsev D.V., Moryachkov R.V., Zabluda V.N., Shchugoreva I., Artyushenko P., Mironov V.A., Morozov D.I., Khorzhevskii V.A., Gorbushin A.V., Koshmanova A.A., Nikolaeva E.D., Grinev I.P., Voronkovskii I.I., Grek D.S., Belugin K.V., Volzhentsev A.A., Badmaev O.N., Luzan N.A., Lukyanenko K.A., Peters G., Lapin I.N., Kirichenko A..K., Konarev P.V., Morozov E.V., Mironov G.G., Gargaun A., Muharemagic D., Zamay S.S., Kochkina E.V., Dymova M.A., Smolyarova T.E., Sokolov A.E., Modestov A.A., Tokarev N.A., Shepelevich N.V., Ozerskaya A.V., Chanchikova N.G., Krat A.V., Zukov R.A., Bakhtina V.I., Shnyakin P.G., Shesternea P.A., Svetlichnyi V.A., Petrova M.M., Artyukhov I.P., Tomilin F.N., Berezovski M.V. Development of DNA aptamers for visualization of glial brain tumors and detection of circulating tumor cells. Mol Ther Nucleic Acids 2023; 32: 267–88. doi: 10.1016/j.omtn.2023.03.015.
- Larcher L.M., Wang T., Veedu R.N. Development of novel antimirzymes for targeted inhibition of miR-21 expression in solid cancer cells. Molecules. 2019; 24(13). doi: 10.3390/molecules24132489.
- Fu W., You C., Ma L., Li H., Ju Y., Guo X., Shi S., Zhang T., Zhou R., Lin Y. Enhanced Efficacy of Temozolomide Loaded by a Tetrahedral Framework DNA Nanoparticle in the Therapy for Glioblastoma. ACS Appl Mater Interfaces. 2019; 11(43): 39525–33. doi: 10.1021/acsami.9b13829.
- Shigdar S., Qiao L., Zhou S.-F., Xiang D., Wang T., Li Y., Lim L.Y., Kong L., Li L., Duan W. RNA aptamers targeting cancer stem cell marker CD133. Cancer Lett. 2013; 330(1): 84–95. doi: 10.1016/j.canlet.2012.11.0320.
- Affinito A., Quintavalle C., Esposito, C.L., Roscigno G., Vilardo C., Nuzzo S., Ricci-Vitiani L., De Luca G., Pallini R., Kichkailo A.S., Lapin I.N., de Franciscis V., Condorelli G. The Discovery of RNA Aptamers that Selectively Bind Glioblastoma Stem Cells. Mol Ther Nucleic Acids. 2019; 18: 99–109. doi: 10.1016/j.omtn.2019.08.015.
- Wei J., Marisetty A., Schrand B., Gabrusiewicz K., Hashimoto Y., Ott M., Grami Z., Kong L.-Y., Ling X., Caruso H., Zhou S., Wang A., Fuller G.N., Huse J., Giboa E., Kang N., Huang X., Verhaak R., Li S., Heimberger A.B. Osteopontin mediates glioblastoma-associated macrophage infiltration and is a potential therapeutic target. J Clin Invest. 2018; 129(1): 137–49. doi: 10.1172/JCI121266.
- Bayrac A.T., Sefah K., Parekh P., Bayrac C., Gulbakan B., Oktem H.A., Tan W. In Vitro Selection of DNA Aptamers to Glioblastoma Multiforme. ACS Chem. Neurosci. 2011; 2(3): 175–81. doi: 10.1021/cn100114k.
- Wu Q.m Lin N., Tian T., Zhu Z., Wu L., Wang H., Wang D., Kang D., Tian R., Yang C. Evolution of Nucleic Acid Aptamers Capable of Specifically Targeting Glioma Stem Cells via Cell-SELEX. Anal Chem. 2019; 91(13): 8070–7. doi: 10.1021/acs.analchem.8b05941.
- Wu Q., Wang Y., Wang H., Wu L., Zhang H., Song Y., Zhu Z., Kang D., Yang C. DNA aptamers from whole-cell SELEX as new diagnostic agents against glioblastoma multiforme cells. Analyst. 2018; 143(10): 2267–75. doi: 10.1039/c8an00271a.
- Gao H., Qian J., Yang Z., Pang Z., Xi Z., Cao S., Wang Y., Pan S., Zhang S., Wang W., Jiang X., Zhang O. Whole-cell SELEX aptamerfunctionalised poly(ethyleneglycol)-poly(ε-caprolactone) nanoparticles for enhanced targeted glioblastoma therapy. Biomaterials. 2012; 33(26): 6264–72. doi: 10.1016/j.biomaterials.2012.05.020.
- Bayraç A.T., Akça O.E., Eyidoğan F.İ., Öktem H.A. Target-specific delivery of doxorubicin to human glioblastoma cell line via ssDNA aptamer. J Biosci. 2018; 43: 97–104. doi:10.1007/s12038-018-9733-x.
- Kang D., Wang J., Zhang W., Song Y., Li X., Zou Y., Zhu M., Zhu Z., Chen F., Yang C.J. Selection of DNA Aptamers against Glioblastoma Cells with High Affinity and Specificity. PLoS One. 2012; 7(10). doi: 10.1371/journal.pone.0042731.
- Miratashi Yazd, S.A., Bakhshi N., Nazar E., Moradi Tabriz H., Gorji R. Epidermal growth factor receptor (EGFR) expression in high grade glioma and relationship with histopathologic findings, a cross sectional study. Int J Surg Open. 2022; 46. doi:10.1016/j.ijso.2022.100527.
- Hatanpaa K.J., Burma S., Zhao D. Habib A.A. Epidermal Growth Factor Receptor in Glioma: Signal Transduction, Neuropathology, Imaging, and Radioresistance. Neoplasia. 2010; 12(9): 675–84. doi: 10.1593/neo.10688.
- Wan Y., Liu Y., Allen P.B., Asghar W., Mahmood M.A.I., Tan J., Duhon H., Kim Y., Ellington A.D., Iqbal S.M. Capture, isolation and release of cancer cells with aptamer-functionalized glass bead array. Lab Chip. 2012; 12(22): 4693–701. doi:10.1039/c2lc21251j.
- Wan Y., Mahmood M.A.I., Li N., Allen P.B., Kim Y., Bachoo R., Ellington A.D., Iqbal S.M. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 2012; 118(4): 1145–54. doi:10.1002/cncr.26349.
- Wan Y., Tamuly D., Allen P.B., Kim Y.T., Bachoo R., Ellington A.D., Iqbal S.M. Proliferation and migration of tumor cells in tapered channels. Biomed Microdevices. 2013; 15(4): 635–43. doi: 10.1007/s10544-012-9721-0.
- Wang L., Zheng, Q., Zyang Q., Xu H., Tong J., Zhu C., Wan Y. Detection of single tumor cell resistance with aptamer biochip. Oncol Lett. 2012; 4(5): 935–40. doi: 10.3892/ol.2012.890.
- Wan Y., Kim Y., Li N., Cho S.K., Bachoo R., Ellington A.D., Iqbal S.M. Surface-Immobilized Aptamers for Cancer Cell Isolation and Microscopic Cytology. Cancer Res. 2010; 70(22): 9371–80. doi: 10.1158/0008-5472.CAN-10-0568.
- Nakada M., Hayashi Y., Hamada J.I. Role of Eph/ephrin tyrosine kinase in malignant glioma. Neuro Oncol. 2011; 13(11): 1163–70. doi: 10.1093/neuonc/nor102.
- Корчагина А.А., Шеин С.А., Гурина О.И., Чехонин В.П. Роль рецепторов VEGFR в неопластическом ангиогенезе и перспективы терапии опухолей мозга. Вестник РАМН. 2013; 68(11): 104–14. [Korchagina A.A., Shein S.A., Gurina O.I., Chekhonin V.P. VEGFRs in neoplastic angiogenesis and prospects for therapy of brain tumors. Ann Russ Acad Med Sci. 2013; 68(11): 104–14. (in Russian)]. doi: 10.15690/vramn.v68i11.851.
- Yalcin F., Dzaye O., Xia S. Tenascin-C Function in Glioma: Immunomodulation and Beyond. Adv Exp Med Biol. 2020; 1272: 149–72. doi: 10.1007/978-3-030-48457-6_9.
- Zhang Q., Xu B., Hu F., Chen X., Liu X., Zhang Q., Zuo Y. Tenascin C Promotes Glioma Cell Malignant Behavior and Inhibits Chemosensitivity to Paclitaxel via Activation of the PI3K/AKT Signaling Pathway. J Mol Neurosci. 2021; 71(8): 1636–47. doi: 10.1007/s12031-021-01832-8.
- Angel I., Pilo Kerman,O., Rousso-Noori L., Friedmann-Morvinski D. Tenascin C promotes cancer cell plasticity in mesenchymal glioblastoma. Oncogene. 2020; 39(46): 6990–7004. doi: 10.1038/s41388-020-01506-6.
- Chen H., Zheng X., Di B., Wang D., Zhang Y., Xia H., Mao Q. Aptamer modification improves the adenoviral transduction of malignant glioma cells. J Biotechnol. 2013; 168(4): 362–6. doi: 10.1016/j.jbiotec.2013.10.024.
- Ma H., Gao Z., Yu P., Shen S., Liu Y., Xu B. A dual functional fluorescent probe for glioma imaging mediated by Blood-brain barrier penetration and glioma cell targeting. Biochem Biophys Res Commun. 2014; 449(1): 44–8. doi: 10.1016/j.bbrc.2014.04.148.
- Чулкова С.В., Шолохова Е.Н., Поддубная И.В., Стилиди И.С., Тупицын Н.Н. Анализ взаимосвязи трансферринового рецептора 1 (TfR1) с клинико-морфологическими и иммунофенотипическими характеристиками рака молочной железы. Современная онкология. 2022; 24(3): 355–60. [Chulkova S.V., Sholokhova E.N., Poddubnaya I.V., Stilidi I.S., Tupitsyn N.N. The analysis of the relationship between transferrin receptor 1 (TfR1) and clinical, morphological and immunophenotypic characteristics of breast cancer: retrospective cohort study. Modern Oncology. 2022; 24(3): 355–60. (in Russian)]. doi: 10.26442/18151434.2022.3.201821.
- Ahmed S.I., Javed G., Laghari A.A., Bareeqa S.B., Farrukh S., Zahid S., Samar S.S., Aziz K. CD133 Expression in Glioblastoma Multiforme: A Literature Review. Cureus. 2018; 10(10). doi: 10.7759/cureus.3439.
- Gasser M., Waaga-Gasser A.M. Therapeutic Antibodies in Cancer Therapy. Adv Exp Med Biol. 2016. doi: 10.1007/978-3-319-32805-8_6.


