Армакокинетическое моделирование и дозиметрическое планирование радионуклидной терапии костных метастазов
Бесплатный доступ
В данной работе обсуждаются особенности моделирования и расчёта фармакокинетических и дозиметрических характеристик остеотропных радиофармацевтических препаратов на основе камерной модели их транспорта в организме человека с костными метастазами. Разработан и апробирован программный комплекс фармакокинетического моделирования и дозиметрического планирования паллиативной радионуклидной терапии костных метастазов с использованием клинических радиометрических данных. В рамках четырёхкамерной модели предложена методика определения поглощённых доз в критических органах и тканях через их массы и через S-факторы. Рассмотрены и проанализированы три подхода к назначению активности радиофармпрепарата и особенности индивидуального дозиметрического планирования радионуклидной терапии костных метастазов. Для 10 пациентов с костными метастазами идентифицированы индивидуальные кинетические параметры транспорта (транспортные константы модели) радиофармпрепарата «153Sm-оксабифор» при его внутривенном поступлении в организм и осуществлены расчёты поглощённых доз в костных тканях и метастазах, кровеносной системе, почках и мочевом пузыре с учётом его периодического опорожнения. Показано, что при введении стандартной и удельной активностей 153Sm-оксабифора в организм пациента (первый и второй подходы) поглощённые дозы у 10 пациентов различаются в 5-6 раз, при этом выявляются случаи недо- или переоблучения костных тканей с метастазами, что может существенно снизить эффективность проведённой радионуклидной терапии или неблагоприятно повлиять на состояние пациента впоследствии. Рассчитанная в рамках третьего подхода индивидуальная вводимая активность 153Sm-оксабифора для 10 пациентов варьирует в широких пределах: от 19 до 165 мКи, при этом отсутствуют случаи недо- или переоблучения костных тканей. Дозовые нагрузки на кровеносную систему, почки и мочевой пузырь для всех пациентов являются толерантными и не превышают предельно допустимых значений.
Моделирование, фармакокинетика, дозиметрическое планирование, радиофармпрепарат, ядерная медицина, радионуклидная терапия, костные метастазы, самарий-153, поглощённые дозы, s-факторы
Короткий адрес: https://sciup.org/170194028
IDR: 170194028 | УДК: 616.71-006.6-033.2]-085.849.1:539.1.074
Текст научной статьи Армакокинетическое моделирование и дозиметрическое планирование радионуклидной терапии костных метастазов
В настоящее время радионуклидная терапия (РНТ) костных метастазов с применением остеотропных радиофармацевтических препаратов (РФП) является одним из актуальных направлений ядерной медицины [1, 2]. Такие РФП содержат β-излучающие радионуклиды, а сама терапия используется в паллиативных целях [3, 4]. Внутреннее облучение метастатической ткани позволяет достигать редукции опухолевой инфильтрации и обеспечивать длительное обезболивание.
Наиболее важным этапом РНТ является дозиметрическое планирование. Гарантии клинического предсказания РНТ могут быть обеспечены только при последовательном применении методик индивидуального дозиметрического планирования (ИДП). Однако до сих пор в клинической практике используются весьма упрощённые методики определения дозиметрических характеристик [5], чем объясняется значительное количество неэффективных случаев прогноза РНТ. К тому же в литературе практически отсутствуют полноценные рекомендации по ИДП и остаётся нерешённым ряд существенных проблем, связанных ним [1, 2]. Методика ИДП подробно описана в работе [5].
В клинической практике можно выделить три подхода к назначению активности РФП при РНТ [5]: 1) введение одинаковой для всех (стандартной) активности; 2) в зависимости от массы тела или критического органа (удельная активность); 3) по поглощённой дозе в критическом органе или ткани (индивидуальная активность). Первый и второй подходы просты в практическом применении, однако научная база у них весьма слабая, и клинический результат лечения плохо прогнозируем. Напротив, метод вычисления индивидуальной активности по поглощённой дозе – единственный из трёх подходов, который имеет научное обоснование, т.к. степень поражения облучённого органа зависит именно от величины поглощённой дозы. При данном подходе результат РНТ вполне прогнозируем, что улучшает качество лечения больных. В то же время этот способ наиболее трудоёмкий и требует значительного времени для проведения дозиметрического планирования. Диагностические процедуры, в результате которых выявляют индивидуальные фармакокинетические параметры транспорта РФП в организме, должны быть проведены непосредственно перед РНТ, что требует пребывания пациента в стационаре в течение двух-трёх суток. По полученным фармакокинетическим данным и рекомендуемой врачом поглощённой дозе в костных тканях и метастазах определяют индивидуальную активность, необходимую для успешного проведения РНТ [5].
Сегодня в мировой практике для терапии костных метастазов используются РФП на основе радионуклидов 32P, 89Sr, 90Y, 117mSn, 131I, 153Sm, 177Lu, 186Re, 188Re и др. Основные характеристики этих радионуклидов приведены в работах [3, 4, 6, 7].
В России для терапии костных метастазов используются два РФП: 89Sr-хлорид и 153Sm-оксабифор, который является первым отечественным остеотропным РФП (патент РФ от 2000 г.) [3]. По механизму действия 153Sm-оксабифор близок к зарубежному аналогу 153Sm-EDTMP [8]. В настоящее время в ФГБУ «НМИЦ радиологии» Минздрава России проводятся клинические испытания ещё одного нового отечественного РФП на основе 188Re [6]. Там же изучаются фармакокинетические и дозиметрические характеристики, а также ведутся доклинические исследования и других перспективных отечественных остеотропных РФП [7, 9-11].
Существенным недостатком радионуклида 89Sr является отсутствие в спектре излучения γ-компоненты, что затрудняет изучение фармакокинетических характеристик 89Sr-хлорида in vivo и применение методики ИДП. Преимуществом короткоживущих радионуклидов 153Sm и 188Re является наличие в спектре излучения γ-компоненты, что значительно упрощает получение картины распределения РФП в организме с помощью гамма-камеры и применение методики ИДП. Однако радионуклид 153Sm получают в реакторе и в связи с невозможностью быстрой транспортировки использование 153Sm-оксабифора ограничено во многих регионах нашей страны. Радионуклид 188Re, напротив, является генераторным (188W/188Re) и отечественные РФП на его основе в будущем станут легкодоступными для применения в условиях клиники ex tempore [7].
Поскольку фармакокинетика радионуклида, включённого в состав конкретного РФП, является индивидуализированной и зависит как от химической структуры самого РФП [10], так и от характера его обращения в организме человека [6], любое заимствование зарубежных данных по другим РФП некорректно. Поэтому существует необходимость в разработке оригинальных методов и моделей исследования фармакокинетических и дозиметрических характеристик отечественных остеотропных РФП. Причём проводить такие исследования желательно в каждой клинике, где осуществляется РНТ больных с костными метастазами. И только после этого, опираясь на результаты данных исследований, следует осуществлять разработку соответствующих методик по ИДП.
В ближайшие годы лечение костных метастазов планируется и в Омске (БУЗОО «Областная клиническая больница»). Это явилось отправной точкой в нашей работе, целью которой стало создание программного комплекса фармакокинетического моделирования и расчёта индивидуальных поглощённых доз при РНТ костных метастазов с помощью РФП «153Sm-оксабифор», а также его апробация на конкретных клинических данных. В соответствии с целью были поставлены следующие задачи: 1) разработка камерной модели кинетики остеотропного РФП с учётом трёх подходов к назначению активности; 2) определение индивидуальных транспортных констант модели на основе клинических данных радиометрии при РНТ; 3) расчёт поглощённых доз в критических органах и тканях (камерах модели); 4) сравнительный анализ результатов моделирования в рамках трёх методов дозиметрического планирования.
Материалы и методы
Камерная модель и идентификация параметров. Так как РФП являются лекарственными препаратами, то для описания их кинетики могут применяться все методы моделирования, используемые в фармакологии [12]. Однако они имеют много специфических свойств, таких как наличие в составе радионуклида с малым периодом полураспада, отсутствие фармакодинамических свойств, ускоренное выведение из крови, отсутствие связи с белками крови, тропность к конкретному органу или ткани и т.д. В связи с этим в ядерной медицине хорошо зарекомендовали себя простые камерные модели, которые описывают кинетику РФП системой линейных однородных дифференциальных уравнений первого порядка с постоянными коэффициентами – транспортными константами, не зависящими от времени. Результатом моделирования является идентификация транспортных констант при помощи численных методов [13].
С учётом особенностей фармакокинетики остеотропных РФП в организме человека [12] для расчёта их индивидуальных фармакокинетических и дозиметрических характеристик при РНТ предлагается четырёхкамерная модель (из четырёх компартментов) [14], геометрическая иллюстрация которой представлена на рис. 1. Данная модель включает в себя камеру кровеносной системы (Haema), камеру костной ткани с метастазами (Os, Mts), камеру почек (Renis) и камеру мочевого пузыря с мочой (Urina). Функции удержания активности РФП в камерах обозначены как F H , F M , F R и F U , а транспортные константы – K HM , K MH , K HR и K RU соответственно. Также учитывается радиоактивный распад радионуклида в составе РФП, постоянная распада которого обозначена буквой λ . Для 153Sm λ ≈0,015 ч-1.
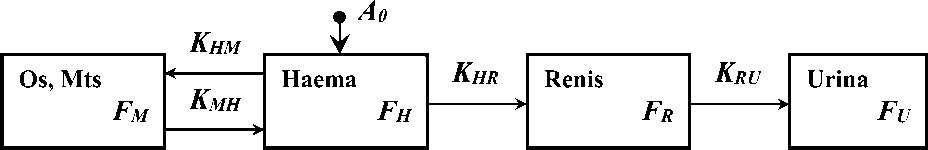
Рис. 1. Иллюстрация камерной модели.
Отметим, что в литературе описаны и более сложные камерные модели кинетики остео-тропных РФП, например, пятикамерная модель [15] с раздельными камерами для костной ткани и метастазов. Такие модели содержат больше транспортных констант, идентификация которых становится сложнее в математическом плане и требует получения дополнительных радиометрических данных. Однако результаты расчёта индивидуальных фармакокинетических и дозиметри- ческих характеристик РФП в аналогичных камерах разных моделей с учётом погрешности практически не различаются [14]. Представленная на рис. 1 четырёхкамерная модель с этой точки зрения является наиболее простой.
В рамках данной модели система дифференциальных уравнений принимает вид:
, = KmhFm (t) (Khm + Khr + x)FH (t)’ dt d X = Khm Fh (t) - (K + X)Fm (t).
dt
dFR^t) = KhrFh (t) - (KR и + X) F (t), HR H RU R dt
F^" = KF ( t) -X F u ( t )
с начальными условиями:
F h (0)=1, F m (0)=0, F r (0)=0, F u (0)=0. (2)
Функции удержания активности здесь и далее выражены в относительных единицах (на единицу введённой активности A 0 ). Система (1) с условиями (2) представляет собой задачу Коши, решение которой может быть найдено аналитически или при помощи численных методов, например, методом Розенброка или методами Рунге-Кутты [13].
Задача идентификации кинетических параметров камерной модели (транспортных констант) решается с помощью функционала невязки F ( K HM , K MH , K HR , K RU ) , который задаёт меру отклонения расчётной (модельной) характеристики от её экспериментальных (клинических) значений в заданные моменты времени t i . В качестве таких значений в данной работе использовались результаты радиометрических измерений кумулятивной активности РФП в моче при t -9, 12, 26 и 36 ч. Тогда функционал невязки принимает вид:
F(K) = Z ?=| (F § асч (t , ) - F Ц с" (ti)} 2 , (3)
где K = [ K hm , K mh , K hr , K ru ] - вектор кинетических параметров модели. Для определения истинных индивидуальных значений транспортных констант требуется решить вариационную задачу по нахождению минимума функционала (3), т.е.:
6F(K)| khm>o,kmh>o, = 0 , 5 2 F > 0 , (4)
kHr>o,kru>o при условии положительных значений всех транспортных констант, которые в данном случае приобретают смысл вариационных параметров. Найденные таким образом истинные значения транспортных констант далее подставляются в решения F = F(t) системы уравнений (1) для построения кривых «Активность-время» и расчёта индивидуальных фармакокинетических и дозиметрических характеристик.
Методика расчёта фармакокинетических и дозиметрических характеристик. Эффективные периоды полувыведения T могут быть выражены через транспортные константы накопления и выведения РФП в камерах либо определены по модельным кривым «Активность-время» как промежуток времени, за который максимальное значение кумулятивной активности в камере F max уменьшается ровно в 2 раза:
1 ртах ртах рТпхх
F h (1 = T h ) = | , FM(t = Тм) = F^- , FR(t = TR) = F^- , F u (t = T u ) = FU_ .
Максимальные значения кумулятивной активности в камерах Fmax и времена их достижения tmax рассчитываются на основе решения системы (1). Значения tmax находятся из решения уравнений:
^FM (£ _ ^max
) = о , ^ (t = t max ) = o , ^(t = t max ) = o .
Подставляя далее найденные из (6) значения t max , t m ax и t m ax в соответствующие решения системы уравнений (1), находим значения Fmax в камерах:
F max М
_ р (tmax^ paxx _ р ^max^ ^max = F u (t m ax ) .
Отметим, что все значения Fmax и tmax также могут быть определены по модельным кривым «Активность-время».
Площадь под кривой «Активность-время» AUC (Area under curve) также рассчитывается с использованием решений F = F(t) системы уравнений (1) как интеграл от соответствующей функции удержания активности в камере F j . Для каждой j -камеры в относительных единицах:
АУС , = Jo F j (t)dt .
Через AUC определяются поглощённые дозы в органах и тканях. Причём учитывается вклад только от β-частиц, так как именно они оказывают существенный терапевтический эффект. Для 153Sm максимальный пробег β-частиц в костной ткани составляет 0,55 мм, в мягких тканях – 3 мм [4].
Поглощённая доза в j -органе (ткани) определяется через площадь под кривой «Активность-время» в соответствующей j -камере [14]:
П ] = кАо^АУС5 , (9)
где < E β > – средняя энергия β-частиц распада радионуклида в составе РФП (для 153Sm < E β > =0,224 МэВ/распад [3]); m j – масса j -органа; k – коэффициент пропорциональности.
Поглощённая доза на мочевой пузырь рассчитывалась с учётом его периодического опорожнения. Поскольку в системе (1) четвёртое уравнение для F U не учитывает мочеиспускание, то формула (9) приведёт к завышенным значениям поглощённой дозы в мочевом пузыре. В результате учёта периодического опорожнения мочевого пузыря формула (9) модифицируется и представляется в виде суммы интегральных слагаемых (площадей под участками кривой) в течение каждого цикла между опорожнениями:
АУС у = S^ i C t , Ct = ^L F u (t)dt - F^t t^M , (10)
-
*-1—1
где At = tt- tt-1 - интервал времени между опорожнениями мочевого пузыря (временной цикл). Суммирование продолжается до тех пор, пока не выполнится условие C i=N ≤ ε , где ε – малое значение, задаваемое требуемой точностью расчёта поглощённой дозы по формуле (10). Сущность методики расчёта поглощённой дозы D U на мочевой пузырь проиллюстрирована в работе [14].
Согласно формализму MIRD [5] поглощённые дозы в органах и тканях также могут быть вычислены с использованием соответствующих S -факторов по формуле:
-
D , = Ао -S j - АУС , . (11)
S -фактор определяется как поглощённая доза в органе-мишени, рассчитанная на единицу активности, накопленной в органе-источнике. Так как для 153Sm пробег β-частиц в органах и тканях не превышает 3 мм, то органом-источником в этом случае является только сам орган-мишень, в котором и происходит облучение ( j -орган). Значения S -факторов для большинства радионуклидов приведены в публикациях MIRD (см. [5] и ссылки в ней).
Результаты и обсуждение
Процедура минимизации (4) при идентификации транспортных констант модели и расчёт индивидуальных фармакокинетических и дозиметрических характеристик РФП по формулам (5)-(11) были проведены на ПЭВМ с помощью разработанного нами по изложенной выше методике программного комплекса на языке программирования C++ в среде Visual Studio [16]. Использование программного комплекса позволяет существенно снизить затраты времени на математические расчёты, не вдаваясь в их подробности, что даёт возможность адаптировать его к рабочему месту врача-радиолога.
В табл. 1 приведены исходные клинические данные радиометрии мочи и массы тела 10 пациентов, полученные в работе [17] при проведении РНТ костных метастазов с использованием РФП «153Sm-оксабифор».
Таблица 1
Исходные клинические данные
|
Номер пациента |
Масса тела, кг |
Данные радиометрии мочи, % |
|||
|
9 ч |
12 ч |
26 ч |
36 ч |
||
|
1 |
90 |
28 |
26 |
21 |
19 |
|
2 |
55 |
60 |
59 |
51 |
46 |
|
3 |
35 |
39 |
38 |
32 |
27 |
|
4 |
70 |
47 |
46 |
38 |
33,5 |
|
5 |
30 |
9 |
9 |
9 |
8 |
|
6 |
40 |
35 |
34 |
30 |
27 |
|
7 |
60 |
54 |
53 |
44 |
38 |
|
8 |
80 |
26 |
25 |
21 |
19 |
|
9 |
80 |
35 |
36 |
31 |
26 |
|
10 |
80 |
2,8 |
3 |
3 |
2 |
В табл. 2 приведены полученные значения кинетических параметров четырёхкамерной модели – идентифицированные на основе клинических данных (табл. 1) индивидуальные транспортные константы для 10 пациентов, а также рассчитанные по формулам (5) эффективные периоды полувыведения РФП из плазмы крови, костной ткани и почек. Расчёт периода полувыведения из камеры мочевого пузыря не производился в связи с тем, что он не имеет клинического значения. Также в табл. 2 и во всех последующих таблицах в последней строке приведены сред- ние значения величин и их стандартные отклонения.
Таблица 2
Идентифицированные транспортные константы модели и соответствующие им эффективные периоды полувыведения
|
Номер пациента |
Транспортные константы, ч-1 |
Периоды полувыведения, ч |
|||||
|
Khm |
Kmh |
Khr |
Kru |
T H |
T M |
T R |
|
|
1 |
0,709 |
0,001 |
0,325 |
0,948 |
0,7 |
51,5 |
2,7 |
|
2 |
0,199 |
0,018 |
0,416 |
0,833 |
1,1 |
32,2 |
3,7 |
|
3 |
0,495 |
0,002 |
0,402 |
0,702 |
0,8 |
49,3 |
3,3 |
|
4 |
0,750 |
0,002 |
0,935 |
0,390 |
0,4 |
47,9 |
3,5 |
|
5 |
0,819 |
0,010 |
0,100 |
0,295 |
0,8 |
49,0 |
5,3 |
|
6 |
0,444 |
0,010 |
0,282 |
0,932 |
0,9 |
43,4 |
3,2 |
|
7 |
0,573 |
0,002 |
0,999 |
0,412 |
0,5 |
47,0 |
3,5 |
|
8 |
0,803 |
0,005 |
0,328 |
0,999 |
0,6 |
47,5 |
2,5 |
|
9 |
0,163 |
0,001 |
0,133 |
0,862 |
2,2 |
60,3 |
5,3 |
|
10 |
0,987 |
0,001 |
0,041 |
0,222 |
0,7 |
51,9 |
5,8 |
|
Ср., ст. откл. |
0,594±0,271 |
0,005±0,005 |
0,396±0,326 |
0,660±0,298 |
0,9±0,5 |
48,0±7,1 |
3,9±1,2 |
В табл. 3 приведены индивидуальные значения фармакокинетических параметров – рассчитанные по формулам (6) и (7) максимальные значения относительной кумулятивной активности в камерах костной ткани, почек, мочевого пузыря и времена их достижения.
Таблица 3
Индивидуальные значения максимальной активности в камерах (отн. ед.) и времена их достижения (ч)
|
Номер пациента |
с ТПХХ г м |
*1ШХХ 1м |
рШХХ |
^тхх |
^Х.ХХ |
^ХХХ |
|
1 |
0,636 |
4,1 |
0,119 |
1,0 |
0,282 |
6,1 |
|
2 |
0,272 |
5,2 |
0,208 |
1,4 |
0,600 |
8,7 |
|
3 |
0,504 |
4,5 |
0,182 |
1,2 |
0,396 |
7,4 |
|
4 |
0,422 |
2,8 |
0,352 |
1,1 |
0,469 |
9,3 |
|
5 |
0,810 |
4,4 |
0,062 |
1,8 |
0,093 |
14,1 |
|
6 |
0,541 |
5,1 |
0,123 |
1,2 |
0,350 |
7,8 |
|
7 |
0,344 |
2,9 |
0,388 |
1,1 |
0,540 |
9,0 |
|
8 |
0,657 |
3,8 |
0,112 |
0,9 |
0,265 |
6,0 |
|
9 |
0,450 |
10,3 |
0,086 |
1,8 |
0,360 |
11,7 |
|
10 |
0,891 |
4,1 |
0,025 |
1,8 |
0,030 |
13,6 |
|
Среднее, ст. откл. |
0,553±0,197 |
4,7±2,1 |
0,166±0,120 |
1,3±0,3 |
0,339±0,181 |
9,4±2,9 |
Из табл. 2 видно, что значение индивидуальной транспортной константы K MH , характеризующей транспорт РФП из костной ткани в кровь, от 10 до 1000 раз меньше значений других транспортных констант K HM , K HR и K RU , значения которых сопоставимы друг с другом. Процесс выделения РФП из кости в кровь описывает ремоделирование костной ткани и, как следует из сравнения значений идентифицированных транспортных констант, им можно пренебрегать при РНТ, полагая K MH ≈0. Например, в работе [18] ремоделирование костной ткани не учитывалось, что существенно упростило аналитическое решение системы дифференциальных уравнений (1), а также расчёт фармакокинетических и дозиметрических характеристик. Малые значения константы K MH в свою очередь обуславливают более высокие значения эффективного периода полувыведения РФП из костной ткани T M , которые от 10 до 100 раз больше значений периодов полувыведения из других камер модели T H и T R .
Рассмотрим фармакокинетику РФП «153Sm-оксабифор» подробнее. Для этого обратимся к восстановленным в рамках четырёхкамерной модели индивидуальным кривым «Активность-время» в каждой камере. В качестве примера, на рис. 2 приведены кривые «Активность-время», рассчитанные при решении задачи Коши (1)-(2) с использованием индивидуальных транспортных констант (табл. 2) для пациента № 4. Также на рис. 2 кружочками показаны клинические данные радиометрии мочи данного пациента (табл. 1).
Камера кровеносной системы является центральной камерой в фармакокинетической модели и взаимодействует со всеми другими камерами. Поэтому кинетика активности РФП в крови особо чувствительна к значениям сразу трёх транспортных констант KHM, KMH и KHR, приведённых в табл. 2. Вначале наступает быстрый спад кривых крови, обусловленный двумя параллельными процессами – активной абсорбцией РФП в костную ткань (характеризуется константой KHM) и экскрецией РФП в камеру почек (характеризуется константой KHR). Данная фаза клиренса крови соответствует α-фазе в клинической фармакокинетике [12]. После 2-11 ч от начала РНТ на этих кривых появляются участки, сходные с медленно убывающими прямыми. За это время накопленная активность РФП в кости достигает максимума (см. табл. 3). Далее начинается очень медлен- ное выделение РФП из депонирующей ткани в кровь (характеризуется константой KMH) с его последующим радиоактивным распадом и экскрецией (β-фаза). Рассчитанные эффективные периоды полувыведения РФП из крови для всех пациентов лежат в диапазоне от 0,4 до 2,2 ч, а смена α- на β-фазу наступает примерно за время, равное пяти периодам полувыведения (2-11 ч).
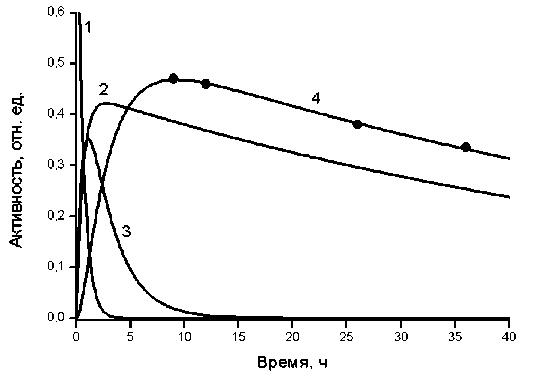
Рис. 2. Кривые «Активность-время» для камер: 1) кровеносной системы, 2) костной ткани с метастазами, 3) почек, 4) мочевого пузыря.
Из анализа кривых «Активность-время» для других камер следует, что фармакокинетика РФП в организме пациентов является сугубо индивидуальной. Также индивидуальны и рассчитанные максимальные значения кумулятивных активностей в камерах и времена их достижения (см. табл. 3). Как видно из рис. 2, достигнуто хорошее согласие расчётных значений кинетики РФП в камере мочевого пузыря с клиническими значениями. Поскольку идентификация всех четырёх транспортных констант фармакокинетической модели проводилась на основе этих радиометрических данных (см. табл. 1), то можно с высокой степенью уверенности предполагать о достоверности расчётных значений кинетики РФП и в других камерах модели. Таким образом, фармакокинетическая модель позволяет восстановить (определить) кинетику активности РФП в критических органах, в том числе в органах и тканях, в которых активность РФП невозможно измерить экспериментально.
На основе идентифицированных параметров фармакокинетической модели (индивидуальных транспортных констант) нами были проведены расчёты поглощённых радиационных доз при РНТ в костных тканях и метастазах, крови, почках и мочевом пузыре в рамках трёх подходов к назначению активности РФП «153Sm-оксабифор». При расчёте доз через массы органов и тканей использовались формулы (8)-(10), при расчёте через S -факторы – формулы (8) и (15). Табличные значения S -факторов для эндостального слоя кости, красного костного мозга, почек и мочевого пузыря соответственно равны 2,97; 1,045; 20,7 и 14,9 мГр/мКи·ч [19]. Для крови S = Δ β / m H , где Δ β =4,80 г·Гр/мКи;·ч – константа равновесной дозы спектра β-излучения 153Sm; m H – масса крови пациента, принимаемая равной 7% от массы тела в соответствии с рекомендациями [20].
В табл. 4 и 5 приведены поглощённые дозы для 10 пациентов, рассчитанные соответственно в рамках первого и второго подходов к назначению активности: стандартная активность вводимого РФП для всех пациентов составляла A 0 =60 мКи (табл. 4) и удельная активность – a 0 =1 мКи/кг (табл. 5). В скобках приведены значения, рассчитанные с использованием S -факторов.
Как видно из табл. 4, при одинаковой введённой активности РФП рассчитанные поглощённые дозы в костных метастазах у 10 пациентов различаются в 5-6 раз, что, несомненно, связано с их индивидуальными особенностями. Говорить о средней поглощённой дозе (105 Гр) для всех пациентов в таком случае нецелесообразно, поскольку она не будет отражать реальной картины исхода РНТ (в одном случае можно получить избыточное облучение костной ткани в целом, а в другом – недостаточное терапевтическое воздействие и, как следствие, неблагоприятный исход самой терапии). Например, у пациентов № 5 и 10 поглощённая доза в костных тканях (метастазы, кость, эндостальный слой, красный мозг) при первом подходе сильно завышена, а у пациента № 2 она явно не достигла терапевтического значения.
Таблица 4
Рассчитанные поглощённые дозы (Гр) на критические органы и ткани с введённой активностью РФП A 0 =60 мКи
|
Номер пациента |
Костные метастазы (на 100 г) |
Костная ткань |
Эндостальный слой кости |
Красный костный мозг |
Кровь |
Почки |
Мочевой пузырь |
|
1 |
129 |
0,84 |
6,24 (8,07) |
2,21 (2,84) |
0,04 (0,04) |
0,37 (0,40) |
0,53 (0,41) |
|
2 |
32 |
0,35 |
2,59 (2,05) |
0,91 (0,72) |
0,14 (0,14) |
1,08 (1,17) |
1,08 (0,84) |
|
3 |
97 |
1,63 |
12,08 (6,08) |
4,27 (2,14) |
0,14 (0,14) |
0,76 (0,82) |
0,71 (0,55) |
|
4 |
81 |
0,68 |
5,01 (5,04) |
1,77 (1,77) |
0,04 (0,04) |
1,62 (1,75) |
0,87 (0,67) |
|
5 |
155 |
3,05 |
22,54 (9,72) |
7,97 (3,42) |
0,23 (0,23) |
0,62 (0,67) |
0,17 (0,13) |
|
6 |
90 |
1,32 |
9,82 (5,65) |
3,47 (1,99) |
0,18 (0,18) |
0,61 (0,66) |
0,64 (0,49) |
|
7 |
65 |
0,63 |
4,67 (4,03) |
1,65 (1,42) |
0,04 (0,05) |
1,75 (1,90) |
0,99 (0,77) |
|
8 |
123 |
0,91 |
6,71 (7,71) |
2,38 (2,71) |
0,05 (0,05) |
0,39 (0,42) |
0,51 (0,40) |
|
9 |
100 |
0,74 |
5,48 (6,29) |
1,94 (2,21) |
0,16 (0,17) |
0,56 (0,60) |
0,63 (0,49) |
|
10 |
182 |
1,34 |
9,91 (11,39) |
3,51 (4,00) |
0,05 (0,05) |
0,19 (0,20) |
0,05 (0,04) |
|
Среднее, ст. откл. |
105±44 |
1,15±0,77 |
8,51±5,70 (6,60±2,73) |
3,01±2,02 (2,32±0,96) |
0,11±0,07 (0,11±0,07) |
0,80±0,52 (0,86±0,57) |
0,62±0,33 (0,48±0,25) |
Таблица 5
Рассчитанные поглощённые дозы (Гр) на критические органы и ткани с введённой удельной активностью РФП a 0 =1 мКи/кг
|
Номер пациента |
Введённая активность, мКи |
Костные метастазы (на 100 г) |
Костная ткань |
Эндостальный слой кости |
Красный костный мозг |
Кровь |
Почки |
Мочевой пузырь |
|
1 |
90 |
194 |
1,27 |
9,36 (12,10) |
3,31 (4,26) |
0,07 (0,07) |
0,56 (0,60) |
0,80 (0,62) |
|
2 |
55 |
30 |
0,32 |
2,37 (1,89) |
0,84 (0,66) |
0,13 (0,13) |
0,99 (1,07) |
0,99 (0,77) |
|
3 |
35 |
57 |
0,95 |
7,05 (3,55) |
2,49 (1,25) |
0,08 (0,08) |
0,44 (0,48) |
0,41 (0,32) |
|
4 |
70 |
94 |
0,79 |
5,85 (5,88) |
2,07 (2,07) |
0,04 (0,04) |
1,89 (2,05) |
1,01 (0,78) |
|
5 |
30 |
78 |
1,52 |
11,27 (4,86) |
3,98 (1,71) |
0,11 (0,12) |
0,31 (0,33) |
0,08 (0,07) |
|
6 |
40 |
60 |
0,89 |
6,54 (3,77) |
2,31 (1,33) |
0,12 (0,12) |
0,41 (0,44) |
0,42 (0,33) |
|
7 |
60 |
65 |
0,63 |
4,67 (4,03) |
1,65 (1,42) |
0,04 (0,05) |
1,75 (1,90) |
0,99 (0,77) |
|
8 |
80 |
165 |
1,21 |
8,95 (10,29) |
3,17 (3,62) |
0,07 (0,07) |
0,51 (0,56) |
0,69 (0,53) |
|
9 |
80 |
134 |
0,99 |
7,31 (8,39) |
2,59 (2,95) |
0,22 (0,22) |
0,74 (0,80) |
0,84 (0,65) |
|
10 |
80 |
243 |
1,79 |
13,22 (15,20) |
4,68 (5,34) |
0,07 (0,07) |
0,25 (0,27) |
0,07 (0,06) |
|
Среднее, ст. откл. |
62±21 |
112±69 |
1,04±0,43 |
7,66±3,17 (7,00±4,33) |
2,71±1,12 (2,46±1,52) |
0,10±0,05 (0,10±0,05) |
0,79±0,59 (0,85±0,64) |
0,63±0,36 (0,49±0,28) |
Как видно из табл. 5, при введении удельной активности РФП различие в рассчитанных значениях поглощённых доз в костных метастазах ещё больше. Однако при данном подходе поглощённые дозы в кости, эндостальном слое и красном костном мозге у пациента № 5 почти в 2 раза ниже, чем при первом подходе. Но и в этом случае у пациента № 2 поглощённая доза в костных метастазах явно не достигла терапевтического значения.
Вариации рассчитанных дозовых нагрузок на кровь, почки и мочевой пузырь составляют 0,04-0,23; 0,19-1,89 и 0,05-1,08 Гр соответственно и являются толерантными, т.е. не превышают предельно допустимых значений [20]. При этом цикл опорожнения мочевого пузыря был принят равным 3 ч. Рассчитанные через S -факторы значения поглощённых доз соответствуют рассчитанным значениям через массы органов только для массы тела человека, равной 70 кг (среднестатистическая масса тела). Чем сильнее масса пациента отличается от 70 кг, тем больше становится различие в значениях вычисленных поглощённых доз (см. значения в скобках).
Кроме того, в процессе моделирования и расчёта поглощённых доз в мочевом пузыре с использованием формулы (10) была выявлена монотонная зависимость дозовых нагрузок на мочевой пузырь от временного цикла его опорожнения – чем чаще опорожняется мочевой пузырь, тем поглощённая доза в нём за весь курс РНТ меньше. Подробнее эта зависимость описана в работе [14], там же приведена гистограмма рассчитанных поглощённых доз в мочевом пузыре в зависимости от цикла его опорожнения. Поэтому при расчёте поглощённой дозы в мочевом пузыре необходимо более точно учитывать временной цикл его опорожнения для каждого конкретного пациента.
Третий подход к назначению вводимой активности РФП непосредственно связан с индивидуальным дозиметрическим планированием РНТ. Этот подход наиболее полно позволяет учесть индивидуальные особенности пациента и требует получение индивидуальных фармакокинетических характеристик конкретного РФП в его организме (кривых «Активность-время») в процессе предварительного диагностического исследования (при подготовке к РНТ с этим РФП). Далее вводимая активность для каждого пациента рассчитывается с использованием формул (9) или (11) на основе запланированной поглощённой дозы в костных тканях (метастазах, эндостальном слое, красном мозге). При этом основным показателем точности ИДП будет отношение реально полученной к запланированной поглощённой дозе. К сожалению, для рассматриваемых нами в данной работе пациентов предварительная диагностика с 153Sm-оксабифором не проводилась. Однако мы решили оценить индивидуальную активность в рамках третьего подхода, исходя из максимально допустимых значений поглощённых доз в костных тканях (для эндостального слоя – 7,5 Гр, для костного мозга – 2,5 Гр) согласно рекомендациям [20].
В табл. 6 приведены основные результаты ИДП для 10 пациентов, полученные в рамках третьего подхода – рассчитанная по запланированной поглощённой дозе в костных метастазах индивидуальная активность вводимого РФП и соответствующие ей дозовые нагрузки на другие критические органы и ткани. При этом запланированная доза в метастазах для каждого пациента определялась, исходя из указанных выше максимально допустимых значений поглощённых доз в костных тканях.
Как видно из табл. 6, запланированная поглощённая доза в костных метастазах лежит в пределах 50-120 Гр и коррелирует с массой тела пациентов. Например, масса тела пациентов № 2, 3, 5, 6 не превышает 55 кг, и значения запланированной дозы для них находятся в диапазоне 50-90 Гр. Для пациентов с большей массой тела (от 60 кг) значения запланированной дозы более высокие (100-120 Гр). Поэтому второй подход к назначению активности (удельная активность на 1 кг массы тела) с этой точки зрения можно считать также научно обоснованным, однако в нём нередко присутствуют случаи избыточного переоблучения костных тканей (см. табл. 5, пациенты № 1, 5, 8, 10).
Таблица 6
Рассчитанные дозиметрические характеристики (Гр) на основе запланированной дозы в костных метастазах
|
Номер пациента |
Запланированная доза в костные метастазы (на 100 г) |
Введённая активность, мКи |
Костная ткань |
Эндостальный слой кости |
Красный костный мозг |
Кровь |
Почки |
Мочевой пузырь |
|
1 |
110 |
51 |
0,72 |
5,30 (6,86) |
1,88 (2,42) |
0,04 (0,04) |
0,32 (0,34) |
0,45 (0,35) |
|
2 |
90 |
165 |
0,96 |
7,12 (5,63) |
2,50 (1,98) |
0,39 (0,40) |
2,96 (3,22) |
2,99 (2,30) |
|
3 |
60 |
37 |
1,01 |
7,45 (3,75) |
2,50 (1,32) |
0,09 (0,09) |
0,47 (0,50) |
0,43 (0,34) |
|
4 |
100 |
75 |
0,85 |
6,26 (6,30) |
2,22 (2,22) |
0,05 (0,05) |
2,02 (2,19) |
1,08 (0,84) |
|
5 |
50 |
19 |
0,96 |
7,14 (3,08) |
2,50 (1,08) |
0,07 (0,07) |
0,20 (0,21) |
0,05 (0,05) |
|
6 |
60 |
40 |
0,89 |
6,54 (3,77) |
2,31 (1,33) |
0,12 (0,12) |
0,41 (0,44) |
0,42 (0,33) |
|
7 |
100 |
92 |
0,97 |
7,17 (6,19) |
2,50 (2,18) |
0,07 (0,07) |
2,68 (2,92) |
1,53 (1,18) |
|
8 |
120 |
58 |
0,88 |
6,49 (7,46) |
2,30 (2,50) |
0,05 (0,05) |
0,37 (0,41) |
0,49 (0,38) |
|
9 |
110 |
66 |
0,82 |
6,03 (6,93) |
2,13 (2,44) |
0,18 (0,18) |
0,61 (0,66) |
0,69 (0,54) |
|
10 |
110 |
36 |
0,81 |
5,95 (6,84) |
2,11 (2,41) |
0,03 (0,03) |
0,11 (0,12) |
0,03 (0,03) |
|
Среднее, ст. откл. |
91±25 |
64±41 |
0,89±0,09 |
6,55±0,68 (5,68±1,57) |
2,30±0,21 (1,99±0,54) |
0,11±0,11 (0,11±0,11) |
1,02±1,02 (1,10±1,10) |
0,82±0,82 (0,64±0,64) |
Как показывают результаты моделирования, при третьем подходе ИДП практически отсутствуют случаи недо- или переоблучения костных тканей, а дозовые нагрузки на другие органы и ткани (кровь, почки, мочевой пузырь) остаются в пределах нормы [20]. Рассчитанная индивидуальная активность вводимого РФП, необходимая для достижения соответствующих запланированных поглощённых доз в метастазах, варьирует в широких пределах от 19 до 165 мКи (!). Среднее же её значение составляет 64 мКи и примерно соответствует стандартной активности (60 мКи) в рамках первого подхода (см. табл. 4). Кроме того, рассчитанные и приведённые в табл. 6 значения стандартных отклонений от среднего значения активности и дозовых нагрузок на кровь, почки и мочевой пузырь очень велики, что подтверждает варьирование их значений у пациентов также в широких пределах. Поэтому первый подход к назначению активности (одинаковая активность для всех пациентов) с этой точки зрения можно считать нецелесообразным.
Заключение
В рамках данной работы был создан программный комплекс фармакокинетического моделирования и расчёта индивидуальных поглощённых доз при РНТ костных метастазов с помощью РФП «153Sm-оксабифор», а также проведена его апробация на клинических радиометрических данных 10 пациентов с костными метастазами. В основу программного комплекса положена разработанная нами четырёхкамерная модель кинетики остеотропного РФП при внутривенном введении, описывающая его накопление и выведение из критических органов и тканей (костные ткани с метастазами, кровеносная система, почки, мочевой пузырь).
Основные результаты работы можно сформулировать следующим образом.
-
1. Рассмотрены особенности расчёта фармакокинетических и дозиметрических характеристик остеотропных РФП на основе четырёхкамерной модели их транспорта в организме человека в рамках трёх подходов дозиметрического планирования РНТ. Наиболее подходящим и клинически растущим отечественным РФП с этой точки зрения в настоящее время является 153Sm-оксабифор.
-
2. На основе количественных данных радиометрии проб мочи 10 пациентов с костными метастазами идентифицированы основные модельные параметры – транспортные константы. Рассчитаны и проанализированы значимые для клинического анализа и оценки эффективности РНТ фармакокинетические характеристики (эффективные периоды полувыведения, значения максимальной активности в камерах и времена их достижения) и зависимости «Активность-время» для критических органов и тканей. Показано, что особенности фармакокинетики РФП для каждого пациента являются сугубо индивидуальными, зависят от целого ряда характеристик самого пациента, и не могут быть описаны усреднёнными кинетическими параметрами.
-
3. Рассмотрены и проанализированы три подхода к назначению активности 153Sm-окса-бифора при РНТ – стандартная, удельная и индивидуальная активности. Показано, что при введении стандартной (60 мКи) и удельной (1 мКи/кг) активностей в организм пациента (первый и второй подходы) рассчитанные на основе индивидуальных фармакокинетических характеристик поглощённые дозы у 10 пациентов различаются в 5-6 раз, при этом выявляются случаи недо- или переоблучения костных тканей с метастазами, что может существенно снизить эффективность проведённой РНТ или неблагоприятно повлиять на состояние пациента впоследствии. Вариации рассчитанных в рамках первого и второго подходов дозовых нагрузок на кровеносную систему, почки и мочевой пузырь являются толерантными и не превышают предельно допустимых значений.
-
4. В рамках третьего подхода ИДП рассчитанная для 10 пациентов индивидуальная вводимая активность 153Sm-оксабифора, необходимая для достижения запланированных поглощённых доз в костных метастазах (50-120 Гр), варьирует в широких пределах от 19 до 165 мКи. При этом отсутствуют случаи недо- или переоблучения костных тканей, а дозовые нагрузки на кровеносную систему, почки и мочевой пузырь также остаются в пределах нормы.
-
5. Рассчитываемые значения поглощённых доз очень чувствительны к кинетическим параметрам камерной модели (транспортным константам). Также была выявлена монотонная зависимость поглощённой дозы в мочевом пузыре от временного цикла его опорожнения: чем чаще опорожняется мочевой пузырь, тем меньше поглощённая доза в нём за весь курс РНТ в целом. Поэтому при индивидуальном планировании РНТ следует уделять особое внимание получению точных количественных данных радиометрии и на их основе – идентификации параметров моделирования.
Список литературы Армакокинетическое моделирование и дозиметрическое планирование радионуклидной терапии костных метастазов
- Murray I., Du Y. Systemic radiotherapy of bone metastases with radionuclides //Clin. Oncol. 2G21. V. 33, N 2. P. 9S-1G5.
- Handkiewicz-Junak D., Poeppel T.D., Bodei L., Aktolun C., Ezziddin S., Giammarile F., Delgado-Bolton R.C., Gabriel M. EANM guidelines for radionuclide therapy of bone metastases with beta-emitting radionuclides //Eur. J. Nucl. Med. Mol. Imaging. 2G1S. V. 45, N 5. P. 846-859.
- Крылов B.B., Дроздовский Б.Я., Цыб A^. Радионуклидная терапия в паллиативном лечении больных с метастазами в кости //Паллиативная медицина и реабилитация. 200S. № 3. С. 4S-53.
- Джужа Д^., Саган Д.Л. Паллиативная радионуклидная терапия костных метастазов //Променева дiагностика, променева тератя. 2010. № 1. С. 6S-59.
- Лиманов B.A. Радиобиологическое и дозиметрическое планирование лучевой и радионуклидной терапии. Ч. 2. М.: НИЯУ МИФИ, 2011. 604 с.
- Зырянов СХ, Затолочина ^Э. Перспективы применения радионуклидных лекарственных препаратов при лечении злокачественных новообразований в РФ //Качественная клиническая практика. 2018. № 2. С. S^!.
- Петриев B.M., Дфанасьева Е.Л., Скворцов В.Г. Остеотропные радиофармпрепараты на основе фос-фоновых кислот для лечения костных метастазов человека (обзор) //Химико-фармацевтический журнал. 2008. Т. 42, № S. С. 3-Ю.
- Pacilio M., Ventroni G., Basile C., Ialongo P., Becci D., Mango L. Improving the dose-myelotoxicity correlation in radiometabolic therapy of bone metastases with 153Sm-EDTMP //Eur. J. Nucl. Med. Mol. Imaging. 2G14. V. 41, N 2. P. 23S-252.
- Дуфлот В.Р., Ермаков В.С., Лобанова Е.И., Петриев B.M., Тищенко B.K., Воронцова M.C., Вене-диктова Ю.Б., Панкратов A.A. Доклинические исследования радиофармпрепарата на основе термочувствительного сополимера и самария-ЮЗ для локальной радионуклидной терапии солидных опухолей //Онкологический журнал: лучевая диагностика, лучевая терапия. 2018. Т. 1, № 4. С. 72-S1.
- Тищенко B.K., Петриев B.M., Сморызанова O.A., Mихайловская A.A. Влияние химической структуры фосфоновых кислот, меченных Re-188, на их поведение в организме лабораторных животных //Радиация и риск. 2017. Т. 26, № 1. С.78^.
- Степаненко В.Ф., Яськова E.K., Белуха И.Г., Петриев B.M., Скворцов В.Г., Юэлыженков Т.В., Петухов A^., Дубов Д.В. Расчёты доз внутреннего облучения нано-, микро- и макро-биоструктур электронами, бета-частицами и квантовым излучением различной энергии при разработках и исследованиях новых РФП в ядерной медицине //Радиация и риск. 201S. Т. 24, № 1. С^-б^
- Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика: основные положения и клиническое применение. М.: Изд-во РАМН, 2003. 208 с.
- №тина Е.Д. Программный комплекс «Диагностика» для обработки радионуклидных исследований //Вестник Санкт-Петербургского университета. 2010. № 2. С. 100-113.
- Mатвеев A.B., Юэрнеева M^. Модель кинетики остеотропного радиофармпрепарата и определение поглощённых доз при радионуклидной терапии костных метастазов //Вестник Омского университета. 2018. Т. 23, № 1. C. 3S-42.
- Доля О.П., Mатусевич Е.С., Илепов A.K, ^раченко ЮА. Дозиметрическое обеспечение радионуклидной диагностики и терапии костных метастазов //Альманах клинической медицины. 2008. Т. 17. С. 310-313.
- Mатвеев A.B., Юэрнеева M^. Фармакокинетическое моделирование и расчёт поглощённых доз при радионуклидной терапии костных метастазов. Свидетельство о государственной регистрации программы для ЭВМ RU 2G1 S515431 , 01.06.2018.
- Доля О.П., ^епов A.K, ^ылов B.B., Дроздовский Б.Я., Mатусевич Е.С. Динамика накопления и выведения 1а^1Т1-оксабифора у больных с метастазами в кости при проведении радионуклидной терапии //Радиация и риск. 2007. Т. 16, № 2-4. С. 39-47.
- Доля О.П., Матусевич Е.С., Клепов А.Н. Математическое моделирование кинетики транспорта остео-тропного радиофармпрепарата в организме пациентов с метастазами в кости //Медицинская физика. 2007. № 2. С. 40-50.
- Bouchet L.G., Bolch W.E., Howell R.W., Rao D.V. S values for radionuclides localized within the skeleton //J. Nucl. Med. 2000. V. 41, N 1. P. 189-212.
- Пределы поступления радионуклидов для работающих с ионизирующим излучением. Публикация 30 МКРЗ. М.: Энергоатомиздат, 1982.


