Артериовенозная мальформация малого таза. Клинический случай
Автор: Сидоров Е.А., Соловов Д.В., Сартакова Е.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Медицинская визуализация
Статья в выпуске: 5 т.14, 2024 года.
Бесплатный доступ
Сосудистые мальформации достаточно редки, но могут возникнуть в лю6ом месте человеческого организма, и при поражении женского таза имеют уникальную картину. Благодаря подро6ному анамнезу и нео6ходимым методам диагностики можно поставить правильный диагноз и начать оптимальное лечение. Артериовенозные мальформации о6ычно тре6уют эм6олизации. Предпочтение хирургического вмешательства или медикаментозного лечения определяется в рамках мультидисциплинарного подхода к лечению пациентов. Представлен клинический случай артериовенозной мальформации малого таза у пациентки 32 лет с привидением анамнеза и результатов компьютерной томографии органов 6рюшной полости с 6олюсным контрастированием. Также представлен о6зор сосудистых пороков развития женского таза, их клинического течения, диагностических исследований и вариантов лечения.
Кт, компьютерная томография, артериовенозная мальформация, аbm, малый таз
Короткий адрес: https://sciup.org/143183989
IDR: 143183989 | УДК: 616.137.73/.74-007.64-07 | DOI: 10.20340/vmi-rvz.2024.5.MIM.1
Текст научной статьи Артериовенозная мальформация малого таза. Клинический случай
Сосудистые мальформации могут возникать в любом месте тела. В 1982 году была предложена их классификация по скорости кровотока (Малликен и Гловацкий) [1]. В 1996 году эта система была принята и модифицирована Международным обществом по изучению сосудистых аномалий (ISSVA). В 2014 году она был обновлена и дополнена информацией о клинических проявлениях, типах поражения сосудов (капиллярных, лимфатических, венозных, артериовенозных или смешанных), а также степени поражения и генетической предрасположенности [2].
Мальформации с медленным кровотоком
Лимфатические мальформации
Пороки развития с медленным кровотоком можно далее разделить на лимфатические и венозные пороки развития. Лимфатические мальформации (ЛМ) часто представляют собой отёк мягких тканей, который может быть очаговым или диффузным. Чаще всего локализуются в области головы и шеи, но могут возникнуть где угодно. Обычно ЛМ формируются при рождении, но могут быстро изменяться в размерах под воздействием множества факторов.
Венозные мальформации
Венозные мальформации (ВМ) — ещё одна сосудистая мальформация с медленным кровотоком, которая может возникнуть в любом месте организма. Они чаще всего врождённые и растут пропорционально ребенку; однако они могут демонстрировать быстрый рост или увеличение во время полового созревания из-за повышенного уровня гормонов. Дополнительными причинами ускоренного увеличения могут быть инфекция, травма или тромбоз. Большинство ВМ возникают спонтанно; однако есть некоторые из них с генетической предрасположенностью.
Быстро-потоковые мальформации
Артериовенозные мальформации (АВМ) представляют собой форму сосудистых мальформаций с быстрым кровотоком, которые могут возникать в малом тазу. У пациента могут наблюдаться боль, гематурия, аномальное вагинальное или ректальное кровотечение, в зависимости от того, какие органы поражены, а АВМ может эрозировать на соседние структуры. Кровотечение может быть хроническим или внезапным и носить угрожающий жизни характер. АВМ таза могут иметь настолько увеличенный кровоток, что у пациентов развивается перегрузка сердечного объёма и застойная сердечная недостаточность. Редко у пациентов может наблюдаться внутрибрюшное кровотечение. Пациенты также могут сообщать о бесплодии или самопроизвольных абортах в анамнезе [3]. При осмотре АВМ могут быть пульсирующими с ощущением дрожи и быть теплее окружающих тканей.
АВМ могут быть врожденными или приобретёнными. Врожденные АВМ развиваются из эмбриональных сосудов и имеют аномальные соединения между тазовыми артериями и венами без промежуточного капиллярного русла. Их отличает наличие множества питающих сосудов. С другой стороны, приобретённые АВМ представляют собой аномальные соединения между маточными артериями и венами миометрия и часто имеют несколько или один питающий сосуд. Обычно существует ятрогенная причина, такая как предшествующее кесарево сечение или дилатация и выскабливание. Большинство пациентов — женщины репродуктивного возраста с самопроизвольными абортами в анамнезе, гестационной трофобластической болезнью или инфекцией [4].
Визуализация. Первоначальная оценка АВМ включает УЗИ. На изображениях видны несвязная масса, состоящая из множественных трубчатых каналов. Цветовые допплеровские исследования показывают, что эти каналы имеют мозаичный турбулентный кровоток с высокой скоростью и низким импедансом. Для определения степени поражения можно провести КТ-ангиографию (КТА) или МРТ. КТ-ангиография и МР-ангиография помогают идентифицировать артериальные питающие и венозные сосуды, а также отсутствие сопутствующих образований. КТА имеет соответствующую дозу ионизирующего излучения, но в неотложных случаях быстро предоставляет ценную информацию. МРТ/МРА чаще предпочтительнее, но их выполнение занимает больше времени, чем КТА, и у молодых педиатрических пациентов может потребоваться седация. МРТ может показать множественные пустоты потока и изменения сигнала, указывающие на разрастание прилегающей фиброзно-жировой ткани АВМ. Поражение костей можно рассматривать как литические изменения и разрастание конечностей с аномальным сигналом в кости. «Золотым» стандартом визуализации АВМ является катетерная ангиография, но её часто оставляют до тех пор, пока лечение не будет проводиться в тех же условиях [5]. Прямая внутриартериальная МРА также была предложена в качестве нового метода обнаружения мелких питающих сосудов при АВМ таза, которые могут не быть очевидным только при МР-ангиографии или цифровой субтракционной ангиографии [6].
Лечение. Несколько исследований показали, что консервативное лечение приобретённых АВМ матки с использованием либо гормональной терапии, либо неинвазивного мониторинга спонтанной регрессии является возможным вариантом при бессимптомном течении у женщин [7]. Однако, когда у пациентки появляется кровотечение, может потребоваться оперативное вмешательство. Диагностику АВМ следует начинать с помощью ангиографии, чтобы определить питающие сосуды и дренажные вены. N-бутилцианоакрилат или сополимеры этилена и винилового спирта могут быть введены транскатетерным артериальным доступом для заполнения очага. Лечение всего очага может потребовать доступа к нескольким ветвям, питающим АВМ, и многократного лечения. Важно закупорить как можно больше ветвей, поскольку, как только одна ветвь блокируется, другая ветвь может быть задействована для продолжения питания АВМ. Частицы гелевой пены и поливинилового спирта также использовались в центрах трансартериальной эмболизации или склеротерапия для облитерации АВМ [8].
В большинстве случаев эмболизации достаточно, чтобы купировать симптомы АВМ, или её можно использовать до операции для уменьшения кровопотери во время последующей хирургической резекции. Некоторые женщины с АВМ матки могут предпочесть эмболизацию для сохранения фертильности, когда это возможно, но в конечном итоге требуется гистерэктомия для полного разрешения [9].
Комбинированные сосудистые мальформации
Существуют синдромы, характеризующиеся обширными сосудистыми пороками развития, охватывающими всю нижнюю конечность с распространением на таз, которые можно разделить на пороки развития с низким или быстрым потоком. Наиболее распространённым типом медленного кровотока является синдром Клиппеля-Треноне (КТС), который характеризуется кожным капиллярным пятном, чрезмерным ростом конечностей и обширными аномальными пороками развития медленного кровотока (лимфатическим или венозным) [10]. Венозный компонент синдрома часто имеет персистирующие эмбриональные вены (ПЭВ). ПЭВ можно разделить на латеральную маргинальную вену, которая проходит в поверхностном латеральном отделе голени, или персистирующую седалищную вену, которая проходит вдоль седалищного нерва в заднем отделе и считается глубокой веной [11]. ПЭВ сливаются централизованно через сеть вен, соединённых с глубокими венами таза, и в случае их тромбообразования может стать путём развития тромбоэмболии лёгочной артерии. Нормальная венозная система поражённой конечности часто является рудиментарной или прерывистой и может иметь плохую функцию, что можно увидеть при неинвазивной визуализации [12]. Если ВМ массивная, у пациентов могут отмечаться отёки конечностей, стазисный дерматит, а также кровотечение из прямой кишки или влагалища.
Также для синдром Паркса-Вебера может быть характерны быстро-потоковые мальформации
(АВМ), обширные кожные капиллярные мальформации и гипертрофии конечностей. У этих пациентов может наблюдаться несоответствие длины ног, перегрузка сердца и повреждение кожи. Может быть вовлечён небольшой лимфатический компонент, который проявляется в виде пузырьков, которые могут служить путём для инфекции [13].
Лечение. В клинике Клиппеля-Треноне консервативное лечение обширных венозных аномалий включает ношение компрессионной одежды, а также физиотерапию, чтобы помочь сохранить подвижность суставов и избежать мышечных контрактур. Серийную склеротерапию можно проводить для облегчения болей и венозной недостаточности или для лечения лимфатического компонента порока развития. ПЭВ можно лечить эндовенозным лазером и использовать для непосредственной абляции вены по всей её длине или хирургического иссечения с помощью лигирования [14]. ПЭВ может обеспечить значительное дренирование поражённой нижней конечности, если имеется слабо развитая система глубоких вен, поэтому необходима соответствующая оценка перед абляцией или лигированием. Если выявлено внутрисуставное поражение, сотрудничество с хирургом-ортопедом для проведения резекции, включая возможную периоперационную эмболизацию, может быть полезным для сохранения сустава. При синдроме Паркса-Вебера лечение возможно с помощью эмболизации венозного оттока и окклюзии или склеротерапии очага, если он поддаётся лечению [15]. Учитывая, что при этих сложных комбинированных синдромах задействовано множество систем организма, следует учитывать мультидисциплинарный подход. Для оптимального лечения может потребоваться многопрофильный центр, специализирующийся на лечении сосудистых аномалий.
Представлен случай АВМ у пациентки 32 лет с привидением результатов компьютерной томографии органов брюшной полости с болюсным контрастированием. Изучены амбулаторная карта, протоколы УЗ-исследования малого таза, данные КТ органов брюшной полости с болюсным контрастированием.
Клинический случай
Пациентка А., 32 лет, во время планового осмотра гинекологом была направлена на КТ органов брюшной полости и малого таза в связи с жалобами на тянущие боли внизу живота, обильные менструации до снижения показателей гемоглобина, обмороки, слабость, ощущение пульсации в нижнем этаже брюшной полости.
Объективный статус: эпидемиологический и наследственный анамнез не отягощён. Конституционально развита правильно. Костно-мышечная система без особенностей. Периферических отёков нет. АД 110/70 мм рт. ст., пульс 70 уд./мин, ритмичный. Общее состояние удовлетворительное. Кожный покров бледно-розовой окраски. Сознание ясное. Дыхание свободное. Одышки, кашля нет. Язык влажный. Живот не вздут, участвует в акте дыхания. При пальпации мягкий, безболезненный во всех отделах. Печень, селезёнка не пальпируются. симптомов раздражения брюшины нет. Газы отходят. Нарушение стула не отмечает. Симптом Пастернацкого отрицательный с обеих сторон.
Анамнез: менструации регулярные с 14 лет, по 5 дней, через 28 дней. Половая жизнь с 16 лет. Беременностей – 4, родов – 3, аборты – 1.
Перенесённые операции: 2012 г. лапаротомия, кесарево сечение.
Объективно: ощущение пульсации в нижнем этаже брюшной полости, безболезненная пальпация.
Лабораторные анализы. Гемоглобин – 99 г/л (норма у женщин — 120–140 г/л), гаматокрит – 29,8% (норма у женщин от 36 до 42%).
УЗ-исследование: по рёбрам матки определяются извитые анэхогенные трубчатые структуры с просветом до 7 мм. Заключение: эхографические признаки артериовенозной мальформации таки. Варикозно расширенные вены малого таза.
КТ-исследование проводилось в Клиниках СамГМУ на аппарате GE Revolution EVO 128 с болюсным введением контрастного препарата (Йогек-сол (350 мг йода/мл), скорость введения 4 мл/сек).
При КТ было выявлено: в полости малого таза определяется сосудистое образование с чёткими неровными контурами, общими размерами до 100×100×60 мм. Отмечается питающая артерия, отходящая от правой почечной артерии, и дренирующая вена слева, впадающая в систему почечных вен (рис. 1–3).
Было выставлено заключение: артериовенозная мальформация малого таза.
Пациентка была проконсультирована сосудистым хирургом, направлена на решение вопроса об оперативном вмешательстве.
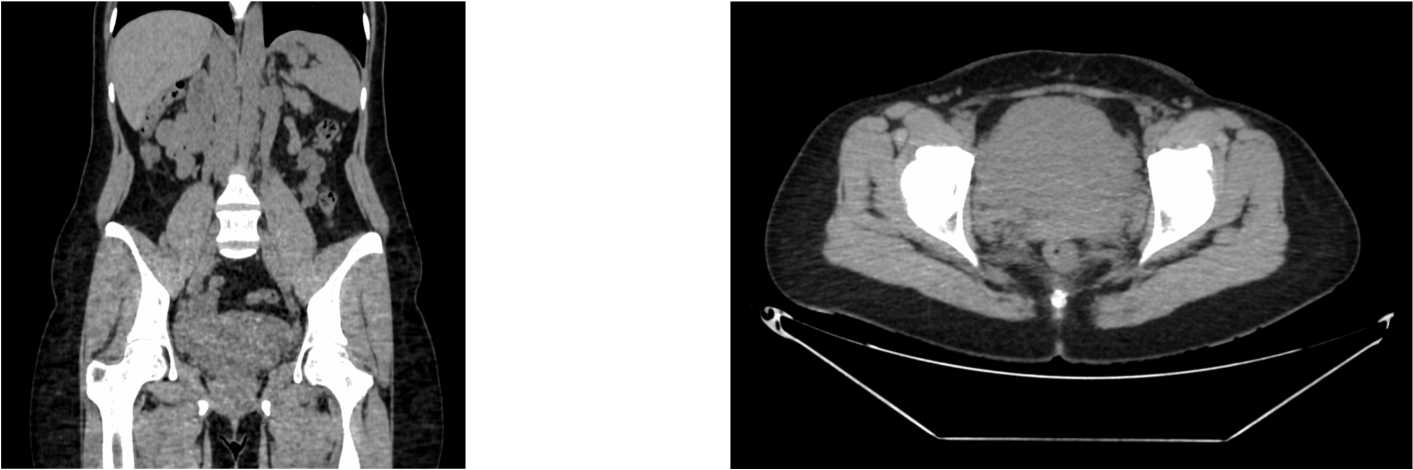
Рисунок 1. КТ брюшной полости, коронарная и аксиальная плоскости. Нативная фаза. В области малого таза определяется мягкотканый конгломерат, общими размерами 100×100×60 мм
Figure 1. CT of the abdominal cavity, coronal and axial planes. Native phase. In the pelvic region, a soft tissue conglomerate is identified, with overall dimensions of 100×100×60 mm
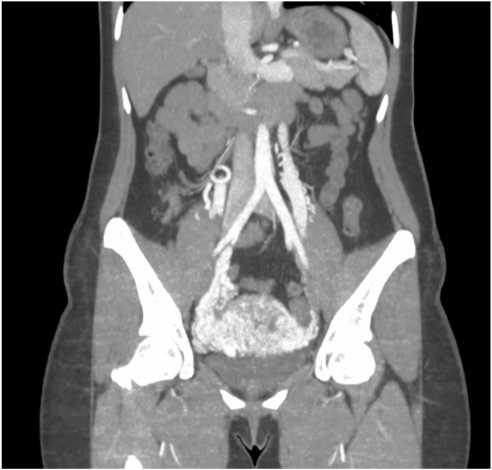
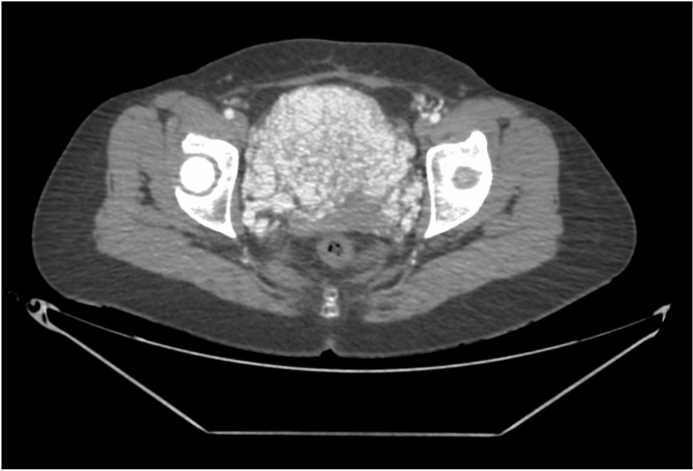
Рисунок 2. КТ брюшной полости, коронарная и аксиальная плоскости. Артериальная фаза. В полости малого таза определяется сосудистое образование с четкими неровными контурами, общими размерами до 100х100х60 мм. Отмечается питающая артерия, отходящая от правой почечной артерии, и дренирующая вена слева, впадающая в систему почечных вен
Figure 2. CT of the abdominal cavity, coronal and axial planes. Arterial phase. In the pelvic cavity, a vascular formation with clear, uneven contours is identified, with overall dimensions up to 100x100x60 mm. A feeding artery originating from the right renal artery and a draining vein on the left, flowing into the renal vein system, are noted
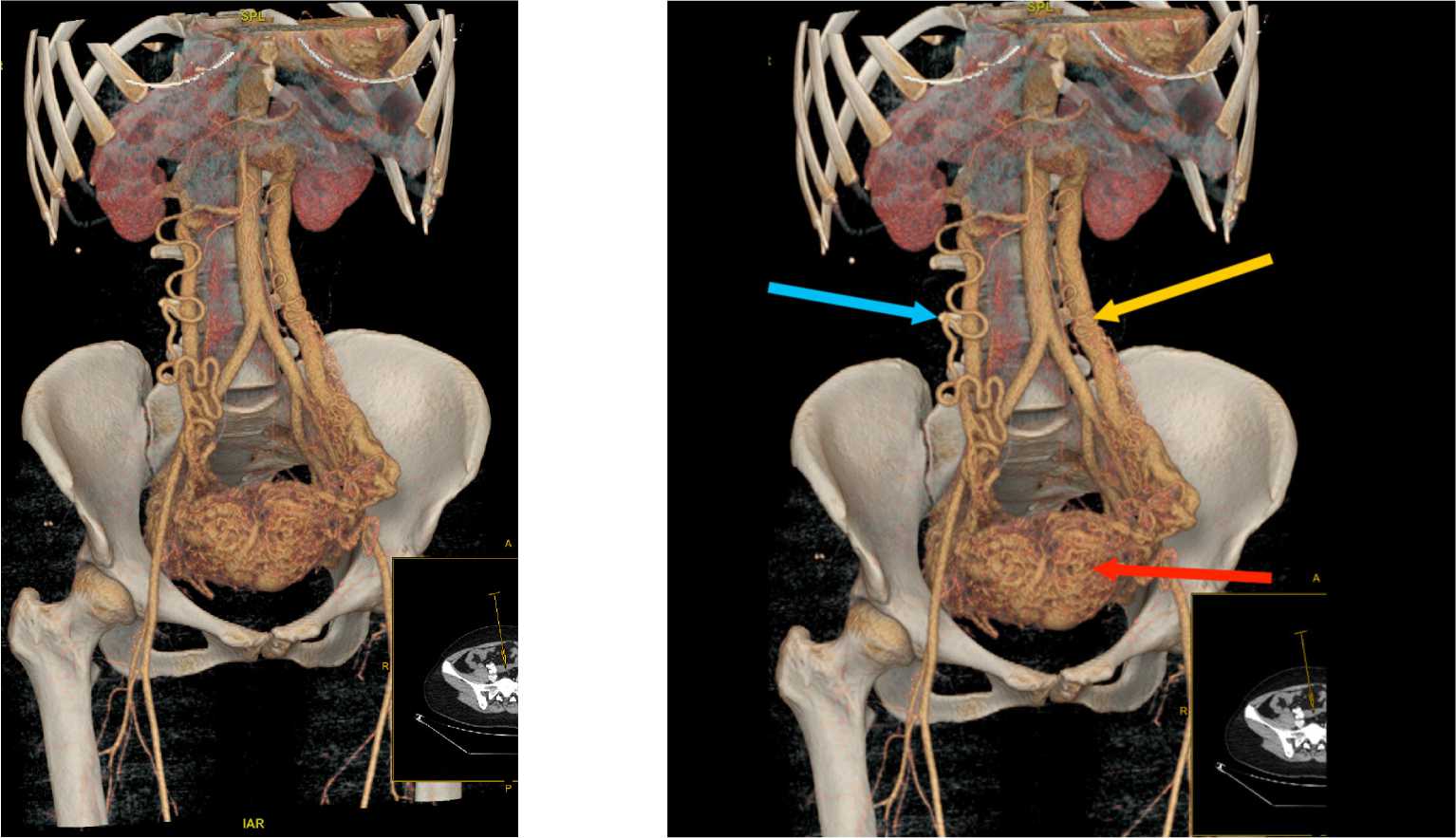
Рисунок 3. КТ брюшной полости. 3D-реконструкция. Дренирующая вена. Питающая артерия. Артериовенозная мальформация малого таза
Figure 3. CT of the abdominal cavity. 3D reconstruction. Draining vein. Feeding artery. Arteriovenous malformation of the pelvis
Рисунок 4. КТ брюшной полости. 3D-реконструкция. Дренирующая вена – желтая стрелка. Питающая артерия – синяя стрелка.
Артериовенозная мальформация малого таза – красная стрелка Figure 4. CT of the abdominal cavity. 3D reconstruction. Draining vein – yellow arrow. Feeding artery – blue arrow. Arteriovenous malformation of the pelvis – red arrow
Обсуждение
Сосудистые пороки развития женского таза представляют собой обширную область, включающую пороки развития как с медленным, так и с быстрым кровотоком. Визуализация играет решающую роль в определении характеристик и степени порока развития.
Основными направлениями лечения остаются склеротерапия и эндоваскулярная терапия, а также мультидисциплинарный подход к лечению пациентов в сложных случаях.
Компьютерная томография с болюсным введением контрастного вещества является эффективным методом диагностики пациентов с АВМ как при первичной диагностике, так и как метод подтверждения диагноза при ультразвуковом подозрении на артериовенозный сброс. Цифровая субтракционная ангиография является «золотым» стандартом в диагностике АВМ, однако ввиду инвазивности не считается методом первой линии визуализации. КТ обеспечивает точную информацию об ангиоархитектонике сосудистых мальформаций для выбора тактики лечения и планирования оперативного вмешательства и является достаточным методом диагностики для определения анатомических особенностей.
В описанном случае АВМ стала случайной находкой у пациентки с аномальными маточными кровотечениями. После консультации сосудистых хирургов методом выбора стало хирургическое лечение, от которого пациентка отказалась.
Список литературы Артериовенозная мальформация малого таза. Клинический случай
- Christenson BM, Gipson MG, Smith MT. Pelvic vascular malformations. Semin Intervent Radiol. 2013 Dec;30(4):364-71. https://doi.org/10.1055/s-0033-1359730 PMID: 24436563; PMCID: PMC3835586.
- ISSVA Classification of Vascular Anomalies. International Society for the Study of Vascular Anomalies. 2018. Available at: is-sva.org/classification. Accessed January 28, 2020.
- Agrawal S, Dave A, Shukla S. Postabortal Bleeding: A Diagnostic Dilemma Resolved As Arteriovenous Malformation and Successfully Man-aged With Uterine Artery Embolization. Cureus. 2023 Nov 29;15(11):e49666. https://doi.org/10.7759/cureus.49666 PMID: 38161858; PMCID: PMC10756586.
- Annam A. Female Pelvic Vascular Malformations. Semin Intervent Radiol. 2018 Mar;35(1):62-68. https://doi.org/10.1055/s-0038-1636524 Epub 2018 Apr 5. PMID: 29628618; PMCID: PMC5886763.
- White CL, Olivieri B, Restrepo R, McKeon B, Karakas SP, Lee EY. Low-Flow Vascular Malformation Pitfalls: From Clinical Examination to Practi-cal Imaging Evaluation--Part 1, Lymphatic Malformation Mimickers. AJR Am J Roentgenol. 2016 May;206(5):940-51. https://doi.org/10.2214/AJR.15.15793 Epub 2016 Mar 21. PMID: 26999565.
- Nakashololo T, Khan N, Dunn Z, Snyman L, Mh Ismail S. Uterine arteriovenous malformations, clinical and radiological considerations: A report of two cases. Radiol Case Rep. 2021 May 6;16(7):1924-1929. https://doi.org/10.1016/j.radcr.2021.02.018 PMID: 34149976; PMCID: PMC8189875.
- Oride A, Kanasaki H, Miyazaki K. Disappearance of a uterine arteriovenous malformation following long-term administration of oral norgestrel/ethinyl estradiol. J Obstet Gynaecol Res. 2014 Jun;40(6):1807-10. https://doi.org/10.1111/jog.12370 PMID: 24888954.
- Müller-Wille R, Wildgruber M, Sadick M, Wohlgemuth WA. Vascular Anomalies (Part II): Interventional Therapy of Peripheral Vascular Mal-formations. Rofo. 2018 Feb 7. https://doi.org/10.1055/s-0044-101266 Epub ahead of print. PMID: 29415296.
- Adams DM, Trenor CC 3rd, Hammill AM, et al. Efficacy and Safety of Sirolimus in the Treatment of Complicated Vascular Anomalies. Pediat-rics. 2016 Feb;137(2):e20153257. https://doi.org/10.1542/peds.2015-3257 Epub 2016 Jan 18. PMID: 26783326; PMCID: PMC4732362.
- Falahati V, Fallahi M, Shahriarpour M, Ghasemi A, Ghaffari K. A Rare Case of Klippel Trenaunay Syndrome with Von Willebrand Factor Defi-ciency and Multiple Accessory Spleens: A Case Report and Brief Literature Review. Adv Biomed Res. 2024 Feb 26;13:20. https://doi.org/10.4103/abr.abr_232_23 PMID: 38525403; PMCID: PMC10958732.
- Oduber CE, Young-Afat DA, van der Wal AC, van Steensel MA, Hennekam RC, van der Horst CM. The persistent embryonic vein in Klippel-Trenaunay syndrome. Vasc Med. 2013 Aug;18(4):185-91. https://doi.org/10.1177/1358863X13498463 PMID: 23966121.
- Ochoco GETD, Enriquez CAG, Urgel RJL, Catibog JS. Multimodality imaging approach in a patient with Klippel-Trenaunay syndrome. BMJ Case Rep. 2019 Aug 20;12(8):e228257. https://doi.org/10.1136/bcr-2018-228257 PMID: 31434664; PMCID: PMC6706670.
- Banzic I, Brankovic M, Maksimović Ž, Davidović L, Marković M, Rančić Z. Parkes Weber syndrome-Diagnostic and management paradigms: A systematic review. Phlebology. 2017 Jul;32(6):371-383. https://doi.org/10.1177/0268355516664212 Epub 2016 Aug 9. PMID: 27511883.
- Lu TF, Shih YH, Lu CH, Sun L. A new fertility-preserving treatment modality for life-threatening bleeding caused by acquired uterine arterio-venous malformation (AVM): Combination laparoscopic ligation of uterine arteries and AVM suture. Taiwan J Obstet Gynecol. 2022 Jul;61(4):703-707. https://doi.org/10.1016/j.tjog.2021.06.001 PMID: 35779926.
- Hammer J, Seront E, Duez S, et al. Sirolimus is efficacious in treatment for extensive and/or complex slow-flow vascular malformations: a monocentric prospective phase II study. Orphanet J Rare Dis. 2018 Oct 29;13(1):191. https://doi.org/10.1186/s13023-018-0934-z PMID: 30373605; PMCID: PMC6206885.


