Асцит как предмет исследований при раке яичников
Автор: Виллерт Алиса Борисовна, Коломиец Лариса Александровна, Юнусова Наталья Валерьевна, Иванова Анна Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Рак яичников (РЯ) представляет собой неоднородную группу опухолей, различающихся этиологией и клиническим течением. Наиболее часто встречающийся гистотип - High-grade серозный рак яичников, который в большинстве случаев диагностируется на диссеминированной стадии и сопровождается асцитом. Перитонеальная диссеминация является одним из наиболее неблагоприятных факторов прогрессирования злокачественных опухолей. Наличие асцита увеличивает точность ультрасонографи-ческой диагностики канцероматоза. Однако прогностические факторы, связанные с злокачественным асцитом при раке яичников, изучены недостаточно. Среди клинических параметров наибольшую про-гностическую информацию несет количество асцитической жидкости - малоасцитные раки обладают более благоприятным лечебным прогнозом и взаимосвязаны с рядом иммунологических особенностей, позволяющих вынести их в отдельную подгруппу. Асцитическая жидкость является легкодоступным и ценным источником клеточного и внеклеточного компонентов, задействованных в овариальном кан-церогенезе. Среди растворимых высоко- и низкомолекулярных компонентов асцита ведется активный поиск дополнительных прогностических и предикторных факторов, позволяющих уточнить молекуляр-ный фенотип рака и персонифицировать лечение больных РЯ.
Асцит, рак яичников, визуализация, компоненты асцита, прогноз, патогенез, мезотелиальные клетки, перитонеальный канцерогенез, ультразвуковое исследование, иммуноцитохимия
Короткий адрес: https://sciup.org/140254235
IDR: 140254235 | УДК: 618.11-006.6-07:616.381-003.217:577.21 | DOI: 10.21294/1814-4861-2019-18-1-116-123
Текст обзорной статьи Асцит как предмет исследований при раке яичников
Актуальность изучения рака яичников (РЯ) обусловлена большим количеством нерешенных вопросов, связанных с поздней диагностикой, сложностями в выборе тактики лечения, высокой долей рецидивов, и в конечном итоге низкими по‑ казателями эффективности лечения и высокими показателями летальности. Клиническое течение РЯ различно даже в пределах морфологически однородной группы пациентов в связи с высокой степенью гетерогенности опухоли. Остаются нере‑ шенными вопросы о том, насколько широк спектр молекулярно‑генетических маркеров и какова корреляция между их уровнем и эффективностью лечения РЯ. Обсуждается возможность создания алгоритма противоопухолевой терапии на осно‑ вании результатов исследования. Поиск маркеров эффективности лечения не должен ограничиваться исследованием лишь тканевых маркеров. Одним из перспективных путей получения информации о ха‑ рактере опухолевого процесса при РЯ может быть исследование асцитической жидкости (АЖ).
Патогенетические аспекты асцита.Классификации асцита
Перитонеальная мембрана покрывает висце‑ ральные органы, а также абдоминальную и тазовую области и состоит из 5 слоёв (рис. 1). Первый слой состоит из эндотелиальных клеток, которые высти‑ лают внутрисосудистое пространство капилляров. Эти клетки имеют экстраклеточный (внеклеточ‑ ный) гликокаликс и фиксированный анионный заряд, который затрудняет прохождение крупных молекул белков плазмы крови, например альбу‑ мина, через стенки капилляров. Внутриклеточные поры обеспечивают внутриклеточный транспорт через этот слой. Второй слой представлен базаль‑ ной мембраной. Интерстициальное пространство (третий слой), которое содержит фибробласты, коллаген и гиалуроновую кислоту, может блоки‑ ровать диффузию макромолекул до субмезотели‑ альной базальной мембраны (четвертый слой). Заключительный слой состоит из мезотелиальных клеток. Связываясь плотными соединениями и секретируя поверхностные гликозаминогликаны в абдоминальное пространство, мезотелиальные клетки предоставляют эффективную антиадге‑ зивную поверхность и защитный барьер против физического повреждения. В физиологических условиях разница в онкотическом давлении через перитонеальную мембрану (высокое в эндоте‑ лиальном слое и низкое в мезотелиальном слое) ограничивает капиллярную фильтрацию жидкости и предотвращает отек, который возникает из‑за реабсорбции воды в капилляры из интерстициаль‑ ного пространства [6].
Механизм образования асцита при перитоне‑ альном канцероматозе сложен и в значительной
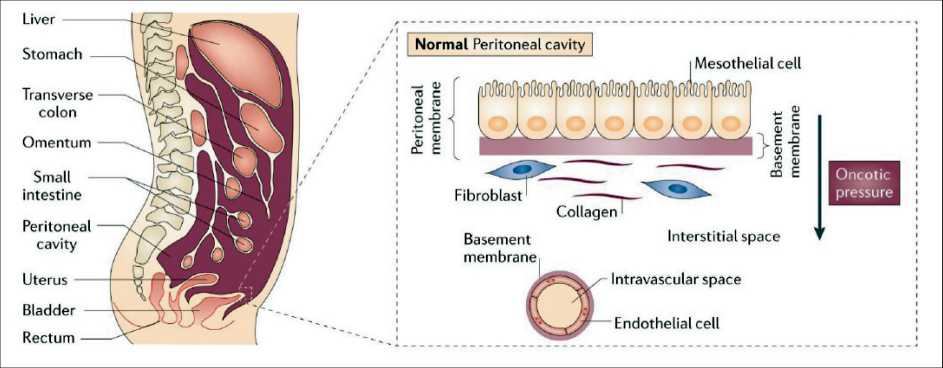
Рис. 1. Строение перитонеальной мембраны [6]
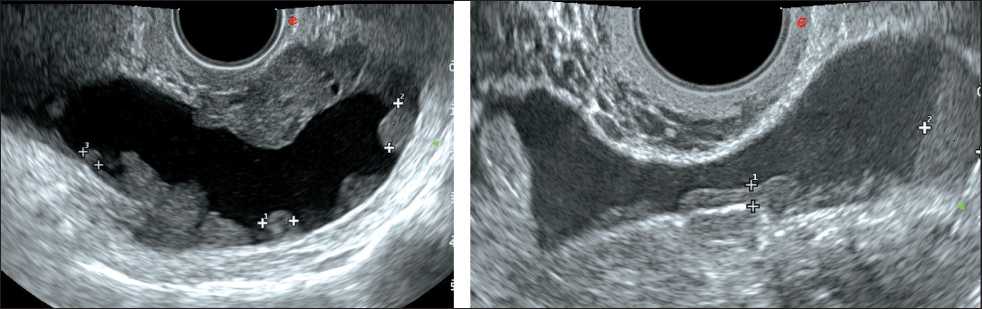
Рис. 2. УЗИ малого таза. Канцероматоз брюшины на фоне асцита, визуализируются участки канцероматоза брюшины в виде узлов солидного строения размерами от 5 мм до 26 мм [17]
степени обусловлен сочетанием повышенного поступления жидкости в брюшную полость и сни‑ жением ее оттока [6, 7]. У больных с абдоминаль‑ ными опухолями площадь поперечного сечения микрососудов, выстилающих брюшную полость, увеличивается, и это приводит к повышенной фильтрации жидкости. Вдобавок, злокачествен‑ ный асцит имеет высокую концентрацию белка, который вторичен по отношению к повышенной проницаемости капилляров [7]. Гиперпродукция VEGF опухолью обеспечивает повышенную про‑ ницаемость капилляров (выход жидкости, белков, ростовых факторов). Растущая опухоль иницииру‑ ет в брюшной полости провоспалительный ответ, тем самым способствуя прикреплению опухолевых клеток на поверхности брюшины. Нарушение ре‑ абсорбции асцитической жидкости обусловлено и механическим сдавлением путей лимфооттока, увеличением вязкости лимфы, ретроградным током лимфы. Любой из механизмов, включая нарушение лимфатического дренажа [8, 9], из‑ менение проницаемости сосудов [8], уменьшение внутрисосудистого онкотического давления вслед‑ ствие гипоальбуминемии, может быть отягощен изменением концентрации натрия и задержкой жидкости за счет коморбидной патологии печени или хронической сердечной недостаточности.
Некоторые анатомо‑физиологические факторы (внутридиафрагмальное давление, подвижность внутренних органов) обусловливают специфику накопления АЖ по мере развития опухоли.
В клинической практике удобна классификация асцита, предложенная Международным клубом по изучению асцита (International Ascetic Club), по которой выделяют три степени: 1‑я степень – жидкость в брюшной полости определяется только при ультразвуковом исследовании, 2‑я степень про‑ является симметричным увеличением живота, 3‑я степень – напряженный асцит [10]. По количеству жидкости в брюшной полости можно провести несколько иную градацию степени асцита: 1‑я сте‑ пень – не более 3 л, 2‑я степень – более 3 л (4–6 л), 3‑я степень – от 10 до 20 л АЖ [11, 12].
Ультразвуковое исследование позволяет выяв‑ лять субклинический асцит или асцит малого объё‑ ма (АМО) [13]. При эхографии наличие свободной жидкости является вспомогательным фактором для выявления метастазов в брюшной полости, так как создаётся анэхогенное акустическое окно, на фоне которого отчётливо дифференцируются метастатические очаги, схожие по эхогенности с окружающими органами и тканями (рис. 2) [14–16]. Не вызывает трудностей и визуализация метастазов в большой сальник на фоне асцита,
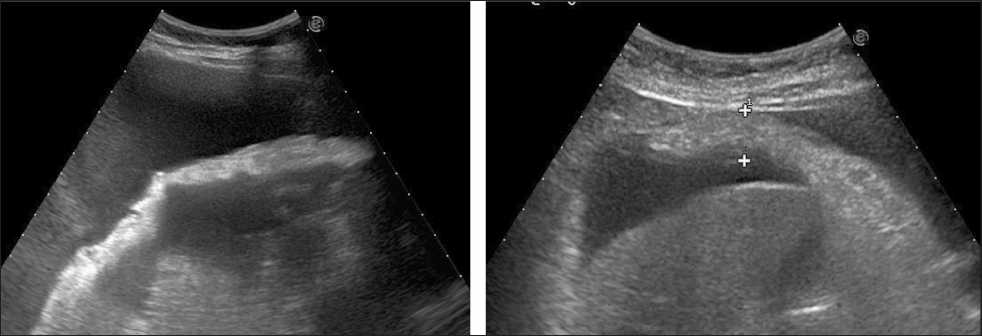
Рис. 3. УЗИ брюшной полости. На фоне асцита определяется утолщенный до 2,5 см гиперэхогенный большой сальник, неоднородной структуры и с бугристыми контурами. Применение оптимизированной методики УЗИ путем сканирования конвексным датчиком в положении пациентки стоя, что вызывает приток свободной жидкости к передней брюшной стенке, метастатически измененный сальник достаточно чётко дифференцируется на фоне асцитической жидкости [17]
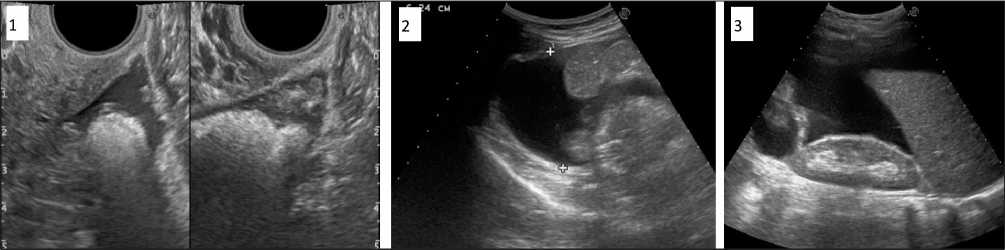
Рис. 4. Эхографическая визуализация асцита различной степени выраженности. 1. Минимальное количество АЖ (100–300 мл), при трансвагинальном УЗИ определяется анэхогенная прослойка свободной жидкости в позадиматочном пространстве (80–100 мл), кпереди от матки, параовариально, между петлями кишечника в нижнем этаже брюшной полости (более 100 мл). 2. Умеренное количество АЖ (300–1000 мл), при трансвагинальном УЗИ – свободная жидкость в тех же анатомических областях, но в большем количестве. При сканировании конвексным датчиком в положении лёжа анэхогенные зоны определяются в боковых каналах брюшной полости и межпетельно. 3. Большое количество АЖ (1000 мл и более), при трансабдоминальном УЗИ конвексным датчиком в положении лёжа – анэхогенная зона достигает передней брюшной стенки, заполняет пространство между париетальной брюшиной, большим сальником и петлями кишечника, подпечёночного пространства [17]
таблица
Результаты клинических и параклинических методов исследования при асците [6]
Методы
Частота
Клиническое обследование
Симптомы
Лучевая диагно‑ стика
Цитологическое исследование
Иммуноцитохи‑ мическое иссле‑ дование
Притупление перкуторного звука, симптом «волны», которые определяются при наличии >1500 мл АЖ.
Чувствительность диагностики – 50–94 %
Анорексия (36 %), тошнота (37 %), вздутие живота (55 %), боли в брюшной полости (53 %), изменение веса (5 %), одышка (11 %), рвота (25 %) и усталость (17 %)
УЗИ позволяет определить асцит объемом от 100 мл жидкости, СКТ и МРТ – от 20 мл АЖ. Методы по‑ зволяют определить распространенность процесса, но не всегда дифференцировать злокачественный и доброкачественный процесс
Стандартная методика для диагностики злокачественного асцита. Позволяет дифференцировать злока‑ чественную, инфекционную и воспалительную природу асцита (чувствительность – 97 %). Клеточный компонент АЖ представлен клетками мезотелия, опухолевыми клетками, клетками гемопоэтического происхождения. Эффективность цитологии выше при первичном раке брюшины
Методика важна для определения локализации опухоли: СА–125 – экспрессируется при РЯ. Также при ИГХ определяют и другие маркеры: рецепторы эстрогена, цитокератин 7, цитокератин 20, рецепторы прогестерона, калретинин, раковоэмбриональный антиген, белок опухоли Вильмса (WT1), GCDFP‑15 (gross cystic disease fluid protein) и TTF 1 (thyroid transcription factor 1)
играющего роль акустического окна (рис. 3). При минимальном количестве АЖ или ее отсутствии особые трудности связаны с выявлением мета‑ стазов размерами до 8–15 мм в брюшной полости. Эхографическая визуализация асцита различной выраженности представлена на рис. 4.
Исследование белка позволяет дифферен‑ цировать транссудат и экссудат: в транссудате содержание белка менее 25 г/л (цирроз печени, гипоальбуминемия), в экссудате – более 30 г/л (малигнизация, воспаление). Общепринятым для дифференциальной диагностики является подсчет градиента «сывороточный альбумин/альбумин асцитической жидкости» (SAAG), который по‑ зволяет предположить причину развития асцита, а также прогнозировать риск инфицирования АЖ. Важным показателем является клеточный состав асцитической жидкости и цитологическое иссле‑ дование, направленное на выявление атипичных клеток (таблица).
Перитонеальная диссеминация и асцит при раке яичников, прогностическое значение Перитонеальная диссеминация является од‑ ним из наиболее неблагоприятных факторов прогрессирования злокачественных опухолей. Однако прогностические факторы, связанные со злокачественным асцитом, изучены недостаточ‑ но. По мнению ряда авторов, наличие асцита в сочетании с отеками, низким уровнем белка в сыворотке крови, метастатическим поражением пе‑ чени отражает наиболее неблагоприятное течение злокачественного процесса [18, 19]. Хотя данные параметры сами по себе могут свидетельствовать о большей запущенности заболевания и снижении компенсаторных резервов, имеются данные, под‑ тверждающие независимое значение каждого из указанных параметров для прогноза, а также важ‑ ное предиктивное значение концентрации белка в АЖ [19, 20].
Частота перитонеальной диссеминации при первичном РЯ с учетом поздней диагностики достигает высоких значений и сопоставима с долей диагностирования запущенных форм, что, собственно, и отражается на эффективности хи‑ рургического и химиотерапевтического лечения. Однако многие исследователи утверждают, что наличие асцита при РЯ носит не столь фатальный характер в отношении показателей выживаемости, в сравнении с асцитными формами карцином дру‑ гих локализаций [19, 20], что, вероятно, связано с различиями в молекулярно‑генетических харак‑ теристиках и спектрах чувствительности к хи‑ миотерапевтическим агентам опухолей различных локализаций. Так или иначе, наличие асцита при РЯ может указывать на наличие злокачественных клеток в брюшной полости и является серьезным прогностическим признаком [21, 22].
Степень выраженности канцероматоза при РЯ напрямую взаимосвязана с запущенностью заболе‑ вания и продукцией асцитической жидкости [23]. Подтверждена взаимосвязь между стадией РЯ и объемом асцитической жидкости [23]. По данным N. Lazarov et al., частота выявления злокачествен‑ ного асцита при РЯ Iа стадии составляет 29 %, при РЯ Iс стадии достигает 59 % [24]. Возраст, стадия, степень дифференцировки опухоли и цитология являются важными прогностическими маркерами раннего РЯ и высокого риска рецидивирования [25]. В 2013 г. в когортном исследовании (n=215) получены важные результаты по выживаемости больных ранним РЯ, свидетельствующие, что нали‑ чие асцитической жидкости и её количество играют меньшее прогностическое значение, чем выявление опухолевых клеток в АЖ. Так, 78 % больных ран‑ ним РЯ с позитивной перитонеальной цитологией умерли в течение 12 лет, что было значимо выше, чем в группе больных с негативной цитологией, – 21 % (р=0,0027), 5‑летняя выживаемость больных в группе с позитивной цитологией была значительно хуже, чем с негативной, – 79 и 33,3 % соответствен‑ но (р=0,0059) [24]. Поэтому оправдана концепция, что локализованной формой РЯ может быть названа лишь Iа стадия с ограничением процесса в преде‑ лах одного яичника, без поражения капсулы и при условии отсутствия опухолевых клеток в АЖ или перитонеальных смывах [26].
Подобные данные подтверждают ценность цитологического исследования жидкости и взятие смывов с брюшины в рамках выполнения хирур‑ гического стадирования. Прогноз пациенток с РЯ ранней стадии при несоблюдении указанных принципов и игнорировании данных цитологии становится намного более неблагоприятным, по‑ скольку может повлечь неправильную лечебную тактику [27].
По некоторым данным, объем асцита сам по себе имеет прогностическое значение у больных с серозными низкодифференцированными карци‑ номами яичников. Подобный вывод был сделан на основании сравнения молекулярных характе‑ ристик АЖ у больных диссеминированным раком яичников с асцитом менее 200 мл и более 1000 мл. Наиболее убедительные результаты касались экс‑ прессии генов иммунного ответа и уровня инфиль‑ трации опухоли иммунными клетками: у больных с меньшим объемом АЖ наблюдалось увеличение данных параметров. В группе из 149 больных было также показано, что при асците небольшого объема получены лучшие хирургические результа‑ ты и более длительная общая выживаемость. Эти данные позволили авторам выделить пациенток с диссеминированными High‑grade карциномами яичников и небольшим количеством асцита в прогностически более благоприятную субгруппу карцином, ассоциированную с up‑регуляцией им‑ мунных параметров [28].
Выводы о прогностическом значении объема асцитической жидкости при РЯ касаются имен‑ но диссеминированного High‑grade серозного овариального рака. Исследование, проведенное T. Feigenberg et al., с рассмотрением сопоставимых по распространенности клинических случаев, предполагает оценку объема асцита не с позиций этапности опухолевой прогрессии, а в качестве рандомизирующего параметра клинического уров‑ ня, позволяющего выделить уникальную по своим иммунологическим характеристикам субгруппу малоасцитных овариальных карцином с более благоприятным клиническим прогнозом [28].
Компоненты асцитической жидкости при раке яичников
Все больше внимания уделяется не только позитивной перитонеальной цитологии, но и ха‑ рактеристике компонентов асцита [29]. В модели поведения опухоли при её диссеминации асциту придается большее значение. Опухолевые клетки в асците присутствуют либо как отдельные клетки, либо, чаще, как агрегаты клеток, обозначаемые как «сфероиды» [30, 31]: существующий сценарий со‑ бытий интраперитонеальной диссеминации при РЯ заключается в непосредственном распространении опухоли дистально от первичного очага, вовлекаю‑ щем ряд процессов, в том числе клеточную проли‑ ферацию, эпителиально‑мезенхимальный переход (EMT), результатом которого является миграция опухолевых клеток, и, наоборот, мезенхимально‑ эпителиальный переход (MET), обеспечивающий колонизацию опухолевых клеток с формированием перитонеальных имплантов [32–34]. Для перито‑ неальной диссеминации РЯ также имеют значение спонтанные и ятрогенные разрывы капсулы опухо‑ ли. Формирование «сфероидов», представленных комплексами опухолевых клеток, приобретших путем ЕМТ способность к миграции и путем МЕТ способность к редифференцировке и восстановле‑ нию тканевой структуры, в итоге приводит к фор‑ мированию имплантов на поверхности соседних органов, а на более поздних стадиях и метастазов
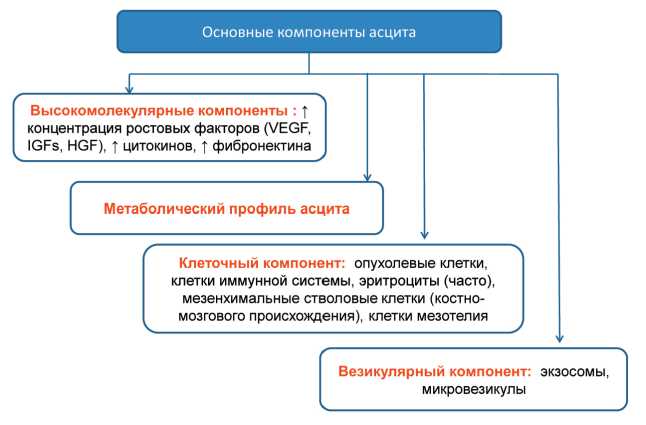
Рис. 5. Основные типичные компоненты асцита при РЯ
в отдаленные органы [35]. При этом злокаче‑ ственный асцит представляет собой уникальное микроокружение опухоли, обеспечивающее фи‑ зический субстрат для накопления клеточного и бесклеточного компонентов (рис. 5).
На основании морфологического анализа по‑ казано, что из асцита можно выделить два раз‑ личных типа клеток: клетки мезенхимального и эпителиального происхождения. Обе клеточные популяции по своим характеристикам напомина‑ ют стволовые/прогениторные клетки с высоким регенераторным/пролиферативным потенциалом, экспрессирующие типичные маркеры опухолевых стволовых клеток, включая CD44high, CD24low и AC133+. Эти клетки также характеризуются высо‑ ким уровнем экспрессии генов, связанных с онко‑ генезом и метастазированием, в том числе BMP‑2, BMP4, TGF‑β, EGFR и integrin α 2β1 [36].
Клеточный компонент асцита можно также под‑ разделить на «резидентные клетки», такие как опу‑ холевые и опухоль‑ассоциированные фибробласты, или стромальные клетки и «нерезидентные клетки», такие как иммунные и мезенхимальные стволовые клетки. Каждая популяция клеток имеет опреде‑ ленную роль и связана друг с другом посредством сигнализации с помощью «внутренних» раство‑ римых факторов [37]. Процессы ауто/паракринной коммуникации и реципрокных отношений между компонентами стромального опухолевого микро‑ окружения, опухолевыми стволовыми клетками и растущими опухолевыми очагами индуцируют стромальный провоспалительный ответ, сопрово‑ ждающийся образованием различных аутокринных и паракринных молекул (факторов роста, цитоки‑
Список литературы Асцит как предмет исследований при раке яичников
- Runyon B.A. Care of patients with ascites. N Engl J Med. 1994 Feb 3; 330 (5): 337-42. DOI: 10.1056/NEJM199402033300508
- Runyon B.A., Hoefs J.C., Morgan T.R. Ascitic fluid analysis in malignancy-related ascites. Hepatology. 1988; 8: 1104-1109.
- Jehn C.F., Küpferling S., Oskay-Özcelik G., Lüftner D. A survey of treatment approaches of malignant ascites in Germany and Austria. Support Care Cancer. 2015 Jul; 23 (7): 2073-8. DOI: 10.1007/s00520-014-2557-9
- Parsons S.L., Lang M.W., Steele R.J. Malignant ascites: a 2-year review from a teaching hospital. Eur. J. Surg. Oncol. 1996; 22: 237-239.
- Smolle E., Taucher V., Haybaeck J. Malignant Ascites in Ovarian Cancer and the Role of Targeted Therapeutics. Anticancer Res. 2014 Apr; 34 (4): 1553-61.


