Асцитная опухоль яичников у крыс - адекватная доклиническая модель канцероматоза для изучения интраперитонеального химиоперфузионного лечения
Автор: Киреева Галина Сергеевна, Беляева Олеся Александровна, Сенчик Константин Юрьевич, Беспалов Владимир Григорьевич, Стуков Александр Николаевич, Губарева Екатерина Александровна, Майдин Михаил Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Введение. Изучение механизмов, лежащих в основе эффектов интраперитонеальной химиоперфу-зии, а также разработка оптимальных режимов и методик химиоперфузии требуют животной модели перитонеального канцероматоза, близкой по своим характеристикам к картине перитонеального канцероматоза у человека. В связи с этим авторами данного исследования была описана, охаракте-ризована и апробирована модель перитонеального канцероматоза у крыс с асцитной опухолью яич-ников, предназначенная для изучения интраперитонеальной химиоперфузии. материал и методы. Были сформированы 3 группы крыс с асцитной опухолью яичника: 1 - контроль (без лечения), n=15; 2 - нормотермическая интраперитонеальная химиоперфузия с цисплатином, 40 мг/кг, n=12; 3 - гипер-термическая интраперитонеальная химиоперфузия с цисплатином, 20 мг/кг, n=14. Все животные под-вергались эвтаназии с последующей аутопсией при достижении критериев эвтаназии, установленных в протоколе исследования. Результаты. Прививаемость асцитной опухоли яичников составила 100 %. Медиана общей выживаемости крыс контрольной группы составила 9,5 дней. На вскрытии у всех крыс данной группы регистрировали асцит, а у крыс, проживших 15-17 дней, регистрировали опухолевые узлы белого цвета размерами 1-3 мм в наибольшем измерении в большом сальнике, брыжейке кишеч-ника, на париетальной и висцеральной брюшине, гистологически верифицированные как метастазы низкодифференцированной опухоли яичника. У двух и пяти крыс в группах 2 и 3 соответственно ре-гистрировались метастазы опухоли яичников в паратрахеальных лимфатических узлах и опухолевый гидроторакс при отсутствии признаков перитонеального канцероматоза. Медиана общей выживаемости крыс в группах 2 и 3 составила 37,5 и 25,5 дней (р=0,256) соответственно, что было достоверно выше по сравнению с контрольной группой. заключение. По результатам экспериментов in vivo локализация асцитной опухоли яичников, 100 % прививаемость штамма, быстрое развитие асцита и опухолевое поражение брюшной полости делают асцитную опухоль яичников у крыс адекватной доклинической моделью перитонеального канцероматоза для изучения интраперитонеального химиоперфузионного лечения. Причины и механизмы развития опухолевого гидроторакса после проведения интраперито-неальной химиоперфузии на данной модели подлежат дальнейшему изучению.
Асцитная опухоль яичников, перитонеальный канцероматоз, интраперитонеальная химиоперфузия, доклиническая модель, цисплатин, крысы, выживаемость
Короткий адрес: https://sciup.org/140254244
IDR: 140254244 | УДК: 618.11-006-08:615.28-092.9 | DOI: 10.21294/1814-4861-2019-18-1-71-78
Текст научной статьи Асцитная опухоль яичников у крыс - адекватная доклиническая модель канцероматоза для изучения интраперитонеального химиоперфузионного лечения
Сложившаяся ситуация серьезно осложняет ши‑ рокое внедрение химиоперфузионных технологий в клиническую практику, несмотря на их очевидный лечебный потенциал. Отсутствие полноценных до‑ клинических исследований ИПХП привело к тому, что фундаментальные основы химиоперфузионного лечения злокачественных опухолей до сих пор мало изучены. С практической точки зрения это обусловливает большой разброс в режимах (темпе‑ ратура, лекарственный препарат и его доза, время) и методиках выполнения внутрибрюшинной хи‑ миоперфузии в разных центрах, а также различные протоколы периоперационного ведения больных, у которых выполняется химиоперфузия, поскольку не доказано преимущества ни одной из методик [7].
Изучение химиоперфузии как метода лечения с точки зрения изменений, происходящих в ор‑ ганизме во время и после ИПХП, и их влияния на исход лечения перитонеального канцерома‑ тоза, особенностей фармако‑ и токсикокинетики различных противоопухолевых препаратов при химиоперфузионном введении, а также поиск оптимальных режимов внутрибрюшинной хи‑ миоперфузии требуют адекватной доклинической модели перитонеального канцероматоза. В данной статье авторы описывают модель перитонеаль‑ ного канцероматоза у крыс с асцитной опухолью яичников и обосновывают рациональность ее ис‑ пользования для изучения интраперитонеальной химиоперфузии.
Материал и методы
Исследование было проведено в соответствии с этическими принципами, установленными Ев‑ ропейской конвенцией по защите позвоночных животных, использующихся в экспериментальных и прочих научных целях (Страсбург, 1986). Была использована 41 крыса‑самка Вистар (Питомник лабораторных животных «Рапполово»).
Поскольку выполнение интраперитонеальной химиоперфузии на мышах – крайне трудоемкая и не вполне оправданная задача из‑за малых разме‑ ров этих животных, необходимо было подобрать крысиную опухоль, которая бы приводила к раз‑ витию перитонеального канцероматоза. Нами была выбрана асцитная опухоль яичников крыс (банк опухолевых штаммов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России), которая по своему описанию могла быть использована для достижения поставленной цели. Данная опухоль была получена Е.Е. Погосянц, Е.Л. Пригожиной и И.Л. Еголиной в 1958 г. от одной из крыс Вистар, матери которых получали во время беременности и лактации большие дозы 7,12‑диметилбенз[α] антрацена. Опухоль характеризовалась обшир‑ ным метастазированием по брюшине и в саль‑ ник, которое сопровождалось развитием асцита. Гистологически опухоль являлась папиллярной аденокарциномой, а метастазы имели строение аденокарциномы. Продолжительность жизни жи‑ вотных после перевивки составляла 25–35 дней [8]. Отметим, что данная опухоль яичников использо‑ валась другими авторами в экспериментальных исследованиях по различной тематике [9–11], но никогда ранее не рассматривалась как модель для изучения интраперитонеальной химиотерапии.
Для моделирования перитонеального канце‑ роматоза осуществляли внутрибрюшинную (в/б) перевивку опухоли яичников. После предвари‑ тельного пассажа на 7‑й день после в/б перевивки опухоли яичников от одной крысы забирали асцит, который перевивали здоровым крысам в/б. Асци‑ тическую жидкость, содержащую необходимое для развития перитонеального карциноматоза число опухолевых клеток, получали следующим образом: у крысы‑опухоленосителя отбирали асцитическую жидкость, затем готовили разведение асцита в соотношении 1:4 – к 1 мл асцита добавляли 3 мл 0,9 % физиологического раствора (разведение 1). Разведение 1 использовали для перевивки здо‑ ровым крысам. Подсчет опухолевых клеток про‑ водили в камере Горяева, для чего использовали разведение 2 (0,2 мл разведения 1 + 3,8 мл 0,3 % уксусной кислоты). Для окончательного расчета использовали формулы:
А × 2 × 100 = Б, Б × 1000 = n×107 в 0,5 мл, где А – сосчитанное в камере Горяева число опу‑ холевых клеток, Б – число опухолевых клеток в 1 мкл (мм3).
Для того чтобы у крыс развивался перитоне‑ альный карциноматоз, необходимо было вводить внутрибрюшинно 1×107 клеток опухоли яичников в 0,5 мл разведенного асцита (разведение 1). По‑ скольку асцитическая жидкость, взятая у разных крыс, отличалась по количеству опухолевых кле‑ ток, при каждой перевивке производили пересчет объема разведения 1, но число вводимых опухоле‑ вых клеток (1×107) оставалось постоянным.
Для макро‑ и микроскопической характери‑ стики разработанной модели перитонеального карциноматоза опухоль яичников была перевита 15 крысам (группа 1 – контрольная). При дости‑ жении критериев эвтаназии (полная анорексия в течение 24 ч, признаки кахексии, слабость/невоз‑ можность получения корма или воды) животные подвергались эвтаназии углекислым газом. Для цитологического исследования на 7‑й день по‑ сле перевивки опухоли у всех крыс контрольной группы забиралась асцитическая жидкость, из которой делали мазок и подвергали стандартной цитологической обработке с окраской гематокси‑ лином и водно‑спиртовым раствором эозина. Для гистологического исследования образцы внутри‑ брюшинных опухолевых узлов отбирались при аутопсии после эвтаназии.
Наряду с контрольной группой были сфор‑ мированы 2 группы крыс с опухолью яичников, в которых выполнялись интраперитонеальные химиоперфузии: группа 2 – нормотермическая ин‑ траперитонельная химиоперфузия с цисплатином, 40 мг/кг (n=12); группа 3 – гипертермическая ин‑ траперитонельная химиоперфузия с цисплатином, 20 мг/кг (n=14). Химиоперфузия проводилась на второй день после перевивки опухоли яичников по методике, описанной ранее [12]. После лече‑ ния животные находились под наблюдением и при достижении критериев эвтаназии, описанных выше, подвергались эвтаназии углекислым газом с последующей аутопсией. Продолжительность жизни животных рассчитывалась как время от дня перевивки до дня эвтаназии.
Результаты
Макро- и микроскопическая характеристика модели перитонеального канцероматоза (группа 1, контрольная)
Прививаемость асцитной опухоли яичников составила 100 %. Опухоль быстро прогресси‑ ровала, приводя к развитию перитонеального карциноматоза, асцита (рис. 1, 2) и гибели крыс на 9–17‑й дни после перевивки. На вскрытии ре‑ гистрировали опухолевый асцит (от умеренного до выраженного), который в 90 % случаев был
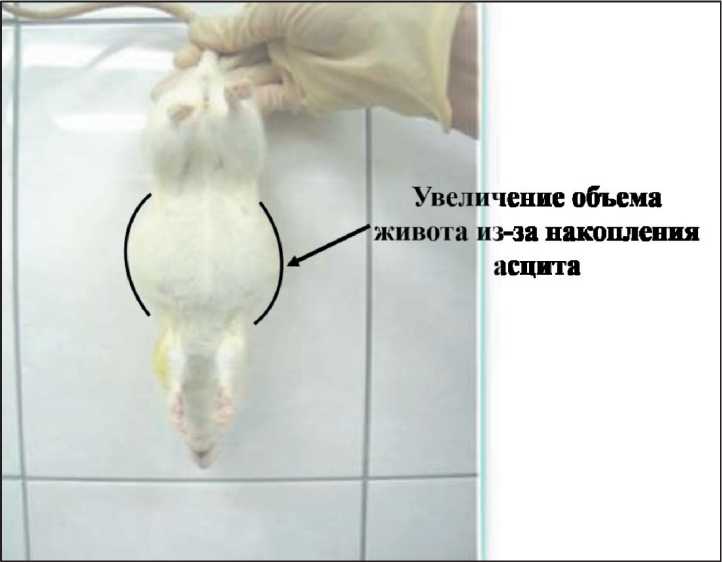
Рис. 1. Макроскопическая картина асцита у крысы после перевивки опухоли яичника
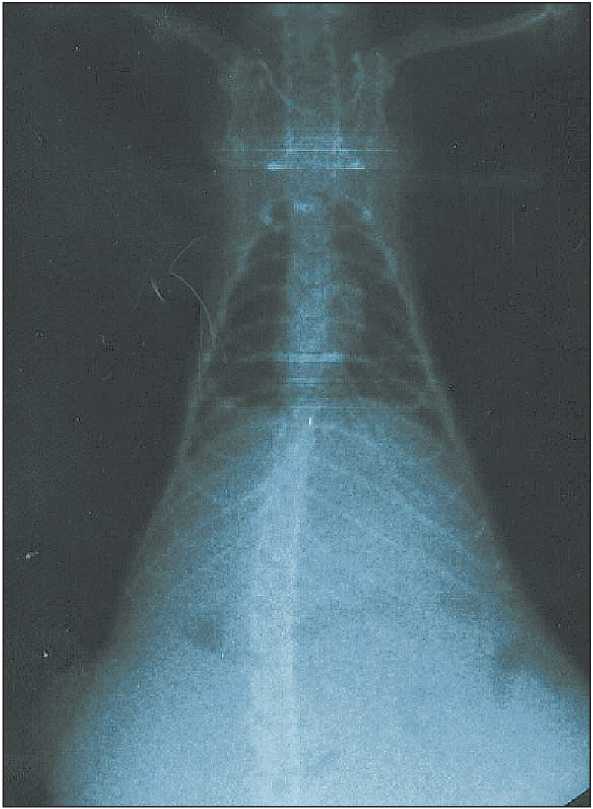
Рис. 2. Рентгеновский снимок. Асцит у крысы с опухолью яичника. Светлая область на снимке – асцитическая жидкость
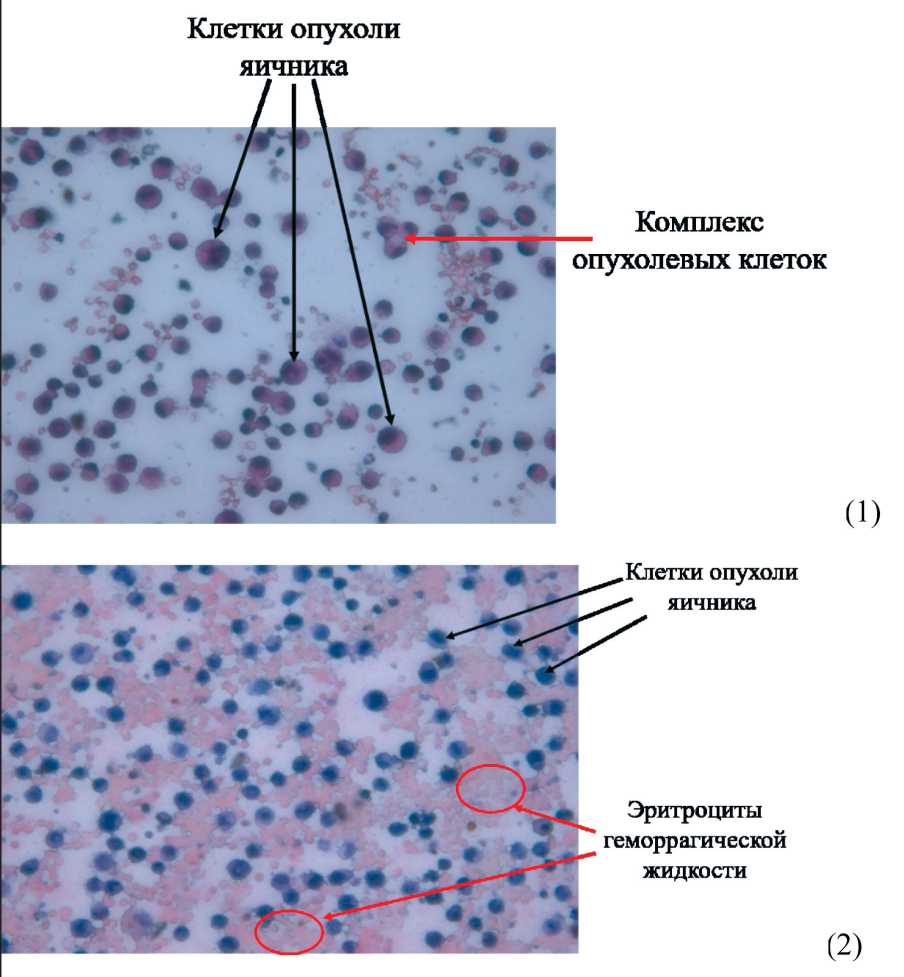
Рис. 3. Микрофото. Цитологический препарат. Клетки низкодифференцированной опухоли яичника в асцитической (1) и геморрагической асцитической (2) жидкости. Окраска гематоксилином и эозином, ×400
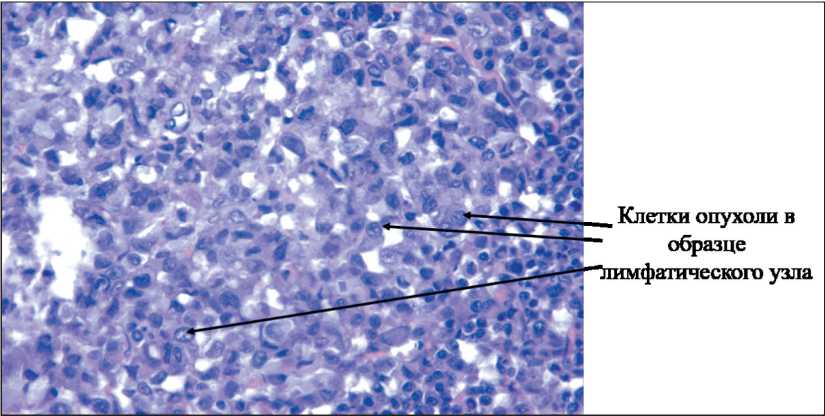
Рис. 4. Микрофото. Гистологический препарат. Метастазы низкодифференцированной опухоли яичника в мезентериальный лимфатический узел. Окраска гематоксилином и эозином, ×400
геморрагическим. У крыс, проживших 15–17 дней, отмечали опухолевые узлы белого цвета, размера‑ ми 1-3 мм в наибольшем измерении, в большом сальнике, брыжейке кишечника, на париетальной и висцеральной брюшине.
При цитологическом исследовании мазков асцитической жидкости опухолевые клетки в асците представлялись крупными, гиперхромны‑ ми, округлыми, с крупным оптически плотным ядром и резко базофильной цитоплазмой (рис. 3). Количество вакуолей в цитоплазме варьировало в разных клетках, а на поверхности цитоплазмы крупных клеток имелись базофильные выступы. В некоторых участках опухолевые клетки асци‑ тической жидкости образовывали комплексы из 2–5 клеток, что является характерным для адено‑ карцином. С учетом происхождения опухоль явля‑ ется низкодифференцированным эпителиальным раком яичников. Гистологическое исследование карциноматозных узлов, взятых из париетальной брюшины, и пораженных мезентериальных лимфа‑ тических узлов (рис. 4) позволило диагностировать метастазы опухоли яичников.
Результаты интраперитонеальной химиоперфузии на модели перитонеального канцероматоза у крыс с асцитной опухолью яичников
Медиана общей выживаемости крыс с опухолью яичников в контрольной группе составила 9,5 дней, тогда как выполнение нормо‑ и гипертермической интраперитонеальной химиоперфузии с цисплати‑ ном существенно увеличивало значение данного показателя до 37,5 и 25,5 дней соответственно (табл. 1). Значимых различий в выживаемости крыс с асцитной опухолью яичников, у которых выполнялись нормо‑ и гипертермическая интра‑ перитонеальные химиоперфузии, не было.
По результатам аутопсии в контрольной группе распространение опухолевого процесса в пределах брюшной полости регистрировалось у 15 (100 %) крыс. В группах 2 и 3 распространение опухоле‑ вого процесса в пределах брюшной полости реги‑ стрировалось не у всех животных (табл. 2), а только у 10 (83 %) крыс, получавших нормотермическую интраперитонеальную химиоперфузию с циспла‑ тином (группа 2) и у 8 (57 %) крыс, получавших таблица 1
выживаемость крыс с асцитной опухолью яичников в исследуемых группах
|
Группа |
Число крыс |
Медиана общей выживаемости, дни |
95 % ДИ для медианы общей выживаемости, дни |
p |
|
1. Контроль |
15 |
9,5 |
8–23 |
– |
|
2. Нормотермическая интраперитонеальная химиоперфузия с цисплатином |
12 |
37,5 |
20–58 |
>0,0011 |
|
3. Гипертермическая интраперитонеальная |
14 |
25,5 |
13–62 |
0,0031 |
|
химиоперфузия с цисплатином |
0,2562 |
таблица 2
Результаты аутопсии крыс с опухолью яичника, у которых выполнялось внутрибрюшинное химиоперфузионное лечение
|
Группа |
Число крыс |
Перитонеальный канцероматоз |
Опухолевый гидроторакс |
Канцероматоз + гидроторакс |
|
1. Контроль |
15 |
15 (100 %) |
‑ |
‑ |
|
2. Нормотермическая интраперитоне‑ альная химиоперфузия с цисплатином |
12 |
10 (83 %) |
2 (17 %) |
‑ |
|
3. Гипертермическая интраперитоне‑ альная химиоперфузия с цисплатином |
14 |
8 (57 %) |
5 (36 %) |
1 (7 %) |
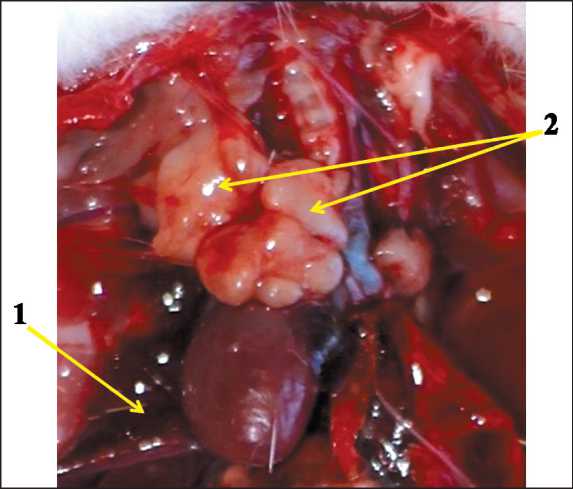
Рис. 5. Геморрагический гидроторакс (1) и метастатическое распространение опухоли яичника в паратрахеальные лимфатические узлы (2)
У 2 (группа 2) и 5 (группа 3) животных соот‑ ветственно развилась выраженная дыхательная недостаточность, вызванная развитием опухо‑ левого гидроторакса, при отсутствии признаков опухолевого поражения брюшной полости. В плевральной полости у этих животных скапливался геморрагический экссудат (5–8 мл), на месте пара‑ трахеальных и медиастинальных лимфатических узлов находились метастатические узлы бело‑ розового цвета 5-8 мм в наибольшем измерении (рис. 5). У одной крысы в группе 3 на аутопсии было отмечено опухолевое поражение брюшной и грудной полостей.
Обсуждение
Экспериментальная модель перитонеального канцероматоза у крыс с асцитной опухолью яич‑ ников является воспроизводимой и адекватной для изучения интраперитонеальной химиоперфузии и имеет ряд преимуществ перед существующими ксенографтными моделями местнораспростра‑ ненного рака яичников (РЯ). В настоящее время животных моделей, которые бы воспроизводили клиническую картину РЯ человека, очень мало.
Большинство из используемых моделей – это экспериментальные РЯ у мышей [13], которые неудобны для исследования химиоперфузион‑ ного лечения. Более того, наиболее часто в ли‑ тературе встречаются ксенографтные модели, для создания которых линии клеток РЯ человека вводятся иммунодефицитным животным. Самыми распространенными клеточными линиями, исполь‑ зующимися для моделирования рака яичников, являются IGR‑OV1, NIH:OVCAR‑3 и SKOV‑3 [14]. Данные ксенографтные модели не являются идеальными, поскольку нельзя предполагать, что взаимодействия между опухолью и окружающей средой в организме животного будут такие же, как в организме человека. Несмотря на то, что ксенографтные модели человеческой опухоли широко используются для оценки потенциальной эффективности лекарственных препаратов в до‑ клинических исследованиях, их прогностическое значение невелико [15]. Кроме того, большинство ксенографтных моделей отличаются плохой вос‑ производимостью и малым потенциалом для пере‑ вивки in vivo [16].
Использованная нами опухоль яичников с учетом происхождения является низкодифферен‑ цированным эпителиальным раком яичников. Опу‑ холь прививалась в 100 % случаев. Также данный штамм опухоли яичников интересен в отношении локализации и морфологии исходной опухоли. По своей морфологии и течению (характер мета‑ стазирования, накопление асцита) асцитная опу‑ холь яичников весьма близка соответствующим опухолям человека. Легкость, с которой асцитная опухоль яичников перешла при внутрибрюшинной перевивке в асцитную форму, возможно, связана с общей склонностью опухолей яичника, как это хорошо известно из клинической практики, к об‑ разованию асцита с развивающимися в нем опу‑ холевыми клетками.
Установлено, что для данной опухоли характерно метастазирование в паратрахеальные лимфоузлы, что отличает ее от существующих ксенографтных моделей. У нескольких крыс с асцитной опухолью яичников, получавших химиоперфузионное лече‑ ние (нормотермическое или гипертермическое), отмечено развитие опухолевого гидроторакса, который не регистрировался у крыс контрольной группы, очевидно, в силу того, что они погибали от осложнений перитонеального канцероматоза, не доживая до диссеминации опухоли в органах грудной полости. В клинической практике респира‑ торные осложнения комбинации циторедуктивной операции и интраперитонеальной химиоперфузии являются вторыми по частоте после осложнений со стороны желудочно‑кишечного тракта [17]. У па‑ циентов могут развиваться ателектаз, отек легких, пневмония, плевральный выпот и пневмоторакс. A.E. Canda et al. проанализировали осложнения 118 интраперитонеальных химиоперфузий, выполнен‑ ных у 115 больных с перитонеальным канцерома‑ тозом, причем почти у половины из них (44,9 %) причиной развития канцероматоза был рак яични‑ ков; плевральный выпот был зарегистрирован у 4 пациентов, пневмоторакс – у одного [18].
Проведение нормо‑ и гипертермической интра‑ перитонеальных химиоперфузий с цисплатином у крыс с асцитной опухолью яичников достоверно увеличивало выживаемость животных по сравне‑ нию с контрольной группой крыс, не получавших лечения, что также подтверждает рациональность использования описанной модели перитонеального канцероматоза для изучения химиоперфузионного лечения.
Список литературы Асцитная опухоль яичников у крыс - адекватная доклиническая модель канцероматоза для изучения интраперитонеального химиоперфузионного лечения
- Morano W.F., Khalili M., Chi D.S., Bowne W.B., Esquivel J. Clinical studies in CRS and HIPEC: Trials, tribulations, and future directions. A systematic review. J Surg Oncol. 2018 Feb; 117 (2): 245-259. DOI: 10.1002/jso.24813
- Sugarbaker P.H. Revised clinical pathway for the management of peritoneal metastases from colorectal cancer using NCCN 2017 guidelines. Colorectal Cancer. 2017. Dec; 6 (3): 75-82. DOI: 10.2217/crc-2017-0016
- Sugarbaker P.H. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in the management of gastrointestinal cancers with peritoneal metastases: Progress toward a new standard of care. Cancer Treat Rev. 2016. Jul; 48: 42-9. DOI: 10.1016/j.ctrv.2016.06.007
- Neuwirth M.G., Alexander H.R., Karakousis G.C. Then and now: cytoreductive surgery with hyperthermic intraperitoneal chemotherapy (HIPEC), a historical perspective. J Gastrointest Oncol. 2016. Feb; 7 (1): 18-28. DOI: 10.3978/j.issn.2078-6891.2015.106
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г. Перитонеальный канцероматоз. Сибирский онкологический журнал. 2014; 5: 45-53. [Stepanov I.V., Paderov Yu.M., Afanasyev S.G. Peritoneal carcinomatosis. Siberian Journal of Oncology. 2014; 5: 45-53. (in Russian)].


