Асцитно-солидная модель рака предстательной железы и ее морфологическая характеристика
Автор: Плотникова Е.А., Морозова Н.Б., Рябова А.В., Трунова Г.В., Хохлова В.А., Лощенов В.Б., Панкратов А.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Подходы, основанные на принципах таргетной терапии и иммунотерапии, рассматриваются как пер-спективное направление для создания новых методов, способных увеличить эффективность лечения больных раком предстательной железы (РПЖ). Цель исследования - получение и характеристика подкожной и асцитно-солидной моделей РПЖ TRAMP-C2 у мышей С57Bl/6j для изучения специфической противоопухолевой активности молекул-кандидатов таргетных лекарственных средств и корректировки стратегий иммунотерапии. материал и методы. Объект исследования - подкожная и асцитная модели рака предстательной железы мыши, полученные с использованием клеток TRAMP-C2. Для исследования тканей опухолей использованы методы гистологического и иммуногистохимического анализов. Результаты. Показана высокая способность клеток TRAMP-C2 к росту in vivo при подкожной и внутрибрюшинной инокуляции мышам С57Bl/6j. Данные опухоли характеризуются высокой воспроизводимостью и уровнем экспрессии PSMA. При гистологическом исследовании показано, что подкожные и канцероматозные опухолевые узлы TRAMP-C2 имеют солидное строение, морфо-логически соответствующее низкодифференцированному образованию, при цитоморфологическом анализе мазков - в перитонеальной жидкости содержится большое количество округлых опухолевых клеток, макрофагов и эритроцитов. заключение. Полученные подкожная и асцитно-солидная модели TRAMP-C2 могут быть полезны для разработки новых способов эффективного лечения РПЖ, в том числе таргетной и иммунотерапии, а также при экспериментальном изучении биотерапевтических воздействий, использующих PSMA в качестве мишени, и фотоиндуцированных эффектов.
Рак предстательной железы, клеточная линия tramp-c2, простатический специфический мембранный антиген, асцитно-солидная модель рака предстательной железы
Короткий адрес: https://sciup.org/140301246
IDR: 140301246 | УДК: 616.65-006.6-085.277.3]-092.9 | DOI: 10.21294/1814-4861-2023-22-4-65-73
Текст научной статьи Асцитно-солидная модель рака предстательной железы и ее морфологическая характеристика
Как в России, так и в мире рак предстательной железы (РПЖ) занимает 5-е место в общей структуре онкологической заболеваемости и 2-е место – в структуре заболеваемости и смертности, обусловленных злокачественными новообразованиями у мужчин [1, 2]. Для лечения РПЖ применяются хирургическое вмешательство [3], гормональная терапия [4], радио- и лучевая терапия [5], а также химиотерапия [6]. Все указанные методы обладают широким спектром побочных эффектов, которые негативно сказываются на состоянии пациентов. С учетом этого актуальной является разработка методов лечения рака предстательной железы с узким спектром неблагоприятных побочных реакций. Такими методами могут быть таргетная терапия и иммунотерапия.
При таргетной терапии лекарственные агенты блокируют сигналы, которые способствуют неконтролируемому росту и размножению малигнизированных клеток; вызывают их гибель путем индукции апоптоза и стимуляции иммунной системы или специфически направляют химиотерапевтические препараты к опухолевым клеткам, минимизируя гибель нормальных клеток и частоту нежелательных эффектов [7].
За последние десять лет иммунотерапия добилась значительного прогресса и в настоящее время является важным компонентом лечения солидных злокачественных опухолей на поздних стадиях [8]. Иммунотерапия направлена на ингибирование опухолевого роста и стимуляцию противоопухолевого иммунного ответа [9, 10]. Недавние открытия, касающиеся активации противоопухолевого иммунитета, привели к развитию иммунотерапии в качестве метода лечения РПЖ, особенно его кастрационно-резистентной формы. Комбинация индивидуальной иммунотерапии и блокаторов контрольных точек иммунитета с традиционными цитотоксическими агентами и терапией, нацеленной на рецепторы андрогенов, должна обеспечить прогресс в этом разделе клинической онкологии [11].
Иммуносупрессивное микроокружение опухоли делает РПЖ сложной мишенью для большинства иммунотерапевтических средств [12], поэтому для изучения механизмов действия иммунопрепаратов и поиска способов повышения их эффективности необходимы экспериментальные модели, которые отражают развитие противоопухолевого иммунного ответа [13]. Таковыми могут стать модели рака предстательной железы мышей, которые будут играть ключевую роль в открытии и разработке новых методов лечения. Их можно разделить на две категории: модели генетически модифицированных мышей и модели ксенотрансплантатов. Ранее [14] были охарактеризованы подкожные ксенотрансплантаты РПЖ человека 22Rv1 и РС-3, которые использовались для изучения эффективности конструкций, нацеленных на простатический специфический мембранный антиген (PSMA). Модели канцероматоза брюшины у мышей как платформа для тестирования, улучшения и/или прогнозирования соответствующих терапевтических вмешательств у пациентов имеют решающее значение для достижения медицинских успехов [15].
Целью исследования явились получение и характеристика солидной и асцитно-солидной моделей РПЖ TRAMP-C2 у мышей линии C57Bl/6j для изучения специфической противоопухолевой активности молекул-кандидатов таргетных лекарственных средств и корректировки стратегий иммунотерапии.
Асцитная модель очень удобна для изоляции иммунокомпетентных клеток в микроокружении опухоли, а также дальнейших манипуляций с ними ex vivo , например, методами конфокальной микроскопии, проточной цитофлуорометрии и другими методами клеточного анализа. Линия клеток аденокарциномы предстательной железы мышей TRAMP-C2 первоначально была получена из предстательной железы трансгенных мышей (TRAMP), у которых спонтанно развился РПЖ, который точно может имитировать развитие болезни у человека [16].
Материал и методы
В работе использовали клеточную линию аденокарциномы предстательной железы человека TRAMP-C2 (ATCC коллекция, США). Клетки культивировали в стандартных условиях (в увлажненной атмосфере при температуре 37 °С и 5 % содержании CO2) во флаконах с площадью поверхности 75 см2 (Costar, США) на среде ДМЕМ (Па-нЭко, Россия) с добавлением 4 mM L-глютамина (ПанЭко, Россия), 0,005 мг/мл бычьего инсулина, 10 нМ дегидроизоандростерона, 5 % эмбриональной телячьей сыворотки (HyClone, США) и 5 % Nu-сыворотки IV (Corning, США).
В работе использовали половозрелых мышей линии С57Bl/6j, самцов, возраст 8–12 нед. Животные получены из ЦКП «SPF-вивария» ИЦиГ СО РАН г. Новосибирска. Все манипуляции с животными проводили в соответствии с национальными и международными стандартами, регламентирующи- ми использование экспериментальных животных в научных целях [17–19].
Для инокуляции животным использовали клетки 6–10 пассажей. Непосредственно перед трансплантацией мышам клетки снимали с флаконов раствором Версена (ПанЭко, Россия), отмывали в среде и готовили клеточную суспензию с концентрацией 3 х 10 6 , 5 х 10 6 и 10 x 10 6 клеток в 0,1 мл среды ДМЕМ для подкожной и с концентрацией 1 x 10 6 , 10 x 10 6 и 50 х 10 6 в 0,5 мл среды ДМЕМ для внутрибрюшинной инокуляции. Клеточный материал при подкожной трансплантации вводили мышам на внешнюю сторону бедра. На этапе подбора количества вводимых клеток экспериментальные группы состояли из 5 мышей, на этапе характеристики – от 5 до 8 животных в группе.
Образцы тканей, полученные при аутопсии животных на 17–20-е сут после подкожной инокуляции клеток и на 28–32-е сут после внутрибрюшинной инокуляции клеток, фиксировали в нейтральном забуференном 10 % формалине и после стандартной гистологической проводки заключали в парафин. Готовили серийные срезы тканей толщиной 4 мкм. Для гистологического анализа срезы окрашивали гематоксилином и эозином. Для выявления экспрессии PSMA использовали поликлональные кроличьи антитела Ab58779 (Abcam, Великобритания) в разведении 1:100. Далее проводили исследование по методике, описанной ранее [20].
Статистическая обработка полученных результатов выполнена с использованием пакета прикладных программ Statistica 8.0 (StatSoft, Inc., США). Для всех количественных данных вычислены групповое среднее арифметическое (М) и стандартная ошибка среднего (m). Для оценки достоверности различий между группами, в зависимости от характера распределения признака в группах, применены t-критерий Стьюдента или U-критерий Манна – Уитни. Различия между группами считались статистически значимыми при р≤0,05.
Результаты и обсуждение
Подкожная модель рака предстательной железы мыши TRAMP-C2
На первом этапе исследовали способность клеток TRAMP-C2 к росту in vivo при подкожной
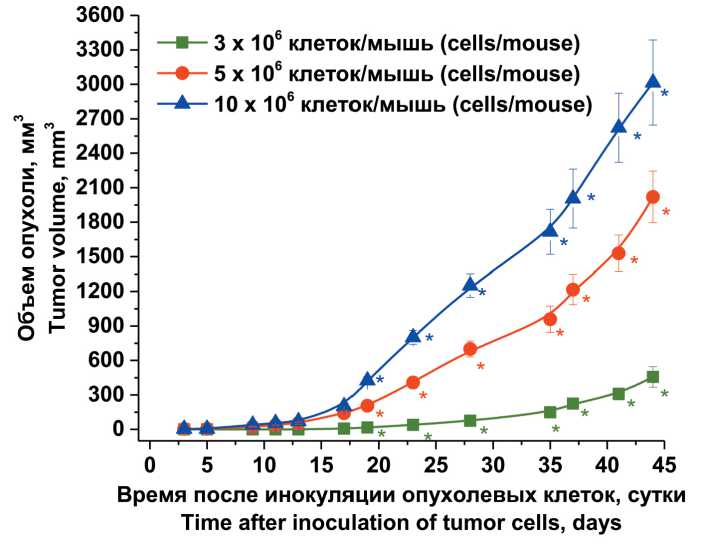
Рис. 1. Динамика роста опухоли TRAMP-C2 после подкожной инокуляции клеток мышам C57Bl/6j в зависимости от прививочной дозы (* – р≤0,05)
Fig. 1. Changes in the TRAMP-C2 tumor growth after subcutaneous cell inoculation in C57Bl/6j mice depending on the inoculation dose (* – р≤0.05)
инокуляции мышам С57Bl/6j на внешнюю поверхность бедра. Оценивали влияние количества инъецированных опухолевых клеток на приви- ваемость, формирование первичного опухолевого узла, динамику его роста и гистологические особенности. Независимо от количества клеток, инъецированных подкожно (3x106, 5x106 и 10x106 клеток/мышь) TRAMP-C2, их прививаемость составила 100 %. По визуальной оценке формирование опухолевого узла начиналось на 3-и сут после инокуляции опухолевых клеток при использовании прививочных доз 5x106 и 10x106 клеток/мышь и на 9-е сут - после инокуляции 3x106 клеток/мышь. Рост опухолевых узлов зависел от прививочной дозы (рис. 1), начиная с 19-х сут объемы опухолевых узлов статистически достоверно отличались между группами (р≤0,05).
На 17-е сут роста опухоли при аутопсии у 3 животных из каждой группы были иссечены опухолевые узлы TRAMP-C2 для морфологического анализа (рис. 2). Результаты проведенного морфологического анализа показали, что к 17-м сут образуется крупный узел, окруженный соединительнотканой капсулой, содержащей умеренное количество воспалительного инфильтрата (рис. 2а, b). Узел образован низкодифференцированными клетками веретеновидной формы, которые формируют тяжи, располагающиеся хаотично.
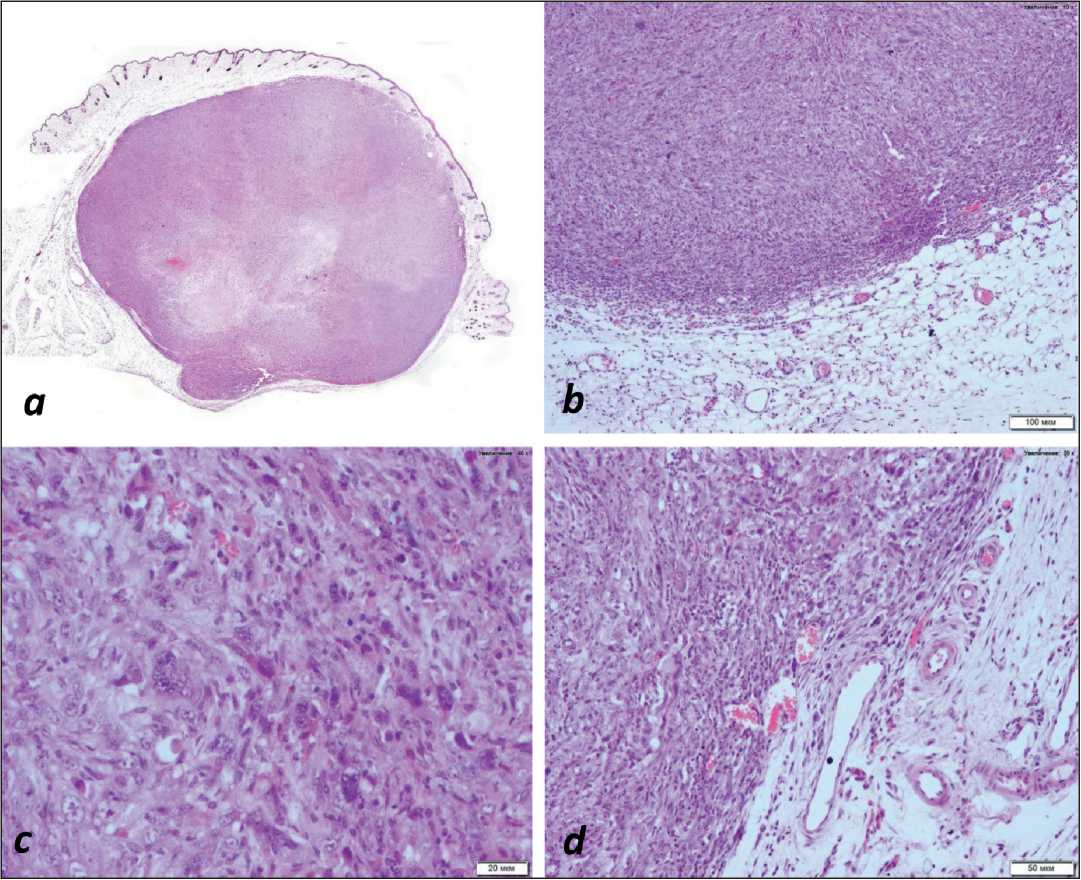
Рис. 2. Гистологическое строение опухолевого узла TRAMP-C2 после подкожной инокуляции 10×106 клеток мышам C57Bl/6j (17-е сут):
а – крупный опухолевый узел, расположенный в подкожной жировой клетчатке, ×40; b – периферическая зона опухоли, капсула узла умеренно инфильтрирована лимфоцитами и макрофагами, ×100; с – паренхима опухоли состоит из низкодифференцированных веретеновидных клеток, образующих разнонаправленные тяжи, ×400; d – периферическая зона узла хорошо васкуляризирована, ×200. Окраска гематоксилином и эозином
Fig. 2. Histological structure of TRAMP-C2 tumor nodule after subcutaneous inoculation of 10×106 cells into C57Bl/6j mice (17 days): a – large tumor nodule located in subcutaneous fatty tissue, ×40; b – peripheral zone of the tumor, the nodule capsule is moderately infiltrated with lymphocytes and macrophages, ×100; c—tumor parenchyma consists of low differentiated spindle-shaped cells forming multidirectional strands, ×400; d—peripheral zone of the nodule is well vascularized, ×200. Hematoxylin and eosin staining
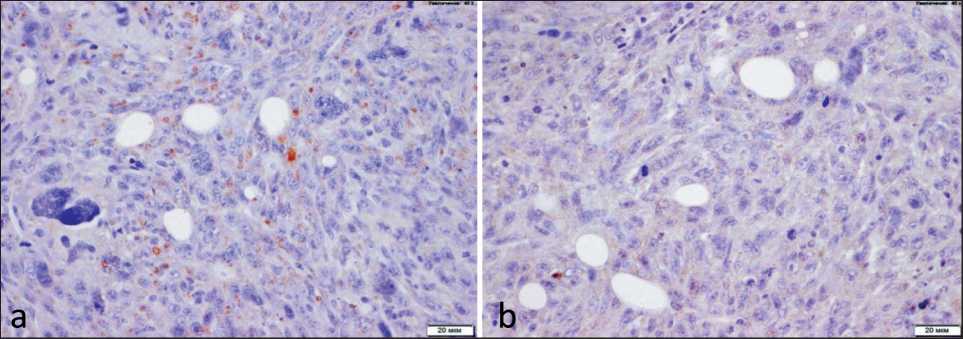
Рис. 3. Экспрессия PSMA в клетках опухоли предстательной железы TRAMP-C2 у мышей C57Bl/6j: а – при окраске кроличьими антителами к PSMA выявляется слабая цитоплазматическая реакция, ×400;
b – окрашивание контрольными неспецифическими иммуноглобулинами кролика, ×400. Докрашивание гематоксилином Fig. 3. PSMA expression in TRAMP-C2 prostate tumor cells of C57Bl/6j mice:
а –weak cytoplasmic reaction is revealed by staining with rabbit antibodies to PSMA; b – staining with control non-specific rabbit immunoglobulins, ×400. Additional staining with hematoxylin
Опухолевые клетки обладают выраженным полиморфизмом: значительно отличаются по размерам, содержат ядра различного размера и формы, встречаются многоядерные клетки (рис. 2с). Ядра клеток содержат 1–3 крупных ядрышка и грубодисперсный хроматин. Цитоплазма клеток развита умеренно, иногда содержит крупные светлые вакуоли. Ядерно-цитоплазматическое соотношение сдвинуто в сторону ядра. Митозы встречаются часто. В центре узла располагается зона некроза, содержащая клеточный детрит, участки разрушенных микрососудов и очаг кровоизлияния. Клетки, гибнущие путем апоптоза, встречаются редко. Тонковолокнистая соединительнотканая опухолевая строма равномерно распределена между клетками и составляет основу тяжей. Периферическая зона узла хорошо васкуляризирована (рис. 2d). Цен-
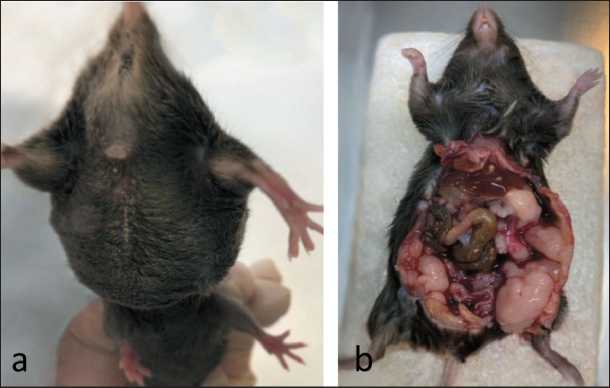
Рис. 4. Фотографии мыши с асцитно-солидной опухолью TRAMP-C2 на 28-е сут после внутрибрюшинной инокуляции; мыши-самцы линии C57Bl/6, прививочная доза 50×106 клеток на мышь: a – перед аутопсией; b – в процессе аутопсии после удаления перитонеальной жидкости
Fig. 4. Photographs of a mouse with TRAMP-C2 ascitic-solid tumor on day 28 after intraperitoneal inoculation; mice, males of the C57Bl/6 line, inoculation dose 50×106 cells per mouse; a – before autopsy, b – during autopsy after removal of peritoneal fluid тральные области содержат заметно меньшее количество профилей щелевидных микрососудов.
При иммуногистохимическом исследовании гистологических срезов опухолевых узлов выявлено специфическое окрашивание антителами к PSMA, локализованное в цитоплазме клеток (рис. 3а, b).
Таким образом, для разработки новых способов эффективного лечения РПЖ на модели солидной опухоли целесообразно использовать аденокарциному предстательной железы TRAMP-C2 в прививочных дозах 5,0 х 10 6 и 10,0 х 10 6 клеток/мышь при подкожной инокуляции на бедро. Культивирование данной клеточной культуры в системе in vitro проводится в стандартных условиях и позволяет нарастить клетки для прививки животным в необходимом количестве.
Асцитно-солидная модель рака предстательной железы мыши TRAMP-C2
На втором этапе исследований оценивали способность клеток TRAMP-C2 к росту in vivo при внутрибрюшинной инокуляции мышам С57Bl/6j. В ходе разработки данной модели оценивали влияние количества инъецированных опухолевых клеток на прививаемость, формирование перитонеальной жидкости, образование вторичных опухолевых узлов, развивающихся в брюшной полости, и цито-и гистологические особенности.
Для внутрибрюшинной инокуляции мышам использовали три прививочные дозы: 1 х 106, 10 х 106 и 50 х 106 клеток/мышь. Накопление асцитической жидкости визуально зафиксировали только при использовании прививочных доз 10 х 106 и 50 х 106 клеток/мышь (рис. 4а). Вес мышей интенсивно увеличивался начиная с 24-х сут наблюдения, и к 28-м сут прирост веса составил 1,9 ± 0,5 и 2,7 ± 0,7 г, соответственно (рис. 5). Различия между контрольной и опытными группами по весу животных были незначимыми (р>0,05).
Проведенный морфологический анализ показал, что к 28-м сут после внутрибрюшинной инокуляции клетки линии TRAMP-С2 формируют диссеминированные перитонеальные канцерома-тозные опухолевые образования, имеющие вид небольших плотных узлов (рис. 6). Опухолевые узлы состоят из низкодифференцированных, преимущественно веретеновидных клеток, образующих разнонаправленные тяжи. Опухолевые клетки имеют выраженный полиморфизм. Среди них встречаются как очень мелкие с одним ядром округло-овальной либо неправильной формы, так и гигантские многоядерные клетки, ядра в которых могут резко отличаться по форме и размерам. Ядра клеток содержат несколько ядрышек различного размера и грубодисперсный хроматин. Цитоплазма клеток развита умеренно. В очень крупных многоядерных клетках цитоплазма занимает значительную часть клетки и содержит множество мелких вакуолей. Фигуры митоза и патологические формы митоза встречаются часто. К указанным срокам после перевивки в опухолевых
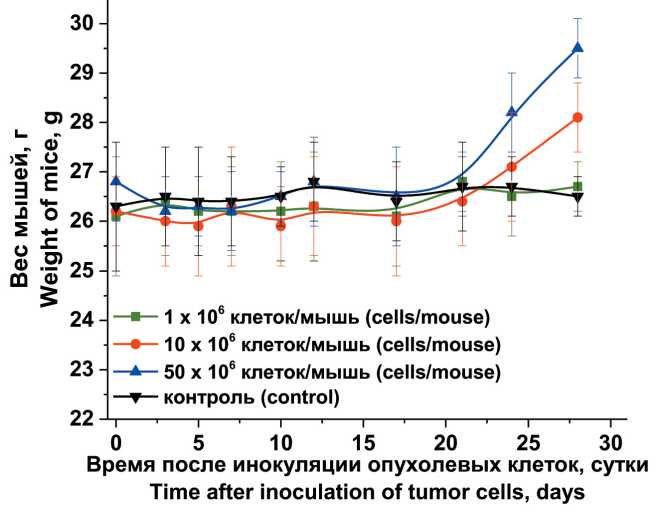
Рис. 5. Динамика изменения веса мышей после внутрибрюшинной инокуляции опухолевых клеток TRAMP-C2 мышам C57Bl/6j в зависимости от прививочной дозы
Fig. 5. Dynamics of mouse weight changes after intraperitoneal inoculation of TRAMP-C2 tumor cells into C57Bl/6j mice depending on the inoculation dose узлах наблюдаются единичные микроочаги некроза и немногочисленные гибнущие многоядерные клетки с морфологическими признаками апоптоза. Опухолевые клетки окружены тонковолокнистой соединительнотканой стромой. Канцероматозные узлы хорошо васкуляризированы, особенно по периферии.
При микроскопическом исследовании асцитической жидкости выявлены опухолевые клетки в количестве 2,5-3,5 x 10 6 клеток в 1 мл. Результаты проведенного цитоморфологического анализа мазков показали, что в асцитической жидкости содержится большое количество округлых опухолевых клеток, лежащих отдельно и группами (рис. 7). Клетки отличаются полиморфизмом: анизоцитоз и анизокариоз сильно выражены, встречаются
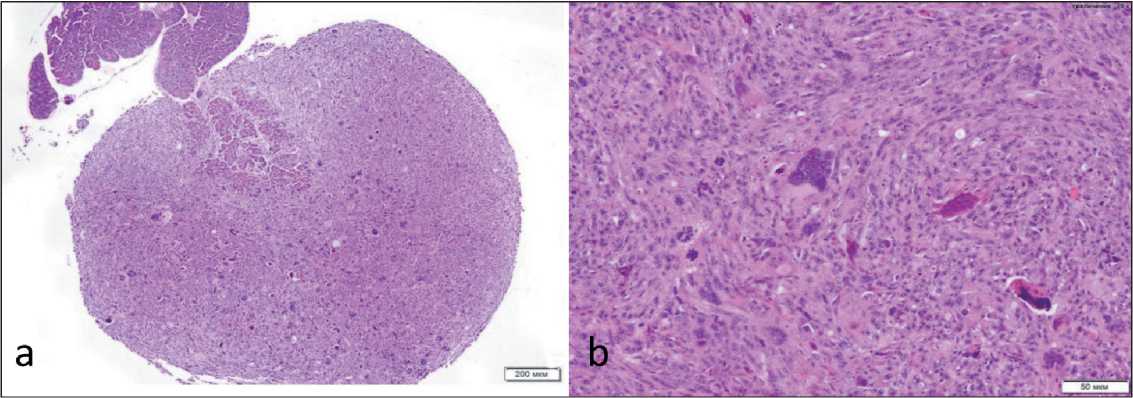
Рис. 6. Гистологическое строение канцероматозных узлов мышиной карциномы предстательной железы линии TRAMP на 28-е сут после внутрибрюшинной инокуляции суспензии опухолевых клеток мышам-самцам С57Bl/6j: а – инвазия в поджелудочную железу, ×40; b – паренхима опухоли состоит из низкодифференцированных веретеновидных клеток, образующих разнонаправленные тяжи, многоядерные клетки, ×200. Окраска гематоксилином и эозином
Fig. 6. Histological structure of carcinomatous nodules of murine prostate carcinoma of TRAMP line 28 days after intraperitoneal inoculation of tumor cell suspension in C57Bl/6j male mice: a – invasion into the pancreas, ×40;
b – tumor parenchyma consists of poorly differentiated spindle-shaped cells forming multidirectional strands, multinucleated cells, ×200. Hematoxylin and eosin staining
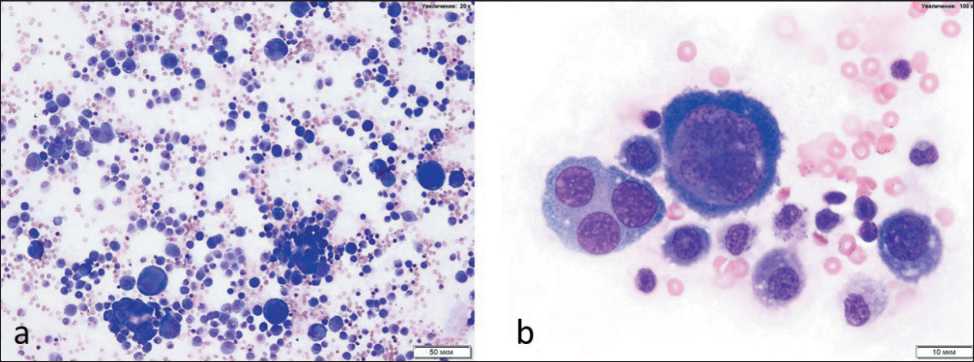
Рис. 7. Цитологическое исследование перитонеальной жидкости на 28-е сут после внутрибрюшинного введения мышам-самцам C57Bl/6j суспензии клеток карциномы предстательной железы линии TRAMP-С2: а – одиночные и сгруппированные опухолевые клетки в мазке, ×20;
b – небольшая группа опухолевых клеток, среди которых две крупные многоядерные клетки, ×1000. Окраска по Романовскому Fig. 7. Cytological examination of the peritoneal fluid on day 28 after intraperitoneal injection of TRAMP-C2 prostate carcinoma cell suspensions into C57Bl/6j male mice: а – single and clustered tumor cells in the smear, ×200;
b – small group of tumor cells, including two large multinucleated cells, ×1000, Romanowsky staining
гигантские клетки, содержащие до 10 ядер, которые часто деформированы соседними ядрами. Базофильная цитоплазма у большинства клеток умеренно развита и иногда содержит вакуоли. Ядерно-цитоплазматическое соотношение сдвинуто в сторону ядра. Форма ядер округло-овальная, встречаются ядра неправильной формы. Ядерный хроматин грубодисперсный. Ядра содержат множественные ядрышки, которые могут отличаться по размеру в пределах одного ядра. Фон представлен многочисленными макрофагами и эритроцитами.
Для дальнейшего поддержания асцитной формы рака предстательной железы неразбавленную выпотную жидкость, полученную от мышей- доноров, инокулировали мышам внутрибрюшинно по 0,5 мл. Количество прививаемых клеток составило 1,25-1,75 x 10 6 на мышь. На 15-17-е сут наблюдения у мышей в брюшной полости образовывалась асцитическая жидкость, которая была помещена в криопробирки c 10 % содержанием DMSO, подвергнута стандартной процедуре заморозки и оставлена на хранение в жидком азоте при температуре -196 ºС.
Следует отметить, что после размораживания и трансплантации животным асцитической жидкости после хранения в жидком азоте в течение 2–6 мес мы наблюдали аналогичную картину развития асцитно-солидной опухоли у мышей.
Таким образом, для разработки новых способов эффективного лечения РПЖ у мышей с асцитно- солидной формой развития опухоли возможно использование клеток линии аденокарциномы предстательной железы TRAMP-C2 в прививочной дозе 50,0x106 на мышь при внутрибрюшинной инокуляции. Однако наиболее целесообразно и экономично для получения асцитно-солидной модели использование клеток, полученных от мышей-доноров «0» – «5» генераций при инокуляции 0,5 мл на мышь, что соответствует 1,2-2,2x106 клеток.


