Ассоциации нарушений ядерной ДНК с индивидуальными вариантами генов системы репарации ДНК APEX1, ERCC2, ERCC5, PARP1 и HOGGL у работников угольных теплоэлектростанций
Автор: Марущак А.В., Торгунакова А.В., Титов Р.А., Соболева О.А., Минина В.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Комбинации генетических вариантов и факторов окружающей среды ответственны за развитие многих заболеваний человека. Информация об индивидуальной способности накапливать повреждения ДНК необходима для развития разработки персонализированной профилактики заболеваний у населения, подвергшегося воздействию факторов окружающей среды. Угольные тепловые электростанции сжигают огромное количество угля и выделяют соответствующее количество токсичных газов, золы, летучих органических веществ. Элементы, входящие в состав угля, являются большой группой разнообразных загрязнителей, связанных с угрозами для здоровья человека и окружающей среды. Настоящая работа основана на определении рисков, которые связаны со здоровьем работников угольных теплоэлектростанций. Проведена оценка степени повреждений ДНК в связи с индивидуальной чувствительностью у 455 работников угольных теплоэлектростанций г. Кемерово и 533 жителей этого же региона, не связанных с производством. Для регистрации нарушений ДНК применялось микроядерное тестирование с цитокинетическим блоком на лимфоцитах периферической крови. Определение влияния генетических факторов на степень повреждения ДНК проводилось методом аллель-специфичной полимеразной цепной реакции полиморфных вариантов генов систем репарации ДНК APEX1 rs1130409, ERCC2 rs13181, PARP1 rs1136410. hOGG1 rs1052133 и ERCC5 rs17655. Выявлены повышенные частоты нарушений ДНК у носителей гетерозиготного генотипа гена APEX1 и минорных вариантов APEX1, ERCC2, hOGG1 и ERCC5.
Работники, угольные теплоэлектростанции, микроядерный тест, полиморфизм, гены репарации днк, apex1, ercc2, parp1, hogg1, ercc5
Короткий адрес: https://sciup.org/147247247
IDR: 147247247 | УДК: 575.22 | DOI: 10.17072/1994-9952-2024-4-421-432
Текст научной статьи Ассоциации нарушений ядерной ДНК с индивидуальными вариантами генов системы репарации ДНК APEX1, ERCC2, ERCC5, PARP1 и HOGGL у работников угольных теплоэлектростанций
Оценка всех видов веществ с точки зрения безопасности для здоровья человека проводится при помощи тестов на изучение генотоксичности. Генотоксические факторы не только могут убивать клетки, но и повреждать их генетический материал [Sommer, Buraczewska, Kruszewski, 2020]. Некоторые повреждения могут сохраняться в клетке при условии ее выживаемости и наследоваться при делении [Sommer, Buraczewska, Kruszewski, 2020]. Методы определения генотоксичности включают в себя изучение обратимых и необратимых повреждений структуры ДНК, а также нарушение механизмов сохранения геномной стабильности [Corvi, Madia, 2017]. Особые виды хромосомных повреждений удается зафиксировать при помощи микроядерного теста. Анализ микроядер может способствовать понимаю механизмов взаимодействия генетических факторов и эффектов окружающей среды, поскольку он считается маркером воздействия мутагенов внешней среды и генетической нестабильности. Данный метод является стандартизированным, позволяет проводить анализ нескольких типов ядерных повреждений [Vral, Fenech, Thierens, 2011].
Совокупность генетических вариантов и факторов окружающей среды является предиктором развития целого ряда заболеваний человека. Репарационные механизмы ДНК определяют результаты после выявления нарушений ДНК и необходимы для поддержания стабильности генома [Wang et al., 2022]. Под геномной нестабильностью подразумевают склонность генома к формированию мутаций [López-Gi, Pascual-Ahuir, Proft, 2023]. Такие процессы происходят при дисфункции механизмов репарации и репликации или увеличении воздействия канцерогенных факторов на организм [Langie et al., 2015].
Целостность генома измеряется увеличенной встречаемостью мутаций в геноме, например, модификациями в нуклеотидных последовательностях [Ferragut Cardoso et al., 2021]. К потере стабильности генома может привести экзогенно-индуцированное повреждение ДНК, вызываемое различными химическими факторами окружающей среды, радиационными агентами, наночастицами [Langie et al., 2015].
Информация об индивидуальной чувствительности к повреждениям ДНК необходима для развития разработки персонализированной профилактики заболеваний у населения, подвергшегося воздействию окружающей среды. Оценка индивидуальной изменчивости имеет решающее значение в выявлении биомаркеров не только для первичной профилактики заболеваний, в том числе рака, и ранней диагностики, но и для их лечения благодаря индивидуально скорректированной терапии [Nagel, Chaim, Samson, 2014].
Кузбасс расположен в юго-западной части Сибири и является одним из крупнейших угольных бассейнов мира [Labzovskii, Belikov, Damiani, 2022]. В столице Кузбасса, г. Кемерово, расположены три теплоэлектростанции (ТЭС), использующие в качестве топлива каменный уголь, – Кемеровская Государственная районная электрическая станция (ГРЭС), Кемеровская теплоэлектростанция и НовоКемеровская теплоэлектростанция (ТЭЦ).
На угольных теплоэлектростанциях сжигается огромное количество угля в год и выделяется не менее огромный объем углекислого газа, оксидов азота и серы, летучих органических веществ, золы [Munawer,
-
2018] . В состав угля входят элементы, которые определяют большую группу опасных для здоровья человека веществ [Hossain, Paul, Hasan, 2015]. В список таких элементов входят тяжелые металлы, которые представляют серьезную угрозу для здоровья человека из-за их широкого распространения и долгого хранения, которое приводит к накоплению в биологических системах [Balali-Mood et al., 2021]. Помимо этого, установлено, что воздействие высокого уровня шума на работников повышено на угольных теплоэлектростанциях по сравнению с электростанциями на природном газе или гидроэлектростанциями [Sarker et al., 2010a, 2010b].
В связи с этим целью данной работы является анализ частот цитогенетических повреждений в связи с унаследованными вариантами генов ферментов репарации ДНК: APEX1 rs1130409 , ERCC2 rs13181 , PARP1 rs1136410. hOGG1 rs1052133 и ERCC5 rs17655 .
Материалы и методы исследования
Исследование проводилось в соответствии с рекомендациями Хельсинской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Прaвилaми клинической прaктики в Российской Федерaции» (утвержденными Прикaзом Минздрaвa РФ от 19.06.2003 г. № 2660). Дизайн исследования (кандидатное исследование по принципу случай-контроль) был одобрен локальным этическим комитетом Федерального исследовательского центра угля и углехимии СО РАН (г. Кемерово). Участие людей в исследовании базировалось на принципах добровольности и информированности о целях, методах и результатах работы.
Материалы исследования представлены 988 образцами периферической венозной крови жителей Кемеровской области. Было обследовано 455 работников угольных теплоэлектростанций г. Кемерово и 533 условно-здоровых жителей этого же региона, не связанных с промышленностью и составивших группу контроля (табл. 1). Контрольные доноры подбирались соответственно полу, возрасту и статусу курения работников угольных теплоэлектростанций.
Таблица 1
Характеристика исследуемых групп [Characteristics of the studied groups]
|
Параметр |
Работники |
Группа сравнения |
|
|
Пол |
женщины |
101 |
168 |
|
мужчины |
354 |
365 |
|
|
Средний возраст, μ ± SEM |
51,9 ± 0.5 |
49,4 ± 4 |
|
|
Статус курения |
курящие |
169 |
170 |
|
некурящие |
286 |
363 |
|
|
Наличие хронических заболеваний |
обладают |
79 |
- |
|
не обладают |
161 |
- |
|
|
Всего |
455 |
533 |
|
Примечание. μ – среднее значение; SEM – стандартная ошибка среднего.
Для определения степени повреждения ядерной ДНК применялся микроядерный тест с блокировкой цитокинеза на лимфоцитах периферической крови с рекомендациями M. Fenech [2007] и модификациями Ф. И. Ингель [2006]. В культуральные флаконы вносили 3 мл среды RPMI 1640. 0.8 мл эмбриональной телячьей сыворотки, 0.25 мл венозной крови, 0.05 мл фитогемагглютинина и оставляли в инкубаторе при 37°С на 44 ч. По истечении 44 ч. в культуры вводили ингибитор цитокинеза цитохалазин В с конечной концентрацией 6 мкг/мл и продолжали инкубацию еще на 28 ч. Полученные клеточные культуры переносили в фальконы объемом 15 мл и центрифугировали 10 мин. при 1 000 rpm. Избавлялись от супернатанта, разбивали осадок и добавляли 6 мл охлажденного гипотонического раствора (0.125 М калий хлористый) для лизиса эритроцитов, перемешивали и добавляли 1 мл ледяного фиксатора Карнуа (3 объема метанола на 1 объем ледяной уксусной кислоты), перемешивали и центрифугировали 10 мин. при 1 000 rpm. Удаляли супернатант, разбивали осадок и вносили 9 мл ледяного метанол-уксусного фиксатора, перемешивали и выдерживали экспозицию при 4°С в течении 20 мин., центрифугировали 10 мин. при 1 000 rpm. Избавлялись от супернатанта, разбивали осадок и вносили 9 мл ледяного метанол-уксусного фиксатора, перемешивали и выдерживали экспозицию при 4°С на протяжении 50 мин. Центрифугировали 10 мин., удаляли супернатант и переносили полученный осадок во флаконы объемом 1.5 мл. Полученные суспензии переносили на предварительно обезжиренные и замороженные предметные стекла, выдерживали ночь и окрашивали 3% красителем Гимза. Полученные препараты просматривали на микроскопах Axio Scope.A1 (Zeiss, Германия) и Eclipse E100 (Nikon, Япония). Регистрировались 500 клеток любой ядерности, на стадии митоза и апоптоза, нарушения (микроядра, мосты, протрузии), после учитывали только двухъядерные лимфоциты и их нарушения, набирая количество данных клеток до 1 000 rpm. Критерии отбора двуядерных лимфоцитов, включаемых в анализ, и критерии для регистрации цитогене- тических нарушений соответствовали общепринятым рекомендациям1. Расчет индекса репликации проводили по формуле, предоставленной там же:
ИР
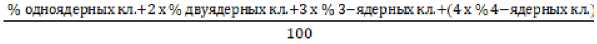
Выделение ДНК проводилось фенол-хлороформным методом. В анализ включены кодирующие ферменты репарации ДНК гены, для которых ранее установлены связи с повреждениями ДНК [Tavares et al., 2020; Liu et al., 2021; Xin et al., 2021] (изучены базы SNPinfo Web Server и RegulomeDB Version 1.1 ). Характеристика (по данным базы National Center for Biotechnology Information ) отобранных SNP генов представлена в табл. 2.
Таблица 2
Характеристика выбранных для исследования полиморфных вариантов
[Characteristics of polymorphic variants selected for study]
|
Ген |
SNP |
Локализация (GRCh38) |
Замена нуклеотидов |
|
APEX1 |
rs1130409 |
Chr 14:20456995 |
T> G |
|
ERCC2 |
rs13181 |
Chr 19:45351661 |
T> G |
|
PARP1 |
rs1136410 |
Chr 1:226367601 |
T> C |
|
hOGG1 |
rs1052133 |
Chr 3:9757089 |
C> G |
|
ERCC5 |
rs17655 |
Chr 13:102875652 |
G> C |
Примечание. SNP – однонуклеотидный полиморфизм.
Определение полиморфных вариантов генов APEX1 rs1130409, ERCC2 rs13181, PARP1 rs1136410. hOGG1 rs1052133 и ERCC5 rs17655 проводили с использованием наборов реактивов НПФ «Литех» (г. Москва) с последующим разделением продуктов амплификации методом горизонтального электрофореза в 3% агарозном геле. Визуализацию результатов проводили универсальной системой гель-документации Gel Doc (BioRad, США).
Статистическая обработка полученных данных проводилась с использованием программного обеспечения StatSoft Statistica 10.0. Соответствие выборки нормальному распределению проверялось критерием Колмогорова-Смирнова. Исходя из вида распределения, применялись методы непараметрической статистики, в частности U-критерий Манна-Уитни, с целью определения различий между изучаемыми выборками. Критический уровень значимости принимался равным 0.05. Оценка частоты редкого аллеля, соответствие распределения частот равновесию Харди–Вайнберга (χ2), статистическую значимость различий между группами по частотам аллелей и генотипов для теста χ2 на гомогенность выборок выполняли при помощи онлайн-ресурса:
Результаты и обсуждение
Для определения влияния угольной производственной среды на формирование цитогенетических нарушений проведено сравнение показателей микроядерного теста работников угольных теплоэлектростанций с группой неработающих жителей той же области (табл. 3).
Выявлены повышенные частоты ( p < 0.000001) лимфоцитов с микроядрами, мостами и протрузиями, а также частота клеток на стадии апоптоза у работников угольных теплоэлектростанций по сравнению с контрольными донорами. Однако наблюдается повышенная встречаемость лимфоцитов на этапе клеточного деления ( p < 0.000001) у жителей Кемеровской обл.
Микроядро представляет собой небольшую хроматин-содержащую структуру, наблюдаемую в клеточной цитоплазме [Fenech, 2007]. Микроядра могут образовываться в результате естественных процессов, таких как метаболизм или старение, или как результат взаимодействия с разнообразными факторами окружающей среды и многими заболеваниями [Sommer, Buraczewska, Kruszewski, 2020].
Формирование цитогенетических нарушений обусловлено несколькими механизмами: 1) отставание хромосомы во время анафазы клеточного деления [Liu, Pellman, 2020]; 2) разрушение хромосом (хромот-рипсис) в результате ошибок на стадии митоза и неспособности разрушить оболочку микроядра, содержащего хромосомные фрагменты; 3) локальные нарушения репликации ДНК, приводящие к перестройкам [Hatch, 2018].
Установлено влияние пола ( p < 0.02) и возраста ( p < 0.01) работника угольных теплоэлектростанций на накопление цитогенетических нарушений. Статус курения и хронические заболевания не влияют на формирование цитогенетических нарушений у работников угольных теплоэлектростанций ( p > 0.05). Выявлено влияние стажа работы на угольном производстве ( p < 0.0005) и профессиональной специализации ( p < 0.009) на образование геномных нарушений и пролиферативные показатели.
-
1 ГОСТ 32635-2014. Методы испытания по воздействию химической продукции на организм человека. Микро-ядерный тест на клетках млекопитающих in vitro. М.: Стандартинформ, 2019. 14 с.
Таблица 3
[Parameters of the micronucleus test in the studied groups]
|
Показатель |
Рабочие теплоэлектростанций (n = 455) |
Группа сравнения (n = 533) |
||||||
|
Медиана |
Мода |
Нижний квартиль |
Верхний квартиль |
Медиана |
Мода |
Нижний квартиль |
Верхний квартиль |
|
Частота двухъядерных клеток с цитогенетическими нарушениями (%)
|
Микроядра |
3.3* |
3.6 |
1.9 |
4.5 |
0.6 |
0.8 |
0.4 |
0.9 |
|
Мосты |
1.5* |
0.5 |
0.8 |
2.3 |
0.3 |
0 |
0 |
0.5 |
|
Протрузии |
2* |
0 |
1.2 |
3 |
0.3 |
0 |
0 |
0.5 |
Пролиферативные показатели (%)
|
Ядерность клеток |
1 |
31.2 |
Мн. |
24.6 |
37.8 |
32.1 |
Мн. |
25.2 |
38.4 |
|
2 |
45.8 |
48.2 |
40.6 |
50.8 |
44.0 |
43.6 |
39.6 |
50.2 |
|
|
3 |
7 |
8.4 |
4.2 |
9.2 |
6.2 |
4.4 |
4.4 |
8.8 |
|
|
4 |
15.2 |
11.2 |
10.8 |
18.6 |
14.5 |
17.4 |
10.4 |
17.2 |
|
|
Митоз |
0.6 |
0.4 |
0.4 |
1 |
2.4* |
2.2 |
1.3 |
3.0 |
|
|
Апоптоз |
1.2* |
0.2 |
0.4 |
1.8 |
0.4 |
0.2 |
0.2 |
1.0 |
|
|
Индекс репликации |
1.9 |
Мн. |
1.7 |
2.1 |
2.0 |
1.9 |
1.8 |
2.1 |
|
Примечание. * – отличается от группы сравнения по критерию Манна-Уитни: * р < 0.000001.
Параметры микроядерного теста в изученных группах
Частоты встречаемости цитогенетических нарушений в клетках крови в связи с различными полиморфными вариантами генов APEX1 rs1130409 , ERCC2 rs13181 , PARP1 rs1136410. hOGG1 rs1052133 и ERCC5 rs17655 работников угольных теплоэлектростанций представлены в табл. 4.
Таблица 4
Цитогенетические показатели микроядерного теста у рабочих теплоэлектростанций с различными вариантами изученных генов
[Cytogenetic parameters of the micronucleus test in thermal power plant workers with different variants of the studied genes]
|
Цитогенетические показатели |
Медиана |
Квартили (25-75%) |
Медиана |
Квартили (25-75%) |
Медиана |
Квартили (25-75%) |
APEX1 rs1130409
|
SNP |
TT (n = 138) |
TG (n = 234) |
GG (n = 83) |
|||
|
Микроядра |
3,3 |
1,9-4,5 |
3,6*1 |
2-4,9 |
3 |
1,8-3,9 |
|
Мосты |
1,5 |
0.8-2,3 |
1,5 |
0.8-2,4 |
1,4 |
0.7-2,2 |
|
Протрузии |
2,1 |
1,1-2,9 |
1,9 |
1,1-3,2 |
2,1*2 |
1,5-2,9 |
ERCC2 rs13181
|
SNP |
TT (n = 191) |
TG (n = 217) |
GG (n = 47) |
|||
|
Микроядра |
3,3 |
1,9-4,5 |
3,3 |
2-4,6 |
3 |
1,3-4,2 |
|
Мосты |
1,4 |
0.9-2,4 |
1,4 |
0.9-2,3 |
1.7*3 |
0.8-2,4 |
|
Протрузии |
2 |
1,2-2,2 |
2,1 |
1,2-2,3 |
2,3*3 |
1,2-3,2 |
PARP1 rs1136410
|
SNP |
CC (n = |
245) |
CG (n = |
180) |
GG (n |
= 30) |
|
Микроядра |
3,5 |
1,6-4,6 |
2,9 |
1,7-4,3 |
3,7*4 |
2,2-4,8 |
|
Мосты |
1,5 |
0.9-2,5 |
1,4 |
0.8-2,2 |
1,4 |
0.6-2,4 |
|
Протрузии |
2 |
1,1-3,1 |
2 |
1,2-3 |
2,2 |
1,3-2,9 |
ERCC5 rs17655
|
SNP |
GG (n = 279) |
GC (n = 149) |
CC (n = 27) |
|||
|
Микроядра |
3,3 |
2-4,5 |
3,3 |
1,7-4,6 |
3,6*5 |
1,9-4,4 |
|
Мосты |
1,4 |
0.8-2,4 |
1,5 |
0.8-2,3 |
1,7*5 |
0.7-2,8 |
|
Протрузии |
1,8 |
1,2-2,8 |
2 |
1,1-3,2 |
1,9 |
1,5-3 |
Примечание. *1 TC от TT и GG p = 0.04; *2 GG от TT и TG p = 0.02; *3 GG от TT и TG p < 0.01; *4 GG от CC и GC p = 0.004; *5 CC от GG и GC p < 0.002.
Установлены повышенные частоты клеток с микроядрами у носителей генотипа TG гена APEX1 ( p = 0.04). Также носители полиморфного варианта GG того же гена обладают повышенной частотой лимфоцитов с протрузиями ( p = 0.02). У обладателей минорного генотипа гена ERCC2 наблюдаются повышенные частоты встречаемости клеток крови с мостами и протрузиями ( p = 0.01). Носители минорного генотипа GG гена hOGG1 обладают повышенной частотой встречаемости клеток с микроядрами ( p < 0.01). У работников с минорным генотипом CC гена ERCC5 установлены повышенные показатели клеток с микроядрами и мостами (p < 0.002).
Не выявлено статистически значимых отличий между генотипами гена PARP1 rs1136410 ( p > 0.05).
Частоты встречаемости цитогенетических нарушений в клетках крови в связи с различными полиморфными вариантами генов APEX1 rs1130409 , ERCC2 rs13181 , PARP1 rs1136410. hOGG1 rs1052133, ERCC5 rs17655 контрольных доноров представлены в табл. 5.
Таблица 5
Цитогенетические показатели микроядерного теста у индивидов контрольной группы с различными вариантами изученных генов
[Cytogenetic parameters of the micronucleus test in individuals of the control group with different variants of the studied genes]
|
Цитогенетические показатели |
Медиана |
Квартили (25-75 %) |
Медиана |
Квартили (25-75 %) |
Медиана |
Квартили (25-75 %) |
|
APEX1 rs1130409 |
||||||
|
SNP |
TT (n = 280) |
TG (n = 221) |
GG (n = 32) |
|||
|
Микроядра |
0.76 |
0.5-1.63 |
0.7 |
0.58-1.01 |
0.6 |
0.6-0.8 |
|
Мосты |
0.49 |
0.2-1.13 |
0.4 |
0.2-0.8 |
0.2 |
0.2-0.4 |
|
Протрузии |
0.51 |
0.3-1.4 |
0.6 |
0.3-1.7 |
0.7 |
0.3-1.5 |
|
ERCC2 rs13181 |
||||||
|
SNP |
TT (n = 272) |
TG (n = 225) |
GG (n = 36) |
|||
|
Микроядра |
0.7 |
0.6-1.4 |
0.8 |
0.6-1.6 |
0.5 |
0.3-0.9 |
|
Мосты |
0.46 |
0.2-1.14 |
0.4 |
0.2-0.9 |
0.25 |
0-0.4 |
|
Протрузии |
0.5 |
0.3-1.43 |
0.5 |
0.3-1.5 |
0.35 |
0-1.2 |
|
PARP1 rs1136410 |
||||||
|
SNP |
TT (n = 311) |
TC (n = 192) |
CC (n = 30) |
|||
|
Микроядра |
0.8 |
0.6-1.4 |
0.7 |
0.6-0.9 |
0.5 |
0.5-0.5 |
|
Мосты |
0.42 |
0.2-1.03 |
0.4 |
0.2-0.93 |
0.4 |
0.1-0.4 |
|
Протрузии |
0.5 |
0.3-1.4 |
0.7 |
0.2-1.5 |
1.7* |
1.4-2.2 |
|
hOGG1 rs1052133 |
||||||
|
SNP |
CC (n = 325) |
CG (n = 185) |
GG (n = 23) |
|||
|
Микроядра |
0.6 |
0.4-0.8 |
0.6 |
0.4-0.9 |
0.5 |
0.3-0.9 |
|
Мосты |
0.3 |
0-0.5 |
0.4 |
0-0.5 |
0.4 |
0.1-0.5 |
|
Протрузии |
0.3 |
0-0.5 |
0.3 |
0-0.5 |
0.5 |
0.1-0.5 |
|
ERCC5 rs17655 |
||||||
|
SNP |
GG (n = 290) |
GC (n = 210) |
CC (n = 33) |
|||
|
Микроядра |
0.5 |
0.3-0.8 |
0.6 |
0.3-0.8 |
0.4 |
0.2-0.8 |
|
Мосты |
0.3 |
0-0.5 |
0.3 |
0-0.5 |
0.4 |
0-0.5 |
|
Протрузии |
0.3 |
0-0.5 |
0.3 |
0-0.5 |
0.4 |
0-0.6 |
|
Примечание. * CC от TT и TC p = 0.04. |
||||||
В группе контроля наблюдается повышенная частота встречаемости клеток с протрузиями у обладателей генотипа CC гена PARP1 ( p = 0.04).
В остальных исследуемых случаях в контрольной группе статистически значимых отличий выявлено не было ( p > 0.05).
Апуриновая/апиримидиновая эндонуклеаза 1/окислительно-восстановительный эффекторный фактор 1 (APEX1/Ref-1) является многофункциональным ферментом, который необходим для поддержания клеточного гомеостаза. APEX1 является основной апуриновой/апиримидиновой эндонуклеазой в пути эксцизионной репарации оснований и действует как окислительно-восстановительный регулятор нескольких транскрипционных факторов, включая NF-κB, AP-1, HIF-1α и STAT3. Эти функции делают APEX1 жизненно важным для регуляции клеточного цикла, старения и воспалительных путей. В дополнение к регуляции экспрессии цитокинов и хемокинов путем активации окислительно-восстановительных факторов транскрипции, APEX1 участвует в других процессах иммунного ответа, включая производство активных форм кислорода. Кроме того, участвуя в активном деметилировании хроматина, функция APEX1 заключается в регуляции транскрипции некоторых генов, включая цитокины, такие как TNFα [Oliveira et al., 2022].
Ген АДФ-рибозилтрансферазы ( PARP1 ) кодирует хроматин-ассоциированный фермент, поли(АДФ-рибозу) полимеразу-1 (PARP-1), и синтезирует после повреждения ДНК и участвует в целостности генома, регулируя клеточные реакции на повреждение ДНК и апоптоз [Gadad et al., 2021]. Участвует в регуляции различных важных клеточных процессов, таких как дифференцировка, пролиферация и трансформация опухоли, а также в регуляции молекулярных событий, участвующих в восстановлении клетки после повреждения ДНК [Zakharenko et al., 2023].
Пигментная ксеродерма группы D ( ERCC2 ) является основным белком, участвующим в NER. Являясь важным геном репарации ДНК, он играет важную роль в белково-опосредованном комплексном NER транскрипционного фактора IIH (TFIIH) и его процессе транскрипции [Wang et al., 2020].
Ген hOGG1 расположен на хромосоме 3p26.2 и кодирует гликозилазу, катализирующую эксцизию 8-оксогуаниновых аддуктов из поврежденной ДНК. Во многих исследованиях подтверждена связь между полиморфизмом hOGG1 rs1052133 и риском развития гинекологического рака в европейской популяции [Shi, Xu, Zhang, 2020]. Полиморфизм hOGG1 rs1052133 , наиболее изученный полиморфизм hOGG1, влияет на активность белка и, таким образом, способствует канцерогенезу [Zhang et al., 2017].
XPG , также называемая ERCC5 , является основной эндонуклеазой DDR, дефицит которой приводит к серьезным дефектам развития, прогерии и раку. Он в основном известен своей ролью в вырезании повреждений ДНК в эксцизионной репарации нуклеотидов (NER), но в последние годы было обнаружено, что он функционирует и в других механизмах поддержания генома. ERCC5 входит в семейство структурно-специфических нуклеаз XPG/RAD2, которое у млекопитающих также включает FEN1, GEN1 и EXO1 и выполняет важные функции поддержания генома. Наследственные мутации гена ERCC5 связаны с несколькими заболеваниями человека, характеризующимися широким спектром симптомов, включая предрасположенность к раку, прогрессирующую нейродегенерацию и нарушение развития [Muniesa-Vargas et al., 2022]. Некоторые мутации ERCC5 вызывают пигментную ксеродерму (XP), которая характеризуется фоточувствительностью, аномальной пигментацией кожи, повышенным риском развития рака и иногда неврологическими заболеваниями [Rizza et al., 2021].
Важность репарации ДНК для поддержания целостности генома и предотвращения развития опухолей подчеркивается тем фактом, что дефекты в репарации ДНК связаны с повышенной восприимчивостью клеток к токсическим, мутагенным и канцерогенным эффектам воздействия окружающей среды [Huang, Zhou, 2021].
Важность удаления продуктов окисления ДНК отражается в избыточности ферментов репарации ДНК для этих поражений. Из-за этой избыточности определение роли АФК в развитии рака и ферментов репарации в его предотвращении является сложной задачей. Однако вмешательство окружающей среды в восстановление таких повреждений может способствовать развитию рака [Langie et al., 2015].
Одним из примеров связи между индукцией АФК и развитием рака является повышенная заболеваемость раком легких, кожи, мочевого пузыря и печени у людей, которые подвергались воздействию агента, индуцирующего АФК, мышьяка [Wang et al., 2012]. Кроме того, было показано, что оксид азота ингибирует ферменты репарации ДНК [Khan et al., 2020]. Также сообщалось, что репарация нуклеотидов может быть ингибирована окислительным стрессом [Van Houten, Santa-Gonzalez, Camargo, 2018].
Генетическая изменчивость в генах репарации ДНК может модулировать восприимчивость к повреждению ДНК [Angelini et al., 2012]. В связи с этим в работе проведена оценка влияния полиморфизмов генов репарации ДНК APEX1 , ERCC2, PARP1. hOGG1 , ERCC5 на формирование микроядер, мостов и протрузий, выявляемых при помощи микроядерного теста.
В работе [Angelini et al., 2005] изучена частота микроядер в группе, подвергшейся воздействию низких уровней ионизирующего излучения, и в соответствующей контрольной группе. Как в исследуемой выборке, так и в контрольной группе также оценивалось возможное влияние однонуклеотидных полиморфизмов генов XRCC1, XRCC3 и ERCC2 на частоту микроядер. Также было рассмотрено влияние статуса курения, возраста и пола. Авторами установлены повышенные частоты подвергшихся воздействию работников, обладающими аллелем дикого типа гена ERCC2 , чем группа сравнения. Статус курения статистически значимо не влиял на частоту встречаемости микроядер в обеих группах. Однако увеличение возраста связано с повышением частоты клеток с микроядрами у работников. Также при объединении обеих групп исследования у женщин наблюдались повышенные частоты лимфоцитов с микроядрами.
У рабочих-носителей генотипа CG гена hOGG1 выявлена повышенная чувствительность к хромосомным повреждениям, выраженная в увеличенном формировании микроядер.
В исследовании [Qiu et al., 2011] рассматривалась взаимосвязь между генетическим полиморфизмом семи генов системы репарации ДНК (XPA, ERCC2, XPC, ERCC5, XPF, ERCC1 и APEX1) и восприимчивостью к хромосомному повреждению после воздействия винилхлорида. Было исследовано сто восемьдесят рабочих, подвергшихся профессиональному воздействию, и 43 контрольных донора, не подвергших- ся воздействию. У работников с вариантом минорного генотипа ERCC2 частота микроядер была незначительно выше (p = 0.07).
Sinitsky M.Y. с соавт. [2015] изучал влияние полиморфных вариантов генов системы репарации на частоту микроядер у детей, проживающих в школе-интернате г. Таштагол (Кемеровская обл., Россия). Выявлено достоверное увеличение частоты двуядерных лимфоцитов с микроядрами у носителей полиморфизма генотипа CC гена ERCC5 по сравнению с гетерозиготными и гомозиготными носителями. Кроме того, генотип CC гена ADPRT ассоциировался с повышенной частотой двуядерных лимфоцитов с нук-леоплазматическими мостами.
Этим же коллективом [Sinitsky et al., 2017] установлена повышенная частота двуядерных лимфоцитов с микроядрами у шахтеров с генотипом GG гена hOGG1 rs1052133 по сравнению с носителями генотипа CC.
В исследовании [Angelini et al., 2012] оценено влияние полиморфизмов генов репарации ДНК ( APEX1, hOGG1, NBS1, ERCC2, XRCC1 и XRCC3 ) на формирование микроядер как биомаркера ранних биологических эффектов при контакте с бензолом. Значительно более высокая частота микроядер была зарегистрирована у регулировщиков дорожного движения, чем в контрольной группе.
Cheng J с соавт. [2007] изучали ассоциации между несколькими генетическими полиморфизмами генов эксцизионной репарации нуклеотидов ( ERCC1, ERCC2, ERCC4, ERCC5 и ERCC6 ) и уровнем повреждения хромосом у 140 коксохимических рабочих, подвергшихся воздействию высокого уровня полиа-роматических углеводородов (ПАУ), и у 66 доноров, не подвергавшихся воздействию. Анализ показал значительную связь между полиморфизмом ERCC2 G23591A и частотами параметров микроядерного теста среди пожилых рабочих коксовых печей. Результаты показывают, что полиморфизмы ERCC1 C19007T, ERCC6 A3368G и ERCC2 G23591A связаны с частотами показателей микроядерного теста среди коксовых рабочих.
Заключение
В работе подтверждено влияние производственной среды угольных теплоэлектростанций на формирование повреждений ДНК в виде повышенных частот микроядер, мостов и протрузий в клетках крови работников.
Установлены ассоциации минорного варианта ERCC2 rs13181 с повышенной частотой нуклеоплаз-менных мостов и протрузий, минорного варианта ERCC5 rs17655 с увеличением формирования микроядер и нуклеоплазменных мостов, гетерозиготного варианта гена APEX1 rs1130409 с повышенной частотой микроядер, минорного генотипа этого же гена с частотой клеток с протрузиями, минорного генотипа hOGG1 rs1052133 c микроядрами при воздействии на организм работников промышленной среды угольных теплоэлектростанций. Обладатели данных генотипических вариантов должны стать приоритетной группой при проведении профилактических мероприятий. Полученные результаты свидетельствуют о значимом вкладе генетических и средовых факторов в формирование генотоксических эффектов у работников угольных теплоэлектростанций.
Список литературы Ассоциации нарушений ядерной ДНК с индивидуальными вариантами генов системы репарации ДНК APEX1, ERCC2, ERCC5, PARP1 и HOGGL у работников угольных теплоэлектростанций
- Ингель Ф.И. Перспективы использования микроядерного теста на лимфоцитах крови человека, культивируемых в условиях цитокинетического блока. Ч. 2. Факторы среды и индивидуальные особенности в системе нестабильности генома человека. Дополнительные возможности теста. Методика проведения экспериментов и цитогенетического анализа // Экологическая генетика. 2006. Т. 4, № 4. С. 38-54.
- Angelini S. et al. Micronuclei in humans induced by exposure to low level of ionizing radiation: influence of polymorphisms in DNA repair genes // Mutat. Res. 2005. Vol. 570, № 1. P. 105-117. DOI: 10.1016/j.mrfmmm.2004.10.007.
- Angelini S. et al. Environmental exposure to benzene, micronucleus formation and polymorphisms in DNA-repair genes: a pilot study // Mutat. Res. 2012. Vol. 743, № 1-2. P. 99-104. DOI: 10.1016/j.mrgentox.2011.10.018.
- Balali-Mood M. et al. Toxic Mechanisms of Five Heavy Metals: Mercury, Lead, Chromium, Cadmium, and Arsenic // Front Pharmacol. 2021. Vol. 12. Art. 643972. DOI: 10.3389/fphar.2021.643972.
- Cheng J. et al. Association between nucleotide excision repair gene polymorphisms and chromosomal damage in coke-oven workers // Biomarkers. 2007. Vol. 12, № 1. P 76-86. DOI: 10.1080/13547500600950168.
- Corvi R., Madia F. In vitro genotoxicity testing-Can the performance be enhanced? // Food Chem. Toxicol. 2017. Vol. 106(Pt B). P. 600-608. DOI: 10.1016/j.fct.2016.08.024.
- Fenech M. Cytokinesis-block micronucleus cytome assay // Nat. Protoc. 2007. Vol. 2, № 5. P. 1084-1104. DOI: 10.1038/nprot.2007.77.
- Fenech M. Cytokinesis-Block Micronucleus Cytome Assay Evolution into a More Comprehensive Method to Measure Chromosomal Instability // Genes. 2020. Vol. 11, № 10. Art. 1203. DOI: 10.3390/genes11101203.
- Ferragut Cardoso A.P. et al. miRNA dysregulation is an emerging modulator of genomic instability // Semin. Cancer Biol. 2021. Vol. 76. P. 120-131. DOI: 10.1016/j.semcancer.2021.05.004.
- Gadad S.S. et al. PARP-1 Regulates Estrogen-Dependent Gene Expression in Estrogen Receptor aPositive Breast Cancer Cells // Mol. Cancer Res. 2021. Vol. 19, № 10. P. 1688-1698. DOI: 10.1158/1541-7786.MCR-21-0103.
- Hatch E.M. Nuclear envelope rupture: little holes, big openings // Curr. Opin. Cell Biol. 2018. Vol. 52. P. 66-72. DOI: 10.1016/j.ceb.2018.02.001.
- Hossain M.N., Paul S.K., Hasan M.M. Environmental impacts of coal mine and thermal power plant to the surroundings of Barapukuria, Dinajpur, Bangladesh // Environ. Monit. Assess. 2015. Vol. 187, № 4. Art. 202. DOI: 10.1007/s10661-015-4435-4.
- Huang R., Zhou P.K. DNA damage repair: historical perspectives, mechanistic pathways and clinical translation for targeted cancer therapy // Signal Transduct. Target Ther. 2021. Vol. 6, № 1. Art. 254. DOI: 10.103 8/s41392-021-00648-7.
- Khan F.H. et al. The Role of Nitric Oxide in Cancer: Master Regulator or NOt? // Int. J. Mol. Sci. 2020. Vol. 21, № 24. Art. 9393. DOI: 10.3390/ijms21249393.
- Labzovskii L.D., Belikov D.A., Damiani A. Spaceborne NO2 observations are sensitive to coal mining and processing in the largest coal basin of Russia // Scto Rep. 2022. Vol. 12, № 1. Art. 12597. DOI: 10.1038/s41598-022-16850-8.
- Langie S.A. et al. Causes of genome instability: the effect of low dose chemical exposures in modern society // Carcinogenesis. 2015. Vol. 36, № 1. P. 61-88. DOI: 10.1093/carcin/bgv031.
- Liu J. et al. Association between APEX1 rs1760944 and rs1130409 polymorphism with prostate cancer risk: A systematic review and meta-analysis // Medicine (Baltimore). 2021. Vol. 100, № 46. Art. e27630. DOI: 10.1097/MD.0000000000027630.
- Liu S., Pellman D. The coordination of nuclear envelope assembly and chromosome segregation in meta-zoans // Nucleus. 2020. Vol. 11. P. 35-52. DOI: 10.1080/19491034.2020.1742064.
- Lopez-Gil L., Pascual-Ahuir A., Proft M. Genomic Instability and Epigenetic Changes during Aging // Int. J. Mol. Sci. 2023. Vol. 24, № 18. Art. 14279. DOI: 10.3390/ijms241814279.
- Munawer M.E. Human health and environmental impacts of coal combustion and post-combustion wastes // Journal of Sustainable Mining. 2018. Vol. 17, № 2. P. 87-96. DOI: 10.1016/j.jsm.2017.12.007.
- Muniesa-Vargas A. et al. XPG: a multitasking genome caretaker // Cell Mol. Life Sci. 2022. Vol. 79, № 3. Art. 166. DOI: 10.1007/s00018-022-04194-5.
- Nagel Z.D., Chaim I.A., Samson L.D. Inter-individual variation in DNA repair capacity: a need for multi-pathway functional assays to promote translational DNA repair research // DNA Repair (Amst). 2014. Vol. 19. Art. 199-213. DOI: 10.1016/j.dnarep.2014.03.009.
- Oliveira T.T. et al. APEX1/Ref-1 Role in Inflammation and Immune Response // Front Immunol. 2022. Vol. 13. Art. 793096. DOI: 10.3389/fimmu.2022.793096.
- Qiu Y.L. et al. DNA repair gene polymorphisms and micronucleus frequencies in Chinese workers exposed to vinyl chloride monomer // Int. J. Hyg. Environ. Health. 2011. Vol. 214, № 3. P. 225-230. DOI: 10.1016/j.ijheh.2010.12.001.
- Rizza E.R.H. et al. Xeroderma Pigmentosum: A Model for Human Premature Aging // J. Invest. Dermatol. 2021. Vol. 141, № 4S. P. 976-984. DOI: 10.1016/j.jid.2020.11.012.
- Sarker S.K. et al. Effect of Barapukuria coal mine on soil environment // Journal of Agro for Environment. 2010a. Vol. 4, № 2. P. 181-183.
- Sarker S.K. et al. Effect of Barapukuria power plant on environment // Journal of Agro for Environment. 2010b. Vol. 4, № 2. P. 125-127.
- Shi Y., Xu W., Zhang X. Association of the hOGG1 Ser326Cys polymorphism with gynecologic cancer susceptibility: a meta-analysis // Biosci. Rep. 2020. Vol. 40, № 12. Art: BSR20203245. DOI: 10.1042/BSR20203245.
- Sinitsky M.Y. et al. Association of DNA repair gene polymorphisms with genotoxic stress in underground coal miners // Mutagenesis. 2017. Vol. 32, № 5. P. 501-509. DOI: 10.1093/mutage/gex018.
- Sinitsky M.Y. et al. Associations of DNA-repair gene polymorphisms with a genetic susceptibility to ionizing radiation in residents of areas with high radon (222Rn) concentration // Int. J. Radiat. Biol. 2015. Vol. 9, № 6. P. 486-494. DOI: 10.3109/09553002.2015.1012306.
- Sommer S., Buraczewska I., Kruszewski M. Micronucleus Assay: The State of Art, and Future Directions // Int. J. Mol. Sci. 2020. Vol. 21, № 4. Art. 1534. DOI: 10.3390/ijms21041534.
- Tavares C.B. et al. Association between Single Nucleotide Polymorphisms and Glioma Risk: A Systematic Literature Review // Cancer Invest. 2020. Vol. 38, № 3. P. 169-183. DOI: 10.1080/07357907.2020.1719502.
- Van Houten B., Santa-Gonzalez G.A., Camargo M. DNA repair after oxidative stress: current challenges // Curr. Opin. Toxicol. 2018. Vol. 7. P. 9-16. DOI: 10.1016/j.cotox.2017.10.009.
- Vral A., Fenech M., Thierens H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure // Mutagenesis. 2011. Vol. 26, № 1. P. 11-17. DOI: 10.1093/mutage/geq078.
- Wang T.S. et al. Lymphocyte-based challenge DNA-repair assays for personalized health risk assessment // Mutat. Res. Rev. 2022. Vol. 790. Art. 108427. DOI: 10.1016/j.mrrev.2022.108427.
- Wang X. et al. Arsenic and chromium in drinking water promote tumorigenesis in a mouse colitis-associated colorectal cancer model and the potential mechanism is ROS-mediated Wnt/ß-catenin signaling pathway // Toxicol. Appl. Pharmacol. 2012. Vol. 262, № 1. P. 11-21. DOI: 10.1016/j.taap.2012.04.014.
- Wang Y. et al. Cloning of the ERCC2 gene and its function in malignant melanoma cells // Oncol. Lett. 2020. Vol. 20, № 2. P. 1803-1809. DOI: 10.3892/ol.2020.11708.
- Xin Y. et al. PARP1 rs1136410 Val762Ala contributes to an increased risk of overall cancer in the East Asian population: a meta-analysis // J. Int. Med. Res. 2021. Vol. 49, № 3. Art. 300060521992956. DOI: 10.1177/0300060521992956.
- Zakharenko A.L. et al. PARP1 Gene Knockout Suppresses Expression of DNA Base Excision Repair Genes // Dokl. Biochem. Biophys. 2023. Vol. 508, № 1. P. 6-11. DOI: 10.1134/S1607672922700028.
- Zhang D. et al. Association between hOGG1 polymorphism rs1052133 and gastric cancer // Oncotarget. 2017. Vol. 8, № 21. P. 34321-34329. DOI: 10.18632/oncotarget.16124.


