Ассоциации RS4244285 в гене CYP2C19 с многофакторными заболеваниями
Автор: Бабушкина Н.П., Постригань А.Е., Кучер А.Н., Шипулин В.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
В современных популяциях система биотрансформации работает в условиях повышенной нагрузки, так как обеспечивает метаболизм не только широкого спектра эндогенных субстратов, но и различных ксенобиотиков, что может способствовать развитию заболеваний различных систем органов, а в ряде случаев приводить к формированию коморбидных состояний, при которых наблюдается усиленная работа системы метаболизма ксенобиотиков. В связи с этим большой интерес вызывает изучение вовлеченности полиморфизма генов метаболизма ксенобиотиков в формирование не только изолированной патологии, но и различных коморбидных состояний.Цель исследования: изучение вовлеченности полиморфного варианта rs4244285 гена CYP2C19, приводящего к синтезу нефункционального белка, в развитие как изолированной патологии, так и сочетанных заболеваний.Материал и методы. Изучена распространенность аллелей и генотипов rs4244285 в гене CYP2C19 в двух группах больных с коморбидными состояниями: ишемическая болезнь сердца с артериальной гипертензией (ИБС_АГ, n = 133); бронхиальная астма с гипертензией (БА_АГ, n = 178), в группе с изолированной патологией (БА, n = 135) и в популяционной выборке г. Томска (n = 377). Ассоциативный анализ проведен как в отношении исходных трех групп больных (ИБС, БА, БА_АГ), так и подгрупп, дифференцированных на основании наличия/отсутствия диагноза «артериальная гипертензия», сформированных с учетом анализа сопутствующих патологий как в выборках больных, так и в популяционном контроле.Результаты и обсуждение. Показан предрасполагающий, по сравнению с изолированной БА, эффект генотипа GA для развития сочетания БА с АГ (OR = 1,94; p = 0,038) и для сочетания ИБС с АГ (OR = 2,26; p = 0,009). Частота генотипа АА в 3,98 раза реже регистрировались в группе индивидов с АГ, чем с нормотензией, однако из-за низкой встречаемости данного генотипа различия не достигают уровня статистической значимости.Заключение. Полученные результаты могут быть объяснены участием CYP2C19-метаболитов арахидоновой кислоты в регуляции сосудистого тонуса, однако представленные данные требуют дальнейшего изучения.
Ассоциативный анализ, генетика многофакторных заболеваний, коморбидные и изолированные состояния, цитохромы
Короткий адрес: https://sciup.org/149139360
IDR: 149139360 | УДК: 616-056.7:575.174.015.3 | DOI: 10.29001/2073-8552-2021-36-4-125-131
Текст научной статьи Ассоциации RS4244285 в гене CYP2C19 с многофакторными заболеваниями
Современные популяции человека испытывают сильные антропогенные нагрузки и все чаще сталкиваются с «эволюционно незнакомыми» веществами, в результате система биотрансформации ксенобиотиков вынуждена работать с большим напряжением. В то же время на относящиеся к этой системе ферменты эволюционно возложена совершенно иная задача, а именно участие в поддержании гомеостаза в организме посредством метаболизма эндогенных веществ (липидов, гормонов, витаминов и т. д.). Насколько успешно будет проходить биотрансформация как эндогенных, так и экзогенных веществ зависит, с одной стороны, от структурно-функцио- нальных особенностей ферментов системы биотрансформации (определяемых полиморфизмом кодирующих их генов), с другой, – от испытываемой организмом нагрузки вредными экзогенными факторами. При наличии дефектов в работе ферментов может повышаться риск возникновения патологических состояний как вследствие экзогенных воздействий, так и в результате сбоев в функционировании метаболических путей.
В системе метаболизма ксенобиотиков особая роль отводится обширной группе ключевых ферментов первой фазы биотрансформации ксенобиотиков – семейству цитохромов P450. Это монооксигеназы с низкой субстратной специфичностью, обусловливающей их возможность окислять различные вещества. Цитохромы P-450 игра- ют важную роль в биотрансформации лекарственных средств и других ксенобиотиков, но их первичная функция заключается в метаболизме желчных кислот, ненасыщенных жирных кислот, синтезе глюкокортикостероидных гормонов, холестерола, эйказаноидов и др. [1].
CYP2C19 является одной из семи изоформ P450, метаболизирующей лекарственные препараты [2]. Для цитохромов P450 характерно наличие генетически обусловленных форм с различной каталитической активностью: «медленные» (ферментативная активность снижена или отсутствует), «активные» (нормально функционирующий фермент), «быстрые» (повышенная ферментативная активность) метаболизаторы. Основной генетический дефект CYP2C19, исторически впервые обнаруженный у «медленных» метаболизаторов (S)-мефенитоина – это точечная замена G на A в пятом экзоне в положении 681 гена CYP2C19 (CYP2C19*2, rs4244285), приводящая к появлению аберрантного сайта сплайсинга и, как следствие, к синтезу укороченного нефункционального белка [3]. Позже снижение активности у гомозигот по вариантному аллелю rs4244285 было подтверждено в многочисленных исследованиях [4]. В настоящее время известно, что в результате синтеза укороченного белка кроме (S)-мефенитоина плохо метаболизируются и другие антиэпилептические и антиконвульсивные средства, а также антидепрессанты, ингибиторы протонной помпы, антигельминтные препараты, диклофенак, индометацин, прогуанил, варфарин, кло-пидогрел, пропранолол, циклофосфамид, нелфинавир, прогестерон, тенипозид, вориконазол и ряд других лекарственных препаратов [2]. Несмотря на то, что описан ряд нуклеотидных замен, приводящих к формированию фенотипа «медленных метаболизаторов» [2; https://omim. org; ], наиболее патогенетически значимым является именно rs4244285 в связи с высоким уровнем полиморфизма: среднепопуляционная частота неблагоприятного редкого аллеля A rs4244285 составляет 22%, варьируя от 6% у жителей Перу, до 41% у тамильцев (Шри-Ланка) [].
В связи с тем, что цитохромы участвуют в метаболизме лекарственных препаратов, наибольший интерес вызывает изучение вовлеченности полиморфизма генов цитохромов P450 в целом, и rs4244285 в частности, в формирование не изолированной патологии, а различных коморбидных состояний. Сочетание нескольких патологий у пациента предполагает наличие более тяжелой лекарственной нагрузки на организм, и в зависимости от того, насколько хорошо справляется с такой нагрузкой система биотрансформации, происходит либо компенсация имеющихся состояний, либо развиваются побочные эффекты вплоть до появления новых сопутствующих заболеваний. В развитии коморбидных состояний далеко не всегда можно выделить первичную патологию; еще сложнее сказать, является ли она причиной развития сочетанных болезней, или же имеется фактор, способствующий возникновению сразу нескольких патологических состояний.
В связи с вышесказанным представляется интересным изучение вовлеченности полиморфного варианта rs4244285 гена CYP2C19 в развитие изолированной и сочетанной форм патологии.
Материал и методы
Материалом для исследования послужила ДНК из «Биобанка населения Северной Евразии» НИИ медицинской генетики Томского НИМЦ. Включенный в исследование материал собирался с 2001 по 2018 г. при участии сотрудников медицинских учреждений г. Томска, диагнозы ставились на основании общепринятых критериев. В исследование включены русские жители г. Томска (всего 823 человек), каждый из которых подписал информированное согласие на проведение исследования.
Было сформировано 4 выборки:
-
1. Группа больных ишемической болезнью сердца (ИБС) в сочетании с артериальной гипертензией (АГ) и некоторыми другими заболеваниями (далее – группа «ИБС_ АГ», n = 133 индивида, средний возраст = 55,3 ± 7,7 года).
-
2. Группа больных бронхиальной астмой (БА) смешанного происхождения (форма, в патогенезе которой задействованы как экзогенные, так и эндогенные факторы, код по МКБ–10 J45.8) в сочетании с АГ (и некоторыми другими заболеваниями, «БА_АГ», n = 178, 61,8 ± 8,5).
-
3. Больные с изолированной БА (аллергическая БА, код J45.0, «БА», n = 135, 39,3 ± 12,3).
-
4. Популяционная выборка («К», n = 377, 47,0 ± 9,4).
Генотипирование осуществляли методом ПЦР-ПДРФ-анализа (полимеразная цепная реакция – полиморфизм длин рестрикционных фрагментов). Амплификацию проводили при 47 ºС (F: 5`-AGAGCTTGGCATATTGTA-3`; R: 5`-GAATCACAAATACGCAAG-3`). Полученный продукт длиной 299 п.о. подвергали гидролизу эндонуклеазой рестрикции MspI (ООО «СибЭнзим»). В результате при наличии аллеля G получали фрагмент длиной 299 п.о., аллеля A – 193 п.о. и 106 п.о.
Статистическую обработку данных проводили с использованием общепринятых методов (χ2, OR с 95% CI, оценка гетерогенности частот аллелей и генотипов осуществлялась методом χ2); статистически значимыми считались различия при p < 0,05.
Результаты
Проведено изучение частот аллелей и генотипов нуклеотидной замены G681A (rs4244285) в гене CYP2C19, приводящей к синтезу нефункционального фермента, в двух группах больных с коморбидными состояниями (ИБС с АГ, БА с АГ), в группе с изолированной патологией (БА) и в популяционной выборке г. Томска (таблица).
Таблица. Распределение частот аллелей и генотипов rs4244285 в гене CYP2C19 в изученных группах, %
Table. Frequencies of alleles and genotypes of rs4244285 in the CYP2C19 gene in study groups, %
|
Группы Groups |
n |
Генотипы Genotypes |
Аллели Alleles |
p (РХВ) (HWE) |
|||
|
GG |
GA |
AA |
G |
A |
|||
|
Аллергическая БА Allergic bronchial asthma |
135 |
85,19 |
14,07 |
0,74 |
92,22 |
7,78 |
0,826 |
|
Популяционная выборка г. Томска Population sample of the city of Tomsk |
377 |
78,25 |
20,95 |
0,80 |
88,73 |
11,27 |
0,356 |
|
Окончание табл. End of table |
|||||||
|
Группы Groups |
n |
Генотипы Genotypes |
Аллели Alleles |
p (РХВ) (HWE) |
|||
|
GG |
GA |
AA |
G |
A |
|||
|
ИБС с АГ Coronary artery disease + hypertension |
134 |
73,88 |
26,12 |
0,00 |
86,94 |
13,06 |
0,082 |
|
БА с АГ Bronchial asthma + hypertension |
178 |
75,28 |
24,16 |
0,56 |
87,36 |
12,64 |
0,211 |
|
*Сравнение групп / Intergroup comparison |
|||||||
|
БА vs. БА_АГ BA vs. BA_HTN |
GG: OR = 1,89 (CI: 1,01-3,53), χ 2 = 4,04; p = 0,044 |
||||||
|
БА_АГ vs. БА BA_HTN vs. BA |
AG: OR = 1,94 (CI: 1,03-3,68), χ2 = 4,30; p = 0,038 |
||||||
|
ИБС_АГ vs. БА CAD_HTN vs. BA |
AG: OR = 2,26 (CI: 1,21-4,27), χ 2 = 6,81; p = 0,009 |
||||||
Примечание: n – численность выборки, p (РХВ) – достигнутый уровень статистической значимости при сравнении наблюдаемого распределения генотипов ожидаемому при равновесии Харди – Вайнберга, * – приведены только статистически значимые различия, где OR – отношение шансов, CI – 95%-й доверительный интервал, χ2 – значение критерия χ2, p – достигнутый уровень значимости.
Note. n – sample size; p (HWE) – the achieved level of statistical significance when comparing the observed genotype distribution expected at Hardy-Weinberg equilibrium; * – only statistically significant differences are shown, where OR is the odds ratio, CI – 95% confidence interval, χ2 – value of the χ2 criterion, p – achieved level of significance.
Во всех изученных выборках наблюдалось соответствие наблюдаемого распределения генотипов, ожидаемому при равновесии Харди – Вайнберга.
Распределение аллелей и генотипов по rs4244285 ни в одной из исследованных групп больных статистически значимо не отличалось от такового в популяционной выборке. В то же время наблюдались существенные различия в распределении частот аллелей и генотипов между группами больных. При этом частота генотипа GG в группе пациентов с аллергической БА была выше, а в выборках пациентов с ИБС и БА в сочетании с АГ – ниже, чем в популяционной выборке (см. таблицу). При сравнении частот аллелей между двумя группами больных с БА различия были статистически не значимы ( p = 0,07), тем не менее можно говорить, что гомозиготный по частому аллею генотип статистически значимо чаще (OR = 1,89 (CI: 1,01–3,53), χ2= 4,04; p = 0,044) встречается в группе с аллергической БА. Гетерозиготный генотип, напротив, чаще встречается в группах больных с коморбидными состояниями: OR = 1,94 (CI: 1,03–3,68), χ2 = 4,30; p = 0,038 (при сравнении группы пациентов с БА и АГ и выборки пациентов с аллергической БА) и OR = 2,26 (CI: 1,21–4,27), χ2= 6,81; p = 0,009 (при сравнении выборок пациентов с ИБС и АГ и группы пациентов с аллергической БА).
Таким образом, аллель G в гомозиготном состоянии в большей степени способствует развитию аллергической БА, а в гетерозиготном состоянии предрасполагает к обоим изученным коморбидным состояниям. При этом значения частот как аллелей, так и генотипов в популяционной выборке занимают среднее положение, будучи немного ближе к таковым в выборках с коморбидными патологиями (с таким общим клиническим фенотипом, как АГ) (см. таблицу). Таким образом, встает вопрос: что мы зарегистрировали – предрасполагающий эффект аллеля G (в гомозиготном состоянии) к развитию БА или же предрасполагающий эффект аллеля A (в гетерозиготном состоянии) к развитию АГ?
По критериям формирования выборок одним из фенотипов, общих для двух групп больных, была БА (группы БА и БА_АГ), вторым – АГ (группы ИБС_АГ и БА_АГ). В популяционной выборке, в отличие от здорового контроля, есть определенная доля индивидов с различными заболеваниями, количество которых определяется распространенностью данных патологий в анализируемой популяции. Интересно, что исключение из популяционной выборки индивидов с АГ, БА и аллергией (подгруппа «К1», n = 117) меняет частоты аллелей всего на 1%, частоты генотипов – в пределах 1,2%. Анализ информации о сопутствующих заболеваниях, доступной для анализируемых групп, позволил подразделить всех включенных в исследование индивидов на пары подгрупп в зависимости от наличия или отсутствия заболеваний: «есть бронхиальная астма» – «нет бронхиальной астмы» и «есть гипертензия» – «нет гипертензии».
Подгруппы, дифференцированные по наличию/от-сутствию диагноза «бронхиальная астма» (рис. 1), оказались близки между собой как по частотам аллелей (различия порядка 1%), так и по частотам генотипов (различия менее 4%). В то же время между подгруппами, сформированными в зависимости от наличия/отсут-ствия диагноза «артериальная гипертензия», различия несколько больше и составляют по частотам аллелей 2,3%, по частотам генотипов доходят до 5,9%. При этом различия частот генотипа AG в группах, дифференцированных по наличию/отсутствию АГ, достигают пограничных значений (уровень значимости без поправки Йейтса составляет 0,049; с введением поправки – 0,06). Сравниваемые группы, выделенные по наличию/отсутствию АГ, достаточно гетерогенны, так как «собраны» искусственно из выборок пациентов с различными заболеваниями. Однако полученные нами результаты сравнения значительно более гомогенных групп, унифицированных по одному из фенотипов (БА) и дифференцированных по другому (АГ) (см. таблицу), подтверждают наличие более высокой частоты гетерозиготного генотипа у групп с АГ по сравнению с выборкой без этого диагноза, и этот результат статистически значим. Соответственно, оба подхода к выделению групп с АГ приводят к одному результату, а именно: гетерозиготный генотип rs4244285 в гене CYP2C19 дифференцирует группу с АГ в составе коморбидности.
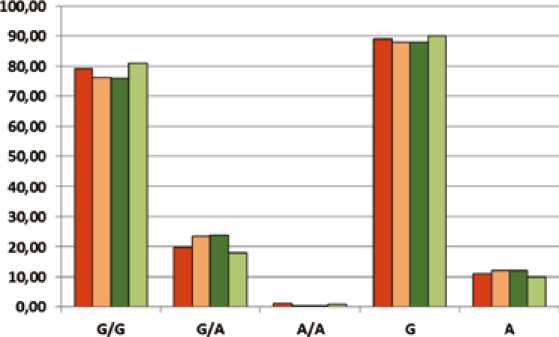
D БА – все
О не БА – все
■ АГ – все a не – АГ все
Рис. 1. Диаграмма частот аллелей и генотипов rs4244285 в гене CYP2C19 в подгруппах, дифференцированных по фенотипам «бронхиальная астма» и «артериальная гипертензия»
Fig. 1. Frequency diagram of alleles and genotypes rs4244285 in the CYP2C19 gene in subgroups assigned based on the phenotypes of “bronchial asthma” and “hypertension”
Вовлеченность полиморфных вариантов генов изоформ цитохрома P450 в развитие АГ изучается довольно активно. Наиболее часто в этой связи для анализа привлекался полиморфизм гена CYP2J2 [5, 6], а также CYP2C8 [5, 7], CYP2C9 [7]. Публикаций, посвященных изучению ассоциаций CYP2C19 с АГ, немного и они противоречивы. В двух популяциях (в корейской и китайской) выявлены ассоциации АГ с другими маркерами (rs4986893 и rs10509676) в гене CYP2C19 [8, 9]. В большом метаанализе, включающем более 146 тыс. индивидов (американцы европейского происхождения, афроамериканцы и латиноамериканцы), установлена ассоциация интронного варианта в гене CYP2C19 (rs4494250) с уровнем артериального давления [10]. Корейскими учеными показано преобладание (на 2,31% чаще) редкого аллеля A rs4244285 у больных с гипертензией [9]. В популяции русских центральной России зарегистрирован на уровне тенденции протективный эффект генотипа АА rs4244285 по отношению к эссенциальной гипертензии (различия частот между группами – 2,2%) [11]. В проведенном нами исследовании генотип АА у больных с гипертензией также встречается реже (в 3,98 раза), чем у индивидов без этой патологии. Следует акцентировать внимание на том факте, что замена G681A (rs4244285) является достаточно редким вариантом, ее усредненная частота в настоящем исследовании составляет 11,3%, частота генотипа AA – 0,61% (варьируя от 0 до 0,8% в сравниваемых подгруппах).
Таким образом, вклад в развитие патологических фенотипов редко регистрируемого гомозиготного генотипа AA, во-первых, трудно оценим (требует больших выборок), во-вторых, не может быть большим. Тем не менее на уровне гетерозигот, частота которых в исследуемых группах варьирует от 14,07 до 26,12%, эффект патологического аллеля выявляется и достигает уровня статистической значимости. Однако увеличения частоты гетерозигот у больных с гипертензией, выявленного в настоящем исследовании (на 5,9%), наши коллеги [11] не наблюдали. Этот феномен может быть связан с тем, что в сравниваемые исследования были включены пациенты с гипертонией различного генеза – исключительно эссенциальная гипертония в центрально-европейской русской когорте и значительно более гетерогенная группа в нашем исследовании. Стоит отметить и тот факт, что в целом частота гомозигот в нашем исследовании была значительно ниже (00,8%) по сравнению с данными А.В. Полоникова и соавт. (0,84–2,82%) [11].
Не до конца понятно, каков механизм вовлеченности данного гена в реализацию гипертензивного фенотипа; в качестве наиболее вероятного в научной литературе обсуждается путь метаболизма арахидоновой кислоты [8, 11]. Арахидоновую кислоту метаболизирует ряд изоформ подсемейства CYP2. Метаболиты арахидоновой кислоты являются вазоактивными медиаторами: эпоксиэйкоза-триеновые кислоты (EET) способствуют вазодилатации, а гидрокси-метаболиты (HETE) обладают вазоконстрикторным свойством [12]. Соответственно, при сниженном метаболизме арахидоновой кислоты можно наблюдать эффекты, к которым приводит недостаток ее активных метаболитов [13].
Наиболее изучен физиологический механизм действия таких медиаторов, как 11,12-EET, 14,15-EET (синтезирующихся в результате работы CYP2C8 и CYP2C9) и 20-HETE (продукт ω-гидроксилазы CYP4A11) [14]. Кроме того, известно, что в клетках тканей сердечно-сосудистой системы из всех цитохромов P450 наиболее активно экспрессируется CYP2J2 [15]. Вероятно, поэтому в ассоциативных исследованиях гипертензии из всех генов цитохромов основное внимание фокусируется именно на генах CYP2J2, CYP2C8 и CYP2C9. Вместе с тем показано, что CYP2C19 также метаболизирует арахидоновую кислоту до 8,9-EET, 14,15-EET и 19-HETE [16]. Видимо, этим и может объясняться рисковый эффект аллеля A rs4244285 гена CYP2C19, для АГ: синтез нефункционального белка в общем пуле ферментов может снижать эффективность продукции EET, что при сохранном уровне продукции HETE может привести к сдвигу баланса в сторону вазоконстрикции и, следовательно, способствовать развитию гипертензии. Следует заметить, что фенотип медленных метаболизаторов наследуется по аутосомно-рецессивному типу [, 4], в связи с этим выявленный нами рисковый эффект гетерозиготного генотипа остается не вполне объяснимым и требует дальнейшего изучения.
Гены белков семейства цитохромов активно привлекаются для изучения подверженности многофакторной патологии. Так, rs4244285 ассоциирован с метаболическим синдромом, атеросклерозом у курящих пациентов, аспирин-индуцированной БА, патогенетически значимыми количественными показательными (у больных БА, туберкулезом легких), циркулирующими сывороточными маркерами воспаления, АДФ-стимулированной реактивностью тромбоцитов, более высокой агрегацией тромбоцитов и остаточной реактивностью тромбоцитов [ и др.]. Много исследований посвящено изучению rs4244285 при сердечно-сосудистых заболеваниях [13, 15, 17, 18].
Поскольку данный полиморфный вариант в гене CYP2C19 приводит к потере функции фермента, основные исследования rs4244285 направлены именно на установление его роли в развитии лекарственного ответа у пациентов. Так, было выявлено, что вероятность неблагоприятных сердечно-сосудистых событий (инфаркты, инсульты и пр.) у принимающих клопидогрел носителей аллеля A (как гомо- так и гетерозиготных) значительно выше, чем у гомозигот по аллелю G [19, 20]. И, напротив, для некоторых патологий лечение оказывается более успешным именно у гомозиготных по аллелю А индивидов, поскольку действующие вещества препаратов у них метаболизируются существенно медленнее, что обусловливает более пролонгированный терапевтический эффект. Этот факт показан, например, при лечении язвенной болезни ингибиторами протонной помпы [21].
Развитие неблагоприятных сердечно-сосудистых событий у лиц с патологией сердечно-сосудистой системы, принимающих клопидогрел, чаще всего объясняется с
Список литературы Ассоциации RS4244285 в гене CYP2C19 с многофакторными заболеваниями
- Rekka E.A., Kourounakis P.N., Pantelidou M. Xenobiotic metabolising enzymes: Impact on pathologic conditions, drug Interactions and drug design. Curr. Top Med. Chem. 2019;19(4):276-291. DOI: 10.2174/156 8026619666190129122727.
- Botton M.R., Whirl-Carrillo M., Del Tredici A.L., Sangkuhl K., Cavallari L.H., Agundez J.A.G. et al. PharmVar GeneFocus: CYP2C19. Clin. Pharmacol. Ther. 2021;109(2):352-366. DOI: 10.1002/cpt.1973.
- De Morais S.M.F., Wilkinson G.R., Blaisdell J., Nakamura K., Meyer U.A., Goldstein J.A. The major genetic defect responsible for the polymorphism of S-mephenytoin metabolism in humans. J. Biol. Chem. 1994;269(22):15419-15422.
- Song B.L., Wan M., Tang D., Sun C., Zhu Y.B., Linda N. et al. Effects of CYP2C19 genetic polymorphisms on the pharmacokinetic and pharmacodynamic properties of Clopidogrel and its active metabolite in healthy Chinese subjects. Clin. Ther. 2018;40(7):1170-1178. DOI: 10.1016/j. clinthera.2018.06.001.
- King L.M., Gainer J.V., David G.L., Dai D., Goldstein J.A., Brown N.J. et al. Single nucleotide polymorphisms in the CYP2J2 and CYP2C8 genes and the risk of hypertension. Pharmacogenet. Genomics. 2005;15(1):7-13. DOI: 10.1097/01213011-200501000-00002.
- Polonikov A.V., Ponomarenko I.V., Bykanova M.A., Sirotina S.S., Bo-charova A.V., Vagaytseva K.V. et al. A comprehensive study revealed SNP-SNP interactions and a sex-dependent relationship between polymorphisms of the CYP2J2 gene and hypertension risk. Hypertens. Res. 2019;42(2):257-272. DOI: 10.1038/s41440-018-0142-1.
- Dreisbach A.W., Japa S., Sigel A., Parenti M.B., Hess A.E., Srinouan-prachanh S.L. et al. The prevalence of CYP2C8, 2C9, 2J2, and soluble epoxide hydrolase polymorphisms in African Americans with hypertension. Am. J. Hypertens. 2005;18(10):1276-1281. DOI: 10.1016/j.amjhy-per.2005.04.019.
- Ma Y., Ni W., Zhu W., Xiong Y., Deng X. Association of genetic polymorphisms of CYP 2C19 with hypertension in a Chinese Han population. Blood Press. 2011;20(3):166-170. DOI: 10.3109/08037051.2010.542640.
- Shin D.J., Kwon J., Park A.R., Bae Y., Shin E.S., Park S. et al. Association of CYP2C19*2 and *3 genetic variants with essential hypertension in Koreans. Yonsei Med. J. 2012;53(6):1113-1119. DOI: 10.3349/ ymj.2012.53.6.1113.
- Liu C., Kraja A.T., Smith J.A., Brody J.A., Franceschini N., Bis J.C. et al. Meta-analysis identifies common and rare variants influencing blood pressure and overlapping with metabolic trait loci. Nat. Genet. 2016;48(10):1162-1170. DOI: 10.1038/ng.3660.
- Polonikov A., Bykanova M., Ponomarenko I., Sirotina S., Bocharova A., Vagaytseva K. et al. The contribution of CYP2C gene subfamily involved in epoxygenase pathway of arachidonic acids metabolism to hypertension susceptibility in Russian population. Clin. Exp. Hypertens. 2017;39(4):306-311. DOI: 10.1080/10641963.2016.1246562.
- Fleming I. The factor in EDHF: Cytochrome P450 derived lipid mediators and vascular signaling. Vascul. Pharmacol. 2016;86:31-40. DOI: 10.1016/j.vph.2016.03.001.
- Zordoky B.N.M., El-Kadi A.O.S. Effect of cytochrome P450 polymorphism on arachidonic acid metabolism and their impact on cardiovascular diseases. Pharmacol. Ther. 2010;125(3):446-463. DOI: 10.1016/j. pharmthera.2009.12.002.
- Capdevila J.H., Wang W., Falck J.R. Arachidonic acid monooxygenase: Genetic and biochemical approaches to physiological/pathophysiologi-cal relevance. Prostaglandins Other Lipid Mediat. 2015;120:40-49. DOI: 10.1016/j.prostaglandins.2015.05.004.
- Fava C., Bonafini S. Eicosanoids via CYP450 and cardiovascular disease: Hints from genetic and nutrition studies. Prostaglandins Other Lipid Mediat. 2018;139:41-47. DOI: 10.1016/j.prostaglandins.2018.10.001.
- Bylund J., Kunz T., Valmsen K., Oliw E.H. Cytochromes P450 with bisal-lylic hydroxylation activity on arachidonic and linoleic acids studied with human recombinant enzymes and with human and rat liver microsomes. J. Pharmacol. Exp. Ther. 1998;284(1):51-60.
- Tantray J.A., Reddy K.P., Jamil K., Yerra S.K. Role of cytochrome ep-oxygenase (CYP2J2) in the pathophysiology of coronary artery disease in South Indian population. Indian Heart J. 2019;71(1):60-64. DOI: 10.1016/j.ihj.2018.11.011.
- Swadi A.A., Mohammad B.I., Hadi N.R., Al-Aubaidy H.A. Correlation of CYP2D6 allelic polymorphism to outcome of acute coronary syndrome in mid-Euphrates Iraqi patients on metoprolol therapy. Gene. 2019;703:112-119. DOI: 10.1016/j.gene.2019.04.012.
- Li S., Choi J.L., Guo L.Z., Goh R.Y., Kim B.R., Woo K.S. et al. Correlation between the CYP2C19 phenotype status and the results of three different platelet function tests in cardiovascular disease patients receiving antiplatelet therapy: An emphasis on newly introduced platelet function analyzer-200 P2Y test. Ann. Lab. Med. 2016;36(1):42-48. DOI: 10.3343/alm.2016.36.1.42.
- Yang D., Peng C., Liao Z., Wang X., Guo W., Li J. The effect of the CY-P2C19*2 allele on cardiovascular outcomes in patients with coronary artery stenting: A prospective study. Arch. Med. Sci. 2019;15(4):837-844. DOI: 10.5114/aoms.2018.75349.
- Lima J.J., Thomas C.D., Barbarino J., Desta Z., Van Driest S.L., El Rouby N. et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for CYP2C19 and proton pump inhibitor dosing. Clin. Pharmacol. Ther. 2021;109(6):1417-1423. DOI: 10.1002/cpt.2015.
- Chen M., Liu X.J., Yan S.D., Peng Y., Chai H., Li Q. et al. Association between cytochrome P450 2C19 polymorphism and clinical outcomes in Chinese patients with coronary artery disease. Atherosclerosis. 2012;220(1):168-171. DOI: 10.1016/j.atherosclerosis.2011.04.008.
- Bertrand-Thiébault C., Berrahmoune H., Thompson A., Marie B., Droesch S., Siest G. et al. Genetic Polymorphism of CYP2C19 gene in the Stanislas cohort. A link with inflammation. Ann. Hum. Genet. 2008;72(2):178-183. DOI: 10.1111/j.1469-1809.2007.00417.x.


