Ассоциация генов XRCC1, HMMR с развитием рака молочной железы в кыргызской популяции
Автор: Семетей Кызы А., Макимбетов Э.К., Исакова Ж.Т., Кудайбергенова И.О., Камарли З.П.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 4 т.8, 2018 года.
Бесплатный доступ
Влияние генов XRCC1, HMMR на развитие рака молочной железы в кыргызской популяции ранее не было изучено. В исследовании приняли участие 99 женщин кыргызской этнической группы с морфологически верифицированным диагнозом рак молочной железы (РМЖ), получавшие стационарное лечение в Национальном центре онкологии и Диагностическом центре «КафМедЦентр» (г. Бишкек, Кыргызская Республика). Средний возраст пациентов составил 53 года (24-74, SE mean = 0,967, STD = 9,81). В контрольную группу вошли 102 условно здоровые женщины кыргызской этнической группы, находящиеся в той же возрастной категории, что и исследуемые. Генотипирование осуществлялось методом ПЦР-ПДРФ. При сравнении результатов генотипирования, гистологической структуры опухоли и фактора «менопауза» использовался точный критерий Фишера. Расчет отношения шансов проводился путем построения таблицы кросс-табуляции. Показано, что для генотипа Arg / Arg полиморфного локуса Arg194Trp гена XRCC1 имеется статистически значимая ассоциация с фактором «менопауза»...
Рак молочной железы, полиморфизм, кыргызская популяция
Короткий адрес: https://sciup.org/140243805
IDR: 140243805 | DOI: 10.18027/2224-5057-2018-8-4-45-49
Текст научной статьи Ассоциация генов XRCC1, HMMR с развитием рака молочной железы в кыргызской популяции
Нарушение процессов репарации поврежденной ДНК является главной движущей силой канцерогенеза [1]. При наличии мутаций в генах, ответственных за репарацию и удаление поврежденных нитей ДНК, происходит накопление мутантных участков ДНК, кодирующих формирование клеток с патологическим геномом. Эти клетки ускользают из-под контроля системы апоптоза, имеют тенденцию к быстрому росту и поддерживают свое существование, несмотря на их функциональную неполноценность.
В данной статье было изучено влияние двух генов на развитие РМЖ в кыргызской популяции: XRCC1 Arg194Trp и HMMR V353A.
Ген XRCC1 (X-ray repair cross-complementing gene 1) – ключевой компонент репарации ДНК [2]. По своей природе он является протеином, состоящим из трех функциональных доменов: терминальный ДНК-связываю-щий N-домен, центрально расположенный BRCT-домен и С-терминальный BRCT-домен. Хотя ген XRCC1 не обладает известной ферментативной активностью, он функционирует как белок молекулярного каркаса и тесно связан с координацией восстановления ДНК, взаимодействуя с несколькими компонентами пути BER (base excision repair)/SSBR (single-strand breaks), такими как гликози-лазы ДНК, апуриновая/апиримидиновая эндонуклеаза (APE1), PARP-1, полинуклеотид-киназа (PNK) и лигаза III [3, 4]. Доклинический дефицит XRCC1 задерживает восстановление SSB (single-strand breaks), индуцирует мутации и приводит к повышенному уровню обмена сестринскими хроматидами, что является отличительной чертой геномной нестабильности. Дефицит XRCC1 приводит к гиперчувствительности опухоли к ионизирующей радиации и химиотерапии [4, 5].
Ген HMMR (hyaluronan mediated motility receptor) является вне- и внутриклеточным протеином, который «утилизирует» гиалуроновую кислоту, а также взаимодействует с тубулином, участвующим в построении митотического веретена [8]. Функции гиалуроновой кислоты (ГК) зависят от размера полисахаридов: ГК с высоким молекулярным весом несет ответственность за структурные функции, тогда как ГК с низким молекулярным весом обеспечивает взаимодействие с клеточными рецепторами (СD44 и RHAAM). То есть ГК с низким молекулярным весом передает сигналы к клеточным путям, регулирующим пролиферацию, дифференцировку, адгезию и инвазивную активность опухолевых клеток. RHAAM вовлекается в пролиферацию, миграцию, инвазию и формирование митотического веретена в опухолевых клетках [8]. Показано, что RHAAM синтезируется в избытке в опухолевых клетках с агрессивным фенотипом (при РМЖ, гемобластозах, раке поджелудочной железы, колоректальном раке, солидных опухолях, миелоидном лейкозе, множественной миеломе). Избыточный синтез RHAAM и гиалуроновой кислоты ассоциирован с неблагоприятным прогнозом заболевания. В связи с этим RHAAM может быть идеальной молекулярной мишенью для разработки противоопухолевых препаратов.
Целью данного исследования является определение ассоциации генотипов XRCC1 Arg194Trp, HMMR V353A с развитием РМЖ в кыргызской популяции.
Материалы и методы исследования
В исследовании приняли участие 99 женщин кыргызской этнической группы с морфологически верифицированным диагнозом рак молочной железы (РМЖ), получавшие стационарное лечение в Национальном центре онкологии и Диагностическом центре «КафМедЦентр» (г. Бишкек, Кыргызская республика). Средний возраст пациентов составил 53 года (24–74, SE mean = 0,967, STD=9,81). В контрольную группу вошли 102 условно здоровые женщины кыргызской этнической группы, находящиеся в той же возрастной категории, что и исследуемые.
Сбор венозной крови и анкетных данных осуществлялся с соблюдением этических норм и с информированного согласия каждого пациента.
Генотипирование проводилось в НИИ молекулярной биологии и медицины (г. Бишкек, Кыргызская Республика) с использованием метода ПЦР-ПДРФ (полимеразно-цепная реакция и полиморфизм длин рестрикционных фрагментов).
Для количественной оценки данных определяли частоты встречаемости в процентах. Для установления связи между возрастом больных и результатами генотипирования использовался коэффициент Хи-квадрат, точный критерий Фишера. Расчет отношения шансов осуществлялся с помощью построения таблицы кросс-табуляции с использованием программы SPSS 16.0.
Таблица 1. Распределение генотипов XRCC1 Arg194Trp, HMMR V353A по частоте встречаемости в разных возрастных группах
Преобладающие генотипы
|
Возрастная группа |
ген XRCC1 Arg194Trp |
ген HMMR V353A |
|
20–30 лет |
Arg/Arg |
TT |
|
30–40 лет |
Arg/Arg |
СT |
|
40–50 лет |
Arg/Arg |
TT |
|
50–60 лет |
Arg/Arg |
TT |
|
60–70 лет |
Arg/Arg |
СС |
|
70–80 лет |
Trp/Trp |
СT |
Результаты
В данной работе мы попытались установить наличие связи между возрастом верификации диагноза РМЖ и генотипом. Для этого мы провели условное разделение женщин на шесть возрастных категорий: 20–30, 30–40, 40–50, 50–60, 60–70, 70–80 лет – и определили частоты встречаемости генотипов в каждой категории. Полученное нами распределение генотипов в каждой возрастной группе показано в табл. 1.
Впрочем в связи с тем, что генотип Trp/Trp в нашем исследовании встречается относительно редко (менее 5 %), для проведения дальнейшего статистического анализа пациенты с генотипами Arg/Trp и Trp/Trp были объединены в одну группу (табл. 2).
Однако статистически значимой связи между возрастом верификации диагноза и генотипами генов XRCC1 (р=0,396), HMMR (р=0,351) выявлено не было.
Далее мы попытались установить наличие достоверных различий между распределением генотипов генов XRCC1, HMMR у женщин с наступившей менопаузой и у женщин без менопаузы. Средний возраст наступления менопаузы в нашем исследовании составил 43 года, при этом менопауза наблюдалась у 33 пациенток (33,3 %). Нами была выявлена статистически значимая связь между распределением генотипов полиморфного локуса Arg194Trp гена XRCC1 и фактором «менопау-
Таблица 2. Распределение генотипов XRCC1 Arg194Trp, HMMR V353A в зависимости от возраста больных
|
Генотип |
Число пациентов |
|||||
|
20–30 лет |
30–40 лет |
40–50 лет |
50–60 лет |
60–70 лет |
70–80 лет |
|
|
XRCC1 Arg194Trp |
||||||
|
Arg/Arg |
3 (100 %) |
13 (92,9 %) |
28 (71,8 %) |
18 (60 %) |
7 (58,3) |
0 (0 %) |
|
Arg/Trp+Trp/Trp |
0 (0%) |
1 (7,1 %) |
11 (25,2 %) |
12 (40 %) |
5 (41,7 %) |
1 (100 %) |
|
HMMR V353A |
||||||
|
CC |
0 (0%) |
3 (21,4 %) |
6 (15,4 %) |
6 (20,0 %) |
5 (41,7 %) |
0 (0 %) |
|
CT |
0 (0%) |
6 (42,9 %) |
15 (38,5 %) |
8 (26,7 %) |
3 (25,0 %) |
1 (100 %) |
|
TT |
3 (100%) |
5 (35,7 %) |
18 (46,2 %) |
16 (53,3 %) |
4 (33,3 %) |
0 (0 %) |
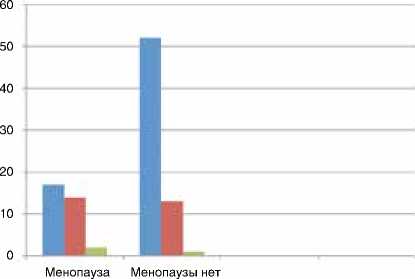
■ Arg/Arg
■ Arg/Trp
Trp/Trp
Рисунок 1. Распределение генотипов полиморфного локуса Arg194Trp гена XRCC1 в группе женщин с менопаузой и без за» (p=0,018). То есть у пациенток в менопаузе генотип Arg/Arg полиморфного локуса Arg194Trp гена XRCC1 встречается с частотой 52 %, тогда как у женщин до наступления менопаузы тот же генотип встречается с частотой 78,8 % (p=0,009) (рис. 1).
Также мы попытались установить наличие связи между генотипами и гистологической структурой опухоли. Гистологическая структура опухоли в нашем исследовании показана в (табл. 3).
Однако статистически значимой связи обнаружено не было (р=0,254).
Также мы предприняли попытку выяснить, является ли определенный генотип генов XRCC1, HMMR фактором риска развития РМЖ в кыргызской популяции. Для этого мы сравнили частоты встречаемости генотипов полиморфного локуса Arg194Trp гена XRCC1, полиморфного локуса V353A гена HMMR в исследуемой и контрольной группах (табл. 4), а также рассчитали отношение шансов для каждого генотипа.
При расчете отношения шансов (OR) нами была выявлена статистически значимая разница во встречаемости генотипа CT полиморфного локуса V353A гена HMMR в исследуемой и контрольной группах (OR=0,481, 95 % CI=0,27–0,85). В связи с этим можно предположить, что генотип СТ является «протективным» фактором и ассоциирован с низким риском развития РМЖ в кыргызской популяции (табл. 5).
Заключение
Таким образом, в результате проведенного нами исследования было обнаружено, что наступление менопаузы
Таблица 3. Гистологическая структура опухоли
Подтипы Число пациентов
|
Дольковый инфильтрирующий |
35 (33,9%) |
|
Протоковый инфильтрирующий |
57 (55,3%) |
|
Рак Педжета |
1 (0,8%) |
|
Цистаденокарцинома |
1 (0,8%) |
|
Рак с признаками лечебного патоморфоза |
8 (7,7%) |
|
Гемангиоперицитома |
1 (0,8%) |
Таблица 4. Частота встречаемости генотипов XRCC1 Arg194Trp, PALB2 T1100T (3300T>G), HMMR V353A, TNF aG3080A в исследуемой и контрольной группах (в процентах)
|
Ген/ полиморфизм |
Генотип |
Частота встречаемости, % (абсолютное число) |
|
|
Исследуемая группа |
Контрольная группа |
||
|
XRCC1 |
Arg/Arg |
69,6% (69) |
61,7% (63) |
|
Arg194Trp |
Arg/Trp |
27,2% (27) |
33,3% (34) |
|
Trp/Trp |
3,03% (3) |
4,9% (5) |
|
|
HMMR |
CC |
20,2% (20) |
11,7% (12) |
|
V353A |
CT |
33,3% (33) |
50,9% (52) |
|
TT |
46,4% (46) |
37,2% (38) |
|
Таблица 5. Расчет отношения шансов для генотипов XRCC1 Arg194Trp, HMMR V353A
Список литературы Ассоциация генов XRCC1, HMMR с развитием рака молочной железы в кыргызской популяции
- Sieber O. M., Heinimann K., Tomlinson I. P. Genomic instability -the engine of tumorigenesis? Nat. Rev. Cancer. 2003. Vol. 3. P. 701-708.
- Sultana R., Abdel-Fatah T., Abbotts R., Hawkes C., Albarakati N. Targeting XRCC1 Deficiency in Breast Cancer for Personalized Therapy. Cancer Res. 2013. Vol. 73 (5). P. 1621-1634. DOI: 10.1158/0008-5472.CAN-12-2929 2013.
- Ladiges W. C. Mouse models of XRCC1 DNA repair polymorphisms and cancer. Oncogene. 2006. Vol. 25. P. 1612-1619.
- Horton J. K., Watson M., Stefanick D. F., Shaughnessy D. T., Taylor J. A., Wilson S. H. XRCC1 and DNA polymerase beta in cellular protection against cytotoxic DNA single-strand breaks. Cell Res. 2008. Vol. 18. P. 48-63.
- Zhang R., Niu Y., Zhou Y. Increase the cisplatin cytotoxicity and cisplatin-induced DNA damage in HepG2 cells by XRCC1 abrogation related mechanisms. Toxicol. Lett. 2010. Vol. 192. P. 108-114.
- Tischkowitz M., Xia B., Sabbaghian N. et al. Analysis of PALB2/FANCN-associated breast cancer families. Proc. Natl. Acad. Sci. USA. 2007. Vol. 104. P. 6788-6793.
- Rahman N., Seal S., Thompson D., Kelly P., Renwick A., Elliott A., Reid S., Spanova K., Barfoot R., Chagtai T. et al. PALB2, which encodes a BRCA2-interacting protein, is a breast cancer susceptibility gene. Cancer. 2007. Vol. 39. P. 165-167.
- Akentyeva N. P., Shushanov S. S., Kotelnikov A. I. Effects of RHAAM/HMMR -selective peptides on survival of breast cancer cells. Bulletin of Experimental Biology and Medicine. 2015. Vol. 159. No. 5. P. 658-661.
- Lejeune F. J., Ruegg C., Lienard D. Clinical applications of TNF-alpha in cancer. Curr. Opin. Immunol. 1998. Vol. 10. P. 573-580.
- Balkwill F., Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001. Vol. 357. P. 539-545
- Balkwill F. Tumor necrosis factor or tumor promoting factor? Cytokine Growth Factor Res. 2002. Vol. 13. P. 135-141.
- Leek R. D., Landers R., Fox S. B., Ng F., Harris A. L. et al. (1998) Association of tumour necrosis factor alpha and its receptors with thymidine phosphorylase expression in invasive breast carcinoma. Brit. J. Cancer. 1998. Vol. 77. P. 2246-2251.


