Ассоциация экспрессии интегринов в ткани опухоли с гематогенным метастазированием рака молочной железы
Автор: Завьялова М.В., Кузнецов Г.А., Григорьева Е.С., Таширева Л.А., Письменный Д.С., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.22, 2023 года.
Бесплатный доступ
Гематогенные метастазы при раке молочной железы чаще всего являются причиной летального исхода. необходим поиск диагностических маркеров, которые могли бы прогнозировать риск и локализацию возможных гематогенных метастазов. Одним из подходов к решению такой задачи является изучение экспрессии интегринов, которые участвуют в процессах, обусловливающих прогрессирование карцином. Цель исследования - изучить ассоциацию экспрессии интегринов в ткани опухоли при гематогенном метастазировании у больных раком молочной железы. Материал и методы. В исследование включено 72 больных (средний возраст - 51 ± 12 лет) с неспецифицированной инвазивной протоковой карциномой молочной железы T1-4N0-3M0-1 стадии, со всеми молекулярно-биологическими подтипами (люминальный А, люминальный Б, HER2-позитивный и трижды негативный). Биопсийный материл исследовался до начала противоопухолевого лечения. Экспрессию интегринов в опухолевых клетках оценивали иммуногистохимическими методами. Использовались антитела CD61 (интегрин β3, Invitrogen, США), CD104 (интегрин β4, Invitrogen, США), CD51 (интегрин αV, Invitrogen, США).
Рак молочной железы, интегрины, гематогенные метастазы, первично-метастатический рак
Короткий адрес: https://sciup.org/140303547
IDR: 140303547 | УДК: 618.19-006.6-033.2:611-018.5 | DOI: 10.21294/1814-4861-2023-22-6-103-110
Текст научной статьи Ассоциация экспрессии интегринов в ткани опухоли с гематогенным метастазированием рака молочной железы
Актуальность
Рак молочной железы (РМЖ) занимает лидирующую позицию в структуре заболеваемости и смертности женщин от онкологической патологии. Несмотря на то, что в последнее время увеличилось число наблюдений, когда диагностируется рак молочной железы I или II стадии, при первом обращении больных за медицинской помощью продолжают встречаться случаи диссеминированного РМЖ [1]. Отдаленные метастазы чаще всего являются причиной наступления летальных исходов при РМЖ. В связи с этим актуальным является поиск прогностических параметров, ассоциированных с гематогенным метастазированием. Изучение интегринового профиля первичной опухоли представляется важным объектом такого поиска [2, 3].
Интегрины представляют собой трансмембранные рецепторы-гликопротеины, имеющие короткий цитоплазматический С-концевой, трансмембранный и длинный внеклеточный N-концевой домены. Внеклеточные домены служат для связывания с различными лигандами. В состав интегри-нов входит две субъединицы: α и β. Субъединица α необходима для передачи сигнала на цитоскелет, благодаря чему может изменяться форма клетки. Благодаря субъединице β осуществляется взаимо- действие с внеклеточным матриксом. Различные комбинации α- и β- цепей представляют собой более 20 интегринов, связывающихся с различными лигандами, наибольшее значение среди которых придают фибронектину, ламинину, витронектину, коллагенам. Взаимодействие с указанными компонентами межклеточного матрикса обеспечивает инвазивный рост и клеточную миграцию [2]. Интегрины играют важную роль в интравазации и экстравазации – важнейших этапах гематогенного метастазирования [4]. Интегрины, которые распознают мотивы RGD, составляют наиболее важное подсемейство интегриновых рецепторов, играющих важную роль в метастазировании [5].
Благодаря межклеточным взаимодействиям и взаимодействию с межклеточным матриксом интегрины рассматривают как один из ключевых моментов опухолевой инвазии и метастазирования. CD104 (интегрин β4) является рецептором ламинина; CD51 (интегрин αV) представляет собой рецептор витронектина; CD61 (интегрин β3) является структурным компонентом мембран тромбоцитов [3]. Данные интегрины представляют интерес для изучения метастатического потенциала злокачественных новообразований с реализацией в отдаленную диссеминацию.
Таблица /table
Характеристика исследуемых групп больных
Characteristics of the groups of patients
|
Гематогенные метастазы/ |
||
|
Параметр/Parameter |
Hematogenous metastases Нет/No (n=49) Есть/Yes (n=23) |
p-level |
|
Возраст/ Age, Me [Q1; Q3] |
50,0 [43,0; 60,0] |
54,0 [42,0; 62,0] |
0,369 |
|
Характеристика первичного опухолевого узла/Primary tumor characteristics |
|||
|
Т1 |
12/49 (24 %) |
2/23 (9 %) |
0,131 |
|
Т2 |
23/49 (47 %) |
15/23 (65 %) |
0,079 |
|
Т3 |
4/49 (8 %) |
1/23 (4 %) |
0,264 |
|
Т4 |
10/49 (21 %) |
5/23 (22 %) |
0,462 |
|
Степень злокачественности/Grade |
|||
|
G1 |
2/49 (4 %) |
2/23 (9 %) |
0,196 |
|
G2 |
45/49 (92 %) |
20/23 (87 %) |
0,252 |
|
G3 |
2/49 (4 %) |
1/23 (4 %) |
0,500 |
|
Молекулярно-генетический тип/Molecular genetic type of breast |
cancer |
||
|
Люминальный А/Luminal A |
9/49 (19 %) |
4/23 (17,5 %) |
0,439 |
|
Люминальный В HER2 отрицательный/ Luminal B HER2 negative |
24/49 (49 %) |
11/23 (48 %) |
0,468 |
|
Люминальный В HER2 положительный/ Luminal B HER2 positive |
7/49 (14 %) |
4/23 (17,5 %) |
0,350 |
|
HER2 положительный (не люминальный)/ HER2 positive (non Luminal) |
3/49 (6 %) |
3/23 (13 %) |
0,158 |
|
Базальноподобный (тройной негативный)/ Basal-like (triple-negative) |
6/49 (12 %) |
1/23 (4 %) |
0,141 |
|
Критерий N/Category N |
|||
|
N0 |
21/49 (43 %) |
1/23 (4 %) |
0,008 |
|
N+ |
28/49 (57 %) |
22/23 (96 %) |
0,008 |
|
N1 |
17/49 (35 %) |
12/23 (52 %) |
0,875 |
|
N2 |
3/49 (6 %) |
0/23 (0 %) |
0,117 |
|
N3 |
8/49 (16 %) |
10/23 (44 %) |
0,051 |
Примечание: таблица составлена авторами.
Note: created by the authors.
Цель исследования ‒ изучить ассоциацию экспрессии интегринов в ткани опухоли при гематогенном метастазировании у больных раком молочной железы.
Материал и методы
Изучался биопсийный материал от 72 больных неспецифицированной инвазивной протоковой карциномой молочной железы T1–4N0–3M0–1, полученный до проведения противоопухолевой терапии. Средний возраст составил 51 ± 12 лет. Основную группу составили 23 пациентки с РМЖ с диагностированными на момент первичного обращения гематогенными метастазами, из них метастазы в кости диагностированы у 15, в печень – у 8, в легкие – у 5, в головной мозг – у 2 больных, в 6 случаях наблюдалось одновременное метастатическое поражение нескольких органов. В группу сравнения вошли 49 больных РМЖ без отдаленных метастазов (таблица). Исследовалась ткань первичной опухоли, полученная при трепанобиопсии под ультразвуковым контролем. Заключительный патоморфологический диагноз устанавливался согласно классификации ВОЗ 2019 г. [6] и классификации TNM-8 [7]. В части случаев для уточнения диссеминации выполнялась биопсия очагов из ткани легких, печени, костей под контролем УЗИ или компьютерной томографии.
Гистологическое и иммуногистохимическое исследование проводилось по стандартной методике. Оценивалась степень дифференцировки опухоли по Ноттингемской системе Скарфа–Блума– Ричардсона [8]. Для иммуногистохимического исследования использовались антитела Estrogen receptor (клон 1D5, Dako, Дания), Progesteron receptor (клон PgR636, Dako, Дания), c-erB-2 (Her2/ neu) (Polyclonal Rabbit, Dako, Дания), Ki67 (клон SP6, Cell Marque, США), CD61 (интегрин β3, клон JE22-64, Invitrogen, разведение 1:100, США), CD104 (интегрин β4, клон JM11-06, Invitrogen, разведение 1:200, США), CD51 (интегрин αV, поликлональные, Invitrogen, разведение 1:600, США).
На основании изучения экспрессии рецепторов к эстрогену, прогестерону, HER2, Ki67 устанавливали люминальный А, люминальный В HER2 отрицательный, люминальный В HER2 положительный,
HER2 положительный (не люминальный) и базальноподобный (тройной негативный) молекулярнобиологические подтипы рака молочной железы.
В клетках первичной опухоли оценивалось наличие или отсутствие цитоплазматической экспрессии, а также цитоплазматическая и мембранная колокализация каждого из исследуемых интегри-нов. Изолированная мембранная экспрессия исследуемых интегринов не встречалась (рис. 1).
Статистическая обработка результатов проводилась с применением пакета программ STATISTICА 10.0. Для оценки различий между группами по частоте встречаемости признака использовали сравнение долей (процентов). Поскольку нулевая гипотеза состоит в том, что частота случаев с экспрессией исследуемых субъединиц интегринов выше в группах с гематогенными метастазами, использовался односторонний критерий. Различия считали статистически значимыми при р<0,05.
Результаты
Изучались особенности экспрессии CD61, CD104 и CD51 в ткани первичной опухоли в группах с наличием и отсутствием отдаленной диссеми-нации, а также с учетом локализации отдаленных метастазов. В группе больных с гематогенными метастазами случаи с позитивной цитоплазматиче- ской экспрессией CD61 выявлялись чаще по сравнению с группой без отдаленной диссеминации (44 и 24 %; р=0,044) (рис. 2). Колокализация цитоплаз-матической/мембранной экспрессии интегрина CD61 наблюдалась на уровне тенденции чаще в группе больных РМЖ с метастазами – 9 и 2 % соответственно (р=0,085). Цитоплазматическая локализация экспрессии CD61 в группе с гематогенными метастазами обнаруживалась чаще, чем цитоплазматическая/мембранная колокализация указанного маркера (44 и 9 %, р=0,0036). Значимых различий в частоте цитоплазматической экспрессии и цитоплазматической/мембранной колокализации интегрина CD61 в случаях с различной локализацией отдаленных метастазов не обнаружено.
У больных с наличием и отсутствием отдаленных метастазов не обнаружено различий экспрессии интегрина CD104 в ткани первичной опухоли как цитоплазматической (48,0 и 43,0 % соответственно, р=0,443), так и цитоплазматической и мембранной колокализации (35,0 и 22,0 % соответственно, р=0,205). При гематогенных метастазах отсутствовали различия частоты цитоплазматической экспрессии и колокализации экспрессии в цитоплазме и мембране (48,0 и 35,0 % соответственно, р=0,275).
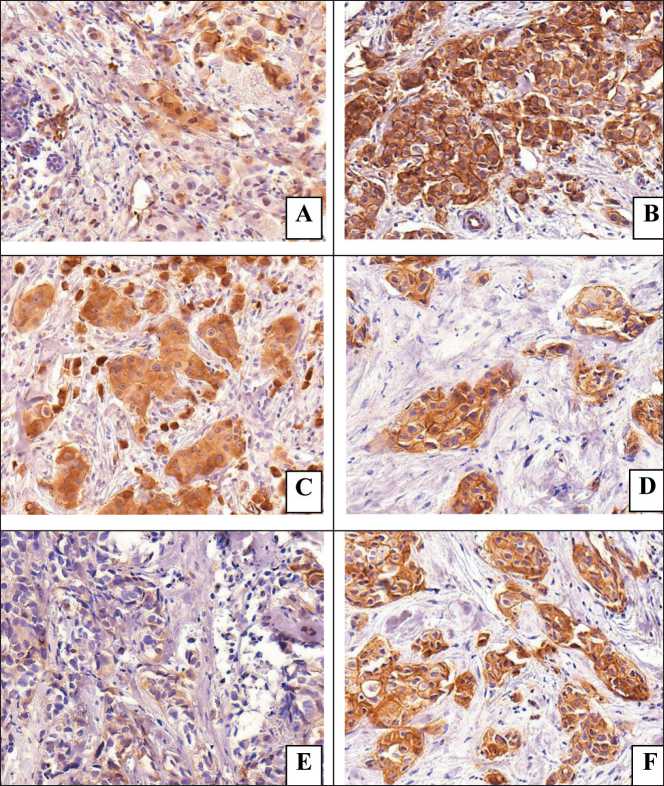
Рис. 1. Микрофото. Экспрессия интегринов в первичной опухоли:
A –цитоплазматическая экспрессия CD61;
B – цитоплазматическая/мембранная колокализация экспрессии CD61; C – цитоплазматическая экспрессия CD104; D – цитоплазматическая/мембранная коло-кализация экспрессии CD104; E – цитоплазматическая экспрессия CD51; F – цитоплазматическая и мембранная колокализация экспрессии CD51. Окраска гематоксилином и эозином, ×400.
Примечание: рисунок выполнен авторами Fig. 1. Microphoto. Expression of integrins in the primary tumor: A – cytoplasmic expression of CD61; B – cytoplasmic/membrane colocalization of CD61 expression; C – cytoplasmic expression of CD104; D – cytoplasmic/ membrane colocalization of CD104 expression; E – cytoplasmic expression of CD51;
F – cytoplasmic and membrane colocalization of expression CD51. Stained with hematoxylin and eosin, ×400. Νote: created by the authors
В отличие от CD61 обращала на себя внимание ассоциация локализации отдаленных метастазов с цитоплазматической/мембранной колокализацией экспрессии CD104 в ткани первичной опухоли. Так, колокализация цитоплазматической и мембранной экспрессии CD104 чаще обнаруживалась при метастатическом поражением головного мозга по сравнению со случаями с метастазами в легких (р=0,026) или костях (р=0,036) (рис. 3).
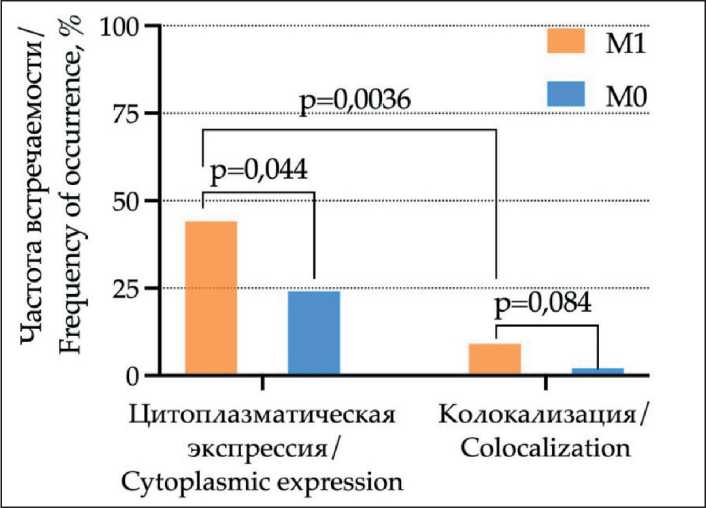
Рис. 2. Экспрессия CD61 в ткани первичной опухоли с учетом внутриклеточной локализации и наличия гематогенного метастазирования. Примечание: рисунок выполнен авторами Fig. 2. Expression of CD61 in primary tumor taking into account intracellular localization and presence of distant metastasis. Νote: created by the authors
Частота случаев с позитивной и негативной цитоплазматической экспрессией (33,0 и 35,0 % соответственно, р=0,443), цитоплазматической/ мембранной колокализацией экспрессии CD51 (14,0 и 22,0 % соответственно, р=0,197) также не различалась у больных с наличием и отсутствием гематогенных метастазов. При метастатическом поражении отдаленных органов частота цитоплазматической экспрессии и колокализации экспрессии CD51 существенно не различалась (35,0 и 22,0 %, р=0,164). В то же время выявлена ассоциация экспрессии CD51 с локализацией отдаленных метастазов. При метастатическом поражении легких чаще обнаруживалась колокализация экспрессии CD51 по сравнению со случаями с метастазами в кости (60 и 20 % соответственно, р=0,045) (рис. 4).
Обсуждение
Обнаружены особенности внутриклеточной локализации экспрессии интегринов CD61, CD104 и CD51 в первичной опухоли у пациенток с метастатическим поражением различных отдаленных органов. В случаях с отдаленной диссеминацией чаще выявляется позитивная цитоплазматическая экспрессия интегрина CD61 по сравнению с наблюдениями без отдаленных метастазов. Имеются наблюдения, показывающие, что увеличение экспрессии интегрина β3 (CD61) в клетках 4T1 тройного негативного рака молочной железы
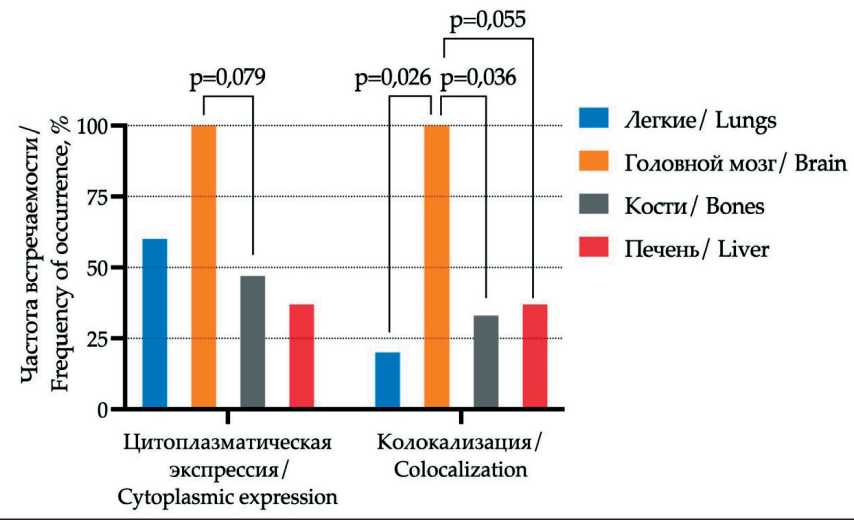
Рис. 3. Экспрессия интегрина CD104 в ткани первичной опухоли с учетом локализации отдаленных метастазов. Примечание: рисунок выполнен авторами
Fig. 3. Expression of CD104 in primary tumor taking into account localization of distant metastasis. Νote: created by the authors
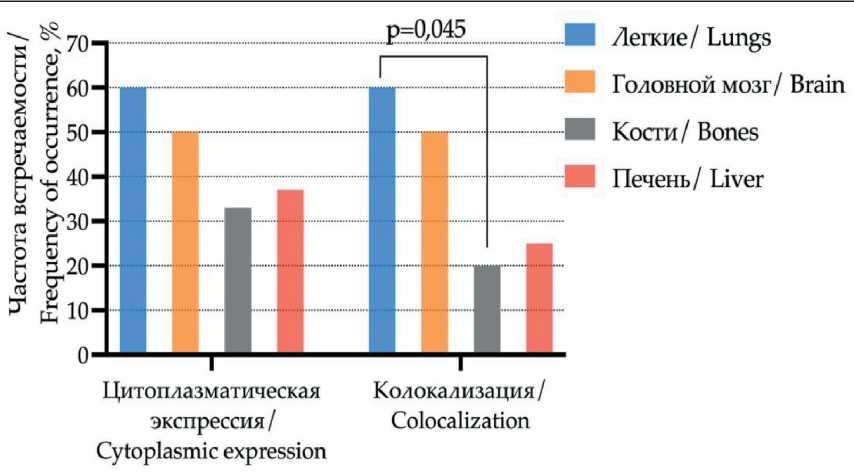
Риc. 4. Экспрессия интегрина CD51 в ткани первичной опухоли с учетом локализации отдаленных метастазов. Примечание: рисунок выполнен авторами
Fig. 4. Expression of CD51 in primary tumor taking into account intracellular localization and presence of distant metastasis. Νote: created by the authors мыши приводит к переключению коллективного движения на движение одиночных клеток in vitro и метастазированию in vivo [9].
Интегрин αvβ3 (CD61) рассматривается как маркер стволовых клеток во многих типах солидных опухолей [10]. Более того, экспрессия αvβ3 на поверхности стволовых клеток тесно связана с фенотипом стволовых клеток, которые обладают свойствами неадгезивных опухолевых клеток и способны к якорно-независимому росту. Якорно-независимый рост рассматривают в качестве отличительной черты стволовых опухолей и прогрессирования. Установлено, что наличие αvβ3 критично при перепрограммировании опухолевых клеток на фенотип стволовых клеток опухоли в карциномах молочной железы, легких и поджелудочной железы [10, 11]. Имеются данные о том, что аберрантная экспрессия avβ3 интегрина связана с более высокой частотой метастазирования и плохим исходом многих карцином [12, 13].
Как свидетельствуют результаты проведенного исследования, локализация отдаленных метастазов может быть связана с особенностями экспрессии CD104 и CD51, причем имеет значение внутриклеточная локализация маркера в опухолевых клетках. Так, позитивная экспрессия CD104 чаще наблюдается в случаях с метастатическим поражением головного мозга независимо от внутриклеточной локализации маркера, а в случае интегрина CD51 позитивная колокализация цитоплазматической/ мембранной экспрессии наблюдалась у больных с метастазами в легких.
По данным литературы, интегрин β4 в составе гетеродимера с α6-субъединицей опосредует связывание эпителиальных клеток с базальной мембраной [12], что ассоциировано с инвазией стволовых клеток и с метастазированием рака легких в мозг [14]. Описан феномен ключевой роли экзосомаль- ных интегринов в органотропности метастазов. Показано, что экзосомальный интегрин α6β4 способен связываться с S100A4+ фибробластами и направляет метастатические клетки в легкие, в то время как интегрин αvβ5 специфически связывается с F4/80+ макрофагами и ассоциируется с метастазированием в печень [15]. Более того, имеются данные о том, что гетеродимер αvβ5 способствует связанной со стволовыми клетками инвазии и метастазированию рака легких в мозг [14].
Список литературы Ассоциация экспрессии интегринов в ткани опухоли с гематогенным метастазированием рака молочной железы
- Zlokachestvennye novoobrazovaniya v Rossii v 2020 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2021. 252 s.
- Su C.Y., Li J.Q., Zhang L.L., Wang H., Wang F.H., Tao Y.W., Wang Y.Q., Guo Q.R., Li J.J., Liu Y., Yan Y.Y., Zhang J.Y. The Biological Functions and Clinical Applications of Integrins in Cancers. Front Pharmacol. 2020; 11. https://doi.org/10.3389/fphar.2020.579068.
- Bagati A., Kumar S., Jiang P., Pyrdol J., Zou A.E., Godicelj A., Mathewson N.D., Cartwright A.N.R., Cejas P., Brown M., Giobbie-Hurder A., Dillon D., Agudo J., Mittendorf E.A., Liu X.S., Wucherpfennig K.W. Integrin αvβ6-TGFβ-SOX4 Pathway Drives Immune Evasion in Triple-Negative Breast Cancer. Cancer Cell. 2021; 39(1): 54-67. https://doi.org/10.1016/j.ccell.2020.12.001.
- Sökeland G., Schumacher U. The functional role of integrins during intra- and extravasation within the metastatic cascade. Mol Cancer. 2019; 18(1): 12. https://doi.org/10.1186/s12943-018-0937-3.
- Kechagia J.Z., Ivaska J., Roca-Cusachs P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 2019; 20(8): 457-73. https://doi.org/10.1038/s41580-019-0134-2.
- Lokuhetty D., White, V.A., Watanabe R., Cree I.A. WHO Classifcation of Tumours. Breast tumours. Lyon (France): International Agency for Pesearch on Cancer, 2019.
- Bertero L., Massa F., Metovic J., Zanetti R., Castellano I., Ricardi U., Papotti M., Cassoni P. Eighth Edition of the UICC Classifcation of Malignant Tumours: an overview of the changes in the pathological TNM classifcation criteria-What has changed and why? Virchows Arch. 2018; 472(4): 519-31. https://doi.org/10.1007/s00428-017-2276-y.
- Stenina M.B., Zhukova L.G., Koroleva I.A., Parokonnaya A.A., Semiglazova T.Yu., Tyulyandin S.A., Frolova M.A. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka molochnoi zhelezy. Zlokachestvennye opukholi: Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka molochnoi zhelezy. Zlokachestvennye opukholi. 2020; 10(3s2-1): 145-82. https://doi.org/10.18027/2224-5057-2020-10-3s2-09.
- Truong H.H., Xiong J., Ghotra V.P., Nirmala E., Haazen L., Le Dévédec S.E., Balcioğlu H.E., He S., Snaar-Jagalska B.E., Vreugdenhil E., Meerman J.H., van de Water B., Danen E.H. β1 integrin inhibition elicits a prometastatic switch through the TGFβ-miR-200-ZEB network in E-cadherin-positive triplenegative breast cancer. Sci Signal. 2014; 7(312). https://doi.org/10.1126/scisignal.2004751.
- Seguin L., Kato S., Franovic A., Camargo M.F., Lesperance J., Elliott K.C., Yebra M., Mielgo A., Lowy A.M., Husain H., Cascone T., Diao L., Wang J., Wistuba I.I., Heymach J.V., Lippman S.M., Desgrosellier J.S., Anand S., Weis S.M., Cheresh D.A. An integrin β₃-KRAS-RalB complex drives tumour stemness and resistance to EGFR inhibition. Nat Cell Biol. 2014; 16(5): 457-68. https://doi.org/10.1038/ncb2953.
- Xiong J., Yan L., Zou C., Wang K., Chen M., Xu B., Zhou Z., Zhang D. Integrins regulate stemness in solid tumor: an emerging therapeutic target. J Hematol Oncol. 2021; 14(1): 177. https://doi.org/10.1186/s13045-021-01192-1.
- Cooper J., Giancotti F.G. Integrin Signaling in Can- cer: Mechanotransduction, Stemness, Epithelial Plasticity, and Therapeutic Resistance. Cancer Cell. 2019; 35(3): 347-67. https://doi.org/10.1016/j.ccell.2019.01.007.
- Böger C., Warneke V.S., Behrens H.M., Kalthoff H., Good- man S.L., Becker T., Röcken C. Integrins αvβ3 and αvβ5 as prognostic, diagnostic, and therapeutic targets in gastric cancer. Gastric Cancer. 2015; 18(4): 784-95. https://doi.org/10.1007/s10120-014-0435-2.
- Berghoff A.S., Kovanda A.K., Melchardt T., Bartsch R., Hainfellner J.A., Sipos B., Schittenhelm J., Zielinski C.C., Widhalm G., Dieckmann K., Weller M., Goodman S.L., Birner P., Preusser M. αvβ3, αvβ5 and αvβ6 integrins in brain metastases of lung cancer. Clin Exp Metastasis. 2014; 31(7): 841-51. https://doi.org/10.1007/s10585-014-9675-0.
- Hoshino A., Costa-Silva B., Shen T.L., Rodrigues G., Hashimoto A., Tesic Mark M., Molina H., Kohsaka S., Di Giannatale A., Ceder S., Singh S., Williams C., Soplop N., Uryu K., Pharmer L., King T., Bojmar L., Davies A.E., Ararso Y., Zhang T., Zhang H., Hernandez J., Weiss J.M., Dumont-Cole V.D., Kramer K., Wexler L.H., Narendran A., Schwartz G.K., Healey J.H., Sandstrom P., Labori K.J., Kure E.H., Grandgenett P.M., Hollingsworth M.A., de Sousa M., Kaur S., Jain M., Mallya K., Batra S.K., Jarnagin W.R., Brady M.S., Fodstad O., Muller V., Pantel K., Minn A.J., Bissell M.J., Garcia B.A., Kang Y., Rajasekhar V.K., Ghajar C.M., Matei I., Peinado H., Bromberg J., Lyden D. Tumour exosome integrins determine organotropic metastasis. Nature. 2015; 527(7578): 329-35. https://doi.org/10.1038/nature15756.


