Ассоциация полиморфизма гена ADRB2 с морфофункциональными нарушениями у больных гипертрофической кардиомиопатией
Автор: Комиссарова Светлана Михайловна, Чакова Наталья Николаевна, Крупнова Эвелина Вячеславовна, Михаленко Елена Петровна, Чеботарева Наталья Вячеславовна, Кругленко Светлана Сергеевна, Арабей Анастасия Анатольевна, Мрочек Александр Геннадьевич
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
Цель. Анализ ассоциации клинической картины и функциональных нарушений с полиморфизмом гена ADRB2 у пациентов, страдающих ГКМП. Материал и методы. В исследование были включены 89 пациентов с ГКМП (69 мужчин и 20 женщин, средний возраст 46,7±15,7 года), среди них у 56 диагностирована обструктивная форма, у 33 пациентов - необструктивная форма заболевания. В контрольную группу вошли 104 здоровых донора, сопоставимых по возрасту и полу с больными ГКМП. Оценивали клиническую картину заболевания, определяли эхокардиографические показатели и параметры суточного мониторирования ЭКГ. У всех пациентов проводили анализ полиморфизма гена ADRB2. Результаты. Изучена ассоциация клинической картины, структурных и функциональных особенностей миокарда левого желудочка с полиморфизмом гена ADRB2 у больных с гипертрофической кардиомиопатией. Выявлено, что комбинация генотипов Arg16rg/Gln27Gln является генотипом риска и ассоциируется с возникновением неблагоприятных клинических проявлений заболевания. Комбинация генотипов Gly16Gly/Glu27Glu является протективной и свидетельствует о благоприятном прогнозе заболевания. Заключение. Полученные результаты выявили ассоциацию полиморфизма гена ADRB2 с клиническими, структурными и функциональными нарушениями у больных с ГКМП, что позволит не только прогнозировать риск возникновения неблагоприятных клинических проявлений заболевания, но и оптимизировать лечение β-адреноблокаторами пациентов с ГКМП.
Гипертрофическая кардиомиопатия, полиморфизм гена adrb2
Короткий адрес: https://sciup.org/14342713
IDR: 14342713
Текст научной статьи Ассоциация полиморфизма гена ADRB2 с морфофункциональными нарушениями у больных гипертрофической кардиомиопатией
Изучена ассоциация клинической картины, структурных и функциональных особенностей миокарда левого желудочка с полиморфизмом гена ADRB2 у больных с гипертрофической кардиомиопатией (ГКМП). Выявлено, что комбинация генотипов Arg16rg/Gln27Gln является генотипом риска и ассоциируется с возникновением неблагоприятных клинических проявлений заболевания. Комбинация генотипов Gly16Gly/Glu27Glu является протективной и свидетельствует о благоприятном прогнозе заболевания.
The association of clinical presentation, myocardial structural and functional characteristics with ADRB2 gene polymorphism in patients with hypertrophic cardiomyopathy has been studied.The Arg16rg/Gln27Gln gene combination was found to be risk genotype and is associated with unfavorable clinical manifestations of the disease. Gly16Gly/ Glu27Glu genotype combination is protective and is indicative of a favorable prognosis of the disease
Основными факторами, определяющими течение гипертрофической кардиомиопатии (ГКМП), являются мутации в генах белков саркомера [1]. В настоящее время активно ведутся поиски генетических факторов, так называемых генов-модификаторов, которые могут влиять на процесс фенотипической реализации этих мутаций [2]. Установлено, что гены-модификаторы имеют полиморфные аллели (вариации последовательности ДНК), которые кодируют белки с различной функциональной активностью. Идентифицирован ряд генов, претендующих на эту роль. Подтверждено влияние генов ренин-ангиотензин-альдо-стероновой системы (РААС): ангиотензиногена, ангиотензин-превращающего фермента, рецептора ангиотензина II типа 1 и синтетазы альдостерона на развитие гипертрофии левого желудочка (ГЛЖ). Большое значение в формирование фенотипических проявлений ГКМП имеет также высокая активность симпатического отдела вегетативной нервной системы (СОВНС). Его активация ведет к развитию ГЛЖ как непосредственно за счет активации рецепторов СОВНС, так и опосредованно за счет активации РААС. Поэтому гены, кодирующие элементы СОВНС, в первую очередь гены адренорецепторов, являются одними из основных генов-модификаторов, которые могут влиять на клиническую картину ГКМП [3].
В настоящее время большое внимание уделяется изучению полиморфизма гена ADRB2, который находится в области 5д31-32 5-й хромосомы. В сердце (32-АР представлены как в желудочках, так и в предсердиях. В значительном количестве эти рецепторы экспрессируются на мембранах пейсмекерных клеток, что указывает на их важную роль в регуляции ритма сердца. В кодирующей части гена ADRB2 выявлено 12 полиморфизмов, 5 из которых приводят к замене аминокислоты: Arg16Gly, Gln27Glu, Val34Met, Thr164lle и Ser220Cys. Все эти маркеры связывают с функциональными свойствами рецептора. В исследовании [4,5] показано влияние полиморфизмов Arg16Gly и Gln27Glu не только на уровень артериального давления, но и развитие гипертрофии ЛЖ.
Целью настоящего исследования был анализ ассоциации клинической картины и функциональных нарушений с полиморфизмом гена
ADRB2 у пациентов, страдающих ГКМП.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 89 пациентов с ГКМП (69 мужчин и 20 женщин, средний возраст 4б,7±15,7 года), среди них у 56 диагностирована обструктивная форма, у 33 пациентов - необструктивная форма заболевания. Семейная форма заболевания выявлена у 26 пробандов, отягощенный анамнез имели 44,3% больных с ГКМП (28,9% сочетание ГКМП и АГ, 15,4% сочетании ГКМП и ИБС). В контрольную группу вошли 104 здоровых донора, сопоставимых по возрасту и полу с больными ГКМП.
Оценивали клиническую картину заболевания, в частности такие параметры, как функциональные классы (ФК) сердечной недостаточности (СН), систолическое (САД) и диастолическое (ДАД) артериальное давление. Определяли следующие эхокардиографические (ЭхоКГ) параметры: толщину миокарда межжелудочковой перегородки (ТМЖП) и задней стенки левого желудочка (ТЗСЛЖ), конечный систолический и диастоличе-ски размеры (КСР и КДР) левого желудочка (ЛЖ), размер левого предсердия (ЛП), наличие обструкции выносящего тракта ЛЖ (ВТЛЖ), индекс массы миокарда (ИММ).
По данным суточного мониторирования ЭКГ анализировались следующие показатели: средняя ЧСС, уд/мин, общее количество желудочковой и суправентрикулярной эктопической активности за сутки, наличие сложных нарушений ритма. Оценивали показатели, характеризующие ишемию миокарда: количество эпизодов ишемии, суммарную длительность ишемии в течение суток, глубину депрессии сегмента ST.
У всех пациентов проводили анализ полиморфизма гена ADRB2. Выделение тотальной ДНК из лейкоцитов периферической крови выполняли методом Mathew [6]. Полиморфизмы A46G (Arg16Gly) и C79G (Gln27Glu) в гене ADRB2 изучали с использованием метода ПЦР-ПДРФ анализа. Последовательности использованных в работе праймеров и условия ПЦР представлены в таблице 1 [7]. Полимеразную цепную реакцию проводили на амплификаторе MyCyclerTM Termal cycler (BIORAD).
Таблица 1. Последовательность праймеров и программа проведения ПЦРГен Последовательность праймера Программа проведения ПЦР Размер продукта
ADRB2 F: 5'gaacggcagcgccttcttgctggcaccccat3' 940С-2мин, [940С-30с, 242 п.н.
640С-45С, 720С-1мин] х35
R: 5'ctgccaggcccatgaccagatcag3' иклов, 720С-7мин
Таблица 1. Распределение частот встречаемости различных генотипов
(32-адренорецептора у больных ГКМП
|
Генотипы 16(Arg> Gly) 27(Gln>Glu) |
Количество больных ГКМП |
|
|
n |
% |
|
|
Arg 16Arg |
21 |
23,3 |
|
Arg16Gly |
44 |
48,9 |
|
Gly16Gly |
25 |
27,8 |
|
Аллель Arg 16 |
86 |
47,8 |
|
Аллель Gly16 |
94 |
52,2 |
|
Gln27Gln |
32 |
35,5 |
|
Gln27Glu |
46 |
51,1 |
|
Glu27Glu |
12 |
13,3 |
|
Аллель Gln27 |
110 |
61,1 |
|
Аллель Glu27 |
70 |
39,9 |
Амплифицированный фрагмент длиной 242 п.н. подвергали рестриктному расщеплению эндонуклеазами Есо130I (Fermentas) и Satl (Fermentas) для выявления точечных нуклеотидных замен A46G и C79G, соответственно. Продукты амплификации фракционировали в 2,5% агарозном геле с бромистым этидием и визуали-ровали в УФ-свете (рис. 1).
Статистическая обработка материала проводилась с использованием программного пакета «Statistica for Windows 6.0» и «SPSS Statistics 17». Об ассоциации генотипов с возникновением клинических проявлений ГКМП судили по величине отношения шансов (OR), которую рассчитывали по стандартной формуле OR=(A/B)/(C/D), где А и В - количество больных, имеющих и не имеющих мутантный генотип, соответственно, и С и D - количество человек в контрольной группе, имеющих и не имеющих мутантный генотип. OR указан с 95%-ным доверительным интервалом (95% CI) [8]. Для сравнения значений клинических показателей между группами пациентов с различными генотипами использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
На первом этапе работы была проанализирована частота встречаемости различных генотипов Arg16Gly и Gln27Glu (32-АР у обследованных нами пациентов с ГКМП. Распределение частот встречаемости различных генотипов (32-АР представлено в таблице 1.
В литературе описано неравновестное сцепление между 16 и 27 кодонами [9], т.е. неслучайное распределение частот аллелей по этим сайтам, которое может быть обусловлено не только тесным генетическим сцеплением генов, но и наличием адаптивного преимущества конкретной комбинации аллелей. Носители гомозиготного генотипа Glu27Glu практически всегда имеют гомозиготный генотип Gly16Gly, гаплотип Arg16Glu27 встречается чрезвычайно редко (менее 1% в популяции). В нашем исследовании все индивидуумы, гомозиготные по Glu27Glu, были гомозиготны по Gly16Gly (рис. 1), комбинации генотипов Arg16Gly/Glu27Glu и Arg16Arg/Glu27Glu отсутствовали.
GG GG AG АА AG АА М
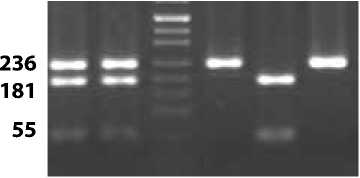
GC GC М GG СС GG
А) Б)
Рисунок 1. Электрофореграмма фрагментов рестрикции гена (32-АР
-
А) электрофореграмма гидролиза эндонуклеазой EcoBOI (Styl);
Б) электрофореграмма гидролиза эндонуклеазой Satl (Епи4Н1).
Таблица 3. Клинические и эхокардиографические показатели у больных ГКМП с различными генотипами 02-АР
|
Показатели |
Генотип Arg16Gly |
Генотип Gln27Glu |
||||
|
Arg/Arg |
Arg/Gly |
Gly/Gly |
Gln/GIn |
Gln/Glu |
Glu/Glu |
|
|
ФК сн, п (%) I II III |
9 (26,0%) 12(31,0%) |
8 (67,0%) 16(47,0%) 16(41,0%) |
4 (33,0%) 9 (26,0%) 11 (28,0%) |
2 (17,0%) 13(38,0%) 15 (38,0%) |
7 (58,0%) 18(53,0%) 19(49,0%) |
3 (25,0%) 3 (9,0%) 5 (13,0%) |
|
ЧСС, уд/мин |
68,0±4,42 |
70,2±2,88 |
69,6±2,38 |
67,1 ±3,02 |
72,2±2,85 |
65,8±2,66 |
|
САД, мм рт. ст. |
134,3±3,8 |
131,3±2,9 |
130,6±3,35 |
133,0±3,06 |
130,3±2,54 |
134,5±6,89 |
|
ДАД, мм рт.ст. |
85,5±2,56 |
81,9±1,65 |
83,0± 1,91 |
83,9± 1,91 |
82,4±1,57 |
83,6±3,57 |
|
ЛП, см |
44,5± 1,55 |
44,1 ±0,97 |
43,7±1,21 |
44,2±1,21 |
44,3±0,91 |
43,3±2,04 |
|
ТМЖП, см |
19,3±0,80 |
20,1 ±0,65 |
18,7±0,80 |
19,1 ±0,63 |
19,9±0,68 |
19,3±0,87 |
|
КДР, см |
51,4±2,22 |
50,3±0,90 |
50,9±1,00 |
50,9±1,70 |
51,0±0,81 |
49,1 ±1,75 |
|
КСР, см |
32,4±2,12 |
31,0±1,09 |
30,8±1,14 |
31,9±1,64 |
31,1 ±0,98 |
30,9±2,30 |
|
ФВ, % |
61,4±1,91 |
5 9,8± 1,49 |
64,1 ±2,03 |
62,5±1,71 |
60,3± 1,44 |
62,1 ±2,98 |
|
ИММ, г/м2 |
182±13,2 |
174,9±8,8 |
173,0±10,8 |
171,0±9,96 |
186,5±8,74 |
148±11,4* |
|
ГДВТЛЖ >30 |
63,5±4,53 |
61,9±4,48 |
73,2±7,00 |
64,87±4,05 |
65,6±4,78 |
61,3±11,39 |
|
ГДВТЛЖ <30 |
15,0±2,58 |
9,7±1,56 |
10,2±1,82 |
13,6±2,10 |
10,0±1,50 |
9,12±2,51 |
|
Е/А |
1,25±0,13 |
1,35±0,10 |
1,45±0,22 |
1,28±0,12 |
1,27±0,09 |
1,86±0,39 |
|
ВИР, мс |
118,1 ±6,7 |
118,1 ±8,2 |
115,3±10,2 |
115,33±5,9 |
121,53±8,9 |
107,18±6 |
|
DT, мс |
192±14,5 |
165,5±6,6 |
186,2±20,4 |
190,7±11,6 |
170,6±11,2 |
171,3±16,5 |
* - значимые различия по критерию t-Стьюдента, р<0,05
Анализ связи клинической картины, гемодинамических и эхокардиографических показателей с генетическим полиморфизмом 02-АР в 16 и 27 кодонах представлен в таблице 3. Было выявлено, что средние уровни таких показателей, как ЧСС, САД, ДАД, а также величина ЛП, ТМЖП, КДР, КСР, ФВ и ГДВТЛЖ не зависят от генотипа 02-АР в исследуемых кодонах. Достоверные различия наблюдались лишь в отношении показателя ИММ:
у носителей генотипа Glu27Glu среднее значение этого показателя (148,1±11,39 г/м2) было ниже, чем у индивидуумов с другими вариантами генотипов, при этом различия с носителями генотипа Gln27Glu были достоверными (t =2,67, р<0,05). У больных, имеющих комбинацию генотипов Arg16Arg/Gln27Gln, величина ИММ составила 182,0±13,2 г/м2, тогда как у пациентов с комбинацией генотипов Gly16Gly/Glu27Glu значение это-
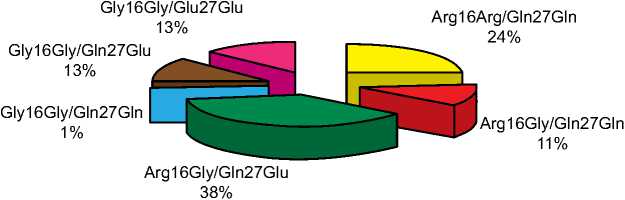
Рис. 1. Распределение частот встречаемости различных комбинаций генотипов 16(Arg>Gly) и 27(Gln>Glu) гена 02-АР у больных ГКМП
Таблица 4. Незначимые нарушения ритма сердца поданным суточного мониторирования у больных ГКМП с различными генотипами 02-АР
|
Показатель |
Генотип Arg16Gly |
Генотип Gln27Glu |
||||
|
Arg/Arg |
Arg/Gly |
Gly/Gly |
Gln/GIn |
Gln/Glu |
С1и/С1и |
|
|
ЖЭ |
64,9±21,0* (17 чел.) |
2б,8±7,б (35 чел.) |
29,6±12,1 (23 чел.) |
53,0±15,0* (11 чел.) |
32,3±9,4** (39 чел.) |
12,3±3,31 (25 чел.) |
|
нэ |
41,1±13,4 (19 чел.) |
33,1 ±6,9 (37 чел.) |
39,4±10,8 (19 чел.) |
34,4±9,34 (28 чел.) |
33,5±7,0 (37 чел.) |
55,2±18,2 (10 чел.) |
* - значимые различия по критерию t-Стьюдента, р<0,05
го параметра было 148,1 ± 11,39 г/м2.
Выявлено, что у больных с I ФК СН не встречался генотип Arg16Arg, а генотип Gln27Gln встречался реже, чем у пациентов из II и III ФК СН.
У 12,4% пациентов с ГКМП по данным суточного мониторирования ЭКГ были выявлены жизнеугрожающие нарушения ритма: пароксизмы неустойчивой желудочковой тахикардии (ЖТ), частая желудочковая одиночная и групповая экстрасистолия (ЖЭ), сочетание желудочковой и суправентрикулярной эктопической активности. У 87,6 % при суточном мониторировании ЭКГ регистрировалась непатологическая желудочковая и суправентрикулярная активность. На основании клинической значимости этих результатов нами были выделены две группы больных ГКМП с различными типами аритмий: 1 группа - клинически значимые аритмии (групповая или одиночная ЖЭ более 300 экстрасистол в сутки, пароксизмальные желудочковые и суправентрикулярные нарушения ритма), 2 группа - незначимые желудочковые и суправентрикулярные аритмии (одиночные экстрасистолы до 300 в сутки), не имеющие клинического значения и не влияющие на прогноз. В этих группах определяли влияние генотипов в 16 и 27 кодонах на значимость нарушений ритма сердца (таблица 4,5).
Анализ генетического полиморфизма в 27 кодоне показал, что в группе больных с незначимыми аритмиями у носителей генотипа Gln27Gln наблюдалось наибольшее среднее значение ЖЭ, у носителей GIh27GIh - наименьшее, а у гетерозиготных носителей Gln27Glu - промежуточное (таблица 4). При исследовании генетического полиморфизма в 1 б кодоне было показано, что у носителей генотипа Arg16Arg среднее значение ЖЭ было выше в 2,2-2,4 раза, чем у больных с другими вариантами генотипов, при этом различия с носителями генотипа Arg16Gly были достоверными.
У пациентов со значимыми аритмиями (таблица 5), которые ассоциируются с риском внезапной смерти у данной категории больных, не встречался генотип GIh27GIh, а генотип Gly16Gly был выявлен только у одного пациента.
В отношении показателей ишемии миокарда по данным суточного мониторирования ЭКГ (таблица 6) выявлено достоверное повышение продолжительности депрессии сегмента ST у пациентов с генотипами Arg16Arg по сравнению с носителями гетерозиготного генотипа Arg16Gly.
ОБСУЖДЕНИЕ
Ген 02-АР характеризуется выраженным природным полиморфизмом, обусловленным различиями в последовательности нуклеотидов. Полученные результаты по изучению влияния генетического полиморфизма 02-АР на клинические и морфофункциональные параметры сердца у больных ГКМП указывают на наличие связи по-
Таблица 5. Значимые нарушения ритма сердца по данным суточного мониторирования у больных ГКМП с различными генотипами 02-АР
|
Показатель |
Генотип Arg16Gly |
Генотип Gln27Glu |
||||
|
Arg/Arg |
Arg/Gly |
Gly/Gly |
Gln/GIn |
Gln/Glu |
С1и/С1и |
|
|
ЖЭ |
2691,0±1649,1 (4 чел.) |
2025,8±820,3 (6 чел.) |
9090,0±9090 (1 чел.) |
2388,6±1312,7 (5 чел.) |
3344,3 ±1401,7 (6 чел.) |
- |
|
НЭ |
2000,0±1697,0 (2 чел.) |
538,0±±98,5 (3 чел.) |
901,0±901,0(1 чел.) |
2000,0±1697,0 (2 чел.) |
628,0± 114,39 (4 чел.) |
- |
Таблица 6. Показатели ишемии миокарда по данным суточного мониторирования у больных ГКМП с различными генотипами Arg16Gly гена 02-АР
|
Показатель |
Генотип Arg16Gly |
Генотип Gln27Glu |
||||
|
Arg/Arg |
Arg/Gly |
Gly/Gly |
Gln/GIn |
Gln/Glu |
С1и/С1и |
|
|
Количество эпизодов ишемии |
3,б±0,50 |
3,2±0,48 |
4,1 ±1,10 |
3,8±0,54 |
3,5±0,41 |
2,7±0,70 |
|
Продолжительность эпизодов ишемии, мин |
95,5±13,0* |
60,5 ±10,2 |
89,3±19,3 |
80,7±10,9 |
77,0±12,9 |
64,3± 17,3 |
*- значимые различия по критерию t-Стьюдента, р<0,05
лиморфных вариантов в 1 б и 27 кодонах с такими показателями, как ФК СН по классификации NYHA, ИММ, нарушения ритма и степень выраженности ишемии миокарда при суточном мониторировании ЭКГ. Анализ комбинаций аллельных вариантов полиморфизмов генов ADRB2 показал, что комбинация генотипов Gly16Gly/Glu27Glu ассоциирована с более благоприятной клинической картиной заболевания и степенью выраженности ГЛЖ, тогда как комбинация Arg16Arg/Gln27Gln связана с более тяжелой клинической картиной, более выраженным ремоделированием ЛЖ и наличием значимых нарушений ритма.
ЗАКЛЮЧЕНИЕ
Исходя из вышеизложенного, можно предположить, что генотип Arg16Arg/Gln27Gln является генотипом «риска» и ассоциируется с возникновением неблагоприятных клинических проявлений заболевания. Комбинация генотипов Gly16Gly/Glu27Glu является протективной и свидетельствует о благоприятном прогнозе заболевания.
Поскольку известно [9], что полиморфные варианты генов 0-АР связаны не только с фенотипическими особенностями заболевания, но и с эффективностью лечения 0-адреноблокаторами, то очень важно провести исследование ассоциации генетического полиморфизма 0-АР с чувствительностью пациентов к лекарственным препаратам, что позволит оптимизировать лечение 0-адреноблокаторами у пациентов с ГКМП.
Список литературы Ассоциация полиморфизма гена ADRB2 с морфофункциональными нарушениями у больных гипертрофической кардиомиопатией
- Brodde O.E. Beta-1 and beta-2 adrenoreceptor polymorphisms: functional impotance, impact on cardiovascular disease and drug responses. Pharmacol Ther. 2008; 117: 1-29.
- Dishy V., Sofowora G.G., Xie H.-G. et al. The effect of common polymorphisms of the beta-2-adrenergic receptor on agonist-mediated vascular desensitization. N Eng J. Med 2001; 345: 1030-1035.
- Reihsaus E., Innis M., MacIntyre N., Liggett S.B. Mutations in the gene encoding for the beta 2-adrenergic receptor in normal and asthmatic subjects. Am J. Respir Cell Mol Biol. 1993; 8: 334-339.
- Mathew C.C. Theisolation of high molecular weight eucaryotic DNA. in Walker JMNJ (ed): Methods in Molecular Biology, Clifton: Human Press 1984; 2, № 4: 31-34.
- Aynacioglu A.S., Cascorbi I., Güngör К. and al. Population frequency, mutation linkage and analytical methodology for the Arg 16Gly, Gln27Glu and Thr 164lle polymorphisms in the b2-adrenergic receptor among Turks. Br.J. Clin. Pharmacol., 1999; 48, № 5: 761-764.
- Флетчер P., Флетчер С., Вагнер Э. Клиническая эпидемиология: Основы доказательной медицины. М.: Медиа Сфера; 2004. 347.
- Johnson J.A., Terra S.G. Beta-adrenergic receptor polymorphisms: cardiovascular disease associations and pharmacogenetics. Pharm Res. 2002; 19, № 12: 1779-1787.


