Ассоциация предикторов кардиоренального риска у пациентов с различными фенотипами ранних нарушений углеводного обмена
Автор: Исакова Д.Н., Трошина И.А., Бутарева М.М., Роюк В.В., Петров И.М.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Эндокринология
Статья в выпуске: 3 т.21, 2025 года.
Бесплатный доступ
Цель: выявить ассоциации предикторов кардиоренального риска у пациентов с предиабетом с различными фенотипами ранних нарушений углеводного обмена. Материал и методы. Проведено одномоментное когортное исследование на выборке пациентов г. Тюмени с предиабетом в количестве 122 человек, средний возраст – 46,2±8,2 года. Изучена роль предикторов кардиоваскулярного риска и раннего почечного повреждения в развитии суммарных кардиоренальных событий в течение года. Степень ассоциации параметров и состояний оценивали в значениях показателей отношения шансов. Результаты. Наиболее значимый вклад в развитие сочетанных ранних нарушений углеводного обмена: нарушенную гликемию натощак (НГН) и нарушенную толерантность к глюкозе (НТГ) продемонстрировали индекс инсулиночувствительности QUICKI (р=0,036), уровень интерлейкина-1β (р=0,021), высокочувствительного С-реактивного белка (р=0,031), цистатина С в моче (р=0,002), С-пептида (р=0,039). Фенотип пациентов с ранними нарушениями углеводного обмена, сочетающий НГН и НТГ, характеризовался увеличением риска развития суммарного кардиоренального события в 1,5 раза. Заключение. Сочетание НГН и НТГ в группе пациентов с ранними нарушениями углеводного обмена демонстрируют повышение риска кардиоренальных событий, что требует дифференцированного подхода к разработке алгоритма ведения пациентов с различными фенотипами предиабета.
Ранние нарушения углеводного обмена, предикторы кардиоренального риска, фенотипы предиабета
Короткий адрес: https://sciup.org/149149428
IDR: 149149428 | УДК: 616-06 | DOI: 10.15275/ssmj2103288
Текст научной статьи Ассоциация предикторов кардиоренального риска у пациентов с различными фенотипами ранних нарушений углеводного обмена
EDN: KLKVFV
Введение. По прогнозам Международной диабетической федерации (International Diabetes Federation – IDF) к 2030 г. число людей с сахарным диабетом (СД) достигнет 578 млн [1]. Рост числа больных с углеводными нарушениями связывают с увеличением числа лиц с ожирением и поведенческими факторами риска [2]. Кроме того, ранние нарушения углеводного обмена (РНУО) не имеют специфических клинических проявлений, характеризуются малосимптомно-стью и высоким процентом поздней верификации состояния [3]. Это подчеркивает необходимость проактивной тактики в части первичной профилактики углеводных нарушений, оценки новых модифицируемых факторов риска и оптимизации мер по выявлению РНУО. Согласно данным исследования ЭССЕ-РФ и ЭССЕ-РФ 2, распространенность СД 2-го типа в российской популяции у лиц в возрасте 25– 64 лет составляет 6,9%, частота нарушенной гликемии натощак (НГН) - 6,2%, с преобладанием распространенности в группе мужчин (7,7%), по сравнению с группой женщин (5,0%) [4]. Группа РНУО включает 2 формы - НГН и нарушенную толерантность к глюкозе (НТГ). Частота ранних углеводных нарушений, оцененная по распространенности НГН, составляет 6,2%. Среди 7,7% мужчин уровень НГН в пределах 6,1–7,0 ммоль/л, доля женщин с диагностированной НГН составляет 5,0% [2]. Согласно данным Американской ассоциации диабета, НТГ в российской популяции составляет 2,2% населения в возрасте 20– 79 лет [1]. Подходы к диагностике ранних углеводных нарушений эндокринологическими сообществами определены различным образом. Так, Российской ассоциацией эндокринологов основными критериями диагностики предиабета определены уровень гликемии натощак в пределах 6,1–6,9 ммоль/л, а также уровень гликемии через 2 ч после приема 75 г глюкозы - в пределах 7,8-11,1 ммоль/л. Согласно рекомендациям Американской диабетической ассоциации НГН следует диагностировать при уровне глюкозы плазмы натощак в пределах 5,6–5,9 ммоль/л. В обновленных рекомендациях Европейского общества кардиологов продемонстрировано существование 2 указанных подходов к диагностике НГН, однако специалисты данного общества рекомендуют использовать более жесткие критерии для верификации НГН – 5,6–6,9 ммоль/л [5]. Независимо от критериев диагностики пациенты с ранними углеводными нарушениями также имеют высокий риск развития макро- и микрососудистых осложнений – ретино-, нефропатии и сердечно-сосудистых заболеваний. Диабетическая ретинопатия у лиц с уровнем гликемии натощак 6,1–6,9 ммоль/л или гликемией через 2 ч в пределах 7,8–11,1 ммоль/л встречалась в 7,9% случаев [6]. Ряд исследований демонстрирует связь ранних углеводных нарушений с более высокой частотой возникновения неблагоприятных сердечно-сосудистых событий, а также повышенным риском общей смертности от них, определенной в диапазоне 6–10% [7].
Цель - выявить ассоциации предикторов кардиоренального риска у пациентов с предиабетом с различными фенотипами ранних нарушений углеводного обмена.
Материал и методы. Выполнено одномоментное когортное исследование на выборке пациентов г. Тюмени с предиабетом. Набор пациентов осуществлялся в период с 2020 по 2022 г. в Многопрофильной клинике ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, ГАУЗ ТО «Городская поликлиника № 4» г. Тюмени. Основную группу исследуемых составили пациенты с предиабетом в количестве 122 человек, в возрасте от 41 до 65 лет (средний возраст - 46,2±8,2 года). Критериями включения явились гликемия натощак ≥ 6,1 и <7,0 ммоль/л, гликемия в ходе орального глюкозотолерантного теста (ОГТТ) ≥ 7,8 и <11,1 ммоль/л; возраст старше 18 лет; добровольное согласие на участие в исследовании. Критериями невключения явились СД 1-го типа, СД 2-го типа; обострение хронических заболеваний; острые респираторные вирусные инфекции; хроническая сердечная недостаточность функционального класса III–IV по классификации Нью-Йоркской ассоциации сердца; хроническая болезнь почек 3б-5-й стадии (скорость клубочковой фильтрации - СКФ менее 45 мл/мин); онкологические заболевания; анемия средней и тяжелой степеней; печеночная недостаточность умеренной и высокой степеней активности; желудочно-кишечные заболевания.
Медианы значения показателей углеводного обмена в группе составили: гликемии натощак – 6,31 [6,1; 6,6] ммоль/л, гликемии через 2 ч в ходе ОГТТ – 8,2 [7,1; 9,1] ммоль/л; гликированного гемоглобина – 5,86 [5,6; 6,1]%. Среднее значение индекса массы тела составило 31,4±6,1 кг/м2. На момент верификации предиабета нарушенная гликемия натощак (НГН) была выявлена у 40,6% исследуемых, у 35,6% - нарушенная толерантность к углеводам (НТГ).
Группа сравнения была представлена исследуемыми в количестве 44 человек, критерием ее формирования явилось определение уровня гликированного гемоглобина в диапазоне от ≥5,7 до <6,5%, без верифицированных иных изменений в показателях углеводного обмена.
В группу контроля вошли 38 практически здоровых человек, сопоставимых с основной группой исследования по полу и возрасту ( р >0,05).
С целью оценки кардиоренального риска в группе пациентов с РНУО производилась регистрация суммарных кардиоренальных событий (СКРС) в течение года наблюдения. В течение года осуществлялась регистрация суммарных кардиоренальных событий. В рамках настоящего исследования к суммарным кардиоренальным событиям относили: эпизоды впервые возникшей стенокардии напряжения; прогрессирование функционального класса стенокардии напряжения; возникший за период наблюдения острый коронарный синдром; появление симптомов хронической сердечной недостаточности и/или повышение функционального класса хронической сердечной недостаточности (по NYHA); возникновение гипертонических кризов, потребовавших вызова бригады скорой медицинской помощи и/или обращение за медицинской помощью в медицинские организации 2 раза и более; неконтролируемая артериальная гипертензия, потребовавшая увеличения доз и количества принимаемых гипотензивных препаратов; впервые диагностированная микроальбуминурия в разовой порции мочи более 30 мг/мл; прогрессирование микроальбуминурии на 5 мг/мл в течение года; снижение уровня СКФ на 5 мл/мин/1,73 м2 и более в течение года. В группе пациентов с РНУО доля зарегистрированных в течение года СКРС составили 44,7% (102 человека) с преобладанием в группе НТГ – 50,4% (63 пациента) в сравнении с НГН – 37,9% (39 человек). Фатальных СКРС в течение года в анализируемой группе зарегистрировано не было.
Всем респондентам проводили исследование антропометрических параметров с последующим расчетом индекса массы тела. Интерпретация результатов расчетов осуществлялась согласно классификации ожирения по индексу массы тела 1997 г., рекомендованной Всемирной организацией здравоохранения (разработанной международной группой по ожирению Всемирной организации здравоохранения). Всем исследуемым измеряли окружность талии (ОТ) и окружность бедер (ОБ). ОТ у мужчин ≥94 см и у женщин ≥80 см расценивали как диагностический критерий абдоминальной формы ожирения (IDF, 2005). Определено значение индекса «талия/бедро» (ИТБ) отношением ОТ к ОБ. ИТБ, превышающий значения 0,9 у мужчин и 0,85 у женщин, рассматривался как показатель абдоминального типа распределения жировой ткани. Медиана и интерквартильный размах ОТ в группе составили 109 [93; 113] см, ОБ – 114 [107; 122] см, ИТБ – 0,93 [0,87; 0,99]. Гендерные различия были выявлены в отношении ОТ ( p =0,021). Артериальную гипертензию (АГ) констатировали при уровне систолического артериального давления – АД (САД) ≥140 мм рт. ст. и/или диастолического АД (ДАД) ≥90 мм рт. ст., и/или если больной получал антигипертензивную терапию. При этом 73% (89/122) исследуемых имели АГ, 43,4% (53/122) участников общей выборки – АГ 1-й степени, 29,5% (36/122) участников общей выборки – АГ 2-й степени. Уровень тревожности оценивали по опроснику Спилбергера (STAI).
Количественное определение C-пептида, инсулина, грелина, лептина, висфатина, ингибитора тканевого активатора плазминогена 1-го типа в плазме оценивали методом проточной флуориметрии на двухлучевом лазерном автоматизированном анализаторе Bio-Plex Protein Assay System (Bio-Rad, США) с использованием тест-системы Bio-Plex ProHuman Diabetes 10-Plex (Bio-Rad, США). Считывание результатов производилось с помощью автоматического фотометра для микропланшета Bio-Plex® 200 Systems (Bio-Rad, США) и программы Bio-Plex Manager (Bio-Rad, США). Уровень высокочувствительного С-реактивного белка (СРБ-hs) определяли методом турбидиметрического анализа агглютинации латексных частиц с помощью реактивов фирмы BioSystems (Испания), на анализаторе Humalyzer, концентрации интерлейкина-18 («Интерлейкин-18-ИФА-БЕСТ», Россия), фактор некроза опухоли α
(ФНО-α) («Альфа-ФНО-ИФА-БЕСТ», Россия). Использовали эвакутайзеры с гепарином, цитратом натрия и этилендиаминтетрауксусной кислоты (в зависимости от рекомендаций производителя реактивов), при хранении биологического материала более 24 ч, для предотвращения потери активности гормонов и цитокинов использовалась температура –70ºС. Производили анализ мочи на микроальбуминурию, осуществляли оценку уровня креатинина по стандартной методике с последующим расчетом СКФ (Modification of Diet in Renal Disease). Анализ уровня подоцина, мочевого и плазменного уровня цистатина С проводили методом иммуноферментного анализа с использованием тест-системы «Цистатин С-ИФА-Бест».
Всем исследуемым рассчитаны индексы инсулино-резистентности и оценки функционирования β-клеток по следующим формулам: HOMA-IR (HOmeostatic Model Assessment for Insulin Resistance) = Глюкоза [ммоль/л] × Инсулин [мкЕд/мл] ÷ 22.5, QUICKI (QUantitative Insulin sensitivity ChecK Index) = 1 ÷ (lg (Глюкоза [мг/дл]) + lg (Инсулин [мкЕд/мл])); HOMA1-β (HOMA1-β%) = 20 × Инсулин [мкЕд/мл] ÷ (Глюкоза [ммоль/л] – 3,5). Исследованы также показатели крови (липидный спектр, показатели углеводного обмена).
Исследование биохимических показателей проводилось на биохимических анализаторах: Immunochemistry Systems и Synchron Clinical System СХ 5 PRO (Beckman Coulter, США) и Humalyzer 3000 (HUMAN GmbH, Германия). Уровень гликированного гемоглобина определяли турбидиметрическим методом с использованием иммуноингибирования с помощью реагента Hemoglobin A1С (Beckman Coulter, США).
В работе соблюдались этические принципы, предъявляемые Хельсинкской декларацией и стандартами надлежащей клинической практики (Good Clinical Practice); исследование выполнено согласно основным правилам к проведению клинических исследований и одобрено комитетом по этике ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, пациенты были включены в исследование после подписания информированного согласия.
Статистическую обработку данных проводили с использованием программного обеспечения SPSS Statistics 26.0 (IBM Corp., США). Количественные показатели оценивали на соответствие нормальному распределению с помощью критерия Шапиро – Уилка или критерия Колмогорова – Смирнова. Для оценки корреляционных связей изучаемых количественных признаков был использован коэффициент корреляции Спирмена. Сравнение групп осуществляли с применением непараметрических критериев Краске-ла – Уоллиса, Манна – Уитни. Для анализа данных в несвязанных группах, представленных в виде абсолютных чисел (абс.) и долей (%), применен критерий χ2 Пирсона или точный критерий Фишера (в случае менее 10 значений ожидаемого явления), при сравнении более чем 2 групп применяли поправку Бен-джамини – Хохберга на множественность сравнений. Степень ассоциаций параметров и состояний оценивали в значениях показателей отношения шансов (ОШ). Статистически значимыми различия считали при р <0,05.
Результаты. С целью проведения внутригрупповой дифференциации пациентов с предиабетом на основании ассоциаций клинико-метаболических параметров с разными фенотипами РНУО выделены следующие группы: пациенты с НГН, пациенты с НТГ, лица с сочетанием НГН и НТГ.
Анализ ассоциаций клинико-метаболических параметров у пациентов с НГН показал статистически значимые прямые связи с объемом жировой массы ( р =0,05), индексом HOMA-IR ( р =0,005) и уровнем ТГ в плазме крови ( р =0,05; табл. 1). Повышение уровня гликемии плазмы натощак ≥6,1 ммоль/л возрастает в 1,3 раза при увеличении концентрации ТГ на 1 ммоль/л (95% доверительный интервал – ДИ 1,01–1,7), в 1,1 раза – при увеличении значения индекса HOMA-IR (95% ДИ 1,01–1,1) и в 1,02 раза при увеличения объема жировой массы на 1 кг (95% ДИ 1,01–1,05).
Анамнестические, метаболические и гормональные показатели продемонстрировали наличие ассоциаций с развитием НТГ (табл. 2). Риск повышения значений гликемии через 2 ч в ходе проведения ОГТТ возрастал с возрастом (ОШ 1,1, 95% ДИ 1,02–1,098; p =0,002), и прогрессированием исулинорезистентно-сти, оцененной с использованием индекса HOMA-IR (ОШ 1,3, 95% ДИ 1,05–1,6; p =0,001). Риск развития НТГ увеличивался при повышении уровня инсулина (ОШ 1,15, 95% ДИ 1,05–1,3; p =0,039) и С-пептида (ОШ 1,3, 95% ДИ 1,1–1,5; p =0,01). Прямая зависимость наблюдалась при прогнозировании развития НТГ и уровнем лептина (ОШ 1,05, 95% ДИ 1,03–1,1; p =0,01).
Наиболее значимый вклад в развитие сочетанных ранних нарушений углеводного обмена (НГН+НТГ) продемонстрировали индекс инсулиночувствитель-ности QUICKI ( р =0,036), уровень интерлейкина (IL)-1β ( р =0,021), СРБ-hs ( р =0,031), цистатина С в моче ( р =0,002), С-пептида ( р =0,039; табл. 3). Увеличение значения индекса QUICKI на 1 ед. повышал риск одновременного развития НГН и НТГ в 3,9 раза (95% ДИ 1,1–14,3), повышение концентрации IL-1β – в 2,6 раза (95% ДИ 1,2–5,7), СРБ-hs – в 1,85 раза (95% ДИ
1,2–5,7), цистатина С в моче – в 1,8 раза (95% ДИ 1,1–17,4; см. табл. 3).
Сравнительный анализ параметров, продемонстрировавших ассоциации с различными фенотипами РНУО, ряд из которых представлен на рисунке. Группа пациентов с НГН характеризовалась более низкими значениями индекса HOMA-IR ( p =0,044), ФНО-α ( р <0,001) и показателей липидного профиля – общего холестерина – ОХС ( р =0,004) и липопротеинов низкой плотности – ЛПНП ( р =0,002) в сравнении с пациентами с НТГ, а также более низким уровнем IL-8 ( р =0,044) и IL-18 ( р =0,024) в сравнении с исследуемыми, имеющими НГН и НТГ. Параметры пациентов с уровнем гликемии через 2 ч в ходе проведения ОГТТ в диапазоне 7,8–11,1 ммоль/л продемонстрировали более высокие значения показателей в части объема жировой массы ( р =0,044), ОХС ( р =0,014), С-пептида ( р =0,003) в сравнении с пациентами с диагностированным сочетанием НГН и НТГ. Зарегистрированы также более высокие значения индекса HOMA-IR ( p =0,044), ОХС (р=0,004), ЛПНП ( р =0,002), ФНО-α ( р <0,001) в сравнении с пациентами группы НГН. В группе пациентов с сочетанием НГН и НТГ были продемонстрированы более высокие значения СРБ-hs ( р =0,044) и IL-8 ( р =0,044), а также уровня лептина, не имевшего, однако, статистически значимых различий.
Наиболее значимыми прогностическими факторами развития НГН являлись объем жировой массы и ассоциированные с ее избытком уровень инсули-норезистентности и дислипидемия. НТГ была ассоциирована с более поздним возрастом дебюта, а также инсулинорезистентностью, дислипидемией и увеличением базального уровня лептина. Сочетание данных форм ранних углеводных нарушений, помимо названных предикторов, также ассоциированы
Таблица 1
Прогностическая значимость маркеров клинико-метаболических показателей в формировании фенотипа предиабета по типу НГН
|
Анализируемый параметр |
Exp(β) |
95% ДИ |
p * |
|
Жировая масса, кг |
1,02 |
1,01–1,05 |
0,05 |
|
HOMA-IR |
1,1 |
1,01–1,1 |
0,005 |
|
ТГ, ммоль/л |
1,3 |
1,01–1,7 |
0,05 |
*Здесь и далее в табл. 2, 3: р <0,05, значимость определена с использованием непараметрического критерия Краскела – Уоллиса с поправкой Бонферрони на множественность сравнений.
Таблица 2
Прогностическая значимость маркеров клинико-метаболических показателей в формировании фенотипа предиабета по типу НТГ
|
Анализируемый параметр |
Exp(β) |
95% ДИ |
p * |
|
Анамнестические показатели |
|||
|
Возраст, полных лет |
1,1 |
1,02–1,098 |
0,002 |
|
Возраст дебюта РНУО, полных лет |
1,05 |
1,02–1,09 |
0,006 |
|
Метаболические показатели |
|||
|
HOMA-IR |
1,3 |
1,05–1,6 |
0,001 |
|
ОХС, ммоль/л |
1,3 |
1,01–1,8 |
0,039 |
|
ЛПНП, ммоль/л |
1,9 |
1,3–2,9 |
0,001 |
|
Гормональные показатели |
|||
|
Инсулин, пг/мл |
1,15 |
1,05–1,3 |
0,039 |
|
С-пептид, пг/мл |
1,3 |
1,1–1,5 |
0,01 |
|
Лептин, нг/мл |
1,05 |
1,03–1,1 |
0,001 |
Таблица 3
|
Анализируемый параметр |
Exp(β) |
95% ДИ |
p * |
|
Анамнестические и антропометрические показатели |
|||
|
Возраст, полных лет |
1,15 |
1,08–1,3 |
0,006 |
|
Жировая масса, кг |
1,05 |
1,01–1,1 |
0,045 |
|
Метаболические показатели |
|||
|
HOMA-IR |
1,05 |
1,01–1,15 |
0,002 |
|
HOMA-β |
1,07 |
1,02–1,09 |
<0,001 |
|
QUICKI |
3,9 |
1,1–14,3 |
0,036 |
|
ОХС, ммоль/л |
1,5 |
1,05–1,7 |
0,045 |
|
Гормональные показатели |
|||
|
С-пептид, пг/мл |
1,2 |
1,15–1,34 |
0,039 |
|
Лептин, нг/мл |
1,08 |
1,001–1,1 |
0,002 |
|
Маркеры раннего почечного повреждения |
|||
|
Цистатин С в моче, мкг/мл |
1,8 |
1,1–17,4 |
0,05 |
|
Маркеры системного низкоинтенсивного воспаления |
|||
|
СРБ-hs, мг/л |
1,85 |
1,1–3,2 |
0,031 |
|
ФНО-α, пкг/мл |
1,1 |
1,005–1,09 |
0,05 |
|
IL, пкг/мл: |
|||
|
-1β |
2,6 |
1,2–5,7 |
0,021 |
|
-6 |
1,2 |
1,01–1,4 |
0,036 |
|
-8 |
1,06 |
1,01–1,1 |
0,011 |
|
-10 |
1,14 |
1,005–1,3 |
0,042 |
|
-18 |
1,002 |
1,001–1,004 |
0,036 |
Сравнительная характеристика параметров, ассоциированных с формированием фенотипов предиабета, в группах пациентов с нарушенной гликемией натощак (НГН) и нарушенной толерантностью к глюкозе (НТГ) и их сочетанием. Значимость определена с использованием непараметрических критериев: * р <0,05 – U -критерия Манна – Уитни;
** р <0,05 – Краскела–Уоллиса, с поправкой Бонферрони на множественность сравнений
Прогностическая значимость маркеров клинико-метаболических показателей в формировании фенотипов предиабета по типу сочетания НГН и НТГ
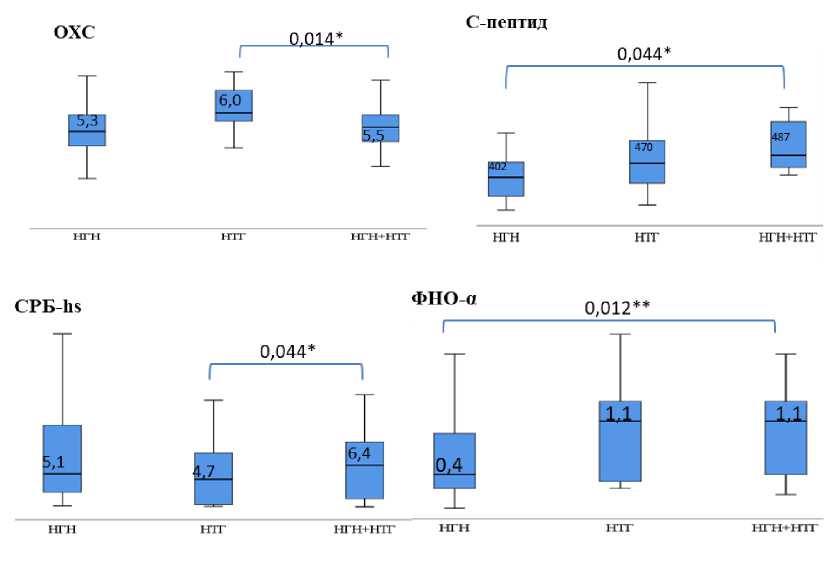
с увеличением уровня маркеров раннего почечного повреждения и кардиоваскулярного риска. Однако однозначных статистически значимых различий при сравнении уровней данных параметров в группах пациентов с различными фенотипами предиабета не выявлено, что требует проведения дальнейших исследований для точной оценки клинико-метаболического статуса каждого фенотипа РНУО.
Учитывая различный клинико-метаболический статус пациентов с НГН, НТГ и сочетанием НГН и НТГ, риск сосудистых осложнений, в том числе вероятность развития СКРС в течение года, для каждого фенотипа РНУО не является равнозначным (табл. 4).
диабетическими фенотипами в больших когортах населения [12].
Заключение. Сочетание НГН и НТГ в группе пациентов с ранними нарушениями углеводного обмена демонстрируют повышение риска кардиоренальных событий, что требует дифференцированного подхода к разработке алгоритма ведéния пациентов с различными фенотипами предиабета.
Вклад авторов. Все авторы сделали эквивалентный вклад в подготовку публикации.


