Атеротромботический инсульт: клинические показатели и параметры тромбоцитарного гемостаза у пациентов в остром периоде
Автор: Голдобин В.В., Клочева Е.Г., Асадуллаева П.М., Вавилова Т.В., Сироткина О.В., Ласковец А.Б.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Неврология
Статья в выпуске: 4 т.8, 2012 года.
Бесплатный доступ
Цель: изучение клинических данных и показателей тромбоцитарного гемостаза у пациентов с атеротромбо-тическим инсультом для совершенствования вторичной профилактики. Материал и методы. Обследованы: 41 пациент (26 (63,4%) мужчин, 15 (36,6%) женщин, средний возраст 66,0±9,4 года) и 18 здоровых лиц контрольной группы. Выполнялся стандартный неврологический осмотр, оценка состояния в баллах по шкале инсульта Американского национального института здоровья и шкале Ранкина, исследование клинического анализа крови, аденозиндифосфат индуцированной агрегометрии и проточной цитометрии, молекулярно-генетический анализ мутации гена Iba. Методом проточной цитометрии в основной группе выявлена активация тромбоцитарного звена гемостаза. Результаты. Показана неинформативность стандартной агрегометрии для оценки активации тромбоцитов у пациентов с атеротромботическим инсультом. В основной группе наблюдалась корреляция экспрессии рецепторов к фактору Виллебранда на тромбоците с баллом по шкале инсульта Американского национального института при выписке. Мутация гена рецептора 1 ba у пациентов с инсультом встречалась чаще, чем у здоровых лиц. Заключение. Выявленные изменения предполагают возможность индивидуализации назначения антиагрегантных препаратов данным больным.
Атеротромботический инсульт, проточная цитометрия, р-селектин, рецепторы тромбоцитов
Короткий адрес: https://sciup.org/14917660
IDR: 14917660
Текст научной статьи Атеротромботический инсульт: клинические показатели и параметры тромбоцитарного гемостаза у пациентов в остром периоде
Адрес: 188645, Ленинградская обл., г. Всеволожск, ул. Центральная,
-
7, кв. 12.
Тел.: +79013016653.
является повторное развитие инсультов в течение пяти лет у 16-42% больных [2]. До настоящего времени механизмы развития ишемического инсульта окончательно не ясны. Определяющую роль в патогенезе атеротромботического инсульта (АТИ) играет взаимодействие тромбоцитов и эндотелия сосудистой стенки [3]. Вследствие этого важной составляющей вторичной профилактики АТИ является назначение антитромбоцитарных препаратов.
Цель : изучение клинических данных и показателей тромбоцитарного гемостаза у пациентов с АТИ для совершенствования вторичной профилактики.
Методы. В остром периоде АТИ обследовали 41 пациента: мужчин 26 (б3,4%), женщин 15 (36,6%), средний возраст 66,0±9,4 года, проходивших обследование и лечение в клинике неврологии Северо-Западного государственного медицинского университета имени И. И. Мечникова и Городской больницы святой преподобномученицы Елизаветы. Диагноз «АТИ» был подтвержден данными компьютерной томографии (КТ) головного мозга (рис. 1). На момент обследования 40 пациентов принимали препараты ацетилсалициловой кислоты, 1 пациент — клопидо-грель.
Рис. 1. КТ головного мозга пациента Н. (стрелкой указан очаг АТИ)
В исследование не включали пациентов с кардиоэмболическим вариантом инсульта, а также больных с хронической почечной недостаточностью на гемодиализе, больных с идиопатической тромбоцитеми-ей, острым коронарным синдромом, так как активация тромбоцитов при данных состояниях доказана. Кроме того, исключались пациенты, принимающие антидепрессанты из группы селективных ингибиторов обратного захвата серотонина, поскольку у больных, длительно принимающих данные препараты, отмечается снижение агрегации тромбоцитов. В качестве контрольной группы были обследованы 18 человек, не имеющих клинических признаков сосудистой патологии головного мозга.
Комплексное обследование включало: клиниконеврологическое обследование, а также инструментальное и лабораторное исследования. На каждого больного заполнялась специально разработанная карта.
Неврологический осмотр выполнялся по стандартной методике. Проводилась также оценка состояния пациентов на момент поступления и при выписке в баллах по общепринятым шкалам. Шкала инсульта Американского национального института здоровья (NIHSS) характеризует основные функции, нарушающиеся при церебральном инсульте [4]. Шкала Ранкина позволяет оценить степень зависимости в повседневной жизни и функциональную независимость [5, 6].
Лабораторное исследование включало клинический анализ крови при поступлении и на 10-й день от развития ЛИ, а также аденозиндифосфат- (АДФ-) индуцированную агрегатометрию и проточную цитометрию на 10-й день от развития инсульта. Венозную кровь забирали в утреннее время, натощак. В условиях процедурного кабинета под венозным жгутом проводилась венепункция локтевой вены иглой 21G со свободным током крови через вакутейнер в вакуумные полипропиленовые пробирки, содержащие в качестве антикоагулянта К2 и К3 соль этинилдиа-минтетрауксусной кислоты (для гематологического анализа) и 3,8% цитрата натрия (для аггрегометрии и проточной цитометрии). Выполнение клинического анализа крови с подсчетом количества тромбоцитов осуществляли кондуктометрическим методом на автоматических гематологических анализаторах «Beck-man Coulter LH 500» и «MaxM» (США). Показатель среднего объема тромбоцитов (MPV) рассчитывался прибором автоматически из гистограммы тромбоцитов.
АДФ-индуцированную агрегацию тромбоцитов исследовали фотометрическим методом на агрегометре «SOLAR» (Беларусь). Концентрация индуктора составляла 2,5 мкМ, 5 мкМ (АДФ производства «Sigma-Aldrich», США). Результат оценивали по изменению степени светопропускания в точке максимума, а также по скорости агрегации через 30 с после добавления АДФ. Перед исследованием на проточном цитометре проводили центрифугирование полученной крови при 1500 об/мин в течение 5 мин при комнатной температуре для получения плазмы, богатой тромбоцитами (БТП). Плазму, обедненную тромбоцитами (ОТП), получали путем центрифугирования БТП при 3000 об/мин в течение 15 мин. ОТП использовали для разведения БТП до 300 тысяч кл/ мкл, если это было необходимо, а также калибровки агрегометра на уровень Т=100%. Содержание GP IIb/ IIIa и GP Ibα на поверхности тромбоцитов, а также число клеток, экспрессирующих Р-селектин, определяли на проточном цитометре «CYTOMICS FC 500» («Beckman Coulter», США). Использовались флуоресцентно меченные моноклональные антитела CD61-FITC, VM16d-FITC и CD62P-PE. Количество GP IIb/IIIa и GP Ibα на поверхности тромбоцитов до и после индукции 10 мкМ АДФ оценивали по показателю средней интенсивности флуоресценции. Экспрессию Р-селектина на поверхности тромбоцитов оценивали как процент клеток, меченных CD62P-PE до и после индукции 10 мкМ АДФ. Математически рассчитывались параметры:
-
1) ΔGP IIb/IIIa, который показывает увеличение в % количества рецепторов GP IIb/IIIa на поверхности тромбоцитов после индукции АДФ;
-
2) ΔР-селектина, показывающий увеличение % тромбоцитов, экспрессирующих Р-селектин после индукции АДФ.
Молекулярно-генетическое исследование включало выявление точечной мутации гена тромбоцитарного гликопротеида 1bα, локализованного в 13-м локусе короткого плеча 17 хромосомы (с.3550С>T — замена С на Т в 3550 позиции). Наличие данной миссенс-мутации приводит к замене триптофана на метионин в 145-м положении аминокислотной последовательности белка (Thr145Met), в результате чего изменяется функциональная активность рецептора к фактору Виллебранда, что предрасполагает к тром-бообразованию и увеличивает риск развития сердечно-сосудистых заболеваний почти в 3 раза [7].
Дезоксирибонуклеиновую кислоту (ДНК) выделяли из лейкоцитов крови стандартным фенолхлороформным методом. Лизис клеток проводили по методу Канкеля с использованием реактивов фирмы «Хеликон» (Россия). Выход ДНК составлял 40–50 мкг ДНК из 500 мкл цельной крови. Для идентификации однонуклеотидных замен использовали амплификацию соответствующего участка гена методом полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом. Амплификацию проводили на амплификаторе «Терцик» (термостат программируемый четырехканальный для проведения ПЦР-анализа ТП4-ПЦР-01 — «Терцик» ТУ 9452-001-46482062-98, НПФ «ДНК-Технология», Россия) при помощи термостабильной высокопроцес-сивной рекомбинантной Taq ДНК полимеразы фирмы «Fermentas» (Литва). В результате реакции получали фрагмент 587 п.н., который подвергался ферментативному расщеплению с помощью рестриктазы Hin 1I (1 ед.) в рестрикционном буфере. Продукт рестрикционного анализа электрофоретически разделяли при 30 мА (150В) в геле в трис-боратном буфере. Результаты визуализировали в ультрафиолетовом свете после окрашивания бромистым этидием. В случае нормального аллельного варианта (Thr) определялись фрагменты 270 п.н., 201 п.н. и 1163 п.н., при мутации образуются фрагменты 386 п.н. и 201 п.н. (Met).
Статистическую обработку результатов выполняли с использованием пакета программ Statistica 6,0 for Windows (StatSoft Inc.). Проверка нормальности распределения проводилась по критерию Шапиро — Уилка. Для проверки гипотезы о равенстве средних для двух групп использовались параметрические (t-Стьюдента для независимых выборок; t-Стьюдента для связанных выборок) или непараметрические (Манна — Уитни, Вилкоксона) критерии. Различия считались статистически значимыми при p<0,05.
Результаты. Клиническая картина у пациентов основной группы представлена на рис. 2.
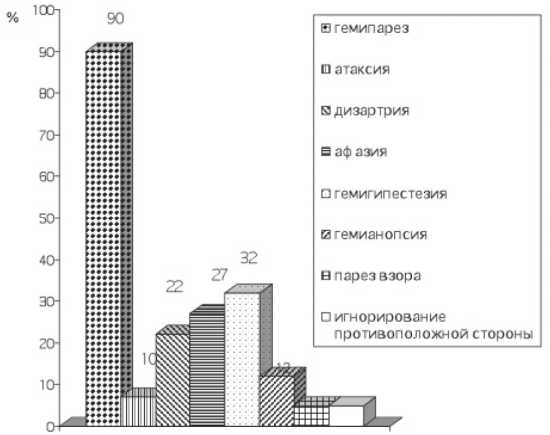
Рис. 2. Клинические синдромы у пациентов основной группы
Показатель шкалы Ранкина при поступлении составил 3,2±1,0 балла, а при выписке 2,1±0,8 балла. Результат NIHSS при поступлении был равен 8,9±4,2 балла, при выписке 4,3±2,5 балла. Наблюдалось значимое уменьшение баллов указанных шкал за время госпитализации (р<0,05), что свидетельствовало об улучшении состояния пациентов.
Уровень тромбоцитов у больных с АТИ при поступлении был равен 223,7±59,3×109/л, на 10-й день от начала заболевания 227,7±65,3×109/л. MPV при поступлении был 10,0±1,1 фл, на 10-й день от начала заболевания 8,6±1,1 фл.
Результаты агрегометрии представлены в таблице. Наблюдалась достоверно более высокая скорость агрегации тромбоцитов на стимуляцию 2,5 мкмоль АДФ у лиц контрольной группы (р<0,05), в то время как при стимуляции 5 мкмоль АДФ значимого различия не выявлено. Полученные результаты меньших значений агрегации тромбоцитов у пациентов с АТИ, вероятно, связаны с действием постоянной антиагрегантной терапии.
Показатели агрегометрии у пациентов с АТИ и в контрольной группе
|
Обследуемые |
2,5 АДФ |
5 АДФ |
||
|
степень, % |
скорость, %/мин |
степень, % |
скорость, %/мин |
|
|
Пациенты с АТИ |
58,4±27,1 |
24,8±10,0* |
69,7±38,9 |
27,0±12,7 |
|
Контрольная группа |
70,5±23,8 |
31,8±13,9* |
67,6±20,9 |
32,6±19,0 |
При мечание: * — p<0,05.
Количество рецепторов IIb/IIIa на тромбоците до активации АДФ составило 7,0±1,7; после активации 7,9±1,8. Коэффициент изменения количества рецепторов IIb/IIIa на тромбоците (∆IIb/IIIa) был равен 10,3±4,8%, что не отличалось от показателей в контрольной группе 9,8±2,1 %. Известно, что количество рецепторов IIb/IIIa является генетически детерминированным и мало изменяется под воздействием экзо- и эндогенных факторов.
Тромбоциты, экспрессирующие Р-селектин, до стимуляции АДФ составляли 5,1±4,3%, после стимуляции 35,6±17,3%. Коэффициент изменения % тромбоцитов, экспрессирующих Р-селектин (АР-селектина), был равен 82,4±17,5%., что достоверно больше значения ∆Р-селектина в контрольной группе — 61,5±8,0% (р<0,05). Более высокое значение ∆Р-селектина у пациентов с АТИ свидетельствовало о более высокой активности тромбоцитов у пациентов данной группы. Таким образом, у пациентов с АТИ наблюдалось несоответствие данных стандартной агрегометрии, указывающей на меньшую агрегацию тромбоцитов при стимуляции низкими дозами АДФ, и результатов проточной цитометрии, свидетельствующей о более высокой активности тромбоцитов.
Достоверного различия количества рецепторов 1bα на тромбоците в основной и контрольной группах не наблюдалось (соответственно 4,0±1,3 и 3,8±1,7; р>0,05). Однако при корреляционном анализе в основной группе наблюдалась прямая достоверная корреляция экспрессии рецепторов к 1bα и балла по NIHSS при выписке (р<0,05), что указывало на худшее восстановление пациентов с более высоким уровнем экспрессии фактора Виллебранда. При молекулярно-генетическом исследовании мутантная аллель в основной группе выявлялась чаще, чем в контрольной, однако достоверного различия не наблюдалось (р>0,05).
Обсуждение. Высокая агрегационная способность тромбоцитов является одним из факторов риска развития сердечно-сосудистых заболеваний. «Золотым стандартом» для анализа активности тромбоцитов признан оптический метод. Однако недостатком данной методики является зависимость оптических характеристик от нетромбоцитарных причин: липидемии, протеинемии. Кроме того, в процессе подготовки к исследованию in vitro происходит изменение активности тромбоцитов. В основе метода проточной цитометрии заложена высокоспецифичная реакция антиген-антитело, что, возможно, позволяет отражать ситуацию in vivo более адекватно, по сравнению с оптической агрегометрией.
Мутация гена c.3550C>T рецептора 1bα на тромбоците предполагает функциональную перестройку и более высокоактивное состояние рецепторного белка. Указанная мутация часто наблюдается совместно с различным числом тандемных повторов гена 1bα, определяющим длину активной «ножки» субъединицы 1b. Большая длина ножки обеспечивает более эффективное связывание с тромбоцитом. В нашем исследовании мы определяли мутацию c.3550C>T в изолированном состоянии. Частота возникновения мутации была выше, чем в контрольной группе, но не достигла значимого уровня, что, вероятно, связано с недостаточно большим числом наблюдений.
В доступной нам литературе не встретилось данных об экспрессии рецепторов к фактору Виллебранда на тромбоците у пациентов с АТИ. Тромбооб-разование определяется взаимодействием фактора Виллебранда со специфическими рецепторами клеток крови, в первую очередь тромбоцитов. Уровень фактора Виллебранда в крови у пациентов с АТИ значимо повышен в остром и в раннем восстановительном периодах [8, 9]. Мы наблюдали прямую значимую корреляцию уровня 1bα-рецепторов с клиническими данными, что, возможно, отражает ухудшение восстановления пациентов с повышенным образованием комплекса «фактора Виллебранда — рецептор к фактору Виллебранда — IX–V».
Перспективным направлением у данных пациентов могут стать препараты, блокирующие рецептор к фактору Виллебранда или комплекс фактор Виллебранда — рецептор к фактору Виллебранда.
Выводы:
-
1. Метод стандартной агрегометрии недостаточно информативен для оценки активации тромбоцитов у больных с атеротромботическим инсультом.
-
2. Метод проточной цитометрии позволяет выявить активацию тромбоцитарного звена гемостаза у пациентов с атеротромботическим инсультом.
-
3. Экспрессия рецепторов к фактору Виллебранда на тромбоците может иметь прогностическое значение для течения инсульта.
-
3. Мутация гена рецептора 1bα c.3550C>T на тромбоците у больных с атеротромботическим инсультом наблюдается чаще, чем у здоровых лиц.
Список литературы Атеротромботический инсульт: клинические показатели и параметры тромбоцитарного гемостаза у пациентов в остром периоде
- Гусев Е. И., Скворцова В. И., Стаховская Л. В. Эпидемиология инсульта в России//Журн. неврологии и психиатрии. Прилож.: Инсульт. 2003. С. 4-9
- Суслина З.А., Пирадов М.А. Инсульт: диагностика, лечение, профилактика. М.: МЕДпресс-информ, 2008. 88 с.
- Суслина З.А., Танашян М.М., Ионова В. Г. Ишемический инсульт: кровь, сосудистая стенка, антитромботическая терапия. М: Медицинская книга. 2005
- Measurement of acute cerebral infarction: a clinical examination scale/T. Brott, H. P. Adams, С. P. Olinger [et al.]//Stroke. 1989. Vol. 20, №.7. P. 864-870
- Bonita R., Beaglehole R. Modification of Rankin Scale: recovery of motor function after stroke//Stroke. 1988. Vol. 19, №. 12. P. 1497-1500
- Rankin J. Cerebral vascular accidents in patients over the age of 60//Scott. Med. J. 1957. Vol. 2, № 5. P. 200-215
- Polymorphisms of platelet membrane glycoprotein lb associated with arterial thrombotic disease/R. Gonzalez-Conejero, M.L. Lozano, J. Rivera [et al.]//Blood. 1998. Vol. 92, № 8. P. 2771-2776
- Шимохина Н.Ю., Петрова M.M., Савченко А. А. Состояние гемостаза, метаболическая активность тромбоцитов и прогнозирование повторных цереброваскулярных осложнений тромботического характера у сердечно-сосудистых больных в остром периоде ишемического инсульта//Клинико-лабораторный консилиум. 2010. Т. 33-34, № 2-3. С. 102-106
- Endothelial markers and adhesion molecules in acute ischemic stroke -sequential change and differences in stroke subtype/K. Kozuka, T. Kohriyama, E. Nomura [et al.]//Atherosclerosis. 2002. Vol. 161, № 1. P. 161-168.


