АТФ-азная активность препарата миозина скелетных мышц после удлинения конечности
Автор: Стогов М.В., Гайдышев А.И.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
Изучена АТФ-азная активность миозина из скелетных мышц различного типа у собаки после оперативного удлинения голени по методу Илизарова. Проведен анализ кинетики миозиновой АТФ-азы в сравнении с миозином, полученным от интактного животного.
Миозин, скелетные мышцы, удлинение голени
Короткий адрес: https://sciup.org/142121029
IDR: 142121029
Текст научной статьи АТФ-азная активность препарата миозина скелетных мышц после удлинения конечности
Современные представления о миозине как о главном белке миофибрилл глобулиновой природы, растворимом лишь в солевых средах с достаточно высокой ионной силой, сложились в результате многочисленных работ, начатых в 1925 г. Вебером. В.А. Энгельгардт и М.Н. Любимова установили наличие у миозина АТФ-азной активности и способности одновременно изменять механические свойства под влиянием АТФ [3]. Способность миозина гидролизовать АТФ является основным процессом в акте механического сокращения, что, в конечном счете, определяет контрактильные способности мышц. Наряду с достаточно изученным строением и свойствами миози- на, вопрос о его кинетике остается мало изученным. Считается что кинетика миозина как фермента – АТФ-азы имеет не Михаэлисовскую зависимость [2]. Однако литературные данные по этому вопросу достаточно скудны. Значительный практический интерес представляет изучение активности этого фермента в условиях удлинения конечности. В связи с этим целью настоящего исследования являлось изучение кинетических свойств миозиновой АТФ-азы различных типов мышц полученной от интактной собаки и собаки после оперативного удлинения голени по методу Илизарова.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве объектов исследования были взяты передняя большеберцовая (ПББМ, быстрая мышца) и икроножная мышца (ИКМ, медленная) двух взрослых беспородных собак. Одна из них интактная (№ 4236), вторая экспериментальная (№ 4284), которой осуществляли удлинение голени методом Илизарова в течение 28 суток с режимом дистракции 1 мм в сутки за 4 приема, срок фиксации составил 30 суток. Срок эвтаназии – 1 месяц после снятия аппарата.
Миозин получали согласно схеме выделения, основанной на растворимости миозина и актомиозина в растворах солей различной ионной силы, которая сводилась к многократному последовательному осаждению и растворению миозина в растворах хлористого калия разной концентрации [4]. После выделения и переоса-ждения полученный препарат миозина лио-фильно высушивали.
Перед исследованием кинетических свойств навеску препарата 2 мг растворяли в 1 мл 0,5М KCl. Оценку на чистоту препарата миозина проводили методом электрофореза с помощью системы Paragon Beckman на пластинках той же фирмы. На электрофореграмме (рис. 1) видно, что две опытные пробы имели одиночную четко выраженную полосу, что свидетельствовало о чистоте полученного препарата.
Об активности фермента судили по количеству неорганического фосфата, который образовался при действии миозина на АТФ в присутствии Ca2+. Инкубационную смесь составляли, смешивая компоненты в следующем соотношении: на 1 мл раствора буфера 0,2 мл CaCl2 (0,1 М), 0,3 мл раствора АТФ (0,05 М), 0,3 мл воды. Реакцию начинали, добавляя в пробу 0,2 мл раствора миозина, содержащего 2-3 мг белка. Смесь хорошо перемешивали и инкубировали при 26 °С в течение 5 мин. Реакцию останавливали добавлением 1 мл 7,5 % раствора трихлоруксусной кислоты (ТХУ). Затем в растворе по реакции с молибдатом аммония определяли неорганический фосфат, образовавшийся в процессе ферментативного расщепления АТФ. Для определения предобразованного фосфата параллельно ставили контрольную пробу, в которую ТХУ приливали к инкубационной смеси перед добавлением миозина. Ферментативную активность миозиновой АТФ-азы рассчитывали на мг белка в пробе. Белок определяли по Лоури [4].
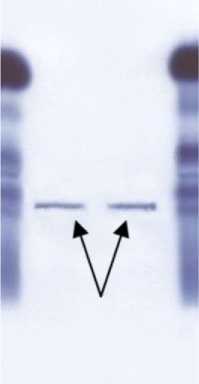
Рис. 1. Электрофореграмма полученного препарата миозина
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты зависимости активности миозиновой АТФ-азы, выделенной из скелетных мышц интактной и оперированной собак, от концентрации субстрата (АТФ) приведены в таблицах 1-4.
Сравнительный анализ активности препарата миозина в логарифмических координатах представлен на рисунке 2.
Таблица 1
Зависимость активности миозиновой АТФ-азы, полученной из передней большеберцовой мышцы интактной собаки, от концентрации субстрата
|
[АТФ], ммоль/л |
0,001 |
0,005 |
0,010 |
0,020 |
0,030 |
0,050 |
0,070 |
0,110 |
0,140 |
|
[Р], ммоль фосфата/мг белка |
0,196 |
0,201 |
0,250 |
0,267 |
0,326 |
0,365 |
0,418 |
0,637 |
0,654 |
Таблица 2
Зависимость активности миозиновой АТФ-азы, полученной из икроножной мышцы интактной собаки, от концентрации субстрата
|
[АТФ], ммоль/л |
0,001 |
0,005 |
0,010 |
0,020 |
0,030 |
0,050 |
0,070 |
0,110 |
0,140 |
|
[Р], ммоль фосфата/мг белка |
0,194 |
0,198 |
0,220 |
0,239 |
0,280 |
0,346 |
0,395 |
0,579 |
0,599 |
Таблица 3
Зависимость активности миозиновой АТФ-азы, полученной из передней большеберцовой мышцы оперированной собаки, от концентрации субстрата
|
[АТФ], ммоль/л |
0,001 |
0,005 |
0,010 |
0,020 |
0,030 |
0,050 |
0,070 |
0,110 |
0,140 |
|
[Р], ммоль фосфата/мг белка |
0,166 |
0,166 |
0,168 |
0,176 |
0,189 |
0,215 |
0,217 |
0,224 |
0,225 |
Таблица 4
Зависимость активности миозиновой АТФ-азы, полученной из икроножной мышцы оперированной собаки, от концентрации субстрата
|
[АТФ], ммоль/л |
0,001 |
0,005 |
0,010 |
0,020 |
0,030 |
0,050 |
0,070 |
0,110 |
0,140 |
|
[Р], ммоль фосфата/мг белка |
0,158 |
0,164 |
0,165 |
0,196 |
0,197 |
0,209 |
0,214 |
0,228 |
0,233 |
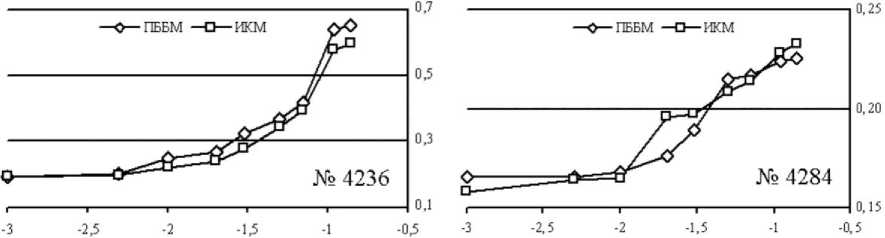
Рис. 2. Сравнение АТФ-азной активности миозина в разных типах мышц здоровой (собака № 4236) и оперированных конечностей (собака № 4284): по оси ОХ: lg[АТФ, ммоль/л]; по OY: активность миозиновой АТФ-азы (ммоль фосфата/мг белка)
Исходя из представленных данных можно сказать, что для обоих типов мышц как у здоровой, так и оперированной собаки мы получили кинетическую зависимость, характерную для ускоренных на начальном этапе реакций – это сигмоидальная зависимость скорости реакции от концентрации субстрата. Согласно литературным данным [1], сигмоидальная зависимость появляется, если в системе имеется несколько центров связывания, приводящих к образованию комплекса фермент/субстрат. Регуляторное значение сигмоидальной зависимости заключается в повышении чувствительности системы к концентрации субстрата и сведении к минимуму изменений концентрации, необходимых для существенного повышения или понижения активности фермента.
Как видно из рисунка 2, начальная скорость реакции миозиновой АТФ-азы в быстрой мышце (передней большеберцовой) выше, нежели в медленной (икроножной) как у интактной, так и у оперированной собаки.
Сравнивая полученные данные, следует отметить значительную разницу между активностью миозина в мышце здорового животного и собаки после оперативного удлинения. Наглядно это отражается при построении кинетической кривой в обратных координатах (рис. 3). Касательная к точке перегиба кривой будет соответствовать той концентрации субстрата, при которой миозиновая АТФ-аза имеет максимальную активность.
На рисунке 3 наглядно продемонстрировано, что активность миозина в здоровых мышцах значительно больше, чем в мышцах после удлинения при тех же концентрациях субстрата. В области низких концентраций графики почти повторяют друг друга, но с ростом концентрации субстрата активность фермента неопериро-ванных мышц растет быстрей. Кроме того, если точка перегиба АТФ-азной активности миозина из скелетных мышц удлиненной конечности была смещена в область высоких концентраций, то точка перегиба на графиках, отражающих зависимость активности фермента от концентрации субстрата мышц здоровых конечностей, была смещена в область низких концентраций. Это свидетельствовало о том, что скорость ферментативной реакции миозина из мышц здорового животного достигала своего максимума при минимальном расходе субстрата, т.е. энергии на сокращение затрачивалось меньше. Напротив, для сокращения мышц удлиненной конечности требовались бóльшие затраты энергии, а следовательно, больший расход субстрата.
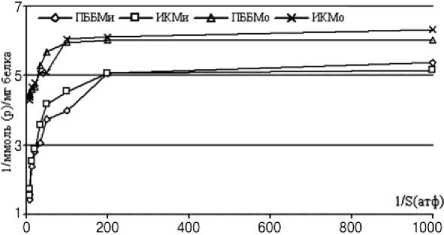
Рис. 3. АТФ-азная активность оперированных и интактных передних большеберцовых (ПББМо и ПББМи соответственно) и икроножных мышц (ИКМо, ИКМи) собак в обратных координатах
ЗАКЛЮЧЕНИЕ
В ближайшие сроки (1 месяц) после оперативного удлинения конечностей АТФ-азная активность миозина различных типов скелетных мышц удлиняемой конечности имеет отличные от мышц здоровых животных свойства. Максимальная активность миозина мышц подвергав- шихся удлинению смещена в сторону высоких концентраций АТФ, что ведет к повышенному расходу субстрата. Следовательно, чтобы обеспечить удлиняемой мышце такую же мышечную активность, как и неоперированной, нужно израсходовать большее количество АТФ.


