Атомно-силовая микроскопия морфологических и биофизических особенностей лимфоцитов крови при разных типах сахарного диабета
Автор: Столбовская Ольга Вениаминовна, Хайруллин Радик Магзинурович, Костишко Борис Борисович, Пчелинцева Екатерина Сергеевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Морфомика - новые технологии
Статья в выпуске: 3 т.23, 2015 года.
Бесплатный доступ
Атомно-силовая микроскопия (далее - АСМ), как один из ведущих прикладных нано-технологических методов исследования клеточных мембран, активно используется в ключевых областях биомедицины. Изучение биофизических свойств мембран и морфологических параметров лимфоцитов с помощью АСМ может дать существенную информацию о закономерностях структурных изменений их цитоплазматической мембраны в процессе развития сахарного диабета, развития нарушений метаболизма, микроциркуляции и иммунитета. Целью настоящего исследования явилось изучение ряда морфологических и биофизических особенностей лимфоцитов крови пациентов с сахарным диабетом с помощью АСМ. Материалом исследования явились лимфоидные клетки препаратов крови пациентов с инсулинозависимым (ИЗСД) и инсулиннезависимым типом сахарного диабета (ИНСД) и практически здоровых добровольцев. Для анализа состояния мембраны лимфоцитов использовали сканирующий зондовый микроскоп Solver P47-PRO (NT-MDT, Россия). Сканирование клеточной поверхности мембраны лимфоцитов крови проводили с использованием кремниевых зондов серии PNP-DB-20 (NT-MDT) с жёсткостью 0,06 Н/м, радиусом закругления 10 нм...
Атомно-силовая микроскопия, клеточная мембрана, лимфоциты, сахарный диабет
Короткий адрес: https://sciup.org/143177063
IDR: 143177063
Текст научной статьи Атомно-силовая микроскопия морфологических и биофизических особенностей лимфоцитов крови при разных типах сахарного диабета
Введение. При сахарном диабете происходят нарушения углеводного и липидного обмена, развиваются аутоиммунные реакции, которые в свою очередь являются факторами риска развития сосудистых осложнений[1, 2]. В условиях гипергликемии, повышения содержания липопротеидов в крови, окислительного стресса закономерно возникают структурные нарушения клеточной мембраны, которые проявляются, в том числе и в изменениях биофизических свойств лимфоцитов крови [3, 4, 5]. Наиболее важными из них являются изменения упруго-эластических свойств, жёсткости мембран, шероховатости, которые определяют способность лимфоцитов к адгезии, перемещению по сосудам и хомингу. Структурная дезорганизация цитоплазматической мембраны лимфоцитов при сахарном диабете может создавать предпосылки к нарушению их функциональной активности в процессе развития инсулинозависимого (ИЗСД) и инсулиннезави-симого диабета (ИНСД). АСМ как один из ведущих прикладных нано-технологических методов исследования клеточных мембран в последнее время активно используется в ключевых областях биомедицины. Несмотря на то, что этот вид неоптической микроскопии появился сравнительно недавно, разработан целый спектр методических приёмов к измерению поверхностных локальных свойств мембраны различных клеток [1, 2]. Изучение биофизических свойств мембран и морфологических параметров живых лимфоцитов с помощью АСМ может дать существенную информацию о закономерностях указанных выше изменений у пациентов с сахарным диабетом [6, 7, 8, 9].
Цель исследования - изучить морфологические и биофизические особенности живых лимфоцитов пациентов с сахарным диабетом с помощью атомно-силовой микроскопии.
Материал и методы исследования. Материалом для исследования послужили лимфоидные клетки препаратов крови пациентов с инсулинозависимым (ИЗСД) и инсулиннезависи-мым сахарным диабетом (ИНСД). Исследованы препараты крови 20 пациентов отделения эндокринологии ГУЗ «Ульяновская областная клиническая больница № 1» Минздрава Ульяновской области. Пациенты с ИЗСД получали человеческий рекомбинантный инсулин в индивидуальной дозе по интенсифицированной схеме. В качестве контроля использовали лимфоциты препаратов крови 10 практически здоровых добровольцев. Кровь стерильно забирали из локтевой вены в пробирки с гепарином в процедурном кабинете отделения эндокринологии ГУЗ «Ульяновская областная клиническая больница № 1» Минздрава Ульяновской области. На все виды исследований были получены разрешения локальной этической комиссии ФГБОУ ВПО «Ульяновский государственный университет» Минобрнауки РФ. Все исследования проводились с соблюдением прав и свобод, определённых законодательством РФ, этическими нормами и принципами в соответствии с Декларацией Хельсинки (1964) со всеми последующими дополнениями и изменениями, регламентирующих научные исследования на человеке, а также международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Все процедуры исследований были обезличены в соответствии требованиями п. 3 ст. 6 действующего Федерального закона РФ 152-ФЗ «О персональных данных».
Лимфоциты крови выделяли в градиенте плотности фиколла-верографина (ρ=1,092 г/см3). Полученную суспензию лимфоцитов объёмом 100 мкл культивировали в чашках Anumbra в растворе Хенкса при 37°С и 5% СО2 в течение 20 минут для обеспечения спонтанной адгезии к пластиковой подложке. Затем производили смену среды Хен-кса на питательную среду 199, содержащую 0,3 мг/ мл L-глутамина, 100 мкг/мл гентамицина и инкубировали в ней клетки в течение 60 минут. Для анализа состояния мембраны лимфоцитов использовали сканирующий зондовый микроскоп Solver P47-PRO (NT-MDT, Россия). На каждом препарате проводили сканирование 15 и более лимфоцитов в контактном режиме в водной среде (рис. 1-А). Сканирование мембраны клеточной поверхности лимфоцитов крови проводили с использованием
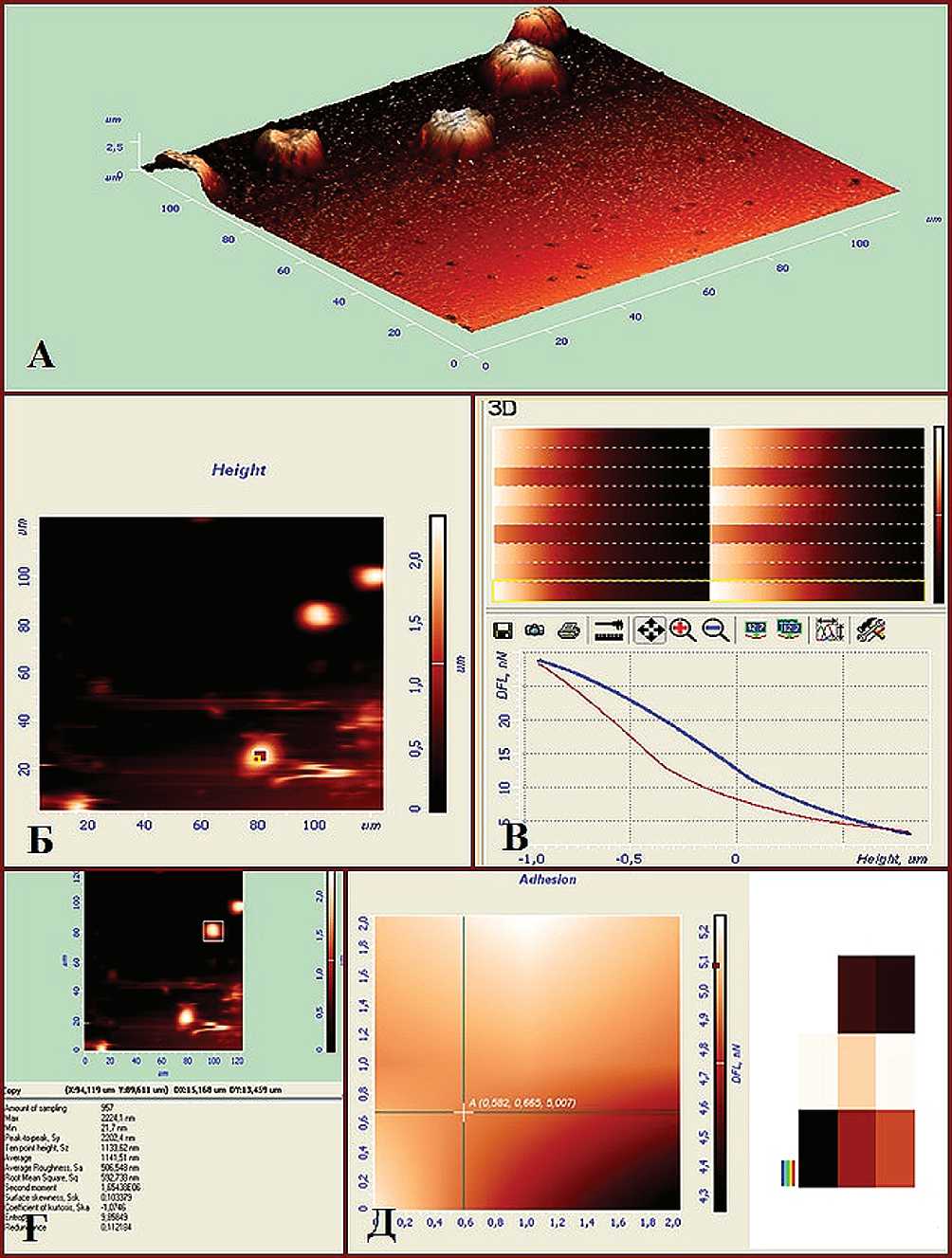
Таблица.
Значения морфометрических и биофизических параметров лимфоцитов периферической крови здоровых доноров и пациентов с разными типами сахарного диабета (M±σ)
|
Наименование параметров |
Лимфоциты контрльной группы |
Лимфоциты пациентов с ИЗСД |
Лимфоциты пациентов с ИНСД |
|
Диаметр, µm |
11,36 ± 0,34 |
11,66 ± 0,34# |
9,57 ± 0,18*# |
|
Высота, µm |
2,54 ± 0,05 |
2,18 ± 0,06* |
2,36 ± 0,06* |
|
Площадь, µm2 |
85,64 ± 3,49* |
84,51 ± 3,18# |
72,38 ± 2,85*# |
|
Объём, µm3 |
91,01 ± 5,42 |
87,64 ± 4,60 |
75,87 ± 5,77* |
|
Коэффициент уплощённости, отн. ед. |
35,70 ± 1,06* |
36,63 ± 1,07# |
30,06 ± 0,55*# |
|
Модуль Юнга, МPа |
0,15±0,01* |
0,56±0,03* |
0,53±0,04* |
|
Адгезия, nN |
4,75±0,02* |
8,26 ± 2,13*# |
3,43±0,22*# |
|
Шероховатость (Ra), nm |
365,45±11,25* |
325,49±9,02* |
317,31±10,19* |
Примечание: * - статистически значимые различия контрольной и опытной групп; # - статистически значимые различия опытных групп между собой кремниевых зондов серии PNP-DB-20 (NT-MDT) с жёсткостью 0,06 Н/м, радиусом закругления 10 нм. Полученные изображения поверхности клеточной мембраны лимфоцитов обрабатывали с помощью программы Nova (NT-MDT, Россия). Определяли следующие морфометрические параметры клеток: диаметр (d, µm) и высоту (h, µm) в микрометрах, площадь в квадратных микрометрах (S, µm2), объём клеток в кубических микрометрах (V, µm3) при помощи соответствующих опций программы (рис. 1-Б, 1-Г).
Для изучения биофизических параметров клеточной мембраны лимфоцитов в норме и при сахарном диабете оценивали модуль изометрического сжатия мембраны (модуля Юнга), характеризующего способность клетки к деформациям, возникающим при взаимодействии мембраны с вершиной зонда АСМ, при этом считали, что чем больше его значения, тем меньше упругие деформации клетки. Модуль Юнга клеточной мембраны лимфоцитов измеряли в мегапаскалях (MPa). Для расчёта модуля Юнга использовали модель Герца [10]. Из полученных серий силовых кривых (рис. 1-В) рассчитывали модуль Юнга в соответствии с моделью Герца для полусферического зонда [10]. Кроме этого, на основании морфологических данных, также полученных методом АСМ, вычисляли площадь соприкосновения клетки с подложкой, объём и коэффициент уплощённости по формуле для шарового сегмента, который выражали в относительных единицах [11].
Для характеристики шероховатости поверхности образцов использовали среднюю арифметическую шероховатость (Ra), измеряемую в нанометрах (nm, рис. 1-В). Сила адгезии зонда к мембране лимфоцитов определялась по участку силовой кривой отвода, соответствующему отрицательному изгибу кантилевера перед отрывом от поверхности клетки (рис. 1-Д). Силу адгезии мембраны лимфоцитов измеряли в наноньютонах (nN). Все полученные изображения сканированных поверхностей клеточных мембран обрабатывали в программе Nova 1.0.26.1443. Статистическую обработку производили с помощью программы «Statistica 8.0, StatSoft Inc. (США) Статистическую значимость различий оценивали на основе U-критерия Манна-Уитни, за значимые принимали различия на уровне значимости 95% (p<0,05).
Результаты ислледования и их обсуждение. В результате АСМ-сканирования получены следующие морфометрические данные характеризующие лимфоциты крови пациентов с сахарным диабетом. Лимфоциты крови здоровых доноров и пациентов с ИЗСД имеют диаметр более 11 мкм, а у пациентов с ИНСД диаметр лимфоцитов меньше на 16% (табл. 1, p<0,05). Для лимфоцитов пациентов с ИНСД характерно статистически значимое уменьшение площади и объема поверхности на 15% и 17% соответственно по сравнению с лимфоцитами здоровых доноров и пациентов с ИЗСД (табл. 1, p<0,05). Показатель уплощенности лимфоцитов пациентов с ИНСД снижался на 15% по сравнению с лимфоцитами доноров и пациентов с ИЗСД (табл. 1, p<0,05). Морфометрические параметры лимфоцитов крови пациентов с ИЗСД превышают аналогичные параметры у пациентов с ИНСД (табл. 1). В крови пациентов с ИНСД преобладали лимфоциты меньших размеров, поверхность которых была менее шероховатой за счет уменьшения высоты разнообразной формы глобулярных выпячиваний, что может быть результатом реорганизации цитоскелета клеток [9, 12].
У пациентов с ИЗСД и ИНСД в живых лимфоцитах крови доказано увеличение величины модуля Юнга (модуля упругости) в среднем на 73% , по сравнению со здоровыми добровольцами (табл. 1, p<0,05). Для лимфоцитов крови при сахарном диабете характерно повышение жесткости и снижение упруго-эластических свойств не только для живых, но и фиксированных лимфоцитов [3, 6]. Повышение жесткости лимфоцитов, по данным литературы, может быть связано с изменениями структурных элементов цитоскелета и деградации фосфолипидного остова клеточной мембраны, затрудняющими их выход в сосудистое русло [9, 12]. Несмотря на это, сходные изменения жёсткости лимфоцитов при разных типах сахарного диабета не приводят к однотипным изменениям в морфометрических показателях клеток и биофизических свойствах клеточной мембраны. При ИЗСД нативные лимфоциты более распластаны по подложке, чем лимфоциты пациентов с ИНСД, об этом свидетельствует более высокие значения силы адгезии и шероховатости клеток пациентов с ИЗСД (табл.1).
Величина клеточной адгезии отражает динамику изменений цитоскелетной организации и адгезионных взаимодействий между клеткой и субстратом. При анализе адгезионных карт методом АСМ, снятых с силовых кривых установлено, что адгезия цитолеммы лимфоцитов пациентов с ИЗСД увеличивается на 42,5% по сравнению с показателями здоровых доноров (р<0,05). При ИНСД показатели адгезии лимфоцитов крови снижаются на 28 и 58% соответственно с показателями здоровых доноров и пациентов с ИЗСД (табл. 1, p<0,05).
Таким образом, полученные нами результаты свидетельствуют о том, что при сахарном диабете происходит значительное повышение жёсткости мембран лимфоцитов крови по сравнению с аналогичными показателями крови здоровых людей. Адгезивные свойства и рельеф поверхности лимфоцитов при разных типах сахарного диабета различаются. У пациентов с ИЗСД значения силы адгезии и шероховатости клеток выше, чем у пациентов с ИНСД. Морфометрические параметры лимфоцитов крови пациентов с ИЗСД также превышают аналогичные параметры пациентов с ИНСД. Выявленные морфологические и биофизические особенности живых лимфоцитов крови пациентов с разными типами сахарного диабета с помощью атомно-силовой микроскопии могут иметь патогенетическое значение в развитии иммунологических нарушений, возникающих при этом заболевании.
Список литературы Атомно-силовая микроскопия морфологических и биофизических особенностей лимфоцитов крови при разных типах сахарного диабета
- Заводник И.Б., Дремза И.К., Лапшина Е.А. Сахарный диабет: метаболические эффекты и окислительный стресс//Биологические мембраны.- 2011.- Т. 28.- № 2.- С. 83-94.
- Wu Y., Lu H., Cai J., He X., Hu Yi., Zhao H., Wang X. Membrane Surface Nanostructures and Adhesion Property of T-Lymphocytes Exploited by AFM. Nanoscale Res Lett. 2009;4:942-947. 10.1007/ s11671-009-9340-8 DOI: 10.1007/s11671-009-9340-8
- Гущина Ю.Ю., Плескова С.Н., Звонкова М.Б. Исследование различий морфометрических параметров клеток крови человека методом сканирующей зондовой микроскопии// Поверхность. Ренгеновские, синхронные и нейтронные исследования.- 2005.- № 1.- С. 48-53.
- Deng Z., Lulevich V., Liu F-T., Liu G-Y. Applications of Atomic Force Microscopy in Biophysical of Cells. J Phys Chem B. 2011; 114(18):5971-5982.
- Dimitrialis E.K., Horkay F., Maresca J. Determination of elastic moduli of thin layers of soft material using the atomic forsemicroscope. Biophys J. 2002;82:2798-2810.
- Столбовская О.В., Хайруллин Р.М., Куликова Т.К., Снежкина А.В., Садритдинова А.Ф. Исследование вязкоэластических свойств цитоплазматической мембраны лимфоцитов крови человека методом атомно-силовой микроскопии// Фундаментальные исследования.- 2013.- № 4.- С. 1149-1152.
- Kuznetsova T., Starodubtseva M., Yegorenkov N. Atomic force microscopy probing of cell elastity. Micron. 2007;38:824-833.
- Hekele J., Goesselsberger C.G., Gebeshuber I.C. Nanodiagnostics performed on human red blood cells with atomic force microscopy. Material Science and technology. 2008;24(9):1162-1165.
- Skorkina M.Yu., Chernyavskiy S.D., Fedorova M.Z., Zabinyakov N.A., Sladkova E.A. Evaluation of Morphometric Parametrs of Native Blood Cells by Atomic Force Microscopy. Bull of Exp Biol and Med. 2010;150(2):273-275.
- Лебедев Д.В., Чукланов А.П., Бухараев А.А. Измерение модуля Юнга биологических объектов в жидкой среде с помощью специального зонда атомно-силового микроскопа// Письма в ЖТФ.- 2009.- Т. 35.- № 8.- С. 54-61
- Зубарева Е.В., Федорова М.З., Надеждин С.В., Павлов Н.А. Оценка действия тепловой нагрузки на морфофункциональные характеристики лимфоцитов крови в опытах in vivo и iv vitro// Научные ведомости. - 2011.- № 3, Вып. 14.- С. 155-162.
- Yumazaki D., Kurisu S., Takenawa T. Regulation of cancer cell motility through actin reorganization. Cancer Sci. 2005;96:379-386.


