Атомы элементов Природы. Краткое описание образования инертных газов
Автор: Неплюй В.И.
Журнал: Доклады независимых авторов @dna-izdatelstwo
Рубрика: Логика
Статья в выпуске: 41, 2018 года.
Бесплатный доступ
Рассмотрено краткое описание образования инертных газов на основании симметрий высокой устойчивости СВУ.
Короткий адрес: https://sciup.org/148311647
IDR: 148311647
Текст научной статьи Атомы элементов Природы. Краткое описание образования инертных газов
Рассмотрено краткое описание образования инертных газов на основании симметрий высокой устойчивости СВУ.
Содержание
-
1. Вступление.
-
2. Краткое описание образования инертных газов.
-
3. Температуры плавления и кипения инертных газов.
-
4. Заключение.
Литература.
1. Вступление
Подробное описание конструкций и свойств атомов инертных газов, как и атомов остальных элементов, с рисунками симметрий, будет подано в разделе “Конструкции и свойства атомов элементов Природы”. В связи с этим, здесь много коллизий их конструкции подробно не рассматриваются, так как более целесообразно рассмотреть их при изучении конструкций конкретных атомов. Здесь же кратко рассмотрено образование инертных газов, по всему диапазону числа “n”, как результат влияния основного ряда участков СВУ на данную коллизию.
В современной науке предпринимались попытки построить какую-то простую числовую формулу инертных газов. Это неправильно. Такой формулы не существует, потому что в Природе нет отдельного закона образования инертных газов. Есть семь Логик Природы, по которым всё образуется и существует, и в Логике сложности есть коллизия структуризации. Она используется Логиками для построения устойчивого и упорядоченного материального Мира, от простых и до самых сложных систем, так как управлять структурированной системой Логикам несравненно проще, чем не структурированной. Коллизия структуризации для векторных симметрий, по которым строятся атомы, разработана в [2]. Эта коллизия учитывается в конструкциях и свойствах всех атомов, таким образом, как показано в разделе “Дискретный расчёт СВУ” ([2] стр. 11÷13).
Инертные газы образуются на участках основных СВУ, когда число “n”, совпадает с каким-то числом расчётного СВУ. Тогда все электроны атома, чтобы структурироваться, находятся внутри него, и так получается инертный газ, в атомах которого нет наружных электронов. Следующие элементы, чтобы иметь структуризацию, повторяют внутреннюю электронную симметрию инертного газа, выбрасывая часть электронов наружу атома, так как они лишние и мешают построить структурированную симметрию внутри атома. Получается, что все они тоже инертные газы, но теперь с наружными электронами, и с другими свойствами. Это потому, что в этом районе чисел “n”, эта структурированная симметрия подходит для расположенных здесь чисел “n”. Независимо одно от другого, если “n” совпало с СВУ, получился инертный газ, если не совпало, получился атом с наружными электронами, но со структурированной, как и в инертного газа, внутренней электронной симметрией. Кроме того выброс наружу части электронов создаёт натяг и повышает устойчивость атома. В инертных газах натяга нет, но из-за того, что уровень структуризации у них выше, чем в атомах с наружными электронами, их устойчивость достаточна. Так как Логикам управлять структурированной системой несравненно проще, чем не структурированной, то образование инертного газа, если это целесообразно, возможно и на других участках чисел “n”. Но это число всё равно должно иметь какую-то достаточно высокую связь с симметриями СВУ.
При расчёте инертных газов необходимо учитывать также следующие коллизии конструкции атомов:
-
1) позитронная оболочка атома должна быть достаточной для нормального обжатия внутренней электронной симметрии (подробно в разделе о геометрической коллизии атомов). Геометрическая коллизия атомов заключается в том, что электроны атома пакуются в объёме шара, а позитроны в его поверхности. С этого вытекает теоретическое ограничение возможного числа “n” для атомов. А для данного расчёта имеются проблемы с размещением всех электронов внутри атома на некоторых числах “n”, где приходится использовать не самую устойчивую механическую симметрию, а другую.
-
2) при расчёте инертных газов необходимо учитывать, что в сути своей конструкция любого атома неустойчива. Электроны не связаны меж собой и отталкиваются один от другого, а позитроны, обжимающие их, могут смещаться в своей сфере. В связи с этим, требования к внутренней электронной симметрии атомов высокие. Она должна быть очень хорошо сбалансирована, в связи, с чем верхний слой их внутренней электронной симметрии для достижения достаточной устойчивости, конструктивно должен быть полным. Иначе торчащие электроны создадут локальные напряжения в позитронной оболочке, и выйдут на поверхность атома. Инертный газ в таком случае не получится, невзирая на СВУ.
-
2. Краткое описание образования инертных газов.
Рассмотрим образование инертных газов. Они образуются на участках основных СВУ [2]:
2 — 7, 8, 9 — 18, 20 — 34, 35, 36 — 54, 56 — 77, 79, 80, 81 — 104, 108, 110.
-
1) — 2 . 2 He является инертным газом. Симметрия S2 линейная, а не пространственная тетраэдрическая. Она устойчива при растягивающих усилиях и неустойчива при сжимающих. Поэтому Логика разности на основе пространственных производных деформирует оба электрона на две половины, и эти гантели разворачиваются друг относительно друга на угол 900. Позитроны давят дальше пока эти половинки не перейдут на противоположную сторону их разделительной плоскости. И теперь получился устойчивый тетраэдр из четырёх половинок электронов. Таким образом, 2 He по целым электронам имеет S2, а конструктивно по половинкам электронов имеет S4. Более подробно можно сказать так: симметрия 2 He всё же S2, и она устойчива при растягивающих усилиях и неустойчива при сжимающих. Сначала позитроны сжимают электроны и создают неустойчивую систему. Но комплекс семи Логик Природы хорошо “знает”, что S2 есть СВУ и устойчива она при растягивающих усилиях, поэтому на основе пространственных производных, Логика разности находит такую конструкцию атома гелия, чтобы сжимающие усилия преобразовались в растягивающие. Это возможно при гантельной деформации электронов, и переходе половинок на противоположную сторону разделительной плоскости. Теперь половинки электронов, отталкиваясь друг от друга, создают в теле симметрии растягивающие усилия. Следует подчеркнуть, что Логики не просто решили заменить S2 на S4. Они
строили устойчивый вариант S2, методом, показанным выше. И добились своей цели. Получилась устойчивая S2 двух электронов. Но при этом электроны пришлось деформировать в гантели и получить из половинок электронов тетраэдр.
Перед 2 He должен быть галоген, но 1H вообще теоретически невозможен как отдельный атом, что выявлено при расчёте теоретически возможного диапазона чисел “n” для атомов. В то же время ядра водорода, позитроны H, то есть протоны с приваренным к оболочке позитрона нейтроном, образуются при облущивании протонов с ядер более тяжелых элементов. Поэтому из двух позитронов H и двух электронов строится атомомолекула H2. По конструкции она аналогична 2 He и является инертным газом, но при этом получается с пониженной устойчивостью, так как его позитроны H не связаны меж собой в одно целое ядром, и удерживаются на электронах только за счёт деформации и сил слипания. По этой же причине атом H2 при одинаковом числе зарядов, геометрически больше, чем 2 He.
Следующий элемент литий имеет 3 позитрона, которыми обжимает 2 электрона сбоку и гантельную деформацию электронов не использует. У него симметрия электронов S2. За счёт большего числа позитронов 3Li обычный металл с внутренней электронной симметрией S2 и одним наружным электроном.
-
2) — 7, 8, 9 . 7N, 8O и 9F инертные газы, потому что имеют СВУ, но неустойчивые, потому что для этих чисел “n” невозможно построить необходимую тетраэдрическую симметрию. Из-за этого физические параметры, температуры плавления, кипения, прочность кристаллической решетки и прочее у них такие же, как и в инертных газов. А химически они активны, так как неустойчивы и легко рассыпаются на свои составные части, ядра и электроны отдельно, которые в таком состоянии очень активны. Предыдущий азоту элемент должен быть галогеном. Это углерод в конструкции графита. Из-за недостаточного количества зарядов в этого галогена электроны не разделены на внутреннюю электронную симметрию и плавающие в положительном слое. У него все электроны внутри атома в равных условиях в симметрии S6, и все слегка выступают наружу положительной оболочки атома. Поэтому его свойства значительно отличаются от свойств других галогенов. Следующий элемент 10Ne должен повторить предыдущую S9 с выбросом наружу 1-го электрона, но S9 неустойчива, поэтому неон берёт предыдущую устойчивую S8 и строит устойчивый атом в виде инертного газа. Для 8 электронов и 8 позитронов кислорода
устойчивость не получается, а для 10 электронов и 10 позитронов неона она получается. Вообще симметрия S8 очень устойчива, но с учётом позитронов, кислород эту возможность не смог реализовать. После S8=4+4 в тетраэдрических симметриях слой 6, 12 или 24, но не 8. То, что неон взял одну из предыдущих СВУ, притом самую устойчивую S8, закономерно. А то, что построился инертным газом, является в какой-то мере совпадением. Неон мог бы получиться и не инертным газом, но всё равно он бы использовал предыдущую самую устойчивую S8. Тем не менее, он получился инертным газом. Это потому что теоретически была такая возможность. Если бы теоретически такой возможности не было, он построился бы не инертным газом, но с наиболее оптимальной конструкцией из всех возможных. Если построить внутреннюю электронную симметрию S8=4+4, и выбросить наружу 2 электрона, атом получится неустойчив. Но можно построить такую симметрию: 4 электрона по вершинам + 6 электронов по рёбрам. Чтобы их обжать, поверх них по запрещённой симметрии ставится 6 позитронов, которые сдеформируют их по гантельной деформации, и половинки электронов растекутся по граням тетраэдра. Оставшиеся 4 позитрона обожмут 4 электрона по вершинам. Так получится устойчивый атом 10Ne. Невзирая на сплошную запрещённую симметрию, атом неона получается устойчив в виде инертного газа с СВУ=4+4×1,5= СВУ8. В то же время при постройке аналогичным образом кислорода, он получается неустойчив. Вообще атомы строятся без гантельной деформации зарядов. Применяется она только в атомах с малым числом зарядов, и только тогда, когда без неё атом получается, неустойчив, а с ней устойчив.
Закономерность построения инертных газов невозможно выразить числовой формулой, но её можно выразить следующей логической формулой. Есть семь Логик и принцип оптимизации, вытекающий из суммарного взаимодействия всех семи Логик Природы. Так как структурированной симметрией управлять проще, то Логики всегда стремятся её построить или приблизиться к ней. А она самая высокая в инертных газах. Поэтому, если есть теоретическая возможность они, их строят.
Следующий за неоном натрий повторяет внутреннюю электронную симметрию неона с выбросом наружу 1 электрона и так далее.
-
3) — 18, 20 . 18Ar инертный газ. Симметрия S20 есть, но не совершенна, и её необходимо обжимать 24-мя позитронами, она
реализуется в 24Cr. Поэтому 20Ca, инертным газом не получился, а повторяет симметрию аргона с выбросом наружу 2-х электронов. Перед аргоном обычный галоген хлор, а после, обычный металл калий с одним наружным электроном.
-
4) — 34, 35, 36 . Здесь инертным газом получился 36Kr. Тетраэдрическая симметрия чётная, и построить её с полным последним слоем нечётной, невозможно. Поэтому 35Br получился галогеном. А 34Se построился неметаллом, так как тетраэдрическая симметрия с полным последним слоем может быть только S32 или S36, но не S34. Простые векторные симметрии устойчивости могут иметь любое количество составляющих. Но они дипольные, и не подходят для атомов, потому что в явно выраженной дипольной конструкции невозможно равномерно обжать электронную симметрию позитронами. Тетраэдрические же симметрии невозможно построить на любом количестве составляющих, а только на некоторых строго определённых. К слову, атомы очень ограниченного количества элементов, где невозможно построить тетраэдрическую симметрию, например, некоторые атомы с очень малым числом “n”, строят простую дипольную симметрию. Но на малых числах “n”, простая и тетраэдрическая симметрии отличаются мало, а S4 у них одна и та же. Также очень редко в атомах или ионах встречается некоторая дипольность, но выражена она незначительно и устойчивость уменьшает мало. Семь Логик Природы на основании пространственных производных всегда строят оптимальный вариант. И он, для имеющихся условий, самый лучший из возможных. После криптона рубидий с одним наружным электроном.
-
5) — 54, 56 . 54Xe инертный газ. Аналогично пункту 4 тетраэдрическая симметрия может быть S54 или S58, но не S56, поэтому 56Ba металл с 2-мя наружными электронами.
Перед ксеноном галоген йод. Имеет оригинальную особенность, заключающуюся в том, что под его тремя наружными электронами, плавающими в положительном слое по направлениям 4в, в электронной симметрии 4-4-6-12-24=50 имеется 4 широких и глубоких углублений по вершинам начального тетраэдра. В хлора в 4-4-6=14 эти углубления широкие, но мелкие. А бром использует само опорную симметрию, в которой электроны следующих слоёв фиксируются не только трёхточечными посадочными местами предыдущих слоёв, но в большой степени и соседними электронами своего слоя, из-за чего этих углублений в брома нет.
Поэтому ни хлор, ни бром не имеет тех проблем, которые имеет йод.
Для глубокого и точного понимания теории атомов следует заметить, что бугры, углубления и гранённость физически существуют только на поверхности атома. Внутри атома таких коллизий нет. За счёт деформации оболочек все электроны и позитроны прижаты друг к другу по всей их поверхности. Но если на модели атома из не сжатых сфер (шариков для тенниса) будут подобные коллизии, тогда в атоме они отразятся неравномерным распределением по объёму сжимающих усилий, эквивалентным данным геометрическим коллизиям. И это повлияет на свойства атома таким же образом, как если бы эти геометрические коллизии реально были бы внутри атома. Поэтому в теории атомов они так и называются: бугры, углубления, внутренние пустоты и гранённость внутренних электронных оболочек атома.
Из-за углублений (см. выше) в атоме йода его 3 наружных электрона, плавающие в положительном слое, всё время проваливаются вовнутрь атома, из-за чего их 3 или 2, может быть 1 или 0, в любой последовательности. Смыкания тяжей, возникающее при этом приводит к ɑ-распаду. Йод не считается радиоактивным, потому что период полураспада у него очень большой, но он с самого начала меньший, чем в нормальных устойчивых атомов. Из-за этого за 4,5 миллиарда лет он медленно распался и на Земле его мало. Когда проваливаются все 3 электрона вовнутрь атома, йод кратковременно становится несбалансированным инертным газом, без наружных электронов, поэтому активно испаряется с твёрдого состояния, при низкой температуре. Изменение количества наружных электронов приводит к изменению его свойств. Эту особенность йода живая природа использует как один из инструментов для своего развития. Связывает его в дийодтирозин, тогда его внешние электроны не проваливаются вовнутрь атома, и накапливает его в щитовидной железе. По команде от ДНК дийодтирозин выпускается в кровеносное русло, и теперь йод вносит сбои в синтез белков. Получается масса разнообразных белков и остаётся только, при помощи пространственных производных, выбрать из них, те, которые необходимы для новой ступени функционирования организма. Безусловно, в этом процессе участвует масса разнообразных систем организма, но йод как инструмент для получения новых белков, незаменим для осуществления этого процесса. Ведь ДНК проще, чем весь организм, тем не менее, ей необходимо управлять всем организмом, в том числе и его развитием. Для этого она использует выше рассмотренное свойство атома йода.
После ксенона цезий с внутренней электронной симметрией ксенона 4-4-6-12-(24+4)=54, и торчащим снаружи атома одним внешним электроном.
-
6) — 77, 79, 80, 81 . Здесь 77Ir, 79Au и 81Tl нечётные и инертными газами не получились. Инертный газ здесь 80Hg. В данное время считается, что ртуть металл. Но ведь она плавится при температуре –390C, почти как инертный газ 86Rn, да и кипит при очень низкой для металлов температуре. Инертна, имеет ещё ряд свойств, не характерных для металлов. Расчёт показывает, что ртуть инертный газ. Тем не менее, она больше похожая на металл, чем на инертный газ. Дело в том, что нормальная СВУ, симметрия S80, конструктивно не достаточно подходит для инертного газа. В этом диапазоне чисел “n” подходящие симметрии S76 или S86. А S80 похожая на S34 или S56 (см выше). Но в отличие от этих симметрий, которые вообще нарушают тетраэдричность симметрии, S80 этого не делает. Тем не менее, в последнем электронном слое имеет 4 электрона, которые не нарушают тетраэдричность и не торчат, поэтому не выходят наружу, но всё же создают 4 свои отдельные тетраэдрические направления, которые искажают основную интегральную тетраэдрическую формулу атома 4в4г. Из-за этого инертный газ 80Hg оригинальный и конструктивно больше похож на галоген, так как эти 4 электрона очень углублены в положительный слой, как в галогена. Все свойства ртути, как и свойства любого атома, вытекают с его конструкции. Ртуть не галоген, а только конструктивно похожа на него, она имеет свою СВУ=80, поэтому перед ней образуется галоген 79Au и не металл 78Pt. Но из-за такого несоответствия на данном участке тетраэдрических симметрий процессу образования инертных газов, галоген и не металл тоже получаются оригинальными. Им ни к чему стремиться к несовершенному инертному газу 80Hg и добавлять электроны. Поэтому они существуют в виде обычных металлов, с внутренней электронной симметрией S76 и обобщают свои внешние электроны с другими элементами. Но, так как они по структуризации находятся на месте галогена и не металла, то “отдают” они их с большим трудом. Из-за этого 78Pt и 79Au являются самыми пассивными металлами в химическом отношении. Как показано выше, в атома ртути две симметрии: основная S76 и дополнительная S4, развёрнутая на
некоторый угол относительно основной. При этом эта S4 находится в слое S12 и может иметь несколько пространственных расположений, не зависимых от основной S76. См. расчёт ядра хлора [3] стр. 27÷28. Это приводит к разнообразным оригинальным свойствам элемента 80Hg.
После ртути таллий с одним наружным электроном, дальше свинец с двумя и так далее. Они тоже имеют некоторые оригинальные свойства, связанные с такими особенностями образования инертного газа на этом участке. Наружные электроны у них не торчат на поверхности атома, как в элементов после инертного газа, а углублены в положительный слой, что влияет на их физико-химические свойства.
-
7) — 104, 108, 110 . Эти элементы находятся вне диапазона возможного существования атомов. Но логические коллизии структуризации распространяются и на них. На синхрофазотроне синтезирован в сверх малом количестве 104Ku. Он склонен к спонтанному распаду ядра. В ядрах атомов в диапазоне чисел “n”=84÷104 облущиваются протоны, из-за того, что в атомах этих элементов электроны сжаты недостаточно, из-за чего схлопывают, (подробно в разделе о теоретически возможном диапазоне чисел “n” для атомов), а под конец диапазона ещё и их наружные электроны проваливаются в атом. При этом смыкаются тяжи и уменьшаются пятна сварки протонов до критического уровня. Процесс этот стабильный и равномерный. А в 104Ku из-за СВУ=104, электроны, попавшие во внутрь атома, задерживаются там, и износ получается больше чем в предыдущих элементов, притом по многим протонам. То есть процесс износа происходит не равномерно, а периодами, в отличие от элементов, не имеющих СВУ. Из-за этого, когда износ достигает критической величины, то облущивается не 1÷2 протона, как в других элементов, а сразу много протонов, и это воспринимается как значительный распад ядра.
-
8) — 86 . Число 86 не попало в основной ряд СВУ и таковым не является. Тем не менее, 86Rn является нормальным инертным газом. Как показано выше, по ряду причин не все числа, находящиеся на участках основных СВУ, имеют возможность реализоваться инертными газами. Аналогично по ряду благоприятных причин, какой то элемент может реализоваться инертным газом, не входя в основной расчётный ряд. Но к СВУ он должен иметь непосредственное отношение. Рассмотрим S86. Это симметрия повышенной устойчивости СПУ, S86= S30+ S56, где S56 является СВУ, а S30 симметричная ей нижняя симметрия, кроме того
S30 является дробной СВУ, приведенной к целым числам, и находится на участке близко расположенных чисел 30÷32 [2]. Симметрия S56, кроме того, что она СВУ, она ещё и СПУ, S56=S20+S36, где обе симметрии являются СВУ. И здесь S20, дополнительно к СВУ также является СПУ. S20= S8+ S12, при этом число 8 это СВУ, а 12 это тетраэдрическое число. Как итог можно сказать, что СВУ=56 состоит из массы меньших СВУ и СПУ, и является самой СВУшной симметрией из всех остальных. Поэтому не стоит удивляться тому, что, не реализовавшись инертным газом в своё время, на пятом участке, она реализовалась ним совместно со своей нижней симметрией S30. Кроме того на участке “n”=84÷104 не хватает электронов внутри атомов, что благоприятствовало размещению их внутри атома, и образованию инертного газа 86Rn. По этой же причине не стоит искать аналогичный случай для участка “n”=1÷83, а на благоприятном участке “n”=84÷104 подобной ситуации ни в одного элемента больше нет. Невзирая на то, что радон получился не на участке основных СВУ его свойства и “действие” на соседние элементы такое же, как и в остальных нормальных инертных газов. И всё же, невзирая на то, что в теории атомов он отнесён в группу нормальных инертных газов, учитывая родословную причину его получения, он несколько отличается от нормальных инертных газов. Так в отличие от них он может быть окислен с положительной валентностью, а галоген и неметалл перед ним наряду с отрицательной валентностью могут иметь и положительную.
Следует более подробно рассмотреть вопрос: почему на участке “2)” инертные газы образовались на всех числах СВУ = 7- 8 - 9, а на других участках образовался только один инертный газ. Семь Логик Природы на основании пространственных производных выбирают один самый оптимальный вариант. На других участках он был, и Логики его выбрали и построили инертный газ, а соседние элементы приближаются к нему, строя свои атомы галогенами, когда “n”<СВУ, или металлами, когда “n”>СВУ. А на участке “2)” ни на одном из чисел 7, 8, 9 не может образоваться устойчивый атом. Поэтому все эти атомы строятся по Логикам, и не учитывают соседний инертный газ, так как он неустойчив. А так как все они имеют СВУ, то строятся инертными газами, и опять неустойчивыми. Так дело дошло до 10Ne, который не СВУ, и даже не СПУ. В теории атомов часто применяется выражение, атом повторяет внутреннюю электронную симметрию предыдущего инертного газа и выбрасывает наружу лишние электроны. Это потому, что так короче и удобнее. Реально же физически семь Логик (Разум Природы) строит каждый атом отдельно на основе логики и оптимизации. Итак, Логики строят неон. Сначала выбирают для него устойчивую СВУ с числом зарядов близким к числу зарядов неона. Это S8. Далее строят атом неона. По пространственным производным они “знают”, что если построить ему внутреннюю симметрию 4+4=8 и выбросить наружу 2 электрона, он будет менее устойчив, чем, если использовать гантельную деформацию электронов и построить 4+4×1,5, так как при этом получится устойчивая конструкция и структуризация. Поэтому, таким образом и строят. При этом они имеют цель построить конструкцию устойчивой и структурированной. Неон же при этом получился инертным газом. Дальше натрий повторяет симметрию неона и выбрасывает наружу 1 электрон.
Как же так, неон 10Ne, не имея ни СВУ, ни СПУ построился инертным газом?
Есть один всеобъемлющий закон Природы — оптимизация объектов материального Мира семью Логиками. Они всегда выбирают оптимальный вариант, но только тот, который теоретически возможный. При гантельной деформации шести электронов, атом неона получается прочный, устойчивый и структурированный. Этот вариант и был выбран, при этом общая симметрия неона получилась не S10 по числу зарядов, а S8, соответствующая структурированной симметрии. В такой конструкции неон закономерно, не нарушая принципов структуризации, получился инертным газом, так как теперь общая симметрия его атома не S10 , а S8.
Логики Природы построили бы устойчивыми и 7N, 8O и 9F, но это оказалось невозможным физически по другим причинам, поэтому они построили их таким образом, чтобы они имели хотя бы какую-то устойчивость, когда эти элементы в твёрдом кристаллическом состоянии, при температуре близкой к –2730C. При нагреве они плавятся и перестраиваются в атомомолекулы и атомы с двойным ядром N2, O2 и F2, в конструкции которых они более устойчивы. Но кислород всё равно имеет достаточно низкую устойчивость. Кислород очень оригинальный элемент. Не имея устойчивого атома, он имеет очень устойчивый ион по симметрии 4+4+6+4=18 с чередованием положительных и отрицательных слоёв и валентностью –2. Из-за этого он очень активный и легко, но прочно соединяется с другими элементами. Если бы не было кислорода, мир атомов был бы простой, скучный и однообразный. Аналогичную роль в живой природе выполняет азот.
9) . — 14, 16, 18. 7N, 8O и 9F при нагреве плавятся и перестраиваются в атомомолекулы и атомы с двойным ядром 14N2, 16O2, и 18F2, в конструкции которых они более устойчивы. Число 14=7+7 и на нём строится атомомолекула N2 инертный газ. С другой стороны 14=8+6, такую сумму электронов имеет угарный газ 14CO, почему бы и ему тоже не построиться инертным газом. Да, он тоже строится инертным газом и аналогичен 14N2, 16O2, и 18F2. Но так можно много настроить инертных газов. Нет, нельзя. Инертные газы, атомы с двойным ядром, 14N2, 16O2 и 18F2 получились инертными газами, потому что они состоят из двух инертных газов, а их СВУ конструктивно не перемешались в одно целое, а остались сами собой, отдельно, но всё же связались одна с другой, за счёт чего повысилась устойчивость. Это не молекула с двух отдельных частей связанных меж собой общим электроном, а полумолекула с одной общей конструкцией. Их конструкции (с рисунками) будут рассматриваться при изучении данных элементов. Здесь же указана только суть данной коллизии. Ни 14Si, ни 16S не получились инертными газами, потому что они имеют одну конструкцию с общим центром, а числа 14 и 16 не СВУ. 18Ar получился инертным газом, потому что есть СВУ=18. И его конструкция с общим центром, как во всех элементов. А 18F2 с таким же количеством зарядов имеет совсем другую конструкцию, состоящую из двух частей 9+9, каждая из которых имеет свою СВУ=9. Так что складывать, что попало нельзя, а только то, что при сложении даст такую конструкцию, которая будет иметь две СВУ, имеющие возможность проявлять свою способность структурироваться, и не мешать друг другу. Таким и является инертный газ 14CO. Он представляет собой атом с двойным ядром, и по конструкции очень похож на 16O2. Только состоит не из одинаковых половинок, а из разных. Невзирая на это он более устойчив, чем 16O2, что вытекает из его конструкции. Имея очень похожую конструкцию и внешнее поле, проникает вместо 16O2 в активный центр гемоглобина и очень не охотно оттуда выходит, так как более устойчив. В атоме угарного газа S 8—СВУ, а S6—не СВУ, но как показано при расчёте симметрий высокой устойчивости [2], S6 векторно эквивалентна S8, кроме того S6 является нижней симметрией для S8. Так что логично, что угарный газ получается инертным газом. Угарный газ 14CO не
3. Температуры плавления и кипения инертных газов.
элемент Природы, поэтому ни галогена перед ним, ни металла после него, разумеется, нет.
Температуры плавления и кипения элементов и молекул зависят от массы факторов и причин (будет рассмотрено в соответствующем разделе теории). Кроме всего этого на температурные характеристики, как атомов, так и молекул влияет ещё их атомная и молекулярная масса. Для того чтобы шевелить микрообъектом с большей массой, плотность материального носителя тепла, ракушек, должна быть больше, значит температура выше. Зависимость температурных характеристик от массы атомов по всему диапазону числа “n” легко найти, по графику роста температуры плавления и кипения инертных газов. Атомы инертных газов круглые, имеют слабо выраженное наружное поле и не имеют наружных электронов, а только разную массу, и их температурные характеристики зависят только от массы их атомов. Поэтому, если построить график роста температуры плавления и кипения инертных газов в зависимости от массы их атомов, то он будет отражать зависимость температуры плавления и кипения в зависимости от массы для всех атомов таблицы элементов.
На рис. 1 показан график роста температуры плавления (синяя линия), и кипения (красная линия), шести устойчивых инертных газов He, Ne, Ar, Kr, Xe и Rn в зависимости от массы их атомов.
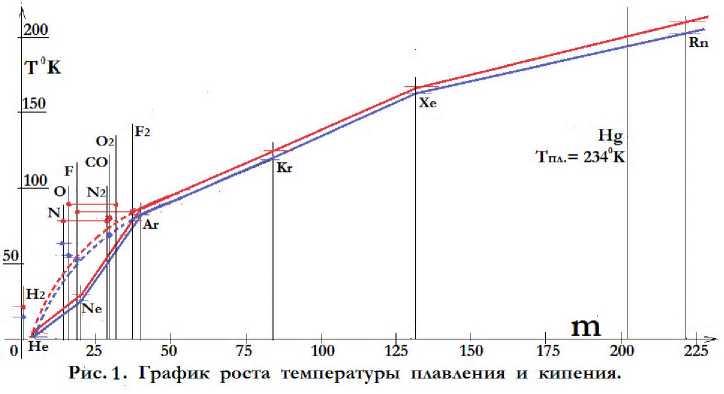
Судя по графику, температуры плавления и кипения одинаково зависят от массы, и с увеличением массы возрастают по кривой близкой к параболе. В диапазоне массы от 4 до 222 единиц возрастают от 4 до 211 градусов, то есть в среднем 1 градус на 1 единицу массы.
На этом же графике также показаны температуры плавления и кипения водорода, азота, кислорода, фтора и угарного газа H2, N, O, F и CO, согласно их атомной массе 2, 14, 16, 18 и 14. Это синие и красные точки на графике, обозначенные H2, N, O, F и CO. Температуры эти взяты из справочных данных.
Теперь сделаем коррекцию кривой роста температур. В теории атомов есть понятие, которое называется “рябь внешнего электрического поля”. Позитроны положительной оболочки атома в большинстве случаев, располагаются по посадочным местам верхнего слоя внутренней электронной симметрии, то есть между тремя электронами. Поэтому если двигаться по поверхности атома и непрерывно измерять его внешнее поле, то оно незначительно будет колебаться от одной точки поверхности к другой. Там же обнаружатся явно выраженные отрицательные вектора внутренней электронной симметрии. Причина их заключается в том, что электроны пакуются слоями в объёме, и могут в определённых направлениях создавать повышенное отрицательное поле, а позитроны пакуются в поверхности в один слой. А из-за того, что каждый позитрон находится между тремя электронами, меж основными отрицательными векторами атома появляется мелкая рябь внешнего электрического поля. Эта рябь, как и основное поле, также в некоторой степени влияет на параметры атома, в частности увеличивает его температуры плавления и кипения. Целесообразно полагать, что это увеличение аналогично и приближенно равно увеличению этих параметров от массы атома.
Редко, где это целесообразно, в атомах используется запрещенная симметрия, когда позитрон стоит непосредственно над электроном. Тогда электрические поля их полностью компенсируются пространственно и ряби нет. Согласно расчёту атомов в He и Ne используется гантелеобразная деформация электронов и позитронов, и в связи с этим запрещённая симметрия. Из-за этого гелий не имеет ни внешних электронов, ни внешнего поля, ни ряби. Поэтому он плавится и кипит при такой сверхнизкой температуре, такой текучий и прочее. Неон имеет незначительно выраженное внешнее поле, но ряби нет. Поэтому на кривой зависимости температуры плавления и кипения от массы он показал заниженные результаты. Для того чтобы эта кривая подходила для всех атомов, её необходимо между He и Ar скорректировать, как показано на рис. 1 штриховыми линиями. Теперь она не имеет излома и подходит для всех атомов.
Синие точки плавления N, O и F окажутся очень близкими к скорректированной линии плавления, но красные точки их кипения по-прежнему завышены. Теория атомов утверждает, что азот, кислород и фтор для обеспечения устойчивости, в жидком состоянии перестраиваются в атомомолекулы или атомы с двойным ядром. Чтобы это проверить, необходимо эти красные точки кипения N, O и F перенести на удвоенную массу. То есть N на 28, O на 32, и F на 36, как показано на графике. По графику видно, что красные точки кипения N2, O2 и F2 теперь близки к скорректированной красной линии кипения, что подтверждает то, что атомы N, O, F в жидком состоянии перестраиваются в атомомолекулы или атомы с двойным ядром. Синие и красные точки CO также попадают на скорректированные линии. Как будет показано при расчёте конструкций 14N2, 14CO, 16O2, 18F2, они аналогично органическим веществам являются полу молекулами (часть внутренних электронов общие). Точнее 14N2 и 18F2 атомомолекулы, (все внутренние электроны общие), а 16O2 и 14CO атомы с двойным ядром, (ядра прижаты одно к другому). Атомомолекулы являются частным случаем полу молекул, а атомы с двойным ядром частный случай атомомолекул. Существует ещё много других полу молекул похожих на эти. Это NO2, CO2 и другие. В них структуризация проявилась не в такой мере, как в 14N2, 14CO, 16O2, 18F2. Логики Природы, на основании пространственных производных, построили их достаточно устойчивыми. Хотя при этом пришлось отказаться от структурированных S7 и S8, зато конструкции NO2, CO2 получились достаточно устойчивы. Они не имеют наружных электронов, но имеют выраженное внешнее электрическое поле, а также часто их внутренние электроны проглядывают через положительную оболочку наружу. Поэтому температуры их плавления и кипения достаточно низкие, но значительно выше температурной кривой рис. 1. В 14N2, 14CO, 16O2, 18F2, структуризация настолько высокая, что их температуры плавления и кипения находятся на кривой зависимости этих параметров от массы объекта, что свидетельствует о том, что это структурированные атомомолекулы или атомы с двойным ядром. Так в теории атомов они и называются и считаются инертными газами. Конструкции типа NO2, CO2 называются атомомолекулами, но инертными газами не считаются.
Исходя из выше показанной на рис. 1. зависимости при расчёте температур плавления и кипения элементов, следует добавлять температуру на массу согласно кривой рис.1. а при приближённом расчёте 10K на одну единицу массы атома.
4. Заключение
Согласно расчёту инертными газами являются:
-
1) . 2He, 10Ne, 18Ar, 36Kr, 54Xe, 86Rn — с одним ядром, устойчивые.
-
2) . 80Hg — с одним ядром, устойчивый, оригинальный.
-
3) . 7N, 8O, 9F — с одним ядром, неустойчивые, возможны только в твёрдом состоянии при температуре чуть выше –2730 С.
-
4) . 2H2, 14N2, 14CO, 16O2 , 18F2 — с двумя ядрами, устойчивые до определённых температур. При превышении критической температуры, рассыпаются на неустойчивые составные части и становятся очень активными химически. Совокупно взятые 1H, 6C, 7N и 8O могут образовывать массу всевозможных органических полумолекул и атомомолекул, в которых их конструкция может быть самой разнообразной, но такой, чтобы устойчивость полученной общей конструкции полумолекулы была достаточной, для условий её образования. Таким образом, в органических соединениях атомы C, N и O, отдельно взятые вне полумолекулы неустойчивы, устойчива только конструкция всей полумолекулы, и то только до определённой температуры. Конструкции атомов этих элементов в полумолекуле разнообразные и не такие как тогда, когда они отдельные. Конструкции неустойчивых атомов C, N и O , рассыпаются на свои составные части не только при повышении температуры, но и при контакте с активными химическими реагентами. Поэтому в живом организме возможна масса самых разнообразных химических преобразований с ними, и многие из них невозможны в неживой природе, из-за чего живая природа такая сложная, по сравнению с неживой природой, и по сложности достаточна для перехода реакции в инициативу, поэтому и является живой.
В современной науке предпринимались попытки построить какую-то простую числовую формулу инертных газов, потому что инертные газы воспринимаются как что-то отдельное от других элементов. На самом деле все атомы строятся с учётом структуризации и инертные газы есть частный случай, когда “n”
совпадает с СВУ, а соседние с ними элементы, тоже своего рода инертные газы по внутренней электронной симметрии, но с наружными электронами и другими свойствами. Современная теоретическая наука, часто опирается только на одну какую-то коллизию и не учитывает остальные коллизии, вытекающие с других Логик. Поэтому является упрощённой и может приводить к ошибочным неверным результатам. Только учёт всех семи Логик, и учёт основного принципа построения материальных объектов на основе оптимизации, даёт возможность точно и достоверно понимать и рассчитывать реально существующий материальный Мир. Для этого в любых теоретических исследованиях, необходимо учитывать максимально возможное число факторов, влияющих на предмет исследования.
Роль и влияние на конструкции и свойства атомов, других чисел СВУ, вычисленных в [2], будут рассмотрены в соответствующих разделах теории атомов.


