Атрезия легочной артерии с дефектом межжелудочковой перегородки: отдаленные результаты некоторых видов первичных паллиативных операций
Автор: Горбатых Юрий Николаевич, Жалнина Елена Валерьевна, Ленько Евгений Владимирович, Наберухин Юрий Леонидович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 2 т.16, 2012 года.
Бесплатный доступ
С 1999 по 2009 г. паллиативные вмешательства, направленные на «реабилитацию» легочных артерий выполнены у 66 пациентов с атрезией легочной артерии и дефектом межжелудочковой перегородки: I группа (n = 38) - системно-легочные анастомозы; II группа (n = 28) - реконструкция пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки. Возраст пациентов был от 3 дней до 14 лет. Исходно, размеры легочных артерий не имели различий между группами (ЭхоКГ, ангиокардиография) (p>0,05). Госпитальная летальность составила 11 пациентов (16,7%). Ангиокардиография, выполненная у всех повторно госпитализированных пациентов показала двукратное увеличение размеров главных ветвей легочных артерий во II группе (индекс Nakata) (р = 0,003) и увеличение нижнедолевых ветвей легочных артерий в 1,3 раза в I группе (индекс Redy) (р = 0,02). Результаты реконструкции пути оттока из правого желудочка показывают, что данная процедура более эффективна в качестве первичного паллиативного вмешательства с целью роста гипоплазированных главных ветвей легочных артерий и повышения насыщения крови кислородом.
Атрезия легочной артерии с дефектом межжелудочковой перегородки, рulmonary atresia, "реабилитация" легочных артерий, системно-легочный анастомоз, реконструкция пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки
Короткий адрес: https://sciup.org/142140469
IDR: 142140469 | УДК: 617-089.844
Текст научной статьи Атрезия легочной артерии с дефектом межжелудочковой перегородки: отдаленные результаты некоторых видов первичных паллиативных операций
ВАК 14.01.26
Поступила в редакцию 4 мая 2012 г.
Е.В. Жалнина,
Е.В. Ленько,
Ю.Л. Наберухин, 2012
С 1999 по 2009 г. паллиативные вмешательства, направленные на «реабилитацию» легочных артерий выполнены у 66 пациентов с атрезией легочной артерии и дефектом межжелудочковой перегородки: I группа (n = 38) – системно-легочные анастомозы; II группа (n = 28) – реконструкция пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки. Возраст пациентов был от 3 дней до 14 лет. Исходно, размеры легочных артерий не имели различий между группами (ЭхоКГ, ангиокардиография) (p>0,05). Госпитальная летальность составила 11 пациентов (16,7%). Ангиокардиография, выполненная у всех повторно госпитализированных пациентов показала двукратное увеличение размеров главных ветвей легочных артерий во II группе (индекс Nakata) (р = 0,003) и увеличение нижнедолевых ветвей легочных артерий в 1,3 раза в I группе (индекс Redy) (р = 0,02). Результаты реконструкции пути оттока из правого желудочка показывают, что данная процедура более эффективна в качестве первичного паллиативного вмешательства с целью роста гипоп-лазированных главных ветвей легочных артерий и повышения насыщения крови кислородом. Ключевые слова: атрезия легочной артерии с дефектом межжелудочковой перегородки; «реабилитация» легочных артерий; системно-легочный анастомоз; реконструкция пути оттока из правого желудочка без закрытия дефекта межжелудочковой перегородки.
Существуют такие анатомические и гемодинамические формы врожденных пороков сердца (ВПС), при которых первичная радикальная коррекция порока – невозможна, и выполнима только после ряда предварительных паллиативных вмешательств. Таковым пороком является ряд анатомо-гемодинамических вариантов атрезии легочной артерии (АЛА) с дефектом межжелудочковой перегородки (ДМЖП) [1–3]. Одним из вариантов многоэтапной коррекции АЛА с ДМЖП является концепция «реабилитации» гипоплазирован-ных истинных легочных артерий [4–7].
При этом идеальное паллиативное вмешательство в рамках данной концепции должно обеспечить адекватный рост и развитие легочного сосудистого русла в короткие сроки и без необходимости повторных паллиативных вмешательств, а также быть простым в техническом исполнении, иметь как можно меньше интра- и послеоперационных ранних и отдаленных осложнений, нулевую летальность, а в конечном итоге привести к радикальной коррекции порока [5]. До сих пор продолжаются дискуссии об оптимальном варианте пер- вичного паллиативного вмешательства: открытые операции – различные варианты системно-легочных анастомозов (СЛА) [2, 5, 8, 9]; реконструкция пути оттока из правого желудочка (РПОПЖ) без пластики ДМЖП [1, 6, 10]; интервенционные процедуры: баллонная ангиопластика легочных артерий (ЛА), стентирование ЛА, транскатетерная перфорация клапана ЛА, стентирование открытого артериального протока (ОАП) [11, 12]. Учитывая существующие особенности (низкую естественную продолжительность жизни при сложном цианотическом ВПС, мультивариантность подходов к хирургической коррекции, высокий риск оперативной коррекции, осложненный послеоперационный период), изучение вопроса оперативного лечения АЛА с ДМЖП имеет большое значение для повышения качества помощи пациентам педиатрической группы. Цель – выполнить сравнительный анализ клинико-лабораторного статуса и динамики развития левых отделов сердца и центрального легочного русла после выполнения двух видов открытой паллиативной коррекции: СЛА и РПОПЖ без закрытия ДМЖП у пациентов с АЛА и ДМЖП.
МАТЕРИАЛ И МЕТОДЫ
В ННИИПК им. акад. Е.Н. Мешалкина с 1999 по 2009 г. 66 пациентам в возрасте от 3 дней до 14 лет выполнены первичные открытые паллиативные вмешательства при АЛА с ДМЖП в объеме: I группа: СЛА – 38 (57,6%) и II группа: РПОПЖ без закрытия ДМЖП – 28 (42,4%). Исследование ретроспективное, когортное, нерандомизированное. Поскольку в данном исследовании производился статистический ретроспективный анализ уже выполненных операций, одобрения Этического комитета не требовалось.
В исследовании применялись разработанные и утвержденные медицинские технологии, каких-либо испытаний новых клинических методик, препаратов не производилось. При оценке данных в качестве основных статистических методов выбраны непараметрические критерии, так как расчеты производятся в выборках малого объема (n <100). Для анализа количественных признаков в группах использовался критерий Манна – Уитни; для качественных признаков – двусторонний вариант точного критерия Фишера, для повторных изменений – критерий Вилкок-сона. По исходной демографической и антропометрической характеристике (по полу, возрасту, росту, массе тела) группы были сопоставимы (р>0,05). Основная группа детей – 72,7% (nI = 33; nII = 15) прооперирована на первом году жизни. По результатам проведенных обследований: все пациенты относились к I или II типам по классификации J. Somerville (1970) [3]; и к типу А или В по классификации C.I. Tchervenkov, N. Roy (2000) [13]. Состояние большинства пациентов при поступлении оценивалось как тяжелое или крайне тяжелое, наиболее часто встречался 4-функцио-нальный класс (ФК) по NYHA – 59,1%, пациентов 0–I ФК не было, основными жалобами являлись цианоз и одышка в покое, усиливающиеся при нагрузке. Исходно у пациентов, подвергшихся первичному паллиативному вмешательству, подтверждено наличие десатурации (методом пуль-соксиметрии), выявлены явления полиглобулии и полицитемии (по лабораторным данным), по которым выявлены статистически значимые различия между группами. Выявлено уменьшение размеров ЛЖ и гипоплазия центрального легочного русла в обеих группах, но при сравнении индексированных размеров левого желудочка по данным ЭхоКГ и степени развития центрального легочного русла в абсолютных и индексированных размерах на всех уровнях (по данным ангиокардиографии и ангиокардиомет-рии) не выявлено различий (p>0,09). Кратко полученные данные в сравнительном аспекте представлены в табл. 1.
Показаниями к выполнению паллиативной коррекции порока были: тяжелое соматическое состояние, выраженная десатурация, малый возраст и вес ребенка, малые размеры левых отделов сердца, гипоплазия центрального легочного русла, мультифокальный тип легочного кровотока. Спектр открытых паллиативных вмешательств СЛА (n = 38): а) модифицированный подключично-легочный анастомоз по Blalock-Taussig – 30; б) анастомоз по Waterston-Cooley – 1; в) центральный СЛА с использованием протеза «Gore-tex» – 7. Десять пациентов оперированы в условиях искусственного кровообращения (ИК). РПОПЖ без закрытия ДМЖП (n = 28): а) трансаннулярная пластика заплатой из ксено- или аутоперикарда – 19; б) двузаплатный метод – 1; в) использование кондуита в легочной позиции – 7; г) изолированная пластика выходного отдела правого желудочка – 1. Все операции РПОПЖ выполнены доступом через срединную стернотомию, в условиях гипотермического ИК, в
Таблица 1
Исходные лабораторные и инструментальные данные пациентов с АЛА и ДМЖП
|
Параметр |
I группа (n = 38) Ме, 25–75% |
II группа (n = 28) Ме, 25–75% |
р |
|
Насыщение крови О2 (пульсоксиметрия), % |
63 56–72 |
70 62–75 |
0,049 |
|
Гемоглобин, г/л |
157,5 146–187 |
189,0 170–211 |
0,0008 |
|
Гематокрит, % |
48,1 43,7–56,4 |
57,5 49,5–61,8 |
0,008 |
|
ЭхоКГ: ИКДО ЛЖ, мл/м2 |
30,3 25,6–38,2 |
31,3 23,9–35,1 |
0,53 |
|
Ангиокардиометрия |
I группа (n = 19) |
II группа (n = 19) |
|
|
Индекс McGoon |
1,65 1,14–2,0 |
1,63 1,43–1,86 |
0,9 |
|
Нижне-долевой индекс McGoon |
1,2 1,1–1,47 |
1,16 1,0–1,27 |
0,38 |
|
Индекс Nakata, мм2/м2 |
197,4 110,0–261,2 |
136,0 116,72–212,5 |
0,29 |
|
Индекс Redy, мм2/м2 |
92,05 42,41–150,43 |
69,39 55,73–84,06 |
0,28 |
24 (85,71%) случаях выполнялась окклюзия аорты. Экстренные вмешательства составили 22,7% (12 пациентов из I группы и 3 пациента – из II группы).
РЕЗУЛЬТАТЫ
Общая госпитальная летальность после первого этапа лечения составила 16,7%: 4 пациента после СЛА, 7 пациентов – после РПОПЖ. У большинства пациентов послеоперационный период протекал с осложнениями. При исследовании нелетальных случаев (n = 55) выявлено, что наиболее часто у пациентов наблюдалась сердечная недостаточность, требующая кардиотонической поддержки более 1 суток – 70,9%; дыхательная недостаточность (ИВЛ – более 1 суток) – 45,5%; почечная дисфункция – 21,8%; появление геморрагической мокроты/признаков отека легкого – 18,2% (следует отметить, что у одного пациента встречалась комбинация нескольких осложнений). Статистический анализ данных свидетельствует о том, что во II группе послеоперационный период чаще протекал с явлениями сердечной недостаточности (р = 0,015). По остальным параметрам не отмечалось значимой разницы между группами (p>0,05). Перед выпиской из стационара у всех пациентов отметилось улучшение общего соматического состояния, уменьшение или купирование одышки, уменьшение степени цианоза. Медиана длительности госпитального периода после операции в I группе составила 14 сут., во II группе – 15 сут., без статистически значимых различий между группами (p = 0,61). При исследовании отдаленных результатов в I и II группах пациентов выявлено следующее их распределение (рис. 1).
Таким образом, из обеих групп можно выделить относительно однородные группы с достаточным количеством наблюдений – это пациенты, которым в качестве второго этапа оперативной коррекции выполнена радикальная коррекция (РК) порока (nI = 21 и nII = 15). Остальные наблюдаемые случаи являются немногочисленными, индивидуальными, гетерогенными и в дальнейшую статистическую обработку не включены.
Второй этап хирургического лечения (РК) выполняли в сроки 9–10 мес. после первичной паллиативной операции, без достоверной разницы между группами (p = 0,55). Перед радикальной коррекцией порока группы были также сопоставимы по демографическим и антропометрическим характеристикам (по полу, возрасту, росту, массе тела) (р>0,05). Распределение по тяжести состояния пациентов I и II группы представлены в схемах (рис. 2) .
Рис. 1.
Блок-схема этапов оперативных вмешательств, в том числе отмечены группы пациентов, выбывших из исследования.
СЛА (разные виды): n = 38 (let = 4), выписано 34 пациента
РК: n = 21 (let = 2)
Другие виды открытых паллиативных вмешательств
(СЛА, РПОПЖ): n = 4
Продолжается наблюдение / эндоваскулярная коррекция / открытая операция отложена или не показана: n = 5
РК: n = 1
Этапная коррекция АЛА с ДМЖП: путь использования истинных ЛА (n = 66)
Выбыли из исследования, нет информации о пациентах: n = 4
РК: n = 15 (let = 1)
РПОПЖ без закрытия ДМЖП: n = 28 (let = 7), выписан 21 пациент
Другие виды открытых паллиативных вмешательств (РПОПЖ): n = 1
Продолжается наблюдение / эндоваскулярная коррекция / открытая операция отложена или не показана: n = 0
РК: n = 1
Выбыли из исследования, нет информации о пациентах: n = 5
Рис. 2.
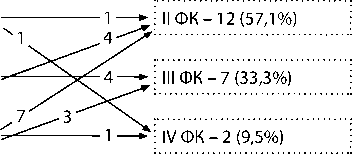
Схема изменения ФК (NYHA) в группах пациентов после паллиативной коррекции порока: а – распределение больных по ФК (NYHA) до СЛА и перед РК АЛА с ДМЖП (I группа, n = 21); б – распределение больных по ФК (NYHA) до РПОПЖ без закрытия ДМЖП и перед РК АЛА с ДМЖП (II группа, n = 15).
а
II ФК – 2 (9,5%)
III ФК – 8 (38,1%)
IV ФК – 11 (52,4%)
До I этапа
Среднее: 3,43±0,68
Ме: 4
Мо: 4
25% – 3, 75% – 4
б
II ФК – 2 (13,3%)
III ФК – 3 (20%)
IV ФК – 10 (66,7%)
До I этапа
Среднее: 3,53±0,74
Ме: 4
Мо: 4
25% – 3, 75% – 4
р = 0,006 До II этапа Среднее: 2,52±0,68 Ме: 2
Мо: 2
25% – 2, 75% – 3
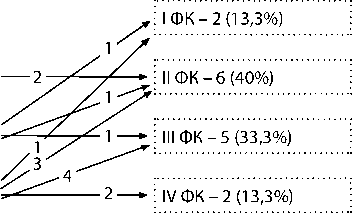
р = 0,005
До II этапа
Среднее: 2,47±0,92
Ме: 2
Мо: 2
25% – 2, 75% – 3
Следует отметить, что в I группе пациентов только у одного пациента отметилось быстрое ухудшение состояния через 2 месяца после коррекции со снижением ФК со II до IV, вследствие тромбоза анастомоза. Если сравнить значение ФК перед вторым этапом хирургической коррекции между группами, то статистической разницы не выявлено (р = 0,9).
В отдаленном периоде исследованы те же клинические, лабораторные и инструментальные параметры. При сравнении насыщения крови кислородом между группами на каждом этапе диагностики выявлено, что после РПОПЖ в ранние и отдаленные сроки наблюдается более высокий уровень кислорода крови (Ме = 90% и Ме = 82%, соответственно), по сравнению с СЛА (Ме = 85% и Ме = 80% соответственно). Выявлена статистически значимая разница между группами на всех этапах обследования: до паллиативной коррекции (р = 0,045), после паллиативного этапа (р = 0,0002), в отдаленные сроки, перед РК (р = 0,049). При использовании анализа повторных изменений (критерий Вилкоксона) на каждом этапе изменения с течением времени имели статистическую значимость: в I группе p<0,003; во II группе p<0,006. Таким образом, отмечается достоверный рост насыщения крови кисло- родом после паллиативной коррекции, а в отдаленные сроки происходит постепенная десатурация в обеих группах. При сравнении лабораторных показателей (гемоглобин, гематокрит) в динамике внутри каждой группы (критерий Вилкоксона) выявлено, что имеется статистически значимое снижение уровня гемоглобина и гематокрита только во II группе (после РПОПЖ без закрытия ДМЖП) (табл. 2). Стоит отметить, что перед радикальной коррекцией уровень полиглобулии и полицитемии был сравним между I и II группами (р = 0,6 и р = 0,2).
При определении статистической значимости изменения ИКДО ЛЖ в динамике с использованием критерия Вилкоксона выявлено, что имеется статистически значимое возрастание ИКДО ЛЖ в I (Me = 43,2 мл/м2) и во II группе (Ме = 49,5 мл/м2) (р = 0,002 в обоих случаях). При сравнении ИКДО ЛЖ и всех ангиометрических показателей между группами перед РК порока не выявлено статистически значимой разницы по всем параметрам в отдаленном периоде (р>0,1). При рассмотрении параметров роста легочного русла внутри каждой группы в динамике (до первичной операции и в отдаленном периоде, перед вторым этапом хирургической коррекции), выявлены закономерности, которые представлены в табл. 3.
|
Таблица 2 Сравнительные |
Лабораторный показатель (Ме, 25–75%) |
I группа (n = 21) |
II группа (n = 15) |
||
|
Перед СЛА |
Перед РК |
Перед РПОПЖ |
Перед РК |
||
|
лабораторные |
158 |
159 |
195 |
147 |
|
|
показатели в группах |
Гемоглобин, г/л |
145–194 |
180– 215 |
||
|
пациентов |
р = 0,39 |
144–180 |
р = 0,003 |
131–182 |
|
|
49,8 |
45,8 |
60,1 |
42 |
||
|
Гематокрит, % |
39–70 р = 0,09 |
41,9–49,9 |
52,2–63,0 р = 0,003 |
36,5–49,2 |
|
|
Таблица 3 Динамика размеров легочного русла за период между I и II этапами хирургической коррекции порока у пациентов I группы (n = 11) и II группы (n = 11) по данным АКГ. Представлены данные, по которым имелись статистически |
Параметр Перед I этапом (паллиа- Отдаленные результаты пе- р (критерий (Ме, 25–75%) тивной коррекцей) ред II этапом (РК порока) Вилкоксона) I группа (СЛА), n = 11 5,95 8,6 А1, мм 4,4–7,8 5,2–10,7 0,008 5,6 9 В, мм 0,02 , 4–7,5 7,2–12,2 , В1, мм 7,9 9,1 0,047 , 5,1–9,1 8,2–9,9 , В2, мм 4,45 6,2 0,02 |
|
значимые различия (p<0,05). А1 – диаметр ствола ЛА на уровне бифуркации; В – диаметр правой ЛА на уровне устья; В1 – диаметр правой ЛА проксимальнее ветвления; В2 – диаметр нижнедолевой ветви правой ЛА; С – диаметр левой ЛА на уровне устья; С1 – диаметр левой ЛА проксимальнее ветвления; С2 – диаметр нижнедолевой ветви левой ЛА; нАо – диаметр нисходящей аорты на уровне диафрагмы. |
3,25–6,15 5,2–7,8 4,6 7,9 С, мм , , 0,02 , 3,7–6,4 6,7– 9,0 , 4,8 8,7 С1, мм 0,03 , мм 3,8–8,2 7,1–9,8 , 4,75 7,2 С2, мм , , 0,02 , 3,25–5,9 5,6–7,9 , 0,83 1,01 В/нАо , , 0,01 0,57–1,17 0,88– 1,43 , 0,67 0,78 С2/нАо , , 0,02 0,49–0,98 0,65–0,79 , Нижне-долевой ин- 1,26 1,57 , , 0,03 декс McGoon 0,99–1,85 1,33–1,84 , 102,37 136,23 Индекс Redy, мм2/м2 0,02 , 54,4–199,54 125,51–177,25 , II группа (РПОПЖ без закрытия ДМЖП), n = 11 7,6 11,7 В1, мм , , 0,003 , 4,8–9,0 8–14 , 4,85 6,6 В2, мм , , 0,04 , 4–5,3 5,2–7,4 , 5,5 10,4 С1, мм , , 0,005 , 5,1–7,5 7,1–14 , 0,77 1,15 В1/нАо , , 0,008 0,68–1,12 0,98–1,31 , 0,75 1,22 С1/нАо , , 0,03 0,61–0,94 0,93–1,28 , 1,63 2,4 Индекс McGoon 0,003 1,43–1,95 2,09–2,62 , 147,73 309 Индекс Nakata, мм2/м2 0,003 116,86–191,6 263,65–404,59 |
ОБСУЖДЕНИЕ
При сравнении сопоставимых групп по исходным демографическим, антропометрическим характеристикам и по инструментальным данным (размеры левого желудочка, легочных артерий) выявлено, что в обеих группах после различных видов паллиативной коррекции (СЛА и РПОПЖ без закрытия ДМЖП) произошло статистически значимое повышение насыщения крови кислородом, более выраженное во II группе и снижение ФК (по NYHA). Не имелось статистически значимых различий по количеству летальных исходов в группах (р = 0,19, двусторонний критерий Фишера). В отдаленном периоде после паллиативной операции произошло статистически значимое улучшение ФК в каждой группе с течением времени, более выраженное во II группе (р = 0,005, критерий Вилкоксона). Наблюдаемые изменения насыщения крови кислородом (повышение) и уровня гемоглобина и гематокрита крови (статистически значимое снижение) после РПОПЖ без закрытия ДМЖП вероятно связаны с появлением поступления преимущественно венозной крови антеградным путем из ПЖ в легочное русло. При этом происходит увеличение доли эффективного (венозного) легочного кровотока. Тогда как при функционировании анастомоза в легочное русло поступает поток достаточно оксигенированной (смешанной) крови из артериального русла (аорта и её ветви), что не увеличивает долю эффективного легочного кровотока (в системный и легочный кровоток поступает идентично оксигенированная кровь). В связи с увеличением гемодинамической нагрузки на МКК через сформированное системно-легочное или правожелудоч-ково-легочное сообщение отмечается прирост артериального возврата в левые отделы сердца, и, как следствие, статистически значимое увеличение объемных показателей ЛЖ. При изучении динамики изменения роста ЛА по данным ангиокардиографии в I группе пациентов (после СЛА) выявлено, что имеется прирост абсолютных размеров главных легочных артерий на всех уровнях, что может свидетельствовать не только об их развитии после увеличения легочного кровотока, но и о естественном росте ЛА при увеличении возраста ребенка. При статистической обработке индексированных параметров выявлены различия преимущественно по нижнедолевым индексированным параметрам (р<0,05). Многие исследователи АЛА с ДМЖП считают, что наиболее показательным параметром роста и развития истинного легочного русла после паллиативных вмешательств являются размеры нижнедолевых ветвей главных ЛА, так как они не подвергаются деформации и стенозированию в зоне наложения швов при анастомозах и редко входят в зону спаечного процесса при выделении сосудов [3, 6, 7], что и подтверждается полученными данными в нашем исследовании. При изучении динамики изменения роста ЛА во II группе пациентов (после РПОПЖ без закрытия ДМЖП) выявлено, что имеется прирост как абсолютных, так и индексированных размеров главных легочных артерий на всех уровнях, кроме уровня устьев главных ветвей ЛА (В, В/нАо, С, С/нАо). Выяв- ленные статистические закономерности объясняются тем, что после операции РПОПЖ часто возникают устьевые стенозы в результате развития спаечного процесса в зоне вмешательства; деформации устьев легочных артерий при продолженной пластике легочного ствола до бифуркации; за счет фиброза и/или кальциноза, имплантированной ксеноперикардиальной заплаты/кондуита; а также в случае наложения дополнительных швов в области дистального анастомоза на тонкостенные легочные артерии при хирургическом гемостазе. В данной группе пациентов стенозы на дистальном анастомозе заплаты / кондуита выявлены в 9 случаях. Но при этом, дистальные участки главных ЛА сохраняют потенцию к росту и развитию за счет прямого симметричного антеградного потока крови из ПЖ, увеличения объемной нагрузки на истинные ЛА.
Итак, паллиативные вмешательства необходимы у ряда пациентов, когда соматическое состояние и/или анатомо-гемодинамические условия не позволяют выполнить первичную радикальную коррекцию порока. СЛА и РПОПЖ без закрытия ДМЖП приводят к улучшению соматического статуса, статистически значимому уменьшению ФК (NYHA) и увеличению насыщения крови кислородом (р<0,05). Устранение обструкции на пути оттока из ПЖ в отдаленные сроки приводит к значимому снижению уровня гемоглобина и гематокрита (р = 0,003), в отличие от формирования системно-легочного анастомоза (р>0,05) за счет создания физиологичного симметричного антеградного кровотока из венозного желудочка и увеличения доли эффективного легочного кровотока. Все виды паллиативных вмешательств приводят к развитию левых отделов сердца (увеличение ИКДО ЛЖ, р = 0,02), создают выгодные гемодинамические условия для роста ЛА, что позволяет выполнить завершающий этап лечения – радикальную коррекцию порока у большинства пациентов. После СЛА наблюдается статистически значимое увеличение индексированных размеров нижнедолевых ветвей легочных артерий и отсутствие увеличения индексированных размеров главных ветвей легочных артерий вследствие деформации ЛА на уровне фиксации шунта и спаечного процесса в зоне вмешательства. После РПОПЖ без закрытия ДМЖП появляется преимущественный рост главных ветвей легочных артерий, но отсутствует рост как абсолютных, так и индексированных размеров устьев правой и левой легочных артерий, так как прогрессируют стенотические изменения в данной зоне.
Список литературы Атрезия легочной артерии с дефектом межжелудочковой перегородки: отдаленные результаты некоторых видов первичных паллиативных операций
- Brian W., Roger B., Mee B. et al.//J. Thorac. Cardiovasc. Surg. 2003. V. 126. P. 694-702.
- Mumtaz M.A., Rosenthal G., Qureshi A. et al.//Ann. Thorac. Surg. 2008. V. 85. P. 2079-2084.
- Somerville J.//Brit. Heart J. 1970. V. 32. P. 641-651.
- Brizard C.P., Liava'a Matthew, d'Udekemc Yves.//Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Ann. 2009. V. 12. P. 139-144.
- Cotrufo M., Arciprete P., Caiaineillo G.//Eur. J. Cardiothorac. Surg. 1989. V. 3 (1). P. 12-15.
- Freedom R.M., Pongiglione G., Williams W.G. et al.//J. Thorac. Cardiovasc. Surg. 1983. V. 86. P. 24-36.
- Rome J.J., Mayer J.E., Castaneda A.R. et al.//Circulation. 1993. V. 88. (part. 1). P. 1691-1698.
- Godart F., Cureshi S., Simcha A. et al.//Eur. Heart J. 1994. V. 15. P. 374.
- Gupta A., Odim J., Levi D. еt al.//J. Thorac. Cardiovasc. Surg. 2003. V. 126. P. 1746-1752.
- Metras D., Chetaille P., Kreitmann B. еt al.//Eur. J. Cardiotorax. Surg. 2001. V. 20. P. 590-597.
- Gibbs J.L., Rothman M.T., Rees M.R. et al.//Br. Heart J. 1992. V. 67. P. 240-245.
- Piehler J.M., Danielson G.K., McGoon D.C. et al.//J. Thorac. Cardiovasc. Surg. 1980. V. 80. P. 552-567.
- Tchervenkov C.I., Roy N.//Ann. Thorac. Surg. 2000. V. 69. P. 97-105.


