Аугментация костных дефектов дистального отдела большеберцовой кости синтетическим b-трикальций фосфатом и ксенопластическим материалом «Остеоматрикс» при хирургическом лечении внутрисуставных импрессионных переломов
Автор: Кутепов Сергей Михайлович, Волокитина Елена Александровна, Гилев Михаил Васильевич, Антониади Юрий Валерьевич, Помогаева Елена Вячеславовна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Цель. Анализ результатов хирургического лечения внутрисуставных переломов дистального отдела большеберцовой кости с применением синтетического материала b-трикальций фосфата (b-threecalcium phosphate, bTCP) и ксенопластического материала «Остеоматрикс». Материал и методы. Проведен ретроспективный анализ результатов хирургического лечения 51 пациента с внутрисуставными импрессионными переломами дистального отдела большеберцовой кости (ДОББК) за период 2009-2013 годы. Критериями включения явились использование метода открытой репозиции и внутренней фиксации, аугментация костного импрессионного дефекта bTCP или ксенопластическим материалом «Остеоматрикс», период послеоперационного наблюдения до 36 месяцев включительно. Для оценки сравнительной эффективности аугментации импрессионных дефектов ДОББК приведены две группы: группа А (N=32), аугментация проводилась синтетическим b-трикальций фосфатом (bTCP); группа B (N=19) - ксенопластическим материалом «Остеоматрикс». Использовали рентгенологический, клинический и статистический методы исследования. Статистические методы включали оценку достоверности различий по параметрическим и непараметрическим критериям, оценку взаимосвязи признаков по величине коэффициента линейной корреляции Pearson. Для оценки сохранения репозиции определяли разницу дистального эпизарно-диафизарного угла (ΔдЭДУ); для оценки функционального статуса использовали балльную шкалу E. Mazur, 2006. Результаты. Через 36 месяцев после операции ∆дЭДУ у больных группы A в значении от 1 до 5 градусов встречалось в 90,7 %, у больных группы B - в 89,4 % (p=0,127). Неудовлетворительные рентгенометрические результаты одинаково часто наблюдались в обеих группах (p=0,0412). По шкале E. Mazur (2006) процент отличных и хороших результатов в группе A составил 53,0 %; удовлетворительных - 37,5 %, неудовлетворительных - 9,5 %. Для группы B процент отличных и хороших результатов составил 57,9 %; удовлетворительные результаты встретились в 36,8 %, неудовлетворительные - в 5,3 %. Выявлена прямая корреляционная связь средней силы между рентгенометрическим и функциональным параметрами (r=0,670±0,143 для группы A, r=0,549±0,103 для группы B). Общее число осложнений для обеих групп составило 8 (15,7 %) случаев. Заключение. В сроке наблюдения 3, 6, 12, 24 и 36 месяцев значимых рентгенометрических и функциональных отличий при использовании bTCP и «Остеоматрикса» не получено. Применение bTCP и «Остеоматрикса» для замещения костного дефекта является малотравматичным и эффективным способом аугментации и может быть рекомендовано при хирургическом лечении больных с внутрисуставными импрессионными переломами дистального отдела большеберцовой кости.
Большеберцовая кость, внутрисуставной перелом, аугментация, хирургическое лечение
Короткий адрес: https://sciup.org/142121903
IDR: 142121903 | УДК: 615.462:616.718.5-001.513-089.844 | DOI: 10.18019/1028-4427-2016-3-14-20
Текст научной статьи Аугментация костных дефектов дистального отдела большеберцовой кости синтетическим b-трикальций фосфатом и ксенопластическим материалом «Остеоматрикс» при хирургическом лечении внутрисуставных импрессионных переломов
Внутрисуставные импрессионные переломы дистального отдела большеберцовой кости (ДОББК), или переломы пилона, относятся к тяжелым повреждениям опорно-двигательного аппарата вследствие отрицатель- ного прогноза восстановления функции голеностопного сустава [1, 5, 7, 18]. Условно все переломы ДОББК с вовлечением суставной поверхности должны быть классифицированы как переломы пилона, за исключением пере-
Ш Кутепов С.М., Волокитина Е.А., Гилев М.В., Антониади Ю.В., Помогаева Е.В. Аугментация костных дефектов дистального отдела большеберцовой кости синтетическим b-трикальций фосфатом и ксенопластическим материалом «Остеоматрикс» при хирургическом лечении внутрисуставных импрессионных переломов // Гений ортопедии. 2016. № 3. С. 14-20.
ломов внутренней или наружной лодыжек и переломов заднего края большеберцовой кости (ББК), если он составляет менее 1/3 суставной поверхности [7]. Переломы пилона составляют 5-7 % от всей костной травмы ББК и 1 % от всех переломов костей нижних конечностей. Актуальность данного типа костной травмы обусловлена высоким количеством неудовлетворительных результатов (до 34 %), связанных с ограничением движений в голеностопном суставе, развитием дегенеративных изменений хряща и гнойными осложнениями. Несмотря на значительные достижения в области хирургического лечения переломов ДОББК, длительная или стойкая инвалидность отмечается у 6-8 % данной категории пострадавших, что также определяет актуальность вопросов совершенствования методов лечения [4, 7, 10, 15].
Особым видом внутрисуставных повреждений являются импрессионные переломы, характеризующиеся импакцией губчатой эпиметафизарной ткани и, как следствие, образованием костного дефекта. Основным методом лечения импрессионных переломов является хирургический, заключающийся в открытой репозиции перелома, элевации импрессионного дефекта с последующей аугментацией; остеосинтез проводится современными накостными металлофиксаторами [1, 2, 4, 17].
Аугментация аутотрансплантатом из гребня подвздошной кости в настоящее время считается «золотым стандартом», однако, наряду с достоинствами, имеет недостатки (развитие болевого синдрома в месте забора трансплантата, нейропатия латерального кожного нерва бедра, наличие эстетического дефекта, возможность развития гнойных осложнений донорского ложа). Современные костезамещающие материалы имеют ряд преимуществ: совместимость с аутологичной костью, отсутствие необходимости наносить дополнительную операционную травму, удобство моделирования костнопластического материала, возможность использования в больших объемах, обширная поверхность взаимодействия с костными клетками [9, 11].
МАТЕРИАЛЫ И МЕТОДЫ
Были проанализированы результаты хирургического лечения 51 больного с внутрисуставными импрессионными переломами дистального отдела большеберцовой кости (ДОББК), пролеченных в травматологическом отделении № 1 Муниципального автономного учреждения «Центральная городская клиническая больница № 24» г. Екатеринбурга за период с 2009 по 2013 г. в возрасте от 20 до 75 лет (средний возраст составил 47,6±2,7 года), из них женщин – 22 (43,1 %), мужчин – 29 (56,9 %). Критериями включения явились проведение операции отрытой репозиции и внутренней фиксации с аугментацией импрессион-ного дефекта синтетическим b-трикальций фосфатом (b-threecalcium phosphate, bTCP) или ксенопластиче-ским костезамещающим материалом «Остеоматрикс», а также период послеоперационного наблюдения до 36 месяцев включительно. В механогенезе травмы преобладало прямое воздействие с гиперэргическим фактором (66,7 % повреждений получены в результате падения с высоты более 1,5 м и 25,5 % получены в результате дорожно-транспортного происшествия); в 7,8 % случаев травмы были вызваны другими обстоятельствами (занятие спортом, насильственная травма). Большинство пациентов (88,2 %) поступили в стационар в первые сутки после травмы. Для детализации характера повреждения и верификации морфологии перелома 40 (78,4 %) пациентам проводили компьютерную томографию. Для стандартизации наблюдения мы использовали классификацию АО/ASIF, как наиболее часто используемую как в отечественной, так и в зарубежной литературе. В большинстве случаев диагностировали тип B3 – 19 пациентов (37,3 %) и тип
В2 – 13 пациентов (25,5 %).
Для оценки эффективности хирургического лечения больные были разделены на две группы: (1) группа A (N=32, 62,7 %) – аугментация импрессионного дефекта проводилась синтетическим b-трикальций фосфатом (bTCP); (2) группа B (N=19, 37,3 %) – им-прессионный дефект восполнялся ксенопластическим материалом «Остеоматрикс». Клинико-статистическая характеристика групп исследования представлена в таблице 1.
Остеосинтез выполняли, в среднем, на 5-8 сутки (предоперационный койко-день составил 6,7±1,1). В обеих группах для остеосинтеза использовали накостные металлофиксаторы: пластины по типу «лист клевера», метафизарные комбинированные пластины с угловой стабильностью, реконструктивные и 1/3-труб-чатые пластины (производство «Остеосинтез», г. Рыбинск). Оперативное пособие выполняли в условиях пневматического жгута в положении больного «лежа на спине». Использовали классические передневнутренний, передненаружный и заднемедиальный доступы. Операционную рану ушивали с обязательной постановкой активного дренажа на первые 24 часа. В послеоперационном периоде пациентам выполняли регулярные перевязки до заживления раны, назначали лечебную гимнастику под контролем методиста ЛФК, магнитотерапию для уменьшения отека и стимулирования процессов тканевой репарации; активизировали больного, обучая ходьбе с ходунками. Осевая нагрузка на оперированную конечность разрешалась, в среднем, через 10-12 недель после операции по факту консолидации перелома.
Таблица 1
Клинико-статистическая характеристика больных группы A и группы B
|
Гендерный состав, м/ж |
Средний возраст, лет |
Тип перелома по классификации AO/ASIF |
||||||||
|
B2 |
B3 |
C1 |
C2 |
|||||||
|
N |
% |
N |
% |
N |
% |
N |
% |
|||
|
Группа А*, N=32; 100,0 % |
17/15 |
39,4 ±1,2 |
8 |
25,0 |
13 |
40,6 |
7 |
21,9 |
4 |
12,5 |
|
Группа B**, N=19; 100,0 % |
12/7 |
51,9 ±2,1 |
5 |
26,3 |
6 |
31,6 |
5 |
26,3 |
3 |
15,8 |
|
Всего, N=51; 100,0 % |
29/22 |
47,6 ±2,7 |
13 |
25,5 |
19 |
37,3 |
12 |
23,5 |
7 |
13,7 |
Обозначения: * – импрессионный дефект восполнялся синтетическим b-трикальций фосфатом (bTCP); ** – импрессионный дефект восполнялся ксенопластическим материалом «Остеоматрикс».
Использовали клинический, рентгенологический и статистический методы исследования. В процессе наблюдения (контрольные явки через 3, 6, 12, 18, 36 месяцев) оценивали функциональное состояние голеностопного сустава, наличие признаков сращения в области перелома, рентгенометрический реферретный параметр – дистальный эпифизарно-диафизарный угол (дЭДУ [6]). Статистические методы [3] включали определение различий между группами больных по параметрическим (критерий Стьюдента) и непараметрическим (критерий Манна-Уитни, критерии сопряженности Пирсона и Чупрова для качественных признаков) критериям. Степень взаимосвязи признаков оценивалась с помощью линейного коэффициента корреляции r по Pearson. Различия считали статистически достоверными при уровне значимости p<0,05. Статистическая обработка данных производилась с помощью программы Microsoft Excel-2010 и Statgraphics Centurion XVI (версия 16.2.04).
Для соблюдения статистической достоверности исследования однородность групп оценивали по следу- ющим показателям: возраст, тип перелома, пол. Группы попарно оценены непараметрическим методом с использованием критерия Манна-Уитни и оценкой критериев сопряженности для качественных признаков (пол и тип перелома по AO/ASIF) с применением статистики «хи-квадрат» на уровне значимости p<0,05. Для искомых параметров получено значение p>0,05, что позволило отвергнуть гипотезу о наличии взаимосвязи и считать группы статистически однородными [3].
Для оценки сохранения репозиции перелома ДОББК переднезаднюю рентгенограмму голеностопного сустава и голени переводили в цифровой вид; при помощи программы Universal desktop ruler (версия 3.6.3481) вычисляли разницу дистального эпифизарно-диафизарного угла (∆дЭДУ) после операции и на искомых сроках наблюдения (дЭДУ формировался пересечением двух линий: первая линия совпадает со среднедиафизарной (медианой) линией большеберцовой кости во фронтальной плоскости, а вторая – совпадает с суставной линией голеностопного сустава во фронтальной плоскости [6]).
РЕЗУЛЬТАТЫ
Наблюдения по разнице величин ∆дЭДУ проводились в сроки 3, 12 и 36 месяцев после операции (табл. 2). В сроке наблюдения 3 месяца после операции ∆дЭДУ у больных группы А в значении от 1 до 5 градусов встречался в 93,7 %, у больных контрольной группы – в 94,6 % (p=0,0874). В 12 месяцев после операции ∆дЭДУ у больных группы А в значении от 1 до 5 градусов встречался в 90,6 %, у больных группы B – в 89,5 % (p=0,114). В 36 месяцев после операции ∆дЭДУ у больных группы А в значении от 1 до 5 градусов встречался в 90,7 %, у больных группы B – в 89,4 % (p=0,127). Таким образом, межгрупповые различия статистически недостоверны (при уровне значимости менее 0,05). Различия между значением ∆дЭДУ между пациентами в пределах одной группы статистически достоверны (p<0,05 при условии равенства внутригрупповых дисперсий). Неудовлетворительные рентгенометрические результаты одинаково часто наблюдались в обеих группах (p=0,0412).
Значение параметра ∆дЭДУ на сроках 3, 6, 12, 24 и 36 месяцев после операции для пациентов группы A и B представлено на рисунке 1.
Тенденция к уменьшению параметра ∆дЭДУ (в значении x от 0 до 1 градусов) с увеличением сроков наблюдения для пациентов группы A и B можно объяснить реализацией полноценной осевой нагрузки на оперированную конечность (в среднем, пациентам разрешалась осевая нагрузка через 10-12 недель после операции). Значение ∆дЭДУ больше 5 градусов для больных группы A и B можно также объяснить реализацией полноценной осевой нагрузки на оперированную конечность и, как следствие, возникновением вторичной импрессии (к 36 месяцам ∆дЭДУ > 5 градусов для больных группы A и B встретилось в 9,4 % и 10,5 % соответственно, p=0,0412).
Данные об оценке результатов хирургического лечения больных группы A и B по шкале E. Mazur (2006) [16] в 36 месяцев после операции представлены в таблице 3.
Таблица 2
Разница дистального эпифизарно-диафизарного угла (∆дЭДУ) у больных группы А и группы B в 3, 12 и 36 месяцев после операции (x – искомая разница, в градусах)
|
Параметр |
Период наблюдения |
Группа больных |
||||||
|
Группа А, N=32, 100 % |
Группа B, N=19, 100 % |
|||||||
|
0≤x<1 |
3≤x≤5 |
x>5 |
0≤x<1 |
3≤x≤5 |
x>5 |
|||
|
∆дЭДУ |
3 месяца |
N |
25 |
5 |
2 |
13 |
5 |
1 |
|
% |
78,1 |
15,6 |
6,3 |
68,4 |
26,3 |
5,3 |
||
|
12 месяцев |
N |
21 |
8 |
3 |
10 |
7 |
2 |
|
|
% |
65,6 |
25,0 |
9,4 |
52,7 |
36,8 |
10,5 |
||
|
36 месяцев |
N |
19 |
10 |
3 |
9 |
8 |
2 |
|
|
% |
59,4 |
31,3 |
9,4 |
47,3 |
42,1 |
10,5 |
||
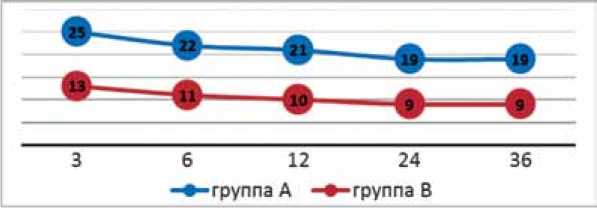
Рис. 1. Количество пациентов группы A и B с параметром ∆дЭДУ (0≤x<1, x в градусах) на сроках 3, 6, 12, 24 и 36 месяцев после операции, график
Таблица 3
Оценка результатов хирургического лечения больных группы A и B по шкале E. Mazur (2006) в срок 36 месяцев после операции
|
Оценка результата |
Группа больных |
||
|
группа А*, N=32, 100 % |
группа B*, N=19, 100 % |
||
|
Отлично |
N |
10 |
5 |
|
% |
31,2 |
26,3 |
|
|
Хорошо |
N |
7 |
6 |
|
% |
21,8 |
31,6 |
|
|
Удовл. |
N |
12 |
7 |
|
% |
37,5 |
36,8 |
|
|
Неуд. |
N |
3 |
1 |
|
% |
9,5 |
5,3 |
|
Как следует из таблицы 3, в сроке наблюдения 36 месяцев после операции процент отличных и хороших результатов лечения для больных группы A составил 53,0; удовлетворительные результаты встретились в 37,5 %, неудовлетворительные – в 9,5 %. Для больных группы B процент отличных и хороших составил 57,9; удовлетворительные результаты встретились в 36,8 %, неудовлетворительные – в 5,3 %.
Взаимосвязь рентгенометрического (дЭДУ) и функционального параметров (количество баллов по шкале E. Mazur, 2006) оценивалась при помощи коэффициента линейной корреляции r по Pearson на искомых сроках наблюдения. Для группы A среднее значение коэффициента r составило 0,670±0,143, что свидетельствует о прямой корреляционной (статистической) связи средней силы [3]. Для группы B среднее значение коэффициента r соста- вило 0,549±0,103, что также свидетельствует о наличии прямой корреляционной (статистической) связи средней силы. Оценка значимости коэффициента проводилась при помощи статистики t по Стьюденту (для обеих групп получено значение t>1,9, что свидетельствует о статистически достоверном уровне различий при p<0,05).
Общее число осложнений для обеих групп составило 8 (15,7 %) случаев. У 5 (9,8 %) больных (у трех из группы A, у двух из группы B) отмечено вторичное смещение фрагментов большеберцовой кости на величину более 5 мм, что обусловило дисконгруэнтность суставной щели и появление ранних признаков остеоартроза (на наш взгляд, вторичная импрессия обусловлена выбором неадекватного накостного фиксатора, а именно, пластины «лист клевера» вместо LCP пластины). У 3 (5,9 %) пациентов (у одного из группы A, у двух из группы B) в раннем послеоперационном периоде развился инфекционно-воспалительный процесс, который в одном случае (группа B) потребовал выполнения вторичной хирургической обработки раны и удаления накостного фиксатора с выполнением чрескостного остеосинтеза аппаратом внешней фиксации по Г.А. Илизарову.
Клинический пример
Больная У., 21 год, травму получила в результате падения с высоты 1,5 метров. Диагноз: импрессионный перелом дистального эпиметафиза правой большеберцовой кости, тип B3.1 по AO/ASIF (рис. 2).
На десятые сутки после поступления в стационар выполнена открытая репозиция перелома, остеосинтез большеберцовой кости опорными пластинами с костной пластикой «Остеоматриксом». Этапы операции представлены на рисунке 3.
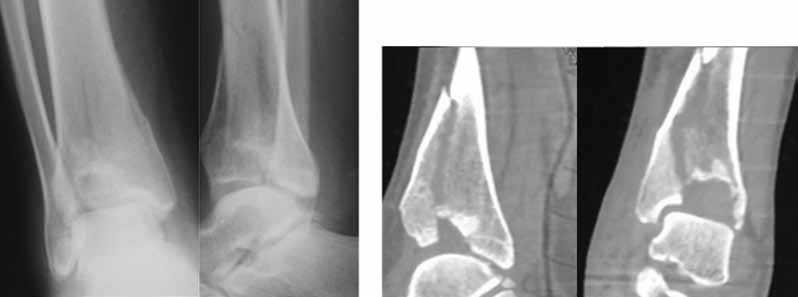
Рис. 2. Рентгенограммы и КТ правого голеностопного сустава в прямой и боковой проекциях больной У., 21 год, при поступлении: отмечается импрессионный оскольчатый перелом дистального эпиметафиза большеберцовой кости (тип B3.1 по АО/ASIF)
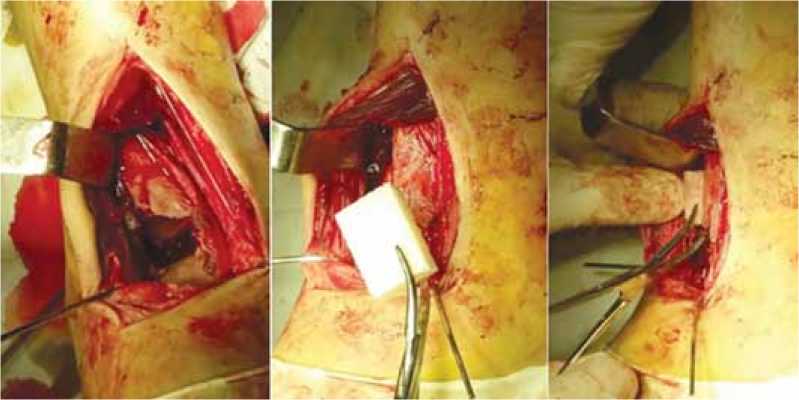
Рис. 3. Этапы операции больной У., 21 год (фото из операционной). На фотографиях виден импрессионный дефект и этапы его возмещения при помощи материала «Остеоматрикс»
Рентгенограммы после операции представлены на рисунке 4.
После снятия швов пациентку выписали на амбулаторное лечение с разрешением полной нагрузки через 4 месяца после операции. Полный объем активных движений в голеностопном суставе был восстановлен через 1 месяц после операции. Консолидация перелома наступила через 12 недель. Функция голеностопного сустава через 12 недель с момента операции представлена на рисунке 5.
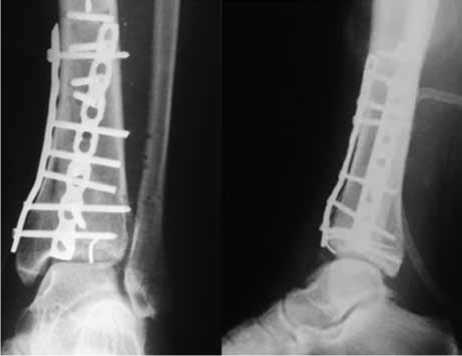
Рис. 4. Рентгенограммы правого голеностопного сустава больной У., 21 год, в прямой и боковой проекциях после операции: остеосинтез выполнен малой прямой и реконструктивной пластинами с угловой стабильностью, проведена субхондральная фиксация спицей-пином; конгруэнтность суставных поверхностей восстановлена
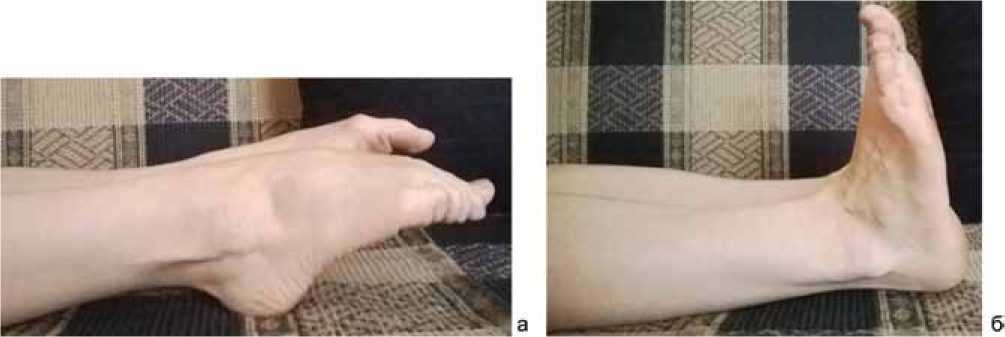
Рис. 5. Функция голеностопного сустава больной У., 21 лет, сгибание (а) и разгибание (б) через 12 недель после операции: объем движений восстановлен
ДИСКУССИЯ
Импрессионные переломы пилона встречаются как изолированно, так и в сочетании с другими типами переломов дистального эпиметафиза большеберцовой кости. При поднятии суставной поверхности образуется дефект костной ткани, который необходимо восполнить для сохранения результатов репозиции [1, 5]. Как отмечают N. Lasanianos (2008), T.A. Russel (2008) [13], «золотым стандартом» остеопластики при оперативном лечении внутрисуставных импрессионных переломов является аутопластика из гребня подвздошной кости. Аутокость не только заполняет костный дефект, но и обладает остеоиндуктивными свойствами. После имплантации аутокости активизируются биологические активные вещества, благодаря которым идет перестройка и дифференциация мезенхимальных клеток в костные. Однако аутопластика, наряду с достоинствами (обладает остеогенным, остеоиндуктивным и остеокондуктивными свойствами), имеет ряд недостатков [11]. Многие авторы отмечают развитие стойкого болевого синдрома в месте забора трансплантата, эстетического дефекта, возможность развития инфекционно-воспалительных осложнений донорского ложа [9, 10]. В целом, вышеназванные недостатки могут зна- чительно затруднять ранний этап послеоперационной реабилитации больных с внутрисуставными переломами костей конечностей и дистального отдела большеберцовой кости, в частности.
В последнее время для восполнения костных дефектов при пластике импрессионных переломов многие авторы стали использовать биокомпозиты на основе фосфата кальция как изолированно, так и в комбинации с аутологичным костным мозгом [18, 19]. Последние имеют ряд преимуществ перед другими вариантами остеопластики: отсутствует риск передачи заболеваний, полная совместимость с аутологичной костью, нет необходимости наносить дополнительную травму, удобство моделирования, возможность использования в больших объемах, обширная поверхность взаимодействия с костными клетками, уменьшение времени операционной сессии. Интересные данные получил P. Lobenhoffer (2002) [14], который показал, что общие затраты на реабилитацию больного после аутопластики из гребня подвздошной кости выше, чем после пластики композитом на основе фосфата кальция. Недавние исследования B. Yu (2009) [19], а также D.N. Yetkinler
-
(2001 ) [18] выявили, что при пластике фосфат-кальциевым и сульфат-кальциевым цементом достигается более жесткая и упругая фиксация в сравнении с аутокостью, что значительно снижает риск вторичного смещения и проседания фрагмента при активизации больного. Ксенопластические материалы обладают достаточными прочностными свойствами в сочетании с остеокондуктивными и остеоиндуктив-ными характеристиками [8, 9, 12]. M.R. Bansal et al.
-
(2009 ) [8], применяя аллогенные замороженные кусочки спонгиозной кости, наблюдали процесс кальцификации и образования трабекул в трансплантате, что позволило им рекомендовать использование материала для костной пластики.
Изучение результатов применения искусственных костезамещающих материалов при восполнении им-прессионных дефектов большеберцовой кости, на наш взгляд, имеет большое практическое значение.
ЗАКЛЮЧЕНИЕ
Таким образом, остеопластика костного дефекта ции и может быть рекомендована при хирургическом b-трикальций фосфатом, наравне с ксенопластиче- лечении больных с внутрисуставными импрессион-ским материалом «Остеоматрикс», является мало- ными переломами дистального отдела большеберцо-травматичным и эффективным способом аугмента- вой кости.
Список литературы Аугментация костных дефектов дистального отдела большеберцовой кости синтетическим b-трикальций фосфатом и ксенопластическим материалом «Остеоматрикс» при хирургическом лечении внутрисуставных импрессионных переломов
- Опыт хирургического лечения внутрисуставных переломов костей конечностей с применением биокомпозита на основе b-трикальций фосфата/Е.А. Волокитина, Ю.В. Антониади, М.В. Гилев, Д.Н. Черницын//Урал. мед. журн. 2014. № 1 (115). С. 75-79.
- Гилёв М.В. Хирургическое лечение внутрисуставных переломов проксимального отдела большеберцовой кости//Гений ортопедии. 2014. № 1. С. 75-81.
- Орлов А.И. Прикладная статистика: учебник для ВУЗов. М.: Экзамен, 2004. 656 с.
- Помогаева Е.В. Вопросы терминологии и классификации внутрисуставных переломов дистального отдела костей голени//Вестн. Урал. мед. акад. науки. 2015. № 4 (55). С. 132-138.
- Внутрисуставные переломы дистального отдела большеберцовой кости: эволюция взглядов на хирургическое лечение (обзор литературы)/В.В. Сластинин, И.Ю. Клюквин, О.П. Филиппов, Ю.А. Боголюбский//Журн. им. Н.В. Склифосовского. Неотложная мед. помощь. 2015. № 3. С. 23-29.
- Определение референтных линий и углов длинных трубчатых костей: пособие для врачей/Л.Н. Соломин, Е.А. Щепкина, П.Н. Кулеш, В.А. Виленский, К.Л. Корчагин, П.В. Скоморошко. СПб.: РНИИТО им. Р.Р. Вредена, 2012. 48 с.
- Шумаев Д.Н., Шагалин Г.А. Результаты лечения больных с переломами пилона//Бюл. мед. интернет-конф. 2015. Т. 5, № 5. С. 864.
- Bansal M.R., Bhagat S.B., Shukla D.D. Bovine cancellous xenograft in the treatment of tibial plateau fractures in elderly patients//Int. Orthop. 2009. Vol. 33, N 3. P. 779-784.
- Bauer T.W., Muschler G.F. Bone graft materials. An overview of the basic science//Clin. Orthop. Relat. Res. 2000. N 371. P. 10-27.
- Trauma: pilon fractures. In: Surgery of the Foot and Ankle. 8th ed./Eds. M.J. Coughlin, R.A. Mann, C.L. Saltzman. Philadelphia: Mosby, 2007. Vol. II, Part X. Ch. 36.
- Finkemeier C.G. Bone-grafting and bone-graft substitutes//J. Bone Joint Surg. Am. 2002. Vol. 84-A, N. 3. P. 454-464.
- Hunziker E.B. Articular cartilage repair: basic science and clinical progress. A review of the current status and prospects//Osteoarthritis Cartilage. 2002. Vol. 10, N 6. P. 432-463.
- Lasanianos N., Mouzopoulos G., Garnavos C. The use of freeze-dried cancellous allograft in the management of impacted tibial plateau fractures//Injury. 2008. Vol. 39, N 10. P. 1106-1112.
- Particular posteromedial and posterolateral approaches for the treatment of tibial head fractures/P. Lobenhoffer, T. Gerich, T. Bertman, C. Lattermann, T. Pohlemann, H. Tscheme//Unfallchirurg. 1997. Vol. 100, N 12. P. 957-967.
- Tibial pilon fractures: a review of incidence, diagnosis, treatment, and complications/C. Mauffrey, G. Vasario, B. Battiston, C. Lewis, J. Beazley, D. Seligson//Acta Orthop. Belg. 2011. Vol. 77, N 4. P. 432-440.
- Mazur J.M., Schwartz E., Simon S.R. Ankle arthrodesis. Long-term follow-up with gait analysis//J. Bone Joint Surg. Am. 1979. Vol. 61, N 7. P. 964-975.
- An update on the management of high-energy pilon fractures/I.S. Tarkin, M.P. Clare, A. Marcantonio, H.C. Pape//Injury. 2008. Vol. 39, N 2. P. 142-154.
- Biomechanical comparison of conventional open reduction and internal fixation versus calcium phosphate cement fixation of a central depressed tibial plateau fracture/D.N. Yetkinler, R.T. McClellan, E.S. Reindel, D. Carter, R.D. Poser//J. Orthop. Trauma. 2001. Vol. 15, N 3. P. 197-206.
- Treatment of tibial plateau fractures with high strength injectable calcium sulphate/B. Yu, K. Han, H. Ma, C. Zhang, J. Su, J. Zhao, J. Li, Y. Bai, H. Tang//Int. Orthop. 2009. Vol. 33, N 4. P. 1127-1133.


