Аутотранслокация комплекса "пигментный эпителий - хориоидея "на питающей ножке" при лечении рубцовой стадии неоваскулярной возрастной макулярной дегенерации
Автор: Сосновский С.В., Бойко Э.В., Осканов Д.Х.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель: комплексный анализ эффективности аутотранслокации комплекса «пигментный эпителий - сосудистая оболочка "на питающей ножке"» при рубцовой стадии неоваскулярной возрастной макулярной дегенерации (ВМД). Материал и методы. Аутотранслокация полнослойного лоскута, включающего пигментный эпителий и сосудистую оболочку «на питающей ножке», проведена 8 пациентам с рубцовой стадией неоваскулярной ВМД. Срок наблюдения составил от 6 до 30 месяцев. Оценивали данные визометрии, офтальмоскопии, оптической когерентной томографии и ангиографии с индоцианином зеленым. Результаты. Средняя острота зрения повысилась с 0,009±0,006 до 0,018±0,022 (р=0,15). У 4 пациентов выявлено улучшение остроты зрения, у остальных 4 пациентов установлено ухудшение. У всех пациентов с ухудшением зрения послеоперационный период осложнился пролиферативной витреоретинопатией с развитием отслойки сетчатки. Ни в одном случае не выявлено рецидива активности хориоидальной неоваскуляризации. С первого месяца послеоперационного периода в транслоцированном аутолоскуте выявлена полноценная перфузия. Заключение. Аутотранслокация комплекса «пигментный эпителий - сосудистая оболочка "на питающей ножке"» может успешно использоваться при лечении рубцовой стадии неоваскулярной ВМД.
Аутотранслокация пигментного эпителия, возрастная макулярная дегенерация, ингибиторы ангиогенеза, субретинальная хирургия, хориоидальная неоваскуляризация
Короткий адрес: https://sciup.org/149135450
IDR: 149135450 | УДК: 617.7
Текст научной статьи Аутотранслокация комплекса "пигментный эпителий - хориоидея "на питающей ножке" при лечении рубцовой стадии неоваскулярной возрастной макулярной дегенерации
-
1Введение. Возрастная макулярная дегенерация (ВМД) — связанное с возрастом хроническое прогрессирующее заболевание центральной зоны сетчатки (макулы), вызывающее снижение остроты зрения. В основе патофизиологических механизмов ВМД лежит ишемия на уровне хориокапиллярного слоя сосудистой оболочки, вызывающая поражение мембраны Бруха, пигметного эпителия и нейросенсорной сетчатки [1]. В развитых странах, судя по результатам эпидемиологических обследований, распространенность ВМД варьируется от 1,7 до 15,6% [2]. Статистика по РФ свидетельствует о показателях заболеваемости ВМД среди пациентов старше 40 лет на уровне 14,1% [3]. В 82-90% ВМД манифестирует в так называемой «сухой» форме, при которой отсутствует отек сетчатки, а морфологическим субстратом является атрофия хориокапилляров и нейросенсорной сетчатки. Сухая ВМД характеризуется медленным и незначительным снижением зрения, пациенты успевают адаптироваться и не испытывают значительного ухудшения качества жизни из-за зрения. В 10-18% развивается так называемая «влажная» (или неоваскулярная) форма ВМД, морфологическим субстратом которой является развитие новообразованных сосудов на уровне хориоидальных капилляров [4]. Это сопровождается экссудацией с формированием отека, кровоизлияниями и рубцеванием в хориоидее и сетчатке макулярной зоны. Процесс протекает быстро со значительным и быстрым снижением зрения, что вызывает выраженное ухудшение качества жизни, инвалидизацию и социальную дезадаптацию пациентов [1]. Ведущую роль в патогенезе неоваскулярной ВМД играет повышение в сетчатке концентрации эндотелиального сосудистого фактора роста [5].
Актуальным «золотым стандартом» лечения не-оваскулярной ВМД является интравитреальное введение ингибиторов ангиогенеза — препаратов, инактивирующих эндотелиальный сосудистый фактор роста. В настоящее время накоплен большой опыт реальной клинической практики, подтверждающий высокую эффективность антиангиогенной терапии [1, 6, 7]. Этот же опыт позволил определить ряд ассоци-
ированных с неоваскулярной ВМД состояний, при которых антиангиогенная терапия неэффективна: обширное субретинальное макулярное кровоизлияние, резистентность и тахифилаксия, исходы макулярной неоваскуляризации в виде атрофии ПЭС и рубцевания в макуле [1, 8–10]. Одним из существующих подходов в таких ситуациях является субретинальная хирургия с пересадкой под сетчатку макулярной зоны полнослойного аутологичного комплекса «пигментный эпителий — сосудистая оболочка» (ПЭС/СО) [10]. При этом существует несколько модификаций хирургии: в виде пересадки комплекса аутотканей «на питающей ножке» или изолированного.
Цель: комплексный анализ эффективности аутотранслокации комплекса «пигментный эпителий — сосудистая оболочка “на питающей ножке”» при рубцовой стадии неоваскулярной ВМД.
Материал и методы. В работе оценивали результаты микрохирургического лечения 8 пациентов (8 глаз). Средний возраст составлял 69,2±7,2 года.
Критерии включения в исследование следующие: — наличие субретинального макулярного фибро за в исходе неоваскулярной ВМД;
-
— острота зрения на исследуемом глазу менее 0,1 по методу Snellen;
-
— согласие на выполнение операции аутотранслокации комплекса ПЭС/СО;
-
— возможность осуществлять визиты в клинику для проведения обследования в соответствии с графиком послеоперационного мониторинга.
Критерии исключения из исследования:
-
— наличие сопутствующих офтальмологических заболеваний, вызывающих снижение остроты зрения;
— наличие сопутствующих офтальмологических заболеваний, опосредованных нарушением регуляции эндотелиального сосудистого фактора роста.
Всем пациентам, вошедшим в исследование в соответствии с критериями включения, выполнено оперативное вмешательство аутотранслокации комплекса ПЭС/СО.
Этапы операции:
— субтотальная трехпортовая витрэктомия с использованием инструментов калибра 25+G с тщательной санацией зоны базального витреума с использованием склеропрессии;
— индукция отслойки сетчатки в наружных квадрантах путем нагнетания сбалансированного рас-
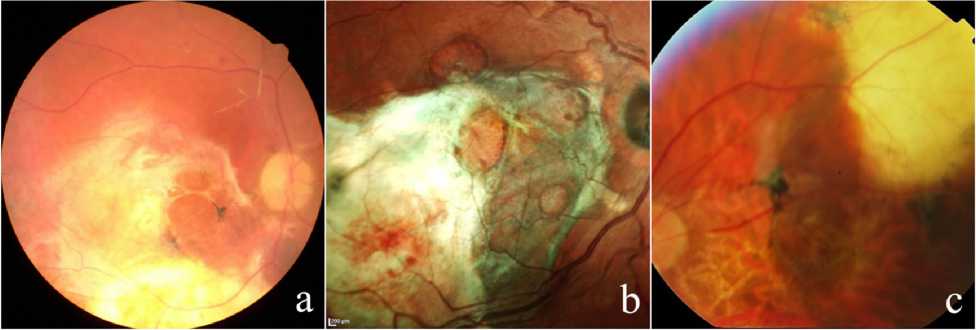
Рис. 1. Данные офтальмоскопии разных пациентов с рубцовой возрастной макулярной дегенерацией в различные сроки после аутотранслокации комплекса «пигментный эпителий — сосудистая оболочка»:
a — через 12 месяцев; b — через 16 месяцев; c — через 24 месяца
твора BSS+ в субретинальное пространство через точечную ретинопунктуру с помощью субретинальной канюли 38G;
-
— распространение отслойки сетчатки на макулярную зону путем аппаратной замены жидкости в стекловидной камере на стерильный воздух;
-
— периферическая ретинотомия на 270° (для левого глаза в меридианах с 11 до 7 часов, для правого глаза с 5 до 1 часа);
-
— доступ в субретинальное пространство макулярной области путем отгибания сетчатки к диску зрительного нерва;
-
— удаление патологических субстратов из субретинальной зоны макулярной области (рубцы, кровь, детрит, ХНВ);
-
— выкраивание в зоне кнаружи от верхней сосудистой аркады и параллельно ей полнослойного дугообразного лоскута ПЭС/СО «на питающей ножке» основанием к диску зрительного нерва (проксимальный конец лоскута сохраняет связь с основной тканью сосудистой оболочки);
-
— ротация дистального конца лоскута в макулярную область и его позиционирование в проекции фовеа;
-
— расправление сетчатки путем введения пер-фторорганической жидкости в преретинальное пространство:
-
— эндолазеркоагуляция в несколько рядов по краю периферической ретинотомии;
-
— последовательная замена перфторорганиче-ской жидкости на стерильный воздух и силиконовое масло.
Через 1,5–2 месяца выполняли удаление силиконового масла.
Исходно и в ходе послеоперационного диспансерного наблюдения (через 1, 6 и далее каждые 6 месяцев после операции) пациентам проводили обследование в следующем объеме:
-
1. Визометрия по методу Snellen с помощью таблиц Головина — Сивцева. Оценивали максимальную корригированную остроту зрения (МКОЗ).
-
2. Офтальмоскопия с фоторегистрацией глазного дна на фундус-камере TRC-50DX (Topcon, Япония). Оценивали правильность позиционирования лоскута ПЭС/СО и наличие послеоперационных патологических изменений в макулярной области.
-
3. Оптическая когерентная томография (ОКТ) на томографе RTVue 100 (Optovue, США). Оценивали правильность позиционирования комплекса
-
4. Ангиография с индоцианином зеленым (ИЗАГ) на приборе Spectralis Spec-CAM (Heidelberg Engineering, Германия). Оценивали перфузию в сосудистой оболочке перемещенного лоскута ПЭС/СО.
ПЭС/СО, наличие признаков активности ХНВ (отек сетчатки, отслойка ПЭС, отслойка нейроэпителия, кистоз нейросенсорной сетчатки).
Кроме этого, оценивали наличие ранних и поздних послеоперационных осложнений и побочных эффектов.
Статистическую обработку проводили с использованием программы Statistica 10.0 (StatSoft, Inc., Tulsa, OK). Числовые показатели определяли 95%-м до-верительныи интервалом как М (среднее) ±s (стандартное отклонение). Значимость различия между выборками данных определяли с помощью критерия Манна–Уитни. Значимыми считали различия при значении p<0,05.
Исследование выполнено в соответствии со стандартами Надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации, одобрено локальным этическим комитетом. Перед включением в исследование пациенты подписывали письменное информированное согласие.
Результаты. Исходная МКОЗ составила 0,009±0,006. К концу периода наблюдения средняя МКОЗ составила 0,018±0,022 (p=0,15). При качественной оценке остроты зрения повышение МКОЗ выявлено у 4 пациентов (50%), ухудшение МКОЗ установлено у остальных 4 пациентов (50%).
По данным офтальмоскопии с фоторегистрацией, во всех случаях аутолоскут ПЭС/СО имел естественный темно-розовый цвет и локализовался в макулярной области (рис. 1).
Во всех случаях отмечали ретракцию аутолоскута ПЭС/СО, чья площадь к концу наблюдения была на 15-30% меньше площади послеоперационной колобомы хориоидеи в месте забора лоскута в парама-кулярной области. В 4 случаях (50%) в сроки от двух до шести месяцев течение послеоперационного периода осложнилось пролиферативной витреоретинопа-тией (ПВР) с формированием отслойки сетчатки. Это потребовало повторной противоотслоечной хирургии, в 3 случаях с постоянной силиконовой тампонадой. В 4 случаях, где ПВР не развилась, до конца периода наблюдения отмечали полное прилегание сечтатки во всех отделах, формирование пигментированных хориоретинальных рубцов после лазеркоагуляции по краю периферической ретинотомии.
По данным ОКТ во всех случаях в макулярной зоне определяли гиперрефлективный плоский субретинальный очаг (транслоцированный лоскут ПЭС/СО), который имел правильную ориентацию пигментным эпителием кнаружи. Ни в одном случае на протяжении всего срока послеоперационного наблюдения не выявлено возникновение отека нейросенсорной сетчатки, экссудативных отслоек ПЭС или ретинального нейроэпителия (рис. 2).
Ангиография с индоцианином зеленым в динамике проводилась 4 пациентам, у которых не развилась ПВР. По данным ИЗАГ во всех случаях уже через 1 месяц после операции в транслоцированном аутолоскуте ПЭС/СО определяли полноценную перфузию сосудистой оболочки, которая сохранялась в течение всего периода диспансерного наблюдения вплоть до 1 года (рис. 3).
В связи со стабильностью перфузии в течение первого года динамического наблюдения инвазивное исследование ИЗАГ в последующем не проводили.
Обсуждение. Антиангиогенная терапия не устраняет основной этиологический фактор неоваскуляр-ной ВМД — хроническую ишемию сетчатки, индуцирующую неоваскуляризацию в хориокапиллярах. По мере элиминации ингибитора ангиогенеза из глаза патологическая концентрация эндотелиального сосудистого фактора роста в сосудистой оболочке восстанавливается, и патологический процесс возобновляется в виде рецидива ХНВ. Многократные рецидивы ХНВ могут осложняться обширным центральным субретинальным кровоизлиянием и субретинальным фиброзом в макулярной области [1, 8], в результате многократно повторяющегося лечения ингибиторами ангиогенеза может развиться тахифилаксия, проявляющаяся снижением эффективности антиангиогенной терапии [9]. Основным недостатком традиционной техники аутотранслокации ПЭС/СО «свободным лоскутом», применяемой при лечении указанных состояний, является непер-фузия перемещенного лоскута, из-за чего с течением времени достигнутый функциональный эффект утрачивается [10].
Использованная в нашем исследовании модификация операции в варианте «на питающей ножке» преследует цель устранения данного недостатка. В результате операции, так же как и при классической технике, из субретинального пространства удаляются все патологические субстраты: организовавшаяся кровь, рубцовая ткань, субретинальная неоваскулярная мембрана. Перемещение комплекса ПЭС/СО восстанавливает относительно нормальные анатомические взаимоотношения на уровне «хо-
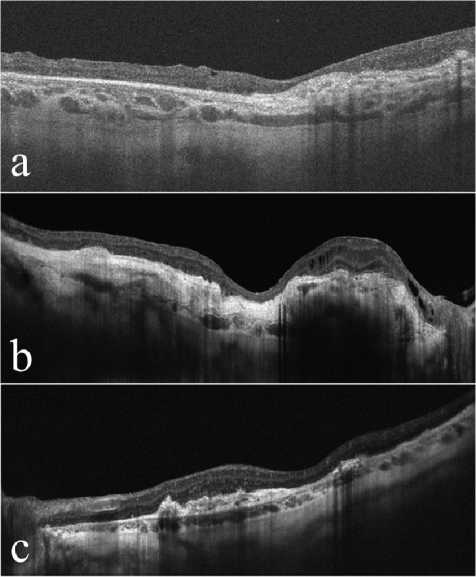
Рис. 2. Данные оптической когерентной томографии разных пациентов с рубцовой возрастной макулярной дегенерацией в различные сроки после аутотранслокации комплекса «пигментный эпителий — сосудистая оболочка»: a — через 12 месяцев; b — через 16 месяцев;
c — через 24 месяца риоидея — мембрана Бруха — ПЭС» в макулярной зоне, что в какой-то степени компенсирует недостаточность хориокапиллярного слоя и, следовательно, ишемию макулярной сетчатки. В отличие от классической техники, лоскут ПЭС/СО «на питающей ножке» сохраняет в своем основании связь с основной тканью сосудистой оболочки, что обеспечивает условия для стойкой перфузии пересаженного лоскута с ранних сроков после операции.
В настоящем исследовании в результате проведенного хирургического лечения удалось достичь повышения средней остроты зрения во всей группе пациентов, однако оно было незначимым. Эти результаты согласуются с данными литературы [10]. Причинами недостоверности повышения МКОЗ, по нашему мнению, являются, с одной стороны, небольшое число наблюдений и значительная дисперсия как исходных,
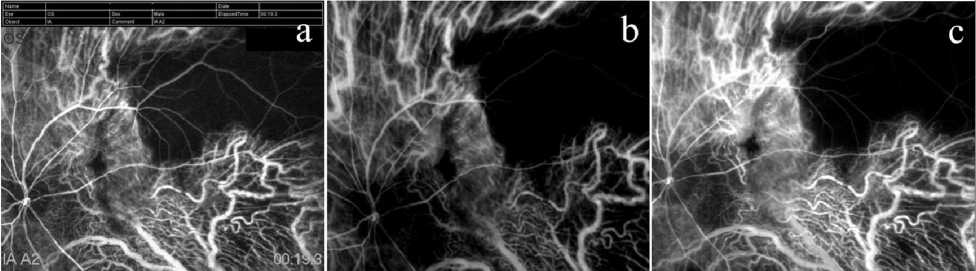
Рис. 3. Данные ангиографии с индоцианином зеленым в различные сроки после аутотранслокации комплекса «пигментный эпителий — сосудистая оболочка» по поводу рубцовой возрастной макулярной дегенерации:
a — через 1 месяц; b — через 6 месяцев; c — через 12 месяцев
так и конечных показателей, а с другой — формирование ПВР с отслойкой сетчатки в послеоперационном периоде в 50% случаев. Ни в одном случае с развившейся ПВР не наблюдали повышения остроты зрения к концу наблюдения по сравнению с исходными данными. И, напротив, во всех случаях без пролиферативных осложнений МКОЗ к концу наблюдения была выше, чем перед операцией.
По данным литературы, рецидив активности ХНВ после операции аутотранслокации комплекса ПЭС/СО встречается в 4%. В нашем исследовании признаков активности ХНВ не выявлено ни в одном случае до конца наблюдения, проведенное хирургическое лечение устранило показания к антиангиоген-ной терапии. Вероятнее всего, это связано с малым числом наблюдений в нашем исследовании.
Основной проблемой послеоперационного периода в нашем исследовании стала ПВР, развившаяся у половины пациентов. По данным литературы, частота развития данного осложнения при аутотранслокации ПЭС/СО «свободным лоскутом» составляет 12-46%. Возможной причиной повышения количества пациентов с ПВР в нашей группе пациентов явились особенности техники операции, а именно избыточная травматизация тканей в центральной зоне сетчатки, где, в отличие от классической методики, помимо удаления патологических субстратов, производится выкраивание лоскута ПЭС/СО.
Основным ограничением нашего исследования было малое число наблюдений. Продолжение данной работы, увеличение количества случаев, очевидно, приведет к совершенствованию техники операции и уменьшению доли пациентов с послеоперационными осложнениями и повышению значимости функциональных результатов.
Заключение. Аутотранслокация комплекса «ПЭС — хориоидея» при рубцовой стадии не-оваскулярной ВМД способна приводить к стойкому улучшению зрительных функций и устранению необходимости в дальнейшей антиангиогенной терапии. Модификация операции «на питающей ножке» с ранних сроков после операции обеспечивает стойкую перфузию в сосудистой оболочке перемещенного лоскута ПЭС/СО. Основным осложнением аутотранслокации комплекса ПЭС/СО «на питающей ножке» является развитие ПВР.
Список литературы Аутотранслокация комплекса "пигментный эпителий - хориоидея "на питающей ножке" при лечении рубцовой стадии неоваскулярной возрастной макулярной дегенерации
- Бойко Э.В., Сосновский С.В., Березин Р.Д. и др. Антиангиогенная терапия в офтальмологии. СПб.: ВМедА им. СМ. Кирова, 2013; 292 с.
- Klein R, Klein В, KnudtsonM,etal. Fifteen-year cumulative incidence of age-related macular degeneration: the Beaver Dam Eye Study. Ophthalmology 2007 Feb; 114(2): 253-62.
- Bikbov MM, Zainullin RM, Gilmanshin TR, et al. Prevalence and Associated Factors of Age-Related Macular Degeneration in a Russian Population: The Ural Eye and Medical Study. Am J Ophthalmol 2020 Feb; 210:146-57. 10.1016/j. ajo. 2019.10.004. DOI: 10.1016/j.ajo.2019.10.004
- Roomasa C, Raafay S, Saghar B, et al. Regression of Choroidal Neovascularization Results in Macular Atrophy in Anti-Vascular Endothelial Growth Factor-Treated Eyes. Am J Ophthalmol 2015; 159:9-19.
- Stewart MW. The expanding role of vascular endothelial growth factor inhibitors in ophthalmology. Mayo Clin Proc 2012; 87:77-88. 10.1016/j. mayocp. 2011.10.001. DOI: 10.1016/j.mayocp.2011.10.001
- Boulanger-Scemama E, Sayag D, Ha Chau Tran T, et al. Ranibizumab and exudative age-related macular degeneration: 5-year multicentric functional and anatomical results in real-life practice. J Fr Ophtalmol 2016; Oct; 39 (8): 668-74. 10.1016/j. jfo. 2016.06.001. DOI: 10.1016/j.jfo.2016.06.001
- Chong V. Ranibizumab for the treatment of wet AMD: a summary of real-world studies. Eye (Lond) 2016 Nov; 30 (11): 1526. 10.1038/eye. 2016.202. DOI: 10.1038/eye.2016.202
- De Silva SR, Bindra MS. Early treatment of acute submacular haemorrhage secondary to wet AMD using intravitreal tissue plasminogen activator, C3F8, and an anti-VEGF agent. Eye (Lond) 2016 Jul; 30 (7): 952-7. 10.1038/eye. 2016.67. DOI: 10.1038/eye.2016.67
- Eghoj MS, Sorensen TL. Tachyphylaxis during treatment of exudative age-related macular degeneration with ranibizumab. BrJ Ophthalmol 2012; 96: 21-3. 10.1136/bjo. 2011.203893. DOI: 10.1136/bjo.2011.203893
- Parolini B, Di Salvatore A, Pinackatt SJ, et al. Long-term results of autologous retinal pigment epithelium and choroid transplantation for the treatment of exudative and atrophic maculopathies. retina 2020 Mar; 40 (3): 507-20. 10.1097/IAE. 0000000000002429. DOI: 10.1097/IAE.0000000000002429


