Автоматизированный выбор параметров частотной фильтрации сигнала для мониторинга сенсорных вызванных потенциалов: пилотное исследование
Автор: Левин Е.А., Писарев Я.В., Мухина И.Г., Глушаева А.А., Кильчуков М.Г.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нейрохирургия
Статья в выпуске: 1 т.29, 2025 года.
Бесплатный доступ
Актуальность. Мониторинг соматосенсорных, зрительных и слуховых вызванных потенциалов используется для контроля сохранности соответствующих функций. Для своевременного выявления признаков их нарушения необходимо минимизировать временные интервалы между последовательными регистрациями вызванных потенциалов. Однако низкая амплитуда последних требует прибегать при их регистрации к усреднению, предполагающему длительное накопление десятков или сотен ответов на повторяемые стимулы. Частотная фильтрация улучшает соотношение сигнал/шум и уменьшает количество требуемых усреднений, но ее оптимальные параметры варьируют у разных пациентов, а их выбор требует значительного времени и высокой квалификации персонала. Цель. Разработать и апробировать методику автоматизированного подбора параметров частотной фильтрации сигнала на реальных данных интраоперационного мониторинга соматосенсорных и зрительных вызванных потенциалов и сравнить результаты автоматизированного подбора с выбором, сделанным нейрофизиологом во время операции. Методы. Методика реализована в созданной нами программе qt5-eeg-filters. Она загружает неотфильтрованные вызванные потенциалы, фильтрует их, используя заданный пользователем набор фильтров, сравнивает результаты фильтрации, учитывая воспроизводимость и амплитуды вызванных потенциалов, и выдает рекомендуемую полосу пропускания частотного фильтра. Неотфильтрованные вызванные потенциалы 23 пациентов (79 записей), которым выполняли интраоперационный мониторинг вызванных потенциалов с персонализированным подбором параметров фильтрации, были автоматически проанализированы с использованием 4 вариантов критерия оптимальности фильтра. Варианты получены комбинацией 2 параметров: способ оценки воспроизводимости вызванных потенциалов (только по характеристикам пиков (PV) или по отрезку кривой (CV)) и используемые значения амплитуд пиков (абсолютные (Abs) или относительные по сравнению с фоновыми колебаниями (Rel)). Для каждого варианта вычисляли коэффициенты корреляции предложенных программой параметров фильтрации с фактически выбиравшимися при интра¬операционном мониторинге и оценивали различия между ними. Предложенные фильтры оценивал нейрофизиолог по 5-балльной шкале для последующего сравнения 4 вариантов критерия оптимальности между собой. Для статистического анализа использовали непараметрические методы: корреляцию Спирмена и критерий Фридмана/Уилкоксона. Результаты. При критериях оптимальности типа AbsCV, RelCV и RelPV нижняя граница полосы пропускания была выше, чем выбранная нейрофизиологом при интраоперационном мониторинге: p = 0,00002, p = 0,00003 и p = 0,056 соответственно для зрительных вызванных потенциалов и p < 0,00001, p < 0,00001 и p = 0,00002 соответственно для сомато¬сенсорных. При этих же критериях верхняя граница полосы пропускания была ниже, чем выбранная при мониторинге: p = 0,00029, p = 0,00002 и p = 0,00037 соответственно для зрительных вызванных потенциалов и p < 0,00001, p < 0,00001 и p = 0,0002 соответственно для соматосенсорных. То есть при всех этих критериях программа предлагала применять более «агрессивную» фильтрацию, чем фактически использовал нейрофизиолог при интра¬операционном мониторинге (далее ИОМ-фильтр). При критерии оптимальности типа AbsPV однозначной тенденции не выявили; оценки качества как соматосенсорных, так и зрительных вызванных потенциалов, выбранных при этом критерии, были наихудшими. Лучшие оценки качества фильтров получили при использовании критерия RelCV для зрительных вызванных потенциалов (значимо не отличались от оценок для ИОМ-фильтра, p = 0,22) и AbsCV для соматосенсорных (были, тем не менее, хуже, чем для ИОМ-фильтра, p = 0,0025). И для зрительных, и для соматосенсорных вызванных потенциалов наблюдали положительные корреляции между оценками качества при использовании ИОМ-фильтра и фильтров, предложенных программой. Для зрительных вызванных потенциалов они составили 0,74 (p = 0,00014), 0,72 (p = 0,0003), 0,74 (p = 0,00016) и 0,56 (p = 0,019) при сравнении ИОМ-фильтра с фильтрами, полученными с использованием критериев RelCV, AbsCV, RelPV и AbsPV соответственно. Для соматосенсорных вызванных потенциалов соответствующие корреляции составили 0,23 (p = 0,085), 0,49 (p = 0,00014), 0,45 (p = 0,00050) и 0,57 (p = 0,00001). Во всех случаях, когда во время мониторинга имелись события, нарушавшие мониторируемую функцию, изменения вызванных потенциалов надежно идентифицировались при использовании как ИОМ-фильтров, так и фильтров, предложенных программой. Однако количество таких событий было недостаточным для статистического анализа. Заключение. С использованием набора данных, полученных при реальном интраоперационном нейромониторинге, продемонстрирована возможность автоматизированного подбора параметров частотной фильтрации сенсорных вызванных потенциалов. Перспективы развития метода связаны с распространением анализа на уровень ответов на единичные стимулы.
Вызванный потенциал, интраоперационный нейрофизиологический мониторинг, персонализированная медицина, соотношение сигнал/шум, частотная фильтрация сигнала
Короткий адрес: https://sciup.org/142243999
IDR: 142243999 | DOI: 10.21688/1681-3472-2025-1-47-60
Текст научной статьи Автоматизированный выбор параметров частотной фильтрации сигнала для мониторинга сенсорных вызванных потенциалов: пилотное исследование
Цитировать: Левин Е.А., Писарев Я.В., Мухина И.Г., Глушаева А.А., Кильчуков М.Г. Автоматизированный выбор параметров частотной фильтрации сигнала для мониторинга сенсорных вызванных потенциалов: пилотное исследование. Патология кровообращения и кардиохирургия. 2025;29(1):47-60. https://doi. org/10.21688/1681-3472-2025-1-47-60
How to cite: Levin E.A., Pisarev Ya.V., Mukhina I.G., Glushaeva A.A., Kilchukov M.G. Automated selection of signal frequency filtering parameters for monitoring sensory evoked potentials: a pilot study. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2025;29(1):47-60. (In Russ.)
E.A. Levin, https://orcid.
Ya.V. Pisarev, https://orcid.
I.G. Mukhina, https://orcid.
A.A. Glushaeva, https://orcid.
M.G. Kilchukov, https://orcid.
Сенсорными вызванными потенциалами (ВП) называют биоэлектрическую активность, регистрируемую от головного или спинного мозга или периферических нервов в ответ на стимулы той или иной модальности. Различают соматосенсорные ВП (ССВП), получаемые, как правило, при стимуляции чувствительных нервов конечностей или других периферических нервов электрическим током; зрительные (ЗВП), возникающие в ответ на световые стимулы, такие как вспышки света или резкие изменения изображения; и слуховые (в том числе акустические стволовые), вызываемые звуковыми стимулами. В последнее время сенсорные ВП широко используются не только в клинической диагностике, но и для продолжительного мониторинга состояния функционально значимых зон у пациентов, находящихся в бессознательном состоянии, в частности, при интраоперационном мониторинге (ИОМ), выполняемом во время нейрохирургических операций, протезирования аорты, нейроваскулярных и других вмешательств [1–3], а также при мониторинге функционального состояния центральной нервной системы в отделениях реанимации и интенсивной терапии [4]. Задачей нейрофизиологического мониторинга является выявление возникающего у пациента нарушения мониторируемой функции. На ранних этапах такие нарушения часто бывают обратимыми, поскольку во многих случаях функциональное нарушение предшествует анатомическому повреждению. При нейрохирургических операциях мониторинг сенсорных ВП помогает предотвратить или минимизировать осложнения, связанные с механическим, тракционным или термическим (от электрокоагуляции) повреждением нейральных структур. При операциях на сосудах (протезирование аорты, клипирование церебральных и спинальных аневризм, вмешательства по поводу артериовенозных мальформаций и др.) — осложнения, связанные с ишемическими повреждениями нервной системы. Так, при протезировании аорты мониторинг ССВП позволяет выявить необходимость реимплантации сегментарных артерий, при клипировании церебральных аневризм — определить положение клипсы, не приводящее к развитию ишемии. Во всех описанных ситуациях возможность предотвращения ятрогенных неврологических осложнений зависит от своевременности сообщения о возникшей дисфункции. А при плановом использовании мониторинга сенсорных ВП для выбора хирургической тактики время, необходимое для регистрации ВП, влияет на общую продолжительность операции. Таким образом, при мониторинге сенсорных ВП существует задача сокращения времени, необходимого для их регистрации, что позволяет регистрировать ВП с меньшими интервалами времени, а также улучшения качества регистрируемого сигнала для возможности выявления дисфункций на ранней стадии.
Однако решению этой задачи препятствует тот факт, что амплитуда регистрируемых сенсорных ВП, как правило, в разы или десятки раз ниже амплитуды фоновой (не связанной со стимулом) активности нервной системы и сторонних электромагнитных шумов. Поэтому для выделения сигнала (ВП) из шума применяется метод усреднения, требующий накопления нескольких десятков или сотен ответов на повторяемые стимулы. В результате получение сенсорных ВП может занимать до нескольких минут (учитывая, что нередко нужно записывать ВП с разных сторон, а иногда и нескольких модальностей). А слишком большие интервалы между последовательными проверками снижают эффективность мониторинга ВП. Для решения этой проблемы можно воспользоваться тем, что при ИОМ контрольными показателями являются не популяционные нормы, а собственные показатели пациента в начале операции, что позволяет использовать более «агрессивные» методы обработки сигнала, чем при стандартной амбулаторной регистрации сенсорных ВП. Одним из таких методов, помогающих значительно уменьшить количество усреднений, требуемых для получения сенсорных ВП, является частотная фильтрация записываемого сигнала, отсекающая внешние помехи и фоновую биоэлектрическую активность, существенно улучшая соотношение сигнал/шум [5–8]. Однако оптимальные параметры фильтрации сигнала значительно варьируют в зависимости от индивидуальных особенностей пациентов, влияния дооперационного неврологического дефицита, анестетиков и так далее, а выбор этих параметров требует значительного времени и высокой квалификации персонала.
Решением проблемы может быть автоматизация подбора рекомендуемых параметров частотной фильтрации сигнала. Мы создали программу, реализующую такую методику. Она загружает не-отфильтрованные ВП, фильтрует их, используя заданный пользователем набор фильтров верхних (ФВЧ) и нижних (ФНЧ) частот, сравнивает результаты фильтрации, используя критерий оптимальности, учитывающий воспроизводимость и амплитуду
ВП, и выдает пользователю рекомендуемую полосу пропускания частотного фильтра, а также информацию о значениях критерия оптимальности для каждой пары значений ФВЧ и ФНЧ.
Цель работы — апробация методики автоматизированного подбора параметров частотной фильтрации на реальныхданных ИОМ ССВП и ЗВП и сравнение результатов, получаемых при использовании различных вариантов вычисления критерия оптимальности между собой, а также с результатами оптимизации параметров частотной фильтрации ВП, выполненной интраоперационно опытным нейрофизиологом.
Методы
Сбор нейрофизиологических данных
Для анализа использовали необработанные данные ИОМ ЗВП и ИОМ ССВП, записанные во время плановых нейрохирургических операций в нейрохирургическом отделении НМИЦ им. ак. Е.Н. Мешал-кина. Отбор пациентов для записи у них данных не проводили, критерием включения был запланированный в соответствии с медицинскими показаниями ИОМ ВП, для каждой модальности записывали данные, полученные у последовательной серии больных. ИОМ во всех случаях также осуществляли в плановом порядке; во время его проведения, параллельно с регистрацией ВП, подвергавшихся обработке с выбранными нейрофизиологом параметрами, записывали неотфильтрованные данные ВП, что не влияло на ход мониторинга. Использование записанных во время ИОМ неотфильтрован-ных данных для последующего анализа в режиме офлайн одобрено решениями Локального этического комитета НМИЦ им. ак. Е.Н. Мешалкина (протоколы № 07-5 от 14.07.2023 г. и № 8 от 30.06.2017 г.). Поскольку данные анализировали ретроспективно в обезличенном виде, а запись данных во время плановых процедур не влияла на их ход, информированное согласие пациентов не требовалось.
Мониторинг во всех случаях выполняли с помощью системы ISIS IOM (Inomed Medizintechnik, Эммендинген, Германия) с программным обеспечением NeuroExplorer 4.4 того же производителя.
Обработка и анализ данных мониторинга вызванных потенциалов
Обработку и анализ зарегистрированных необработанных данных выполняли с помощью программного обеспечения qt5-eeg-filters , созданного Я.В. Писаревым. Техническое описание приведе-
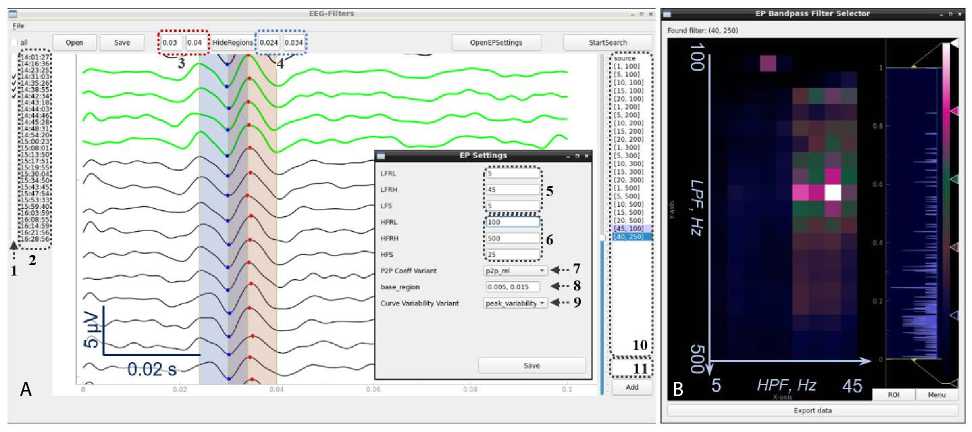
Рис. 1. Пользовательский интерфейс программы qt5-eeg-filters : A — основное окно, пример отфильтрованных соматосенсорных вызванных потенциалов. Пунктирными рамками и стрелками с числами отмечены основные элементы интерфейса; B — пример всплывающего окна с тепловой картой, представляющей коэффициенты оптимальности для всех проверенных сочетаний фильтров верхней (HPF) и нижней (LPF) частоты. В верхней строке — полоса пропускания фильтра, оцененного как оптимальный (40, 250). Результат получен при анализе вызванных потенциалов, представленных на панели А с указанными в окне EP Settings параметрами
Примечание к рис. 1, A. 1 — ряд чекбоксов для выбора треков, по которым следует выбирать оптимальный фильтр, 2 — обозначения треков (по времени записи), 3, 4 — пары окошек для задания границ интервалов поиска пиков (интервалы поиска и найденные экстремумы выделены соответствующим цветом в окне графиков), 5, 6 — поля для задания параметров поиска нижней и верхней (соответственно) границ полосы пропускания частотного фильтра, сверху вниз: нижняя граница интервала поиска, верхняя граница интервала поиска, шаг перебора, 7 — поле выбора варианта оценки межпиковой амплитуды; возможные варианты: p2p_abs — абсолютное значение разности, p2p_rel — относительное значение разности (способ вычисления этих показателей описан в тексте), 8 — поле для задания базового интервала для п. 7 (доступно только при выборе p2p_rel ), 9 — поле для выбора варианта оценки воспроизводимости треков; возможные варианты: peak_variability — по вариативности пиков, curve_variability — по вариативности треков (способ вычисления этих показателей описан в тексте), поля 5–9 находятся во всплывающем окне, вызываемом нажатием кнопки OpenEPSettings , 10 — окно для отображения и выбора частотных фильтров; показан набор предзаданных вариантов, варианты, находившиеся автоматически и задававшиеся вручную пользователем, 11 — поле для задания фильтра (нижней и верхней границ полосы пропускания) пользователем.
но в Приложении 1 , пользовательский интерфейс показан на рис. 1, А. Сохраненные неотфильтро-ванные записи ВП загружали из файла ASCII в программу qt5-eeg-filters , после чего задавали интервалы поиска основных негативного и позитивного пиков ВП (рис. 1, А). Затем отмечали 3–5 треков ВП для последующего определения на их данных оптимального фильтра. Как правило, выбирали несколько первых треков, соответствующих периоду перед началом операции или в начале этапа доступа. После этого в окне ввода модуля ep-bandpass-filter-selector (см. рис. 1, А) задавали диапазон и шаг перебора вариантов ФВЧ и ФНЧ и метод вычисления критерия оптимальности фильтра (см. ниже). Затем запускали поиск оптимального для заданных параметров фильтра, результаты которого отображались в окне вывода модуля ep-bandpass-filter-selector
(рис. 1, B). В этом окне показывались результаты вычисления критерия оптимальности для каждой пары ФВЧ и ФНЧ в виде тепловой карты, а для фильтра, определенного как оптимальный, отображались границы полосы пропускания в числовом виде. Отобранный программой фильтр использовали для отображения анализируемых ВП, результат оценивал нейрофизиолог (Л.Е.А.) по разработанной авторами 5-балльной шкале с точки зрения идентифицируемости и воспроизводимости основных пиков и волн ВП и возможности выявления начала сенсорной дисфункции (если такое событие имелось во время мониторинга) на отфильтрованной записи. Аналогичную оценку выполняли отдельно и для ВП, отфильтрованных с параметрами, которые применяли во время операции. Характеристики, соответствующие оценкам от 1 до 5, приведены в табл. 1.
Табл. 1. Критерии оценки качества треков вызванных потенциалов после применения частотной фильтрации
|
Оценка |
Идентифицируемость пиков |
Соотношение амплитуд пик/шум |
Вариативность амплитуд пиков |
Вариативность латентностей пиков |
Признаки возможной дисфункции, доступные для выявления * |
|
5 |
Однозначная, по |
> 10 |
Минимальная |
Минимальная |
↓ амплитуд и/или ↑ латентностей на единицы процентов** |
|
4 |
морфологии и/или амплитуде |
> 5 |
< 25 % |
< 5 % |
↓ амплитуд на > 30 % и/или ↑ латентностей на > 5 % |
|
3 |
Возможно сходство по морфологии |
> 2 |
< 50 % |
< 10 % |
↓ амплитуд на > 50 % и/или ↑ латентностей на > 10 %*** |
|
2 |
и амплитуде с соседними пиками |
< 2 |
> 50 % |
> 10–15 % |
Все или ничего*** |
|
1 |
Воспроизводимые пики |
не определяются |
Выявить невозможно |
||
Примечание. * — оценочно (в большинстве анализировавшихся записей дисфункции не выявлялись); ** — сообщение хирургам при унилатеральных изменениях; при изменениях для нескольких мониторируемых вызванных потенциалов — проверка системных параметров (изменялись ли глубина анестезии, температура, артериальное давление); *** — может требоваться повторная запись для подтверждения изменений.
Варианты критерия оптимальности частотного фильтра
В программе реализовано 4 варианта вычисления критерия оптимальности, определяющихся сочетанием 2 параметров, для каждого из которых имеется 2 опции. Первый параметр — способ определения межпиковой амплитуды: либо как разность между максимумом и минимумом (Abs), либо как отношение межпиковой амплитуды к среднему размаху амплитуд на «фоновом» интервале (Rel). Второй параметр — способ оценки воспроизводимости треков ВП. Для этой цели использовали обратное воспроизводимости понятие «вариативность». Последнюю определяли 2 способами: либо как вариативность пиков ВП (Peak Variability, PV), либо как вариативность треков ВП (Curve Variability, CV). В первом случае вычисляли средние для выбранного набора треков значения амплитуд и латентностей пиков ВП, для каждого из этих треков определяли отклонения (в процентах) этих значений от среднего, а затем вычисляли средневзвешенное значение модулей этих отклонений. Во втором случае попарные различия треков вычисляли как интеграл модуля разности между ними на заданном временном интервале, а затем вычисляли среднее для этих попарных различий. Получившиеся сочетания далее будут обозначаться как AbsPV, AbsCV, RelPV и RelCV.
Статистический анализ
Для сравнения вариантов вычисления критерия оптимальности вычисляли коэффициенты корреляции между фактически использовавшимися при ИОМ границами полосы пропускания частотного фильтра и рекомендованными на основе каждого из 4 вариантов критерия оптимальности, а также про- водили сравнение оценок, выставленных нейрофизиологом результатам фильтрации для каждого варианта. Сравнения выполняли отдельно для ССВП и ЗВП (корреляции для ЗВП не вычисляли, поскольку при ИОМ во всех анализировавшихся случаях, кроме одного, применяли одни и те же параметры фильтрации). Использовали непараметрические методы статистического анализа: коэффициент корреляции Спирмена и тест Фридмана/Уилкоксона для сопоставления фактически использовавшихся при ИОМ и выбранных программой фильтров и для сравнения оценок, выставленных нейрофизиологом результатам фильтрации. Коэффициенты значимости приведены с поправкой Бонферрони на множественные сравнения. Статистический анализ выполняли с помощью программы Statistica (TIBCO Software Inc., США).
Результаты
Собранные данные пациентов
Использовали необработанные данные мониторинга, записанные во время плановых нейрохирургических операций, выполнявшихся в январе – мае 2018 г. (собирались данные ЗВП) и в сентябре – октябре 2023 г. (собирались данные ССВП) в нейрохирургическом отделении НМИЦ им. ак. Е.Н. Мешалкина. Необработанные ССВП сохранили для 17 пациентов (55 конечностей), необработанные ЗВП — для 6 больных (12 глаз, 24 записи: ипси- и контралатеральное полушария для каждого из глаз). Характеристики пациентов приведены в табл. 2. Во всех случаях при мониторинге ВП использовали персонализированный подход. Его применение при мониторинге ЗВП подробно описали в недавней работе [8],
Табл. 2. Данные пациентов
Корреляции между характеристиками фильтров
В отношении ССВП для фильтров, фактически использовавшихся при ИОМ (далее ИОМ-фильтр) и выбранных при автоматическом анализе с разными критериями оптимальности, сопоставляли нижние и верхние границы полосы пропускания, а также оценки качества ВП. Для нижней границы полосы пропускания не получили значимых корреляций между ИОМ-фильтром и фильтрами, выбранными автоматически с любым из 4 критери- ев оптимальности. Для верхней границы полосы пропускания значимыми были корреляции между ИОМ-фильтром и фильтрами, полученными с критериями оптимальности RelPV и AbsPV (R = 0,39, p = 0,012 и R = 0,35, p = 0,034). Для оценок качества ССВП, полученных при фильтрации, корреляции с ИОМ-фильтром были значимыми для всех вариантов критерия оптимальности, кроме RelCV: R = 0,57, p = 0,0002; R = 0,45, p = 0,002 и R = 0,49, p = 0,0056 для AbsPV; RelPV и AbsCV соответственно. Для ЗВП корреляции с результатами использования ИОМ-филь-тра вычисляли только для оценок качества полученных в результате фильтрации ВП. Они оказались статистически значимыми для всех вариантов критерия оптимальности, при этом, в отличие от корреляций для ССВП, являлись максимальными для ВП, полученных с параметром CV, а не PV, и Rel, а не Abs. А именно: R = 0,74, p = 0,00014; R = 0,72, p = 0,0003; R = 0,74, p = 0,00016 и R = 0,56, p = 0,019 для RelCV; AbsCV; RelPV и AbsPV соответственно.
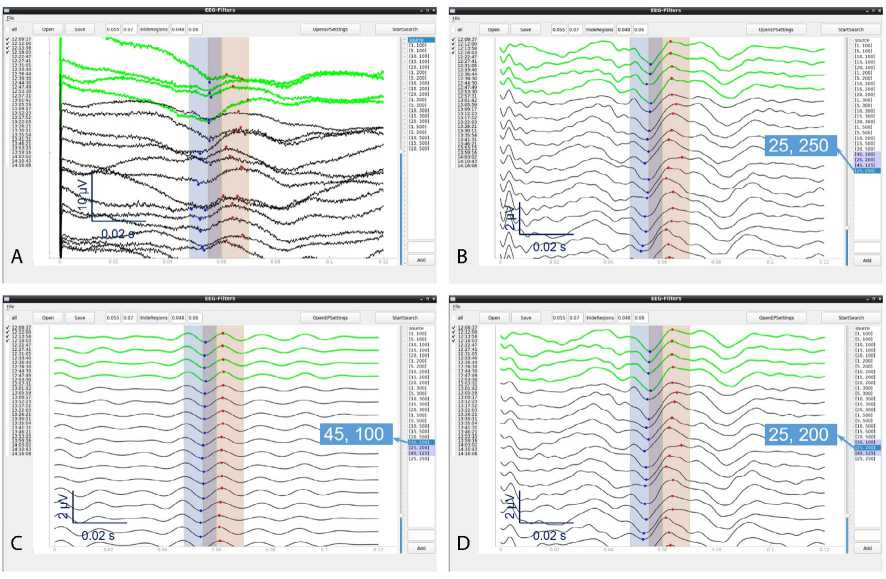
Рис. 2. Неотфильтрованные соматосенсорные вызванные потенциалы, фильтрация с используемыми при интраоперационном мониторинге параметрами и с параметрами фильтров, отобранных программой в качестве оптимальных: А — неотфильтрованные соматосенсорные вызванные потенциалы. Идентификация пиков практически невозможна, несмотря на то что каждый трек является результатом около 40 усреднений; B — результат фильтрации с параметрами, которые фактически использовали при интраоперационном мониторинге (полоса пропускания 25–250 Гц); C — результат фильтрации с параметрами, отобранными программой при критерии оптимальности, использующем абсолютные значения межпиковых амплитуд и вариативность треков на всем анализируемом участке (AbsCV, см. основной текст). Пример «сверхсглаживания»: за счет узкой полосы пропускания фильтра (45–100 Гц) достигнута очень хорошая воспроизводимость пиков, однако морфология последовательных пиков практически совпадает; D — результат фильтрации с параметрами, отобранными при критерии оптимальности, использующем вариативность пиков (AbsPV). Для соматосенсорных вызванных потенциалов использование этого критерия оптимальности наиболее часто приводило к результату автоматического выбора, сходному с фильтром, который использовали при интраоперационном мониторинге (в данном случае 25–200 Гц)
Групповые различия между характеристиками фильтров
Помимо корреляций, между вышеуказанными характеристиками оценивали групповые различия. Тест Фридмана выявил значимые различия и для верхних и нижних границ полосы пропускания частотных фильтров, и для оценок качества ВП как для ССВП (p < 0,00001, p < 0,00001 и p = 0,00001 соответственно (рис. 2)), так и для ЗВП (p < 0,00001, p < 0,00001 и p = 0,0015 соответственно (рис. 3); для ЗВП границы полосы пропускания ИОМ-фильтра в сравнение не включали). В связи с этим выполнили попарные сравнения с участием ИОМ-филь-тра и фильтров, рекомендованных программой qt5-eeg-filters. Результаты этих сравнений представлены в табл. 3. Кроме того, провели попарное сравнение результатов подбора фильтров с разными критери- ями оптимальности. Наиболее значимыми и проявившимися как для ССВП, так и для ЗВП оказались различия между характеристиками фильтров, выбиравшихся с использованием критериев оптимальности на основе вариативности пиков (PV) и вариативности треков (CV). При этом для ФВЧ частота среза при использовании CV была выше, а для ФНЧ, наоборот, ниже. Таким образом, использование CV для оценки оптимальности фильтра было во всех случаях связано со значимым сужением полосы пропускания рекомендованных программой фильтров по сравнению с использованием PV. Характерные различия результирующих ССВП для двух этих вариантов показаны на рис. 2, C, D. При этом фильтры, которые выбирал нейрофизиолог во время ИОМ (рис. 2, B), обычно оказывались ближе к варианту с PV (см. табл. 3).
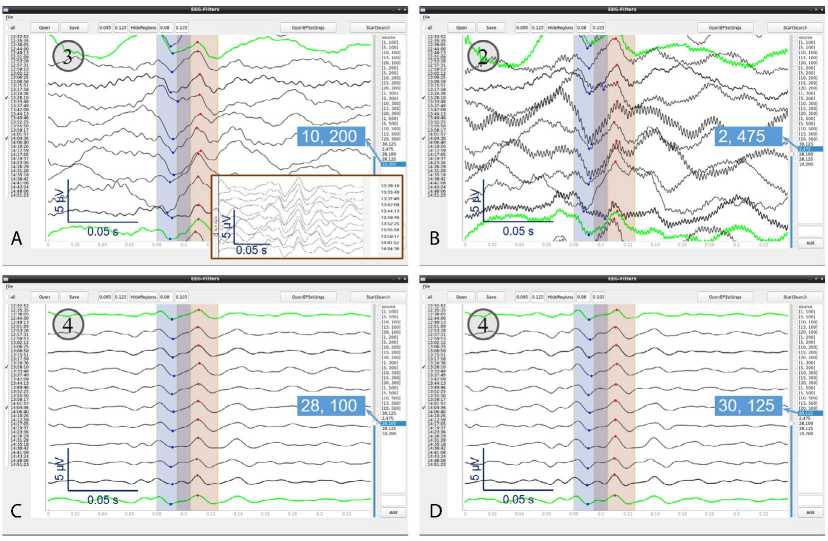
Рис. 3. Зрительные вызванные потенциалы, отфильтрованные с разными параметрами фильтрации, и оценки, которые выставлял им нейрофизиолог: A — зрительные вызванные потенциалы, отфильтрованные с полосой пропускания 10–200 Гц, которую использовали при интраоперационном мониторинге. На врезке для сравнения те же кривые с теми же (формально) параметрами фильтрации из окна анализа системы NeuroЕxplorer 4.4 (ISIS IOM); B — зрительные вызванные потенциалы, отфильтрованные с полосой пропускания 2–475 Гц (предложена программой при критерии оптимальности типа AbsPV); C, D — фильтрация зрительных вызванных потенциалов с полосой пропускания 28–100 и 30–125 Гц (предложена программой при критериях оптимальности типа RelCV и AbsCV соответственно) позволила получить лучше воспроизводимые треки, чем используемая при интраоперационном мониторинге, хотя и приводит к снижению амплитуд пиков зрительных вызванных потенциалов Примечание. Число в круге слева вверху на каждом графике — оценка, выставленная нейрофизиологом этим зрительным вызванным потенциалам по критериям, перечисленным в табл. 1.
Табл. 3. Сравнение результатов фильтрации с помощью фильтров, рекомендованных программой qt5-eeg-filters , и фильтра, который выбирал нейрофизиолог во время интраоперационного мониторинга
|
Характеристика |
ИОМ-фильтр |
Рекомендованные фильтры при критериях оптимальности |
|||
|
AbsCV |
AbsPV |
RelCV |
RelPV |
||
|
Соматосенсорные вызванные |
потенциалы |
||||
|
Фильтры верхних частот, Гц |
20 (20–20) |
45 (35–45) |
25 (17,5–40) |
45 (40–45) |
30 (20–45) |
|
p |
< 0,00001 |
0,003 |
< 0,00001 |
0,00002 |
|
|
Фильтры нижних частот, Гц |
300 (250–300) |
125 (100–162,5) |
225 (150–362,5) |
125 (100–150) |
150 (125–250) |
|
p |
< 0,00001 |
0,7 |
< 0,00001 |
0,0002 |
|
|
Оценка качества вызванных |
4 (3–5) |
3 (3–4) |
3 (3–4) |
3 (3–4) |
3 (3–4) |
|
потенциалов, балл |
p |
0,0025 |
0,00007 |
0,00024 |
0,00022 |
|
Зрительные вызванные потенциалы |
|||||
|
Фильтры верхних частот, Гц |
10 (10–10) |
26 (22–28) |
7 (3,5–18,5) |
28 (19,5–30) |
14 (7,5–22) |
|
p |
0,00002 |
0,69 |
0,00003 |
0,056 |
|
|
Фильтры нижних частот, Гц |
200 (200–200) |
100 (100–125) |
437,5 (162,5–500) |
100 (100–100) |
125 (100–131,25) |
|
p |
0,00029 |
0,0047 |
0,00002 |
0,00037 |
|
|
Оценка качества вызванных |
3 (3–4) |
3 (3–4) |
3 (2–3,25) |
3 (3–4) |
3 (3–4) |
|
потенциалов, балл |
p |
0,09 |
0,0086 |
0,22 |
0,14 |
Примечание. ИОМ-фильтр — фильтр, который выбирал нейрофизиолог во время операции; AbsCV, AbsPV, RelCV, RelPV — методы вычисления критерия оптимальности с использованием абсолютных (Abs) или относительных (Rel) межпиковых амплитуд и определения воспроизводимости ответов по показателям вариативности треков (CV) или пиков (PV); фильтры верхних и нижних частот — нижняя и верхняя границы полосы пропускания частотного фильтра соответственно. Данные представлены как медиана (Q1–Q3). Во второй строчке курсивом приведена статистическая значимость (по критерию Вилкоксона) различий между значениями соответствующего показателя при использовании ИОМ-фильтра и фильтра, рекомендованного программой с использованием метода определения критерия оптимальности, указанного в заголовке столбца.
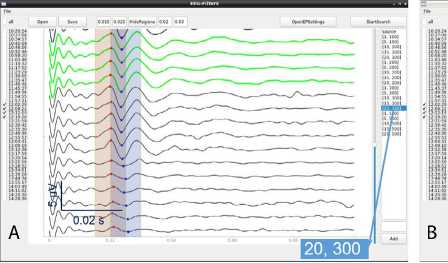
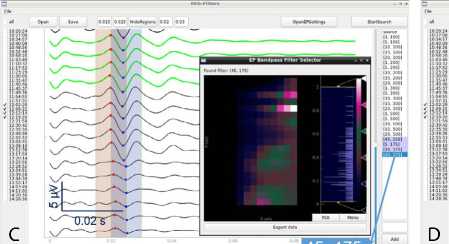
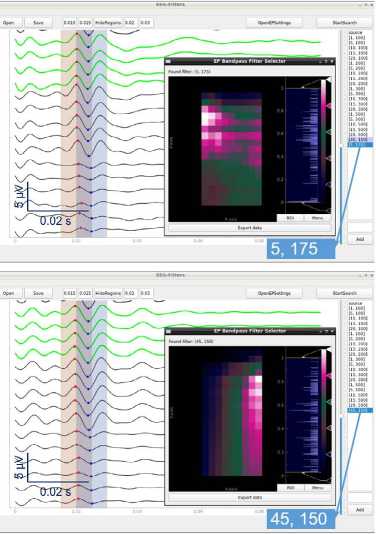
Рис. 4. Пример хорошей различимости интраоперационного нарушения соматосенсорной функции при значительно различающихся полосах пропускания частотного фильтра: A — соматосенсорные вызванные потенциалы, отфильтрованные с полосой пропускания 20–300 Гц, которую использовали при мониторинге; B — соматосенсорные вызванные потенциалы, отфильтрованные с полосой пропускания 5–175 Гц (предложена программой при критерии оптимальности типа AbsPV); C , D — соматосенсорные вызванные потенциалы, отфильтрованные с полосой пропускания 45–175 и 45–150 Гц (предложена программой при критериях оптимальности типа RelCV и AbsCV соответственно)
Примечание. На врезках (B–D) показаны тепловые карты критериев оптимальности для соответствующих вариантов их определения. Для AbsPV (B) и AbsCV (D) близким к оптимальному оказывается большой диапазон вариантов (см. цветовую шкалу справа от тепловой карты).
Возможность выявления начинающейся дисфункции
Качество ВП рассматривали выше с точки зрения ситуации стабильных условий регистрации, однако ключевой характеристикой качества мониторинга является возможность как можно раньше выявить признаки начинающейся дисфункции. Во всех таких ситуациях, а именно 1 случае при мониторинге ССВП (рис. 4) и 2 случаях при мониторинге ЗВП, моменты значительного снижения амплитуд и/или увеличения латентностей ВП определялись одинаково четко при всех вариантах использовавшихся в этих случаях фильтров. Одни и те же треки нейрофизиолог расценил как изменившиеся по сравнению с базовыми в достаточной мере для сообщения об этом хирургам. Для ЗВП моделью временной зрительной дисфункции можно считать также переход с внутривенной анестезии пропофолом к ингаляционной анестезии севофлураном, поскольку сево-флуран в значительно большей степени, чем пропофол, нарушает проведение по зрительным путям. В используемом наборе данных такой переход после закрытия твердой мозговой оболочки выпол- нялся по усмотрению анестезиологов в 4 случаях. Существенных различий между разными фильтрами в возможности выявлять изменения на ЗВП не обнаружили и в этой ситуации.
Обсуждение
Основной целью пилотного исследования была апробация возможности автоматического подбора частотного фильтра для улучшения качества мониторируемых ВП с точки зрения задач нейромониторинга. В целом полученные результаты свидетельствуют, что эта концепция вполне работоспособна. Несмотря на то что рекомендованные программой параметры фильтров могли значительно отличаться от тех, которые выбирал нейрофизиолог во время ИОМ (табл. 3, рис. 3, 4), результирующие треки ВП были как минимум приемлемого качества в большинстве случаев (за редкими исключениями, см. рис. 3, B), а нередко и превосходили по воспроизводимости варианты, выбранные при ИОМ (рис. 3, C, D; ср. с рис. 3, А). В то же время для ССВП на групповом уровне оценки качества получавшихся ВП были значимо хуже для автоматически выбран- ных фильтров, чем для подобранных нейрофизиологом во время ИОМ (табл. 3). Здесь, однако, может играть роль субъективный фактор, поскольку оценки в обоих случаях давал тот же человек, который выбирал параметры фильтрации во время ИОМ. В случае ЗВП различия с ИОМ-фильтрами были незначимы (кроме фильтров, выбиравшихся по критерию AbsPV), хотя ИОМ-фильтры имели в среднем несколько более высокие оценки, чем все остальные.
Обращают на себя внимание значительные различия параметров не только между фильтрами, выбранными при мониторинге и автоматически, но и между собой для фильтров, выбранных автоматически. Наибольшие различия были связаны с тем, использовалась при вычислении критерия оптимальности фильтра вариабельность пиков или вариабельность кривых (треков). Каждый из этих вариантов имеет свои недостатки. В первом случае при оценке результатов фильтрации программа может иногда «игнорировать» высокочастотный шум (рис. 3, B), затрудняющий как минимум визуальное восприятие треков ВП. Во втором программа склонна выбирать чрезмерно сглаживающие варианты фильтрации (рис. 2, C), в частности, выбирая максимальную из доступных частоту среза для нижней границы полосы пропускания. В этой ситуации и пики, и сами треки могут иметь отличную воспроизводимость, что, казалось бы, компенсирует значительное снижение амплитуд, однако соседние волны при этом часто оказываются практически неразличимы по морфологии. Это опасная ситуация, поскольку она сопряжена с риском пропустить тревогу в случае увеличения латентности на величину около длины волны. Возможно, избежать этих крайностей может помочь использование комбинированного показателя вариабельности. Высокочастотный шум реже игнорируется при использовании в критерии оптимальности относительной, а не абсолютной межпиковой амплитуды (ср. в табл. 3 значения ФНЧ в колонках AbsPV и RelPV). Однако определение относительной амплитуды требует от пользователя задания референтного «фонового» отрезка, что делает подбор фильтров более трудоемким.
Во всех случаях, когда при мониторинге происходили события, нарушавшие мониторируемую функцию, соответствующие изменения на ВП одинаково хорошо определялись при использовании ИОМ-фильтра и фильтров, предложенных программой. В то же время таких ситуаций было недостаточно для возможности статистического анализа. Кроме того, примененный подход «фильтрация после усреднения» (а не «усреднение после фильтрации»)
может быть недостаточно чувствительным для выявления различий в возможности детектировать начало развития дисфункции. Подробнее об этом сказано ниже. Тем не менее можно предположить, что основными характеристиками, определяющими качество ВП с точки зрения быстроты обнаружения признаков дисфункции, являются высокая воспроизводимость и идентифицируемость основных пиков (волн) ВП, позволяющие выявлять изменения на более ранних стадиях, чем традиционный [9; 10] критерий «10/50 %» (для увеличения латентно-сти/снижения амплитуды соответственно), использование которого критикуется в современных клинических рекомендациях по ИОМ [11]. Проверка этого предположения требует проведения исследования на массиве данных, записанных при наличии подтвержденных и точно определенных во времени интраоперационных воздействий, нарушавших мониторируемую сенсорную функцию.
К недостаткам исследования относятся его од-ноцентровый характер и использование оценок результатов фильтрации, данных одним нейрофизиологом. Для частичного преодоления этого недостатка была сделана попытка слепого оценивания, прямого сопоставления ВП, обработанных программой и записанных при ИОМ, а также формализации критериев оценивания. Тем не менее влияние субъективного фактора на выставляемые оценки полностью исключить нельзя. Для преодоления этого недостатка необходимо более крупное многоцентровое исследование с оцениванием результатов подбора фильтров несколькими нейрофизиологами, которые не участвовали в наборе данных.
Существенным недостатком работы является использование для анализа не ответов на единичные стимулы, которые бы фильтровались, а затем усреднялись, а ВП, являющихся результатом усреднения и подвергнутых фильтрации уже после него. В результате выполненный анализ не давал возможности сравнить эффективность фильтров непосредственно по целевому показателю — количеству усреднений, необходимых для получения ВП заданного качества, а использовал косвенную оценку — качество ВП при том же количестве усреднений. К сожалению, система ISIS IOM не сохраняет ответы на единичные стимулы и не выставляет метки о моментах их подачи на записываемую электроэнцефалограмму, в связи с чем мы не имели возможности применить подход «усреднение после фильтрации». Помимо указанного выше, если при записи ВП во время мониторинга используется избыточное количество усреднений, то остаточная мощность шумовых компонент оказывается очень малой. В результате этого показатели качества отфильтрованных ВП оказываются высокими на большом диапазоне частот (рис. 4, B, D), а коэффициент оптимальности в такой ситуации оценивает фактически только степень (не)подавления фильтром волн ВП. Заметим, однако, что в связи с применением во время мониторинга достаточно «агрессивной» фильтрации, а также практики досрочного завершения накопления усреднений при достижении достаточного качества ВП, в анализировавшейся выборке данные с избыточным числом усреднений встречались лишь в единичных случаях.
Наконец, поскольку точные характеристики частотного фильтра, применяемого в программе NeuroExplorer 4.4 системы ISIS IOM, являются закрытой информацией, нам, вероятно, не удалось подобрать полностью соответствующий им тип фильтра. В частности, имеются признаки, что фильтр в NeuroExplorer 4.4 имеет более крутой спад амплитудно-частотной характеристики на верхней границе полосы пропускания, чем применявшийся нами. Это приводит к неполному совпадению результатов фильтрации при задании одинаковых частот среза (см. врезку на рис. 3, А). Однако этот недостаток ограничивает только прямое сопоставление числовых характеристик фильтров, использованных при ИОМ и рекомендованных программой qt5-eeg-filters , но не возможность сравнения результатов фильтрации.
Перспективным направлением развития представленной методики может быть упоминавшийся выше переход от анализа уже усредненных данных к работе с ответами на каждый стимул (single-trial). Это даст возможность не только оптимизировать параметры фильтрации ВП непосредственно по целевой функции максимально быстрого получения ВП с заданными показателями качества, но и применять для этой цели методы, сфокусированные на анализе характеристик самих записываемых сигналов. Например, поиск оптимального фильтра методом Колмогорова – Винера [12], выбор полосы пропускания фильтра на основе изменений спектральной мощности в разных частотных диапазонах при увеличении количества усреднений [5], с помощью которого удавалось значительно ускорить регистрацию акустических стволовых вызванных потенциалов [6], и другие направляемые данными (data-driven) подходы, преимуществом которых является возможность поиска оптимального варианта без необходимости пользователю предварительно определять параметры этого поиска.
Заключение
Возможность автоматизированного подбора параметров частотной фильтрации сенсорных ВП продемонстрирована нами на наборе данных, полученных при реальном интраоперационном нейромониторинге с использованием ССВП и ЗВП. Несмотря на то, что выбиравшиеся автоматически границы полосы пропускания частотных фильтров, как правило, отличались от тех, которые выбирал нейрофизиолог во время ИОМ, качественные характеристики результирующих ВП были сопоставимыми. Для усовершенствования метода требуется более крупное многоцентровое исследование с независимой оценкой результатов подбора фильтров несколькими нейрофизиологами. Внедрение представленной методики в практику позволит шире применять персонализированный подход к мониторингу сенсорных ВП, который, в свою очередь, помогает увеличивать эффективность мониторинга в отношении предотвращения послеоперационных неврологических осложнений. Перспективы развития метода могут быть также связаны с совершенствованием способа вычисления критерия оптимальности фильтров и распространением анализа на уровень ответов на единичные стимулы.


