Азотные основания растений рода Berberis
Автор: Хомидов И.И.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 9 (76), 2020 года.
Бесплатный доступ
Изучен алкалоидный состав листьев Berberis densiflora Boiss. Из листьев хроматографичеким путем выделены алкалоиды берберин, □-аллокриптопин, оксиакантин, глауцин, таликмидин, изокоридин, О-метилкорипаллин, а также денсинин и денсиберин. Изучением спектральных данных и химических превращений установлено строение алкалдоидов денсинина и денсиберина. Все известные алкалоиды, кроме берберина, впервые выделены из растения данного вида, □-аллокриптопин и О-метилкорипаллин - из рода Berberis.
Химия, соединение, алкалоиды, растения, физиологически активные, гетероциклические, природные, бензилизохинолины
Короткий адрес: https://sciup.org/140253026
IDR: 140253026 | УДК: 004.02:004.5:004.9
Текст научной статьи Азотные основания растений рода Berberis
Введение. Применение барбарисов в медицине известно из глубокой древности. Великий врачеватель средневековья Абу Али Ибн Сина 1
использовал в своей практике плоды, листья, корни кишечных заболеваний, а также от заболеваний желчного пузыря и селезенки [1]. Растения рода Berberis L. (семейство Berberidaceae ) являются одними из широко распространённых на земном шаре. Названия их произошло от местности Берберия (Африка). На территории СНГ основное флористическое разнообразие сосредоточено в Средней Азии - 9 видов, на Кавказе встречается 3 вида, а в Сибири и на Дальнем Востоке - по 1 виду.
Материалы. Berberis densiflora Boiss. et Buhse (барбарис густоцветковый, сем. Berberidaceae ) - колючий кустарник, высотой 2-4 метра, произрастает в Закавказье, а также на юге Туркменистана [2] и является хорошим медоносом. Ранее из корней этого растения выделен берберин [3]. Авторами установлено, что содержания алкалоидов в надземной части растений выше в период начале вегетации и заметно снижается к периоду плодоношении [4]. Такая динамика алкалоидов сохраняется и в растениях рода Berberis .
Продолжая исследования растений рода Berberis , мы изучили алкалоидный состав листьев В.densiflora , собранных в фазу конец цветения на Юго-Западном Копетдаге, в ущелье Айдары (Туркменистан).
Методика эксперимента и обсуждение полученных результатов. Хлороформной экстракцией сырья получили 0.15% суммы оснований: 0.1% эфирной и 0.05% хлороформной. Хроматографированием на колонке с окисью алюминия из эфирной суммы выделили алкалоиды глауцин, таликмидин. изокоридин, оксиакантин, О-метилкорипаллин и денсинин ( 1 ), а из хлороформной суммы - берберин, в -аллокриптопин и денсиберин виде хлорида ( 2 ).
Денсинин (1) - основание нефенольного характера, кристаллизуется из спирта. УФ-спектр 1 имеет максимумы, характерные для замещенных р-фенетиламинов. В ИК-спектре наблюдаются полосы поглощения активного водорода при 3319 см-1, амиднокарбонильной группы и ароматического кетона при 1635 и 1673 см-1 соответственно. Масс-спектрометрический распад денсинина напоминает таковой N-ацетилгомовератриламина, выделенного из B.oblonga [5]. Анализируя масс-спектры β-фенетиламинов, установлено, что основным направлением их распада под электронным ударом является разрыв связи Сα–Сβ и Сα–N. Разрыв последней связи дает представление о заместителе при азоте.
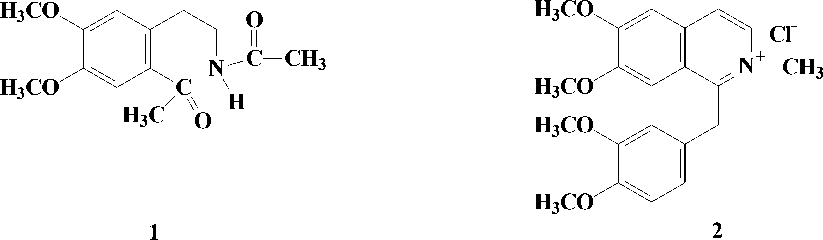
В случае денсинина наблюдается такой же распад с образованием ионов с m/z 194 (С а -С р ) и 206 (C a —N).
В ПМР-спектре денсинина, снятом в CDCI3, трехпротонный синглет при 1.86 м.д. принадлежит N-ацетильной группе, второй синглет в 3Н при 2.56 м.д. можно отнести к протонам СН3–СО–Аr -группы [6]. При 2.94 и 3.49 м.д. проявляются сигналы двух метиленовых групп, первый в виде двухпротонного триплета с 3J=6 Гц (H–C β ) и второй в виде двух однопротонных триплетов с 3J=6 Гц (Н–С α ) с общей интегральной интенсивностью в две протонные единицы. Проявление сигналов С– α протонов в виде двух триплетов можно объяснить заторможенной инверсией неподеленной пары электронов на азоте. Протоны двух метоксильных групп проявляются при 3.88 м.д. в виде шестипротонного синглета. В ароматической области спектра наблюдаются два однопротонных синглета от пара -расположенных ароматических протонов при 6.73 и 7.14 м.д. (Н-6, Н-3), а протон NH-группы дает широкий синглет при 6.66 м.д.
Вероятно, 1 представляет собой биогенетический предшественник простых изохинолиновых алкалоидов. Не исключен и альтернативный путь его биогенеза. Это соединение можно рассматривать как секотетрагидроизохинолин, т. е. окисленный продукт 1-метил-N-ацетилтетрагидроизохинолиновых алкалоидов. С этой точки зрения 1 является представителем изохинолиновых оснований секоизохинолинового типа.
В УФ-спектре денсиберина ( 2 ) имеются максимумы при 222, 256 и 317 нм. В масс-спектре пик молекулярного иона незначителен, а интенсивными являются пики ионов (М–1)+ и (М–16)+ с m/z 353 и 338 соответственно. В ПМР-спектре основания 2 , снятом в CDCI3, сигнал N-метильной группы проявляется более слабом поле при 4.49 м.д. в виде трехпротонного уширенного синглета. Это свидетельствует о четвертичности атома азота. В спектре имеются также сигналы четырех метоксильных групп и двухпротонный синглет метиленовой группы бензильной части молекулы. В ароматической области спектра обнаруживаются сигналы семи ароматических протонов. Два однопротонных дублета в слабом поле при 8.24 и 8.68 м.д. с КССВ J=6.0 характерны для протонов H-4 и Н-3 1-бензилизохинолиновых алкалоидов.
Мы синтезировали N-метилпапавериниодид с т.пл. 132-134° и пропусканием его через колонку, наполненную анионитом в С1-форме, получили N-метилпапаверинхлорид с т.пл. 154-156° из СН 3 ОН–(СН 3 ) 2 СО 1:1 и 156-157° из С2Н5ОН. Образовавшийся продукт оказался идентичным полученному нами природному соединению 2 .
Следует отметить, что восстановление 2 NaBH 4 в спирте дало продукт, идентичный лауданозину.
Экспериментальная часть. Разделение суммы алкалоидов.
Хлороформной экстракцией 1.07 кг листьев получили 1.61 г суммы оснований. 1.09 г эфирной суммы хроматографировали на колонке с окисью алюминия в соотношении 1:30. Элюирование проводили 4
хлороформом и смесью хлороформа с метанолом в различных соотношениях. Из хлороформных элюатов выделили 0.01 г глауцина, 0.16 г таликмидина, 0.09 г изокоридина и 0.02 г О- метилкорипаллина. Из фракций, элюированных смесью хлороформ-метанол (98:2) - оксиакантин (0.06 г) и денсинин (0.02 г).
Денсинин (1) - C 14 H 19 NО 4 , т.пл. 128-129° (ЕtОН).
УФ-спектр (EtOH, λ max , нм): 231, 274, 310.
ИК-спектр (KBr, ν , см-1): 3319, 1673, 1635, 1451, 1300.
Масс-спектр (ЭУ, 70 эВ; m/z ; 1 отн , %): 265(М+, 40), 206(100), 194(90), 192(70), 179(90), 164(50), 151(40), 149(40).
Хлороформную сумму (0.52 г) делили на колонке с 15 г силикагеля. При элюировании смесью хлороформа с метанолом в соотношении 96:4 выделили 0.01 г берберина в виде хлорида, 0.02 г β -аллокриптопина и 0.04 г денсиберина в виде хлорида.
Денсиберинхлорид (2) – C 21 H 24 N+О 4 , т.пл. 156-157° (ЕtOН).
УФ-спектр (ЕtOН, λ max , нм): 222, 256, 317.
Масс-спектр (ЭУ, 70 эВ; m/z ; I отн , %): 354(М+, 8), 353([М-1]+, 50), 340(15), 339(75), 338([М-16]+, 100), 325(25), 324(90), 151(60), 142(50).
ПМР (100 МГц; CDCI 3 , δ , м.д., J, Гц, 0-ГМДС): 3.74, 3.79, 3.96, 4.10 (по 3Н, с, 4OСН 3 ), 4.49 (3Н, уш.с, N+–CH 3 ), 5.05 (2Н, с, СН 2 ), 6.19 (1Н, д.д, J=9.0, 2.0, Н-6'), 6.65 (1Н, д, J=9.0, Н-5'), 6.95 (1Н, д, J=2.0, Н-2'), 7.46, 7.61 (по 1Н, с, Н-5, Н-8), 8.24, 8.68 (по 1Н, д, J=6.0, Н-4, Н-3).
Получение N-метилпапавериниодида . К 0.65 г папаверина добавили 4 мл МеОН и 2 мл CH 3 I. Реакционную смесь кипятили в течение 1.5 ч на водяной бане. При упаривании под вакуумом получили осадок (0.85 г), который кристаллизовали из смеси метанол-ацетон (1:1). Получили 0.63 г кристаллического N-метилпапавериниодида с т.пл. 132-134°.
Получение N-метилпапаверинхлорида. 0.5 г N-метилпапавериниодида растворили в 10 мл МеОН. Метанольный раствор пропустили через 5
колонку, наполненную 2 г анионита марки IRA-400 (С1-форма), приготовленного по методике. Получили 0.45 г. N-метилнапаверинхлорида. (выход-90%), т.пл. 154-156° (МеОН–(Ме) 2 СО, 1:1), 156-157° (EtOH). Полученный продукт идентичен 2 по температуре плавления смешанной пробы, а также по ТСХ (система хлороформ-метанол, 9:1, SiO 2 ).
Получение лауданозина. 35 мг 2 растворили в 2 мл спирта и добавили 0.1 г NаВН4. Реакционную смесь кипятили в течение 1 ч. После упаривания спирта остаток растворили в воде и обработали эфиром. Эфирное извлечение упарили, остаток кристаллизовали из спирта, получили продукт с т.пл. 89 - 90°, идентичный лауданозину (температура плавления смешанной пробы и ТСХ в системе С6Н5–С2Н5ОН 9:1 на слое Al2O3).
Заключение. Приведенные выше данные позволяют предположить, что 1 имеет структуру N,2-диацетил-4,5-диметокси- β -фенетиламина. Таким образом, денсинин ( 1 ) является представителем подгруппы 3-фенетиламиновых оснований с заместителем в положении 2.
Совокупность приведенных данных позволяет предположить, что основание 2 является N-метилным производным 1-бензилизохинолинового алкалоида папаверина.
Следовательно, денсиберин ( 2 ) является четвертичным алкалоидом N-метилпапаверинхлоридом и найден в природе впервые.
Список литературы Азотные основания растений рода Berberis
- Абу Али Ибн Сина.//Законы врачебной науки. -Ташкент. - 1965. - 38 стр.
- "Растительные ресурсы СССР". "Наука". Ленинград. - 1985. - 26 стр.
- Найдович Л.П., Васильева В.Д.//"Фармация". - 1976. - № 25. - 33 стр.
- Цыпышева И.П., Галкин Е.Г., Ковальская А.В., Петрова П.Р., Байкова И.П., Галин Ф.З., Федоров Н.И. // Журнал "Химия растительного сырья". - 2015. - № 3. - 65-69 стр.
- Каримов А., Левкович М.Г., Абдуллаев Н.Д., Шакиров Р. Ш.//Журнал "Химия природных соединений". - 1993. - №. - 424 стр.
- Наканиси К.//"Инфракрасные спектры и строение органических соединений". "Мир". - Москва. - 1965. - 164 стр.


