Bacillus megaterium 501RIF как антидот гербицида прометрина в посевах овса и кукурузы
Автор: Круглов Ю.В., Лисина Т.О., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агроэкология
Статья в выпуске: 3 т.55, 2020 года.
Бесплатный доступ
Использование гербицида прометрина - 4,6-бис-(изопропиламино)-2-метилтио-1,3,5-триазина для борьбы с сорняками на посевах сельскохозяйственных культур приводит к возникновению ряда агротехнологических и экологических проблем в связи с его относительно высокой персистентностью в окружающей среде. Предпринимаются попытки использовать для биоремедиации почв микроорганизмы. Особый интерес представляют споровые бактерии Bacillus megaterium , продуцирующие ряд физиологически активных веществ, повышающие эффективность фотосинтеза, стимулирующие рост и формирование генеративных органов растений, а также утилизирующие некоторые пестициды. В настоящей работе впервые показано, что культура B. megaterium 501rif снижает фитотоксичность гербицида и разлагает его в ризосфере овса и кукурузы. Целью работы было изучение приживаемости культуры Bacillus megaterium 501rif в ризосфере овса и кукурузы, оценка ее влияния на устойчивость растений к прометрину и эффективность разложения этого гербицида в почве. B. megaterium 501rif - мутант, устойчивый к антибиотику рифампицину, получен методом градиентного отбора из исходного штамма, выделенного нами из чернозема обыкновенного (Кокчетавская обл., Казахстан). Для проведения вегетационных опытов B. megaterium 501rif выращивали на ротационной качалке в течение 48 ч при 30 °С и 140 об/мин. Титр бактерий составлял 5½108 КОЕ/мл и включал не менее 90 % вегетативных клеток. Семена овса посевного ( Avena sativa L.) сорта Победа и кукурузы ( Zeal mays L.) сорта Росс 199 Мв инокулировали 2-суточной жидкой культурой B. megaterium 501rif, после чего высаживали в вегетационные сосуды объемом 2,0 кг. Почва - дерново-подзолистая, среднесуглинистая, c содержанием органического вещества 2,3 %, рНсол. 5,8. Гербицид прометрин в виде водной суспензии смачивающегося порошка («Panama Agrochemical Inc.», Панама) вносили в количестве 0,12; 0,22; 0,67 и 1,23 мг/кг в опыте с овсом и 3,4; 6,8 и 20,4 мг/кг в опыте с кукурузой. В последнем случае дополнительно был введен вариант с парующей почвой, содержащей прометрин (6,8 мг/кг). Контролем служили аналогичные варианты без инокуляции. Растения выращивали в световой камере Фитос-4 (ФГУП «Фитос», Россия) при температуре 22-25 °С. Сухую биомассу растений, содержание прометрина в почве и численность бактерий в ризосфере учитывали через 30 сут после появления всходов. Полевой опыт проводили в 2010 году на опытном поле Всероссийского НИИ сельскохозяйственной микробиологии (г. Пушкин, Ленинградская обл.). Почва - дерново-подзолистая среднесуглинистая, с содержанием органического углерода 2,3 %, рН 5,6. Гербицид прометрин вносился в верхний слой почвы на глубину 0-10 см в дозе 500 мг/м2, что соответствует 1,5 мг/кг. Семена кукурузы сорта Росс 199 Мв перед посевом инокулировали жидкой культурой B. megaterium 501rif с титром 5½108 КОЕ/мл. В контрольном варианте инокуляцию не проводили. Наземную массу растений и содержание гербицида в почве определяли спустя 30 сут после появления всходов. Бацилла B. megaterium 501rif хорошо приживалась в ризосфере овса и кукурузы. Численность бактерий составляла от 300 до 500 тыс. КОЕ/г почвы, причем от 58 до 80 % бактерий находилось в виде физиологически активных вегетативных клеток. При инокуляции культурой B. megaterium 501rif биомасса овса в варианте без гербицида возрастала на 11 %, кукурузы - на 20 %. Эффективность инокуляции увеличивалась на фоне прометрина. Существенно повышалась устойчивость растений к гербициду, содержание прометрина в почве под овсом снижалось в 2-3 раза, под кукурузой - в 20 раз. В полевых опытах через 30 сут после появления всходов масса растений кукурузы в контроле составляла 257±15 г/м2, при инокуляции B. megaterium 501rif - 287±20 г/м2. Содержание гербицида в почве в варианте с инокуляцией уменьшалось почти в 3 раза по сравнению с контролем (0,15±0,03 против 0,4
Протектор, антидот, прометрин, деградация гербицида, овес, кукуруза, биоремедиация почвы
Короткий адрес: https://sciup.org/142226310
IDR: 142226310 | УДК: 631.95:631.46 | DOI: 10.15389/agrobiology.2020.3.481rus
Текст научной статьи Bacillus megaterium 501RIF как антидот гербицида прометрина в посевах овса и кукурузы
Гербицид прометрин — 4,6-бис-(изопропиламино)-2-метилтио-1,3,5- триазин широко и эффективно применяется для борьбы с однолетними двудольными и злаковыми сорняками в посевах кукурузы, хлопчатника, сои, картофеля, а также овощных и зеленных культур (1, 2). Его персистентность (Т50) в почве в зависимости от дозы, почвенно-климатических условий и агротехнических приемов использования составляет от нескольких недель до 18 мес (3, 4). Длительное присутствие гербицида в почве обусловливает ряд проблем агротехнологического и экологического характера. С агрономической точки зрения они связаны прежде всего с чередованием сельскохозяйственных культур в севообороте. Имеется значительный риск снижения урожая и даже гибели чувствительных к гербициду растений, высеянных по предшественнику, обработанному прометрином. С экотоксикологи-ческой точки зрения следует отметить, что, несмотря на относительно низкую подвижность, прометрин и продукты его трансформации вымываются из почвы в окружающие водоемы, оказывая отрицательное влияние на водную растительность и подрывая кормовую базу гидробионтов (5, 6).
Основные факторы разложения гербицидов — физико-химические свойства почвы и микроорганизмы (6, 7). Из почвы выделены бактерии, использующие прометрин в качестве источника углерода (8), азота (9, 10) и серы (11). По данным Ю.В. Круглова с соавт. (12), в почве, инокулированной культурой Bacillus megaterium 501rif, наблюдалось ускоренное разложение гербицида. Некоторые штаммы B. megaterium продуцируют поли-бета-гидрокимасляную кислоту. Установлено, что обработка посевов препаратом, содержащим это вещество, повышает устойчивость растений к стрессам, включая некоторые пестициды (13). На основе B. megaterium созданы препараты, которые используются в растениеводстве для повышения урожая сельскохозяйственных культур (14, 15). Вместе с тем практически отсутствуют работы, в которых изучено влияние этих микроорганизмов на устойчивость растений к гербицидам, широко и повсеместно используемым в современных агротехнологиях.
В настоящем исследовании получены новые данные о последствиях инокуляции B. megaterium 501rif для растений в отношении их устойчивости к гербициду прометрину. Впервые показано, что культура B. megaterium 501rif снижает фитотоксичность гербицида и разлагает его в ризосфере овса и кукурузы.
Целью работы было изучение приживаемости культуры Bacillus megaterium 501rif в ризосфере овса и кукурузы, оценка ее влияния на устойчивость растений к прометрину и эффективность разложения этого гербицида в почве.
Методика . Вегетационные опыты проводили на экспериментальной базе ФГБНУ Всероссийского НИИ сельскохозяйственной микробиологии (г. Пушкин).
-
B. megaterium 501rif (мутант, устойчивый к антибиотику рифампицину) был получен методом градиентного отбора из исходного штамма, выделенного нами из чернозема обыкновенного (Кокчетавская обл., Казахстан). Исходный штамм депонирован в Коллекции непатогенных полезных микроорганизмов сельскохозяйственного назначения (ФГБНУ Всероссийский НИИ сельскохозяйственной микробиологии) (16).
-
B. megaterium 501rif выращивали на ротационной качалке в течение 48 ч при 30 ° С и 140 об/мин. Состав питательной среды был следующим (г/л): K 2 HPO 4 — 1,6; KH 2 PO 4 — 0,4; NH 4 NO 3 — 0,5; MgSO 4 — 0,2; CaCO 3 — 0,05; FeSO 4 — 0,025; дрожжевой экстракт — 0,2; сахароза — 10,0; рН 6,8. Титр бактерий составлял 5½108 КОЕ/мл (не менее 90 % вегетативных клеток).
Накопление поли-бета-гидроксимасляной кислоты (в виде гранул) в клетках B. megaterium 501rif исследовали методом фазово-контрастной микр-скопии (Axio Lab. A1, «Carl Zeiss», Германия).
Семена овса посевного ( Avena sativa L.) сорта Победа и кукурузы ( Zeal mays L.) сорта Росс 199 Мв инокулировали 2-суточной жидкой культурой B. megaterium 501rif, после чего высаживали в вегетационные сосуды объемом 2,0 кг. Почва — дерново-подзолистая среднесуглинистая, с содержанием органического вещества 2,3 %, рН сол. 5,8. Гербицид прометрин в виде водной суспензии смачивающегося порошка («Panama Agrochemical Inc.», Панама) вносили в количестве 0,0 (без гербицида), 0,12; 0,22; 0,67 и 1,23 мг/кг в опыте с овсом и 0,0 (без гербицида), 3,4; 6,8 и 20,4 мг/кг — с кукурузой. В последнем случае дополнительно был введен вариант с парующей почвой, содержащей прометрин (6,8 мг/кг). Почву тщательно перемешивали и расфасовывали. Контролем служили аналогичные варианты без инокуляции.
Растения выращивали в световой камере Фитос-4 (ФГУП «Фитос», Россия) при температуре 22-25 ° С. Влажность почвы составляла 50-60 % от полной влагоемкости. Повторность опыта 3-кратная.
Сухую биомассу растений, содержание прометрина в почве и численность B. megaterium 501rif в ризосфере овса и кукурузы учитывали спустя 30 сут после появления всходов. Количество бактерий определяли методом серийных разведений (17) на агаризованной минеральной среде указанного выше состава с добавлением 2,5 % агара («Difco», США) и 0,02 г/л антибиотика рифампицина. Для дифференцированного определения спор бактерий почвенную суспензию перед посевом на питательную среду пастеризовали 10 мин при 80 ° С. Гербицид экстрагировали из почвы ацетоном с последующим количественным определением на газовом хроматографе Цвет-106 (НПО «Химавтоматика», Россия) с термоионным детектором (18). Степень экстракции прометрина из почвы составляла 65-70 % от расчетного количества.
Полевой опыт проводили в 2010 году (опытное поле Всероссийского НИИ сельскохозяйственной микробиологии, г. Пушкин, Ленинградская обл.). Размер делянок — 1 м2, повторность 3-кратная. Почва — дерновоподзолистая среднесуглинистая, с содержанием органического углерода 2,3 %, рН 5,6. Гербицид прометрин вносили в верхний слой почвы на глубину 0-10 см в дозе 500 мг/м2, что, по данным анализа, соответствовало 1,5 мг/кг. Семена кукурузы сорта Росс 199 Мв перед посевом инокулировали жидкой культурой B. megaterium 501rif с титром 5½108 КОЕ/мл. В контрольном варианте инокуляцию не проводили. Наземную массу растений, содержание гербицида в почве и титр бактерий определяли спустя 30 сут после появления всходов.
Статистическую обработку данных проводили в программе Microsoft Excel. Рассчитывали средние значения показателей ( M ) и среднеквадратические отклонения (±SD). Достоверность результатов оценивали на уровне доверительной вероятности Р 0,95.
Результаты. В вегетационном опыте гербицид прометрин в количестве 0,12 мг/кг оказывал незначительное стимулирующее действие на рост овса. Биомасса растений по сравнению с вариантом без гербицида возрастала на 11 % (Р 0,05 ) (рис. 1). Дозы прометрина выше 0,22 мг/кг ингибировали рост растений, а при 1,23 мг/кг уже через 2 нед происходила их гибель.
Инокуляция семян овса культурой B. megaterium 501rif приводила к снижению фитотоксического эффекта прометрина и достоверному (Р 0,95 )
увеличению наземной массы растений по сравнению с контролем (без инокуляции) независимо от содержания гербицида в почве. Культура B. megaterium 501rif хорошо приживалась в ризосфере овса, причем от 58 до 80 % бактерий находилось в виде физиологически активных вегетативных клеток. Спустя 1 мес после появления всходов содержание прометрина в почве снижалось, при этом в опытном варианте, где семена инокулировали культурой бактерий, его было в 1,5-3,0 раза меньше, чем в контроле (табл.). Следовательно, B. megaterium 501rif оказывала протекторное действие на растения овса, повышая их устойчивость к гербициду, а также снижала содержание гербицида в почве, что, в свою очередь, уменьшало его фито-токсический эффект.
Аналогичное действие прометрин оказывал на кукурузу, однако ее устойчивость была на порядок выше, чем у овса (см. рис. 1). Ингибирующий эффект гербицида проявлялся при концентрации 20,4 мг/кг. Меньшие концентрации стимулировали рост растений. Инокуляция бактериями семян кукурузы полностью снимала фитотоксический эффект гербицида. При этом биомасса растений по сравнению с неинокулированными вариантами опыта возрастала в 1,5-3,0 раза (Р 0,95 ).
Бактерии B. megaterium 501rif прекрасно приживались в ризосфере растений, достигая численности 335 тыс. КОЕ г/почвы (см. табл.). Через 30 сут после всходов содержание гербицида в почве под кукурузой снижалось в 20 раз, а при инокуляции бактериями — в 60 раз по сравнению с парующей почвой. Следовательно, в деградации гербицида участвовали как растения, так и бактерии B. megaterium 501rif, присутствующие в ризосфере.
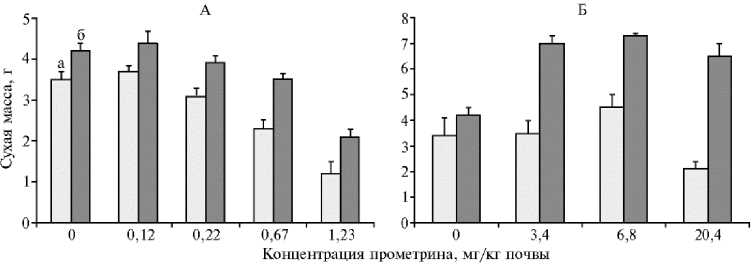
Рис. 1. Сухая масса растений овса посевного ( Avena sativa L.) сорта Победа (А) и кукурузы ( Zeal mays L.) сорта Росс 199 Мв (Б) под влиянием гербицида прометрина при инокуляции семян культурой Bacillus megaterium 501rif (30-е сут после появления всходов): а — контроль (без инокуляции), б — опыт (вегетационный опыт, вертикальные отрезки — среднеквадратические отклонения).
Содержание прометрина и бактериального инокулянта Bacillus megaterium 501rif в почве под овсом посевным ( Avena sativa L.) сорта Победа и кукурузой ( Zeal mays L.) сорта Росс 199 Мв (30-е сут после появления всходов) (вегетационный опыт, M ±SD)
|
Почва |
Прометрин, мг/кг |
B. megaterium 501rif, КОЕ тыс/г |
|||
|
исходное |
30-е сут |
||||
|
без инокуляции |
инокуляция семян B. megaterium 501rif |
общее число |
споры, % от общего числа |
||
|
Под овсом |
0,22±0,03 |
< 0,02 |
< 0,02 |
500±70 |
20,0 |
|
Под овсом |
0,67±0,04 |
0,59±0,02 |
0,18±0,03 |
550±65 |
27,0 |
|
Под овсом |
1,23±0,03 |
0,93±0,15 |
0,58±0,07 |
350±33 |
42,0 |
|
Под кукурузой |
6,80±0,05 |
0,22±0,02 |
0,07±0,02 |
335±40 |
12,0 |
|
Почва (без кукурузы) |
6,80±0,05 |
4,50±0,07 |
|||
Учитывая высокую эффективность деградации гербицида под по- кровом кукурузы, провели оценку влияния бактерий на накопление зеленой массы растений и деградацию прометрина в почве в условиях микроделя-ночного полевого опыта. Через 30 сут после появления всходов масса растений в контроле составляла 257±15 г/м2, в то время как при инокуляции B. megaterium 501rif — 287±20 г/м2, или на 12 % больше показателя в контроле. Разница между вариантами опыта практически отсутствовала. Содержание гербицида в почве в варианте с инокуляцией уменьшалось почти в 3 раза по сравнению с контролем — 0,15±0,03 против 0,45±0,10 мг/кг, что согласуется с результатами вегетационного опыта.
Рассматривая причины положительного эффекта B. megaterium 501rif, следует обратить внимание на то, что у инокулированных бактериями растений существенно изменяется архитектура корневой системы за счет более интенсивного развития боковых корней (19), ускоряется формирование генеративных органов (20), возрастает суммарное содержание фотосинтетических пигментов в листьях (21).
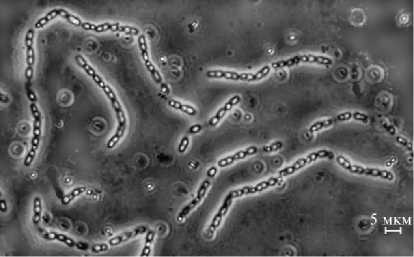
Рис. 2. Клетки Bacillus megaterium 501rif, наполненные гранулами поли-бета-гидроксимасляной кислоты (микроскоп Axio Lab. A1, «Carl Zeiss», Германия, фазовый контраст) .
Среди продуктов жизнедеятельности этих микроорганизмов обнаружены ауксины и витамины группы В (22), а также поли-бета-гидроксимасляная кислота (23-26), которые оказывали положительное влияние на формирование корневой системы растений и фотосинтез. Содержание поли-бета-гидроксимасяной кислоты в клетках B. megaterium составляло от 10 до 80 % от массы бактерий в зависимости от штамма и условий культивирования (2325). Полученный нами штамм
B. megaterium 501rif при росте на жидкой среде также интенсивно синтезировал и накапливал в вегетативных клетках гранулы поли-бета-гидрокси-масляной кислоты (рис. 2).
Результаты испытаний препарата Альбит (ООО «Научно-производственная фирма «Альбит», Россия), основным действующим веществом которого служит поли-бета-гидроксимасляная кислота, показали высокую эффективность его применения в посевах ряда сельскохозяйственных культур на фоне различных по химическому составу гербицидов (13, 27). А.К. Злотников с соавт. (13, 27) рассматривают Альбит как универсальный антистрессовый препарат, обладающий свойствами антидота по отношению к применяемым в сельском хозяйстве ядохимикатам. По мнению авторов, механизм его протекторного действия на растение связан прежде всего с положительным влиянием поли-бета-гидроксибутирата на фотосинтез. Исходя из этого, можно полагать, что протекторное действие B. megaterium 501rif на растения в наших опытах с высокой долей вероятности было связано с положительным эффектом продуктов жизнедеятельности бактерий, прежде всего поли-бета-гидроксимасляной кислоты.
Особый интерес представляют результаты опытов с кукурузой. Известно, что кукуруза поглощает и разлагает триазиновые гербициды. При этом значительную роль играют ферменты, участвующие в реакции гидроксилирования (28). Установлено, что при трансформации прометрина растением и микроорганизмами образуется значительное количество продуктов метаболизма, среди которых основное место занимают сульфоксид, сульфон, гидроксипропазин, а при последующей трансформации гидроксипропазина возможно образование амелина, амелида и циануровой кислоты. Продукты гидролиза и N-деалкилирования сим-триазинов образуют конъюгаты с глю-татионом и сахарами (6, 28).
До сих пор основное внимание исследователей было сосредоточено на изучении гербицидного эффекта прометрина и продуктов его трансформации (29). Имеется очень мало данных об их положительном действии на растения. Так, в опытах Е.В. Лебедева (30, 31) малые дозы прометрина повышали чистую продуктивность фотосинтеза, поглощение азота и фосфора сеянцами сосны обыкновенной и кедра сибирского. В работе H.M. Nadar с соавт. (32) наблюдалось стимулирующее действие сим-триазиновых гербицидов, включая метилтиопризводные (прометрин и аметрин), на рост каллуса сорго и синтез белка, на основании чего авторы пришли к выводу о гормональном кинин-подобном действии малых концентраций сим-триазинов на растение. Триазиновые гербициды оказывают влияние на ионный баланс растений и, соответственно, на синтез ДНК, белков и энзимов (33), поэтому не исключено, что высокая эффективность инокуляции кукурузы культурой B. megaterium 501rif на фоне прометрина обусловлена синергическим эффектом продуктов жизнедеятельности бациллы, гербицида и продуктов его трансформации.
Таким образом, инокуляция семян овса и кукурузы культурой Bacillus megaterium 501rif оказывала положительное влияние на рост растений. Причем эффективность инокуляции на фоне гербицида прометрина была выше, чем в контроле. Также повышалась устойчивость растений к промет-рину и ускорялось его разложение в ризосфере. Следовательно, культура бактерий B. megaterium 501rif и продукты ее жизнедеятельности, в частности поли-бета-гидроксимасляная кислота, служат протекторами, или антидотами, снимающими фитотоксический эффект прометрина. Показано, что кукуруза, инокулированная B. megaterium 501rif, в условиях вегетационного и микрополевого опытов проявила себя как биомелиорант, эффективно очищающий почву от прометрина. Это открывает перспективы для использования инокулированной бациллой кукурузы в биоремедиации загрязненной гербицидом почвы.
Список литературы Bacillus megaterium 501RIF как антидот гербицида прометрина в посевах овса и кукурузы
- Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. М., 2013.
- Новожилов К.В., Долженко В.И. Средства защиты растений. М., 2011.
- Koskinen W.C., Banks P.A. Soil movement and persistence of triazine herbicides. In: The triazine herbicides: 50 years revolutionizing agriculture /H.M. LeBaron, J.E. McFarland, O.C. Burnside (eds.). Elsevier BV, Amsterdam, Boston, Heidelberg, London, New York, Paris, San Diego, San Francisco, Sydney, Tokio, 2008: 355-385 ( ). DOI: 10.1016/B978-044451167-6.50027-1
- Scott M. Herbicide residues in soil and water. SMART train chemical notes 3, 2008.
- Risks of prometryn use to federally threatened California red-legged frog (Rana aurora draytonii). Pesticide effects determination environmental fate and effects. Division Office of Pesticide Programs Washington, D.C. 20460 6.17.2009.
- Мельников Н.Н., Волков А.И., Короткова О.А. Пестициды и окружающая среда. М., 1977.
- Charles S. Soil residual herbicides: science and management. In: Topics in Canadian weed science /R.C. Van Acker (ed.). Sainte-Anne-de Bellevue, Québec, Canadian Weed Science Society - Société canadienne de malherbologie, 2005, 3: 3-22.
- Игнатовец О.С., Леонтьев В.Н. Механизм деградации прометрина бактериями рода Pseudomonas. Доклады НАН Беларуси, 2008, 52(3): 82-86.
- Myśków W., Lasota T., Stachyra A. Cyanuric acid-a s-triazine derivate as a nitrogen source for some soil microorganisms. Acta Microbiologica Polonica, 1983, 32(2): 80-85.
- Cook A.M., Hütter R. Triazines as nitrogen sources for bacteria. J. Agric. Food Chem., 1981, 29(6): 1135-1143 ( ).
- DOI: 10.1021/jf00108a009
- Cook A.M., Hütter R. Ametryne and prometryne as sulfur sources for bacteria. Applied Environmental Microbiology, 1982, 43(4): 781-786 ( ).
- DOI: 10.1128/aem.43.4.781-786.1982
- Круглов Ю.В., Лисина Т.О. Интродукция в почву B. megaterium 501rif: факторы, влияющие на выживание, спорообразование и разложение гербицида прометрина. Сельскохозяйственная биология, 2014, 5: 107-112 ( ).
- DOI: 10.15389/agrobiology.2014.5.107rus
- Злотников А.К. Разработка и комплексная характеристика полифункционального препарата альбит для защиты растений от болезней и стрессов. Автореф. докт. дис. Пущино-Рамонь, 2011.
- Доросинский Л.М. Бактериальные удобрения - дополнительное средство повышения урожая. М., 1965.
- Chumthong A., Kanjanamaneesathian M., Pengnoo A., Wiwattanapatapee R. Water-soluble granules containing Bacillus megaterium for biological of rice sheath blight: formulation, bacterial viability efficacy testing. World J. Microbiol. Biotechnol., 2008, 24(11): 2499-2507 ( ).
- DOI: 10.1007/s11274-008-9774-7
- Гаврилова Е.А., Лисина Т.О., Круглов Ю.В. Штамм B. megaterium, предназначенный для деструкции фосфорорганических пестицидов. А.с. 1735359 А1. (РФ). Всесоюзный научно-исследовательский институт сельскохозяйственной микробиологии (РФ). №4781535. Заявл. 11.01.90. Опубл. 23.05.92. Бюл. 19.
- Методы почвенной микробиологии и биохимии /Под ред. Д.Г. Звягинцева. М., 1991.
- Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде /Под ред. М.А. Клисенко. М., 1983.
- López-Bucio J., Campos-Cuevas J.C., Hernández-Calderón E., Velásquez-Becerra C., Farías-Rodríguez R., Macías-Rodríguez L.I., Valencia-Cantero E. Bacillus megaterium rhizobacteria promote growth and alter root-system architecture through an auxin- and ethylene-independent signaling mechanism in Arabidopsis thaliana. Molecular Plant Microbe Interaction, 2007, 20(2): 207-217 ( ).
- DOI: 10.1094/MPMI-20-2-0207
- Лисина Т.О., Гаранькина Н.Г., Круглов Ю.В. Влияние интродуцируеых в почву микроорганизмов деструкторов пестицидов на рост и развитие растений. Прикладная биохимия и микробиология, 2001, 37(3): 374-378.
- Субботин А.М., Нарушко М.В., Петров С.А. Штамм микроорганизмов Bacillus megaterium 2-06-TS1 в качестве активатора фотосинтеза и энергии прорастания растений. Пат. 2627608 С1 (РФ). ФГБУН Тюменский научный центр СО РАН (РФ). № 2016125604. Заявл. 27.06.2016. Опубл. 09.08.2017, Бюл. № 22.
- Возняковская Ю.М. Микрофлора растений и урожай. Л., 1969.
- Otari S.V., Ghosh J.S. Production and characterization of the polymer polyhydroxy butyrate-co-polyhydroxy valerate by Bacillus megaterium NCIM 2475. Current Research Journal of Biology Sciences, 2009, 1(2): 23-26.
- Mohapatra S., Maity S., Dash H.R., Das S., Pattnaik S., Rath C.C., Samantaray D. Bacillus and biopolymer: prospects and challenges. Biochemistry and Biophysics Reports, 2017, 12: 206-213 ( ).
- DOI: 10.1016/j.bbrep.2017.10.001
- Mona K., Gouda A., Swellam A., Omar S. Production of PHB by a Bacillus megaterium strain, using sugarcane molаses and corn steep liquor as sole carbon and nitrogen source. Microbiology Research, 2001, 156(3): 201-207 ( ).
- DOI: 10.1078/0944-5013-00104
- Kofroňová O., Ptáčková L., Chaloupka J. Poly(3-hydroxybutyrate) granules of Bacillus megaterium. Folia Microbiologica, 1994, 39(2): 166-167 ( ).
- DOI: 10.1007/BF02906816
- Злотников А.К., Злотников К.М., Подварко A.Т., Балахоненков B.Е., Хрюкина Е.И. Альбит как антидот при сочетании с послевсходовыми гербицидами на сое. Земледелие, 2010, 3: 40-41.
- Simoneaux B.J., Gould T.J. Plant uptake and metabolism of triazine herbicides. In: The triazine herbicides. 50 years revolutionizing agriculture /H.M. LeBaron, J.E. McFarland, O.C. Burnside (eds.). Elsevier BV, Amsterdam, Boston, Heidelberg, London, NY, Paris, San Diego, San Francisco, Sydney, Tokio, 2008: 73-99 ( ).
- DOI: 10.1016/B978-044451167-6.50010-6
- Trebst A. The mode of action of triazine herbicides in plants. In: The Triazine herbicides. 50 years revolutionizing agriculture /H.M. LeBaron, J.E. McFarland, O.C. Burnside (eds). Elsevier BV, Amsterdam, Boston, Heidelberg, London, NY, Paris, San Diego, San Francisco, Sydney, Tokio, 2008: 101-110 ( ).
- DOI: 10.1016/B978-044451167-6.50011-8
- Лебедев Е.В. К вопросу о действии гербицида гезагарда (прометрина) на сеянцы сосны обыкновенной в условиях дерново-подзолистой почвы Нижегородского Заволжья. Известия Оренбургского аграрного университета, 2011, 4(32): 21-23.
- Лебедев Е.В. Влияние гербицида гезагарда (прометрина) на сеянцы лиственницы сибирской в условиях серых лесных почв центральной части Нижегородской области. Известия Оренбургского аграрного университета, 2012, 1(33): 23-26.
- Nadar H.M., Clegg M.D., Maranville J.W. Promotion of sorghum callus growth by the s-triazine. Plant Physiology, 1975, 56(6): 747-751 ( ).
- DOI: 10.1104/pp.56.6.747
- Ebert E., Dumford S.W., Van Assche C.J., Warwick D.D. Effects of triazine herbicides on the physiology of plants. In: Residue reviews. Residues of pesticides and other contaminants in the total environment (сontinuation of residue reviews), vol. 65 /F.A. Gunther, J.D. Gunther (eds.). Springer, New York, NY, 1976 ( ).
- DOI: 10.1007/978-1-4613-9413-6_1


