Бактериальный изолят из ризосферы картофеля (Solanum tuberosum L.), идентифицированный как Ochrobactrum lupini IPA7.2
Автор: Бурыгин Г.Л., Попова И.А., Каргаполова К.Ю., Ткаченко О.В., Матора Л.Ю., Щеголев С.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
При создании растительно-микробных ассоциаций in vitro для разработки систем экологически безопасного сельского хозяйства, основанных на замещении минеральных удобрений и пестицидов микробиологическими препаратами, и получения высококачественного оздоровленного посадочного материала особый интерес представляют бактериальные ассоцианты, выделяемые in situ непосредственно из растений и сред их обитания. Использование для их идентификации введенных в стандарт филогенетических маркеров - последовательностей генов 16S рРНК считается достаточно надежным, однако при этом следует принимать во внимание возникающие концептуальные и технические проблемы. Некоторые из них иллюстрирует представляемая работа, в которой приведены результаты молекулярно-генетических и физиолого-биохимических исследований бактериального изолята IPA7.2, выделенного нами из ризосферы картофеля ( Solanum tuberosum L.) сорта Невский. Отметим, что эта культура - один из объектов в изучении растительно-микробной ассоциативности в связи с совершенствованием технологий для получения высококачественного посадочного материала методом микроклонального размножения in vitro. Корректная видовая идентификации изолята основывалась на анализе систематики прокариот, состояние которой отражено в ряде обобщающих публикаций последних лет. В филогенетических конструкциях с близкородственными изучаемому изоляту штаммами родов Ochrobactrum, Brucella, Ensifer, Mesorhizobium, Rhizobium и др., полученных нами на основании сравнения последовательностей ДНК генов 16S рРНК, идентифицируемый изолят находился в непосредственном окружении представителей рода Ochrobactrum. При этом он оказался в составе таксономической группы Ochrobactrum anthropi - одной из 1912 зарегистрированных (по состоянию на ноябрь 2016 года) таксономических групп с 6193 видами прокариот, в каждой из которых сосредоточены виды с совпадающими (или почти совпадающими) последовательностями ДНК гена 16S рРНК (http://www.ezbiocloud.net/identify). В соответствии с концептуальными положениями, сформулированными в имеющихся публикациях, видовые различия внутри этих групп определяются иными молекулярно-генетическими (и физиолого-биохимическими) свойствами и с большой вероятностью связаны с горизонтальным переносом генов. С учетом совокупности результатов, полученных при сравнении свойств культур на основе полифазного подхода, выделенный нами штамм IPA7.2 ближе всего соответствует известному типовому штамму Ochrobactrum lupini LUP21. O. lupini LUP21 способен реинфицировать бобовые растения рода Lupinus и несет гены нодуляции и азотфиксации ( nodD и nifH ), полученные им от ризобиальных видов посредством горизонтального переноса. Это дает основание идентифицировать изучаемый изолят как Ochrobactrum lupini IPA7.2, который может оказаться перспективным бактериальным ассоциантом растений картофеля
Растительно-микробная ассоциативность, бактериальный изолят, таксономическая идентификация, 16s ррнк, полифазный подход, горизонтальный перенос генов
Короткий адрес: https://sciup.org/142214002
IDR: 142214002 | УДК: 633.49:632.3.01/.08:577.21:57.088 | DOI: 10.15389/agrobiology.2017.1.105rus
Текст научной статьи Бактериальный изолят из ризосферы картофеля (Solanum tuberosum L.), идентифицированный как Ochrobactrum lupini IPA7.2
Симбиозы микроорганизмов с растениями играют принципиальную роль в эволюции жизни и представляют большой фундаментальный и практический интерес для создания инновационных систем экологически безопасного сельского хозяйства, основанных на замещении минеральных удобрений и пестицидов микробиологическими препаратами (1). Среди форм симбиотических взаимодействий важное место занимают растительно-микробные ассоциации с участием свободноживущих почвенных (ри-зо)бактерий (plant growth-promoting rhizobacteria — PGPR или plant growthpromoting bacteria — PGPB), стимулирующих рост растений. Такие ассоциации обладают высоким потенциалом в качестве природного компонен-
Иммунофлуоресцентную микроскопию проводили в Центре коллективного пользования научным оборудованием Института биохимии и физиологии растений и микроорганизмов РАН «Симбиоз» (г. Саратов). Получение, секвенирование ДНК и сборка фрагментов выполнены в лаборатории микробиологии болотных экосистем Института микробиологии РАН (г. Москва) и в ЗАО «Евроген» (г. Москва).
та для современных агробиотехнологий (2-4). Хорошую перспективу имеет создание растительно-микробных ассоциаций in vitro на основе клеточных технологий с использованием смешанных культур клеток или тканей растений с бактериями категории PGPB для получения высококачественного оздоровленного посадочного материала сельскохозяйственных и декоративных растений с повышенной устойчивостью ex vitro к действию неблагоприятных условий окружающей среды (5-7). Число коллекционных культур бактериальных ассоциантов (5-7) достаточно велико, однако их выделение in situ непосредственно из растений и сред их обитания с последующей филогенетической идентификацией и оценкой перспектив использования в агробиотехнологиях по-прежнему представляет особый интерес.
Широко распространенные молекулярно-генетические методы, в том числе основанные на использовании введенных в стандарт филогенетических маркеров — последовательностей генов 16S рРНК (8), считаются достаточно надежными для решения подобных задач. При этом в ряде публикаций последних лет (9-11), более развернутое обсуждение которых может быть предметом отдельного обзора, анализируются возникающие концептуальные и технические проблемы в систематике прокариот, которые следует, по нашему мнению, принимать во внимание. В том числе возможно попадание изучаемого изолята в одну из таксономических групп с совпадающими (или почти совпадающими) последовательностями ДНК генов 16S рРНК .
Представляемая работа иллюстрирует некоторые из этих проблем и концепций на примере идентификации бактериального изолята, выделенного нами из ризосферы растений картофеля сорта Невский при скрининге штаммов для возможного использования в технологиях репродукции посадочного материала на основе микроклонального размножения in vitro (7).
Нашей целью было применение секвенирования гена 16S рРНК и полифазного подхода (10) для идентификации исследуемого штамма и прогнозирование его свойств как перспективного бактериального ассоцианта.
Методика . Изолят IPA7.2 был выделен в 2012 году из гомогената отмытых корней картофеля ( Solanum tuberosum L.) сорта Невский, произраставшего в 3 км юго-восточнее пос. Новопушкинское (Энгельсский р-н, Саратовская обл.; N 51°2Г28.04" E 46°9 ‘ 23.82"), на стадии начала формирования клубней. Бактерии выделяли на твердой безазотистой малатной среде NFb (N-free bromothymol blue medium) следующего состава (г/л): яблочная кислота — 3,8; K 2 HPO 4 •3H 2 O — 0,4; KH 2 PO 4 — 0,4; MgSO 4 • 6H 2 O — 0,2; NaCl — 0,1; Na2MoO4•12H2O — 0,002; FeSO4 (в хелатном комплексе с EDTA) — 0,02; агар-агар — 15 (рН доводили NaOH до 7,0), на которой в дальнейшем культуру поддерживали периодическим пересевом.
В экспериментах по определению физиолого-биохимических свойств изолята для оценки оптимальных значений температуры и рН изолят выращивали на жидкой среде NFb с добавлением 1 г/л NH4Cl в следующих режимах: при рН 7,0 и температуре 4 °С, 20 °С, 28 °С, 35 °С, 42 °С, 50 °С или 60 °С; при рН 4,0; 5,0; 6,0; 7,0; 8,0 или 9,0 и температуре 35 °С. Рост бактерий фиксировали по оптической плотности суспензии при X = 660 нм (спектрофотометр Specord S 300, «Analytik Jena AG», Германия). Активность уреазы (ЕС 3.5.1.5) определяли через 48 ч культивирования на среде с 2 % мочевины в качестве источника углерода (рН 6,8) в присутствии фенолового красного, восстановление нитратов — в тесте с реактивом Грисса после выращивания бактерий в течение 7 сут на среде NFb с добавлением KNO3 (2 г/л). О способности утилизировать различные органические соединения в качестве источника углерода и энергии судили по наличию ро-106
ста в 0,1 % пептонной воде с добавлением лимонной кислоты, глутамата натрия, маннита, d - глюкозы , мальтозы, сахарозы, глюконата, d - маннозы и глицерина (по 10 г/л) при рН 7.0.
Для специфической детекции изолята IPA7.2 на корнях растений использовали кроличьи поликлональные антитела, полученные к клеткам изучаемого штамма после фиксации 2 % глутаровым альдегидом (12), и флуоресцентно меченные антикроличьи антитела (Alexa Fluor® 532, «Invi-trogen», США). Трехсуточные проростки люпина белого ( Lupinus alba L.) и пшеницы ( Triticum aestivum L.) сорта Саратовская 29 инкубировали в бактериальной суспензии изолята IPA7.2 (106-108 кл/мл) в течение 1 сут, после чего растения 3 сут росли в стерильной воде. Иммунофлуоресцентную микроскопию проводили с помощью микроскопа из комплекта лазерного диссектора Leica LMD7000 («Leica Mikrosysteme Vertrieb GmbH», Германия) с использованием светофильтра ¹ 21 (545±12 нм).
Геномную ДНК штамма IPA7.2 экстрагировали из клеток, выращенных на твердой питательной среде, и очищали согласно описанию (13). Фрагменты ДНК гена 16S рРНК были подвергнуты ПЦР-амплифика-ции с использованием универсальных праймеров (529R, 350F и 1492R) и соответствующих протоколов. Полученная после сборки последовательность ДНК гена 16S рРНК штамма IPA7.2 (1403 п.н.) депонирована в GenBank под номером KU217325.
При выравнивании исходный набор гомологичных последовательностей ДНК гена 16S рРНК штаммов — представителей родов, близкородственных изоляту IPA7.2, составляли с применением технологии BLASTN ( EC=TargLociBlast). Кроме того, при отборе референтных штаммов для филогенетического анализа учитывалось их соответствие базе данных SILVA . Приведенные на этом сайте биоинформацион-ные ресурсы использовались нами для сравнения филогенетических конструкций, полученных традиционными методами и с помощью анализа на основе специально разработанных методов выравнивания последовательностей 16S рРНК (14). При сравнительном изучении последовательностей ДНК и РНК применяли алгоритмы попарного и множественного выравнивания: , и
Для построения филогенетического дерева по последовательностям 16S рРНК либо их генов применялись методы MrBayes и Neighbor Joining из интегрированного пакета программ филогенетического анализа MEGA v.6 . Эти построения выполняли по множественным выравниваниям, полученным с использованием алгоритма Clustal Omega и ресурса SINA Alignment Service , расположенного на портале SILVA .
Результаты. Отличительная особенность использованных в этой работе специальных методов выравнивания последовательностей заключается в возможности учитывать вторичную структуру молекул с помощью базового (затравочного) выравнивания на большом массиве данных для 16S рРНК прокариот (около 70 тыс. последовательностей; .
Бластинг последовательности ДНК гена 16S рРНК изолята IPA7.2 с использованием специализированной базы данных для последовательностей рибосомной РНК бактерий и архей, а также скрининг в базе SILVA показали, что наиболее близким к идентифицируемому изоляту по общему счету, оценке максимального сходства при применении технологии SILVA и проценту идентичности (табл. 1) был типовой штамм Ochrobac-trum lupini LUP21 (15). Анализ фрагментов попарного глобального и локального выравнивания последовательностей 16S рРНК у этих двух штаммов на участках с зарегистрированными различиями, которое мы выполнили двумя независимыми методами — в программе LALIGN и методом EzTaxon (19), показывает, что с точностью до введенных двух (см. рис. 1, А) и одной (см. рис. 1, Б) брешей в пределах полной длины 16S рРНК штамма IPA7.2 (1403 п.н.) обе последовательности практически совпадали (идентичность 99,9 %).
1. Члены таксономической группы Ochrobactrum anthropi (попарная идентичность с последовательностями 16S рДНК изолята > 98,65 %)
|
Типовой штамм |
Ссылка |
Источник выделения |
Идентификатор GenBank |
Идентичность, % |
Счет |
|
O . |
lupini LUP21 |
(15) |
Люпин Lupinus honoratus C.P. Sm. |
NR_042911 |
99,93 |
2586 |
|
O . |
cytisi ESC1 |
(16) |
Ракитник венечный Cytisus sco-parius (L.) Link |
NR_043184 |
99,86 |
2580 |
|
O . |
anthropi ATCC 49188 |
(17) |
Клинические пробы от человека |
NR_074243 |
99,86 |
2580 |
|
O . |
tritici SCII24 |
(18) |
Почва и ризоплана пшеницы Triticum aestivum L. |
NR_028902 |
99,57 |
2543 |
П р и м еч а ни е. Процент идентичности и счет указаны по результатам определения в BLASTN.

Рис. 1. Фрагменты глобального (А) и локального (Б) выравнивания последовательностей гена 16S рРНК идентифицируемого изолята IPA7.2 (i) и штамма Ochrobactrum lupini LUP21 (ii): 1 — метод O.S. Kim с соавт. (19), 2 — в программе LALIGN.
Однако согласно данным, полученным с использованием ресурса , оба штамма при этом попадают в состав одной из 1912 так называемых таксономических групп (Ochrobactrum anthro-pi) с 6193 видами прокариот, в каждой из которых объединены виды, представители которых имеют совпадающие (или почти совпадающие) последовательности ДНК генов 16S рРНК. Степень их консервативности оказалась столь высокой, что внутри каждой из указанных групп бактериальные виды фактически неотличимы друг от друга по этому признаку и не могут быть идентифицированы с помощью технологии на основе анализа 16S рРНК без привлечения результатов дополнительных генетических или физиологобиохимических исследований. Статья G.E. Fox с соавт. (20), вероятно, была одной из первых работ, в которой описан отмеченный феномен. Лежащая в его основе высокая консервативность последовательностей генов 16S рРНК приводит в этих случаях к своего рода «вырожденности» признака по отношению к процессам видообразования, контролируемым преимущественно 108
горизонтальным переносом генов (ГПГ) для прокариотов с открытым типом пангенома (9, 10). Подобные результаты, следовательно, могут служить указанием для выявления ксенологов в геномах изучаемых микроорганизмов, ответственных за характерные для вида фенотипические признаки (21). В этом смысле достаточно наглядны полученные нами результаты множественного (МВП, по методу MUSCLE, и попарного выравнивания последовательностей генов 16S рРНК для представителей таксономической группы O. anthropi: из десяти входящих в нее видов наиболее близко изучаемому изоляту по попарной идентичности последовательностей гена 16S рРНК, оцененной в программе BLASTN, соответствовали представители видов O. lupini, O. anthropi, O. tritici и O. cytisi. Указанная идентичность оказалась для них выше условной границы разделения видов 98,65 %, введенной недавно (22) (см. табл. 1).
Наши данные по МВП генов 16S рРНК для представителей таксономической группы O. anthropi и изучаемого изолята показали практическое совпадение (включая изолят IPA7.2) с точностью до четырех оснований в составе трех штаммов вида O. tritici и концевых брешей, не играющих существенной роли в таксономических оценках. Принимая во внимание результаты многочисленных исследований общей структуры генов 16S рРНК прокариот, обобщенных, к примеру, в работе O. Paliy с соавт. (23), можно допустить, что отмеченные различия, приходящиеся на область высокой консервативности гена 16S рРНК O. tritici (позиции 160-163), могут быть признаны незначительными (примерно 0,3 % общей длины) погрешностями секвенирования 16S рДНК штаммов O. tritici. Отметим также, что аналогичные результаты МВП в указанном случае получили при использовании методов MAFFT и TCOFFEE .
Из четырех штаммов группы O. anthropi (см. табл. 1) три относятся к категории почвенных бактерий, активно взаимодействующих с бобовыми растениями ( O. lupini LUP21, O. cytisi ESC1) или живущих на корнях пшеницы ( O. tritici SCII24), а один ( O. anthropi ATCC 49188) выделен из взятых у человека клинических проб (в большинстве случаев из крови). Поскольку межвидовой показатель идентичности генов 16S рРНК, определенный M. Kim с соавт. (22) в результате статистической обработки данных для 6787 геномов прокариот, принадлежащих 22 таксономическим группам, приходится на диапазон < 98,65 %, отнесение исследуемого изолята к одному из этих четырех видов только по этому признаку не представляется возможным, и для решения поставленной задачи мы использовали результаты дополнительных физиолого-биохимических исследований.
Таксономическое окружение исследуемого изолята как представителя порядка Rhizobiales на эволюционных расстояниях, достигающих межродовых значений, характеризуют филогенетические деревья (рис. 2), построенные с использованием МВП, которые мы получили двумя разными методами — Clustal Omega (рис. 2, А) и с применением веб-ресурса (см. рис. 2, Б). Сообщается (24), что разделению на межродовом уровне соответствует попарная идентичность последовательностей 16S рРНК и их генов в диапазоне ≥ 94,5 %. Из первоначального набора более 100 последовательностей (BLASTN, SILVA), удовлетворяющих этому требованию, мы отобрали 13 референтных образцов, удовлетворяющих следующим требованиям: они имелись у типовых штаммов, относились к категории полных последовательностей либо их длина составляла не менее 1380 п.н. Сравнение (см. рис. 2, А и Б) показывает, что общая топология получен- ных филогенетических конструкций практически совпадала (с точностью до эквивалентных взаимных расположений одних и тех же ветвей) в вариантах с выравниванием двумя независимыми методами при высокой статистической поддержке узлов (байесовская апостериорная вероятность). Наблюдаемая топология также воспроизводилась при использовании обоих МВП и метода Neighbor Joining (25) с поддержкой узлов 70-100 % (при 1000 циклах бутстрэппинга).
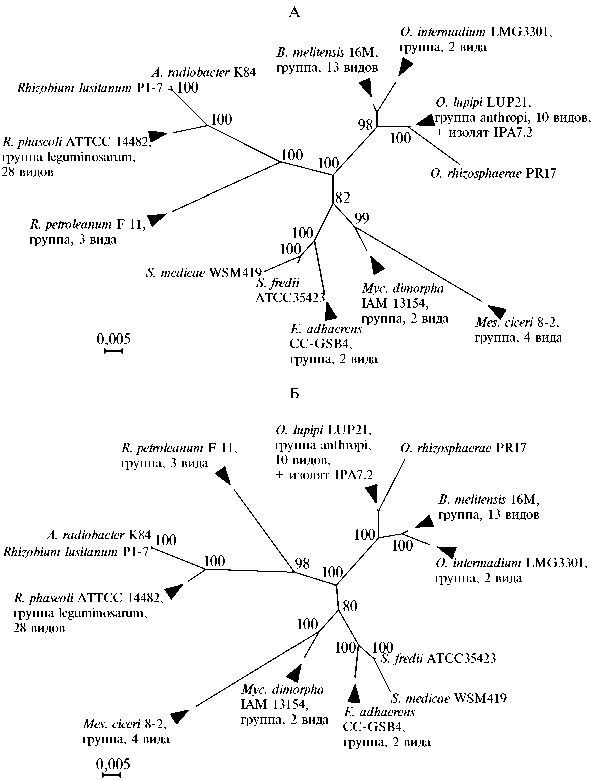
Рис. 2. Филограмма штаммов, близкородственных изоляту IPA7.2, построенная по методу MrBayes с множественным выравниванием последовательностей методом Clustal Omega (А) и по технологии SILVA (Б). Указаны сокращенные родовые названия Agrobacterium, Brucella, Ensifer, Meso-rhizobium, Mycoplana, Ochrobactrum, Rhizobium, Sinorhizobium. Цифрами показана статистическая поддержка узлов (байесовская апостериорная вероятность, %). Черными треугольниками обозначено попадание организмов с выявленными последовательностями 16S рРНК в состав соответствующих таксономических групп , число видов в которых варьирует от 2 до 28.
Среди исследованных объектов мы выявили 8 групп с практически идентичными, согласно условной границе (22, 26), последовательностями 16S рРНК (> 97 %, и числом видов от 2 до 28, объединяющих 64 бактериальных вида, что более чем в 5 раз расширяет фактический список видов, близкородственных IPA7.2 и входящих неявно в филогенетические деревья (см. рис. 2). Построения такого типа отражают фактически вклад сетевой составляющей в обобщенные филогенети-110
ческие конструкции (9), который проявляется вследствие существенного значения горизонтального переноса генов для процессов видообразования в пределах указанных таксономических групп. В использованном наборе последовательностей обнаруживается обособление трех кластеров (монофилетических групп), объединяющих представителей семейств Brucellaceae, Phyl-lobacteriaceae и Rhizobiaceae. Полученная кластеризация видов в целом согласуется с данными расширенных таксономических исследований порядка Rhizobiales по результатам полногеномного секвенирования ДНК штаммов .
Сведения о штаммах, составляющих ближнее таксономическое окружение IPA7.2, отраженные в аннотациях и ссылках в записях GenBank, выявляют широкий набор сред обитания этих бактерий — от ризосферы картофеля, почвенных образцов и растений риса до промышленных зон, сельскохозяйственных животных и клинических проб человека. Это свидетельствует о глубоких эволюционных связях исследуемого нами изолята с почвенной микрофлорой, присутствующей и функционирующей в весьма разнообразных экологических нишах: от участия в эндо- и эктосимбиоти-ческих отношениях с растениями, до выживания в агрессивных экологически неблагополучных средах. Отмечается также ряд эволюционных метаморфоз, приведших к весьма активному продвижению отдельных представителей рода Ochrobactrum в сторону установления его тесных взаимоотношений с миром животных (17).
А
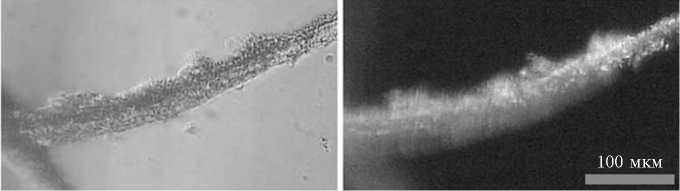
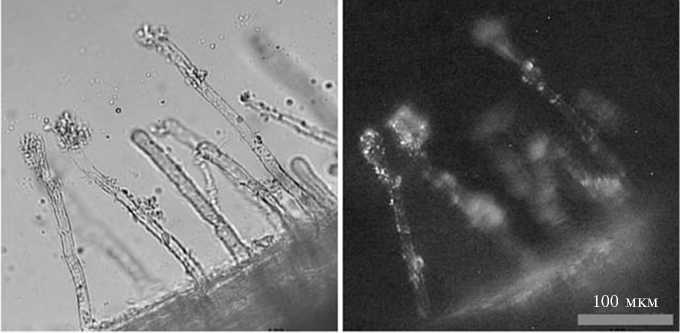
Рис. 3. Иммунофлуоресцентное выявление колонизации корней люпина белого ( Lupinus alba L.) (А) и пшеницы ( Triticum aestivum L.) сорта Саратовская 29 (Б) идентифицируемым изолятом IPA7.2 (Leica LMD7000, «Leica Mikrosysteme Vertrieb GmbH», Германия).
Для обоснованного соотнесения штамма IPA7.2 с тем или иным видом внутри таксономической группы Ochrobactrum anthropi (см. табл. 1) потребовались дополнительные физиолого-биохимические исследования. Рассмотрение набора фенотипических, хемотаксономических и расширенных генотипических характеристик штаммов, повышающее надежность описания новых таксонов (как и идентификацию изолятов среди существующих), называют полифазным подходом (10). Учитывая принадлежность большинства рассматриваемых представителей группы Ochrobactrum anthropi к категории почвенных бактерий, активно взаимодействующих с растениями, мы оценили способность штамма IPA7.2 к колонизации корней люпина и пшеницы — макропартнеров в симбиозе (ассоциации) с растениями для представителей видов O. lupini и O. tritici. Результаты иммунофлуоресцент-ного выявления клеток IPA7.2 на корнях этих растений иллюстрирует рисунок 3. В серии экспериментов было установлено, что клетки IPA7.2 колонизируют как корни, так и корневые волоски люпина и пшеницы в составе многоклеточных образований (микроколоний или биопленок). При этом отмечалось активное заселение штаммом IPA7.2 поверхности корней обоих растений, что указывает на отсутствие у бактерий специфичности по отношению к растению-хозяину.
Мы установили высокую биохимическую активность изолята IPA7.2, проявляющуюся в способности к росту на среде с малатом, цитратом, глутаматом, маннитом, D-глюкозой, мальтозой, сахарозой, глюконатом и D-маннозой, но не глицерином (лучшие ростовые характеристики отмечали на средах с органическими кислотами), на безазотистой среде NFb при многократных пересевах, а также в широком диапазоне температур (от 4 до 42 °С с оптимумом при 35 °С) и рН (от 5,0 до 10,0 с оптимумом при pH 7,0). Выявленный оптимум pH близок к интервалу значений (pH 7-9), наиболее благоприятному для роста культур O. lupini LUP21.
2. Биохимические характеристики изолята IPA7.2 и близкородственных штаммов из таксономической группы Ochrobactrum anthropi (попарная идентичность с последовательностями 16S рДНК изолята > 98,65 %)
|
Признак |
IPA7.2 |
O. lupini LUP21 |
O. anthropi ATCC 49188 |
O. tritici SCII24 |
O. cytisi ESC1 |
|
Нитратредукция |
- |
- |
+ |
+ |
+ |
|
Продукция урезы |
|||||
|
через 48 ч |
+ |
+ |
+ |
+ |
- |
|
Ассимиляция: |
|||||
|
глюконата |
+ |
+ |
+ |
+ |
- |
|
цитрата |
+ |
+ |
- |
- |
+ |
|
D-маннозы |
+ |
+ |
+ |
- |
+ |
|
Примечание. |
«+» и « - |
» — соответственно наличие или отсутствие активности. |
|||
При сравнении изолята IPA7.2 и представителей группы Ochrobactrum anthropi (табл. 2) оказалось, что по биохимическим свойствам, а также по общему счету в бластинге, оценке максимального сходства по технологии SILVA и установленным процентам идентичности (см. рис. 1, табл. 1) IPA7.2 наиболее близко соответствует штамму O. lupini LUP21. Отметим, что O. lupini LUP21 — типовой штамм, он способен реинфицировать бобовые растения рода Lupinus и несет гены нодуляции и азотфиксации ( nodD и nifH ), полученные от ризобиальных видов посредством горизонтального переноса (15).
С учетом совокупности элементов полифазного подхода (10) выделенный нами штамм IPA7.2 ближе всего подходит к виду O. lupini и на текущем этапе исследований может быть идентифицирован как O. lupini IPA7.2. На этом основании можно считать целесообразным продолжение его изучения в качестве потенциального ассоцианта (инокулята) в работах по усовершенствованию технологий микроклонального размножения растений в культурах in vitro (7).
Таким образом, выполненные филогенетические исследования по- казали, что непосредственное таксономическое окружение изолята IPA7.2 составляют представители рода Ochrobactrum. Биоинформационный анализ выявил принадлежность IPA7.2 к одной из таксономических групп прокариот, в каждой из которых сосредоточены виды с совпадающими или почти совпадающими последовательностями ДНК гена 16S рРНК (группа Ochrobactrum anthropi с 10 видами рода). В совокупности с физиолого-биохимическими тестами полученные результаты биоинформационного анализа позволяют идентифицировать исследуемый изолят как Ochrobactrum lupini IPA7.2. Наличие у типового представителя этого вида — O. lupini LUP21 генов нодуляции и азотфиксации (nodD и nifH) позволяет прогнозировать у выделенного нами изолята IPA7.2 свойства бактериального ас-социанта, что, однако, требует специального изучения.
Авторы выражают благодарность С.Н. Дедыш за содействие в проведении молекулярно-генетических исследований и Ю.М. Серкебаевой за помощь в определении последовательности ДНК гена 16S рРНК. Мы также искренне признательны профессору д-ру Frank Oliver Glockner за ценные замечания относительно использования ресурса
Список литературы Бактериальный изолят из ризосферы картофеля (Solanum tuberosum L.), идентифицированный как Ochrobactrum lupini IPA7.2
- Тихонович И.А., Проворов Н.А. Симбиозы растений и микроорганизмов: молекулярная генетика агросистем будущего. СПб, 2009.
- Bloemberg G.V., Lugtenberg B.J.J. Molecular basis of plant growth promotion and biocontrol by rhizobacteria. Cur. Opin. Plant Biol., 2001, 4(4): 343-350 ( ) DOI: 0.1016/S1369-5266(00)00183-7
- Vessey J.K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil, 2003, 255(2): 571-586 ( ) DOI: 10.1023/A:1026037216893
- Bashan Y., de-Bashan L.E., Prabhu S.R., Hernandez J.-P. Advances in plant growth-promoting bacterial inoculant technology: Formulations and practical perspectives (1998-2013). Plant Soil, 2014, 378(1-2): 1-33 ( ) DOI: 10.1007/s11104-013-1956-x
- Bensalim S., Nowak J., Asiedu S.K. A plant growth promoting rhizobacterium and temperature effects on performance of 18 clones of potato. Am. J. Potato Res., 1998, 75(3): 145-152 ( ) DOI: 10.1007/BF02895849
- Волкогон В.В., Димова С.Б., Мамчур А.Е. Особенности взаимоотношений бактерий рода Azospirillum с растениями картофеля, культивируемыми in vitro. Сiльськогосподарська мiкробiологiя (мiжвiдомчий тематичний науковий збiрник, Чернiгiв, Україна), 2006, 3: 19-25.
- Tkachenko O.V., Evseeva N.V., Boikova N.V., Matora L.Yu., Burygin G.L., Lobachev Yu.V., Shchyogolev S.Yu. Improved potato microclonal reproduction with the plant growth-promoting rhizobacteria Azospirillum. Agron. Sustain. Dev., 2015, 35(3): 1167-1174 ( ) DOI: 10.1007/s13593-015-0304-3
- Woese C.R. Bacterial evolution. Microbiol. Rev., 1987, 51(2): 221-271.
- Кунин Е.В. Логика случая. О природе и происхождении биологической эволюции. М., 2014.
- Oren A., Garrity G.M. Then and now: a systematic review of the systematics of prokaryotes in the last 80 years. Antonie van Leeuwenhoek, 2014, 106: 43-56 ( ) DOI: 10.1007/s10482-013-0084-1
- Chun J., Rainey F.A. Integrating genomics into the taxonomy and systematics of the Bacteria and Archaea. Int. J. Syst. Evol. Micr., 2014, 64(2): 316-324 ( ) DOI: 10.1099/ijs.0.054171-0
- Матора Л.Ю., Шварцбурд Б.И., Щеголев С.Ю. Иммунохимический анализ О-специфических полисахаридов почвенных азотфиксирующих бактерий Azospirillum brasilense. Микробиология, 1998, 67(6): 815-820.
- Dedysh S.N., Panikov N.S., Tiedje J.M. Acidophilic methanotrophic communities from sphagnum peat bogs. Appl. Environ. Microb., 1998, 64(3): 922-929.
- Pruesse E., Peplies J., Glöckner F.O. SINA: Accurate high-throughput multiple sequence alignment of ribosomal RNA genes. Bioinformatics, 2012, 28(14): 1823-1829 ( ) DOI: 10.1093/bioinformatics/bts252
- Trujillo M.E., Willems A., Abril A., Planchuelo A.-M., Rivas R., Ludeña D., Mateos P.F., Martínez-Molina E., Velázquez E. Nodulation of Lupinus albus by strains of Ochrobactrum lupini sp. nov. Appl. Environ. Microb., 2005, 71(3): 1318-1327 ( ) DOI: 10.1128/AEM.71.3.1318-1327.2005
- Zurdo-Piñeiro J.L., Rivas R., Trujillo M.E., Vizcaíno N., Carrasco J.A., Chamber M., Palomares A., Mateos P.F., Martínez-Molina E., Velázquez E. Ochrobactrum cytisi sp. nov., isolated from nodules of Cytisus scoparius in Spain. Int. J. Syst. Evol. Micr., 2007, 57(4): 784-788 ( ) DOI: 10.1099/ijs.0.64613-0
- Holmes B., Popoff M., Kiredjan M., Kersters K. Ochrobactrum anthropi gen. nov., sp. nov. from human clinical specimens and previously known as group Vd. Int. J. Syst. Bacteriol., 1988, 38(4): 406-416 ( ) DOI: 10.1099/00207713-38-4-406
- Lebuhn M., Achouak W., Schloter M., Berge O., Meier H., Barakat M., Hartmann A., Heulin T. Taxonomic characterization of Ochrobactrum sp. isolates from soil samples and wheat roots, and description of Ochrobactrum tritici sp. nov. and Ochrobactrum grignonense sp. nov. Int. J. Syst. Evol. Micr., 2000, 50(6): 2207-2223 ( ) DOI: 10.1099/00207713-50-6-2207
- Kim O.S., Cho Y.J., Lee K., Yoon S.H., Kim M., Na H., Park S.C., Jeon Y.S., Lee J.H., Yi H., Won S., Chun J. Introducing EzTaxon: a prokaryotic 16S rRNA Gene sequence database with phylotypes that represent uncultured species. Int. J. Syst. Evol. Micr., 2012, 62(3): 716-721 ( ) DOI: 10.1099/ijs.0.038075-0
- Fox G.E., Wisotzkey J.D., Jurtshyk P., jr. How close is close: 16s rRNA sequence identity may not be sufficient to guarantee species identity. Int. J. Syst. Bacteriol., 1992, 42(1): 166-170 ( ) DOI: 10.1099/00207713-42-1-166
- Wisniewski-Dye F., Borziak K., Khalsa-Moyers G. et al. Azospirillum genomes reveal transition of bacteria from aquatic to terrestrial environments. PLoS Genetics, 2011, 7(12): e1002430 ( ) DOI: 10.1371/journal.pgen.1002430
- Kim M., Oh H.S., Park S.C., Chun J. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes. Int. J. Syst. Evol. Micr., 2014, 64(2): 346-351 ( ) DOI: 10.1099/ijs.0.059774-0
- Paliy O., Shankar V., Sagova-Mareckova M. Phylogenetic microarrays. In: Bioinformatics and data analysis in microbiology/Ö.T. Bishop (ed.). Caister Academic Press, Norfolk, 2014: 207-230.
- Yarza P., Yilmaz P., Pruesse E., Glöckner F.O., Ludwig W., Schleifer K.-H., Whitman W.B., Euzéby J., Amann R., Rosselló-Móra R. Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences. Nat. Rev. Microbiol., 2014, 12(9): 635-645 ( ) DOI: 10.1038/nrmicro3330
- Hall B.G. Phylogenetic trees made easy: a how-to manual. Sunderland, USA, 2011.
- Tindall B.J., Rosselló-Móra R., Busse H.-J., Ludwig W., Kampfer P. Notes on the characterization of prokaryote strains for taxonomic purposes. Int. J. Syst. Evol. Micr., 2010, 60: 249-266 ( ) DOI: 10.1099/ijs.0.016949-0


