Бактерицидные и фунгицидные свойства ацетиленовых четвертичных аммониевых солей
Автор: Андреев Владимир Петрович, Зачиняева Анна Владимировна, Ремизова Людмила Александровна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 4 (125), 2012 года.
Бесплатный доступ
Диско-диффузионным методом показано, что моноацетиленовые четвертичные аммониевые соли обладают более слабым, но более избирательным бактерицидным и фунгицидным действием по отношению к микроорганизмам Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Proteus vulgaris, Proteus mirabilis, Penicillium spp. и Bacillus cereus, чем не содержащий тройной связи триоктилметиламмоний иодид и диацетиленовый диоктилди(гепт-2-инил)аммоний бромид. Только триоктил(гепт-2-инил)аммоний иодид активен по отношению к Saccharomyces cerevisiae.
Ацетиленовые четвертичные аммониевые соли, противомикробные, бактерицидные, фунгицидные свойства, дезинфекция
Короткий адрес: https://sciup.org/14750153
IDR: 14750153 | УДК: 547.333.4+579.23+579.25+579.66
Текст научной статьи Бактерицидные и фунгицидные свойства ацетиленовых четвертичных аммониевых солей
Среди четвертичных аммониевых соединений (ЧАС, [R 1 R 2 R 3 R 4 N] + X - ) наибольшее практическое значение имеют алкилбензилди-метиламмонийхлорид, смесь равных частей ал-килбензилдиметиламмонийхлорида с алкилди-метилбензиламмоний хлоридом, диоктилдиме-тиламмонийхлорид, дидецилдиметиламмоний хлорид, смесь октилдецилдиметиламонийхло-рида (50 %) с диоктилдиметил-аммоний-хлори-дом (25 %) и дидецилдиметиламмоний хлоридом (25 %), которые входят в состав большинства современных дезинфекционных и антисептических средств [7]. Действующим веществом в средстве «ДЕЗЭФЕКТ-САНИТ» является смесь 6 четвертичных аммониевых солей, суммарное содержание которых составляет 3,8 %. В состав смеси этих ЧАС входят октилдецилдиметилам-моний хлорид (30,0 %), тетрадецилдиметил бен-зиламмоний хлорид (20,0 %), додецилдиметил бензиламмоний хлорид (16,0 %), диоктилдиме-тиламмоний хлорид (15,0 %), дидецилдимети-ламмоний хлорид (15,0 %) и гексадецилдиметил бензиламмоний хлорид (4,0 %) [11].
Согласно [12], среднегодовые темпы роста спроса на дезинфекционные и антисептические средства из группы ЧАС в промышленно развитых странах составляют 6–7 %, причем в настоящее время наблюдается отчетливая тенденция возрастания объемов потребления препаратов, в состав которых они входят в смеси с другими активно действующими веществами (АДВ) аль
дегидами, производными гуанидина, алкилами-нами, пероксисоединениями, спиртами и др.
Первым комплексным препаратом широкого спектра действия стало дезинфицирующее средство «Лизафин», зарегистрированное в РФ в 1999 году. Оно обладает антимикробной активностью в отношении Гр + и Гр - бактерий (в том числе возбудителей внутрибольничных инфекций, микобактерий туберкулеза, чумы и холеры), грибов рода Candida и Trichophyton, вирусов – возбудителей гепатита, полиомиелита и других энтеровирусных, аденовирусных инфекций, вирусов группы Herpesviridea, ВИЧ-ассоциированных инфекций. В качестве действующих веществ в состав препарата были введены алкилдиметилбензиламмоний хлорид, глутаровый альдегид и глиоксаль. Основными достоинствами альдегидов являются щадящее действие на объекты и наличие антимикробной активности в отношении всех видов микроорганизмов за счет алкилирования амино-, карбоксильных и сульфгидрильных групп протеинов и других органических соединений и подавления синтеза последних.
ЧАС проявляют сравнительно узкий спектр противомикробной активности: они эффективны в отношении возбудителей кишечных и воздушно-капельных инфекций бактериальной этиологии, грибов, некоторых вирусов, однако недостаточно активны в отношении культур Proteus vulgaris, Proteus morganii, Proteus mirabilis, что существенно ограничивает возможности их применения для профилактики нозокомиальных инфекций. По данным [30], около 89,5 % госпитальных штаммов микроорганизмов рода Proteus резистентны к ЧАС. Имеют место случаи нозокомиальных инфекций (сепсис с высоким процентом летальности), которые связаны с использованием в клинике растворов ЧАС, контаминированных культурами Proteus mirabilis [29]. Большинство препаратов этой группы не активны в отношении вирусов, споровых форм бактерий и микобактерий туберкулеза [7], [25], [32]. В экспериментальных и клинических условиях установлена гетерогенность чувствительности популяций бактерий к ЧАС. В частности, бактериальные клетки одного штамма Escherichia coli, находящиеся на разных стадиях онтогенетического развития, проявляют неодинаковую чувствительность к препаратам этой группы. Переход культуры из экспоненциальной к стационарной фазе роста сопровождается уменьшением гидрофобности и повышением содержания липополисахаридов во внешней мембране клеток, которые защищают цитоплазматическую мембрану от дезорганизации под влиянием ЧАС [10]. Экспоненциальные клетки Гр+ микроорганизмов (B. cereus), наоборот, уступают в чувствительности к ЧАС клеткам, которые находятся в стационарной фазе роста [7].
Учитывая сравнительно узкий спектр про-тивомикробной активности, дезинфекционные средства из группы ЧАС применяют для дезинфекции ограниченного круга объектов в учреждениях здравоохранения – поверхностей помещения (стены, пол, окна, двери, оконные стекла), предметов обстановки, медицинских приборов, оборудования и аппаратов с лакокрасочным, гальваническим и полимерным покрытием, предметов ухода за больными, нательного и постельного белья, однако их не используют для дезинфекции хирургического и стоматологического инструментария вследствие ограниченного спектра противомикробной активности ЧАС [27]. Многочисленные экспериментальные исследования и клинические наблюдения свидетельствуют о быстром формировании и распространении резистентных к ЧАС бактерий в учреждениях здравоохранения и окружающей среде. Например, чувствительность клинических изолянтов Staphylococcus aureus к препаратам из группы бис-четвертичных аммониевых соединений (декаметоксин, этоний) на протяжении 10-летнего периода снизилась в 2–10 раз [7]. Это обусловлено недостаточно обоснованным применением одних и тех же препаратов из группы ЧАС в учреждениях здравоохранения, ветеринарии, пищевой и перерабатывающей промышленности, в быту. Дезинфекцию объектов (емкости, коммуникации, трубопроводы и др.) в таких отраслях пищевой промышленности, как пиво-безалкогольная, молочная, кондитерская, выполняют объемным способом – заполняют их рабочим раствором дезинфекционного средства с последующим сбросом в канализационную систему. Такой способ дезинфекции обусловливает поступление значительных количеств ЧАС в объекты внешней среды (вода водоемов, почва) и селекцию устойчивых к ним вариантов микроорганизмов.
Таким образом, существующий ассортимент средств дезинфекции из группы ЧАС не полностью отвечает современным требованиям к свойствам препаратов этой группы по таким критериям, как универсальность (применяют для дезинфекции сравнительно узкого круга объектов), узкий спектр противомикробной активности, сравнительно быстрое формирование и распространение резистентных к ЧАС видов микроорганизмов .
Целью данной работы явился поиск новых типов ЧАС, у которых отсутствуют отмеченные недостатки.
Хорошо известно, что к основным элементам структуры, обусловливающим противомикроб-ные свойства ЧАС, относятся гидрофильные полярные четвертичные аммониевые группы и гидрофобные углеводородные радикалы [7]. Соединения, содержащие короткоцепочечные углеводородные радикалы у атома четвертичного азота, проявляют умеренные противо-микробные свойства или лишены их. Увеличение количества атомов углерода в радикале до восьми приводит к появлению поверхностной активности и вместе с ней противомикробных свойств. Активность повышается при введении в структуру ЧАС ненасыщенных углеводородных радикалов [28], асимметричного атома азота [15], простых эфирных связей [7]. Среди моночетвертичных аммониевых солей максимальную активность, как правило, проявляют соединения, которые содержат 12–16 атомов углерода в радикале [14], [17]. Дальнейшее удлинение углеродной цепи приводит к снижению активности [22]. Согласно [8], противомикробные свойства ЧАС коррелируют с поверхностной активностью. Эти соединения концентрируются на поверхности раздела фаз «раствор : поверхность клетки бактерий», встраиваются в цитоплазматическую мембрану с последующими изменениями конформации мембранных липидов, что приводит к повышению проницаемости цитоплазматической мембраны.
Токсичность ЧАС, наоборот, находится в обратно пропорциональной зависимости от длины углеродной цепи – уменьшается по мере того, как увеличивается количество атомов углерода в радикале. Кроме того, алифатические ЧАС менее токсичны, чем циклические [21], а ацетиленовые соединения менее токсичны, чем олефиновые, и особенно алифатические [1].
В литературе отмечаются особые свойства четвертичных аммониевых солей, содержащих длинноцепной ацетиленовый радикал, в частности их повышенная бактерицидная активность [16]. Поэтому мы поставили задачу выяснить влияние длины и числа алкильных и алкинильных групп в ЧАС на бактерицидные и фунгицидные свойства этих веществ.
В качестве обьектов исследования были выбраны следующие соединения:
[(C8H17)3NCH2C CH] Br [(C10H21)3NCH2C CC6H13] Br [(C 8 H 17 ) 3 NCH 2 C CC4H9 ] I
[(C8H17)2N(CH2C CC4H9)2] Br
[(C 8 H 17 ) 3 NCH 3 ]I
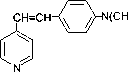
I
O
Следует отметить, что ЧАС (1–4) могут быть легко синтезированы по разработанной нами методике кватернизацией триоктиламина, тридециламина и диоктил(ди-2-гептинил)амина соответствующими галогенидами пропаргильного типа в очень мягких условиях [1], [3]. Реакция между этими реагентами при комнатной температуре заканчивается в ацетонитриле за 1–2 часа, а в пентане за 1–2 суток с выходами ЧАС, близкими к количественным. Указанные моно- и диацетиленовые ЧАС содержат от 27 до 39 атомов углерода, в качестве стандарта использован алифатический аналог (5) с 25 атомами углерода.
N-оксид транс-4-(4-диметиламиностирил) пиридина (4-DPyO) был получен согласно методике [2]. Последнее соединение было выбрано нами для исследований, поскольку стирильные производные вида
NO2
R = CH2OCONHAc, CH2Cl, CH2I, CH2OP(O)(OH)2, CH2NRR' и др.
обладают противомикробной, противодерма-тозной и противопротозойной активностью [13], а 4-DPyO – апоптогенной активностью [5].
Экспериментальные данные относительно чувствительности микроорганизмов к химиотерапевтическим препаратам, полученные нами диско-диффузионным методом, даны в таблице, в которой представлены все классы микроорганизмов (бактерии и грибы), имеющие эпидемиологическое значение.
К сожалению, стирильное производное N-оксида пиридина (6) оказалось неактивным по отношению ко всем видам микроорганизмов, в то время как ЧАС в зависимости от строения проявляют избирательное биологическое действие.
Следует отметить (см. таблицу), что Proteus vulgaris (тест-культура № 3) резистентна ко всем образцам ЧАС, а рост Saccharomyces cerevisiae (№ 7) подавляется только триоктилгепт-2-инил-аммонийиодидом (3).
Диаметр зоны подавления роста микроорганизмов химиотерапевтическим препаратом (4-DPyO, предельные, моно- и диацетиленовые ЧАС)
|
Четвертичные аммониевые соли и DPyO (формула и номер согласно схеме) |
Тест-культура* Диаметр зоны подавления роста микроорганизмов, мм |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
[(C8H17)3NCH2C≡CH]Br (1) |
0 |
0 |
0 |
0 |
20 |
25 |
0 |
|
[(C10H21)3NCH2C≡CC6H13]Br (2) |
15 |
15 |
0 |
0 |
0 |
0 |
0 |
|
[(C8H17)3NCH2C≡CC4H9]I (3) |
0 |
0 |
0 |
15 |
10 |
12 |
10 |
|
[(C8H17)2N(CH2C≡CC4H9)2]Br (4) |
20 |
20 |
0 |
20 |
30 |
17 |
0 |
|
[(C8H17)3NCH3]I (5) |
30 |
20 |
0 |
20 |
30 |
17 |
0 |
|
транс- (CH3)2NC6H4CH=CHC5H4N→O (6) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
* Staphylococcus aureus – № 1, Escherichia coli – № 2, Proteus vulgaris – № 3, Proteus mirabilis – № 4, Penicilliu m spp. – № 5, Bacillus cereus – № 6, Saccharomyces cerevisiae – № 7.
По отношению к культурам 1–5 (триоктилп-ропаргиламмоний бромид (1) на Bacillus cereus (№ 6) оказывает более сильное химиотерапевтическое воздействие) триоктилметиламмонийио-дид с алкильными группами (5) и диацетиленовый диоктилдил-2-гептиниламмонийбромид (4) проявляют одинаковое (за исключением культуры № 1), более сильное подавление роста культур, чем моноацетиленовые ЧАС (1–3). В то же время избирательность биологического действия последних соединений (1 – № 5, 6; 2 – № 1, 2; 3 – № 4–7) теоретически может позволить избирательно уничтожать некоторые виды микроорганизмов, не влияя на жизнеспособность других.
Особенно важным может оказаться тот факт, что ЧАС (3) подавляют рост культуры № 7, на которую не воздействуют другие исследованные в данной статье химиотерапевтические препараты. Это соединение можно было бы использовать как добавку к применяемым в настоящее время мягким дезинфицирующим средствам.
Кроме того, ввиду сравнительно быстрого формирования и распространения резистентных к ЧАС видов микроорганизмов применение ацетиленовых ЧАС, с которыми они пока не сталкивались, может привести к разработке новых эффективных бактерицидных и фунгицидных средств.
Целью нашей дальнейшей работы является синтез и исследование противомикробной активности более доступных ацетиленовых ЧАС меньшей молекулярной массы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетиленовые четвертичные аммониевые соли
Синтез 1-бром-2-пропина (бромистого пропаргила)
В трехгорлую колбу, снабженную мешалкой, капельной воронкой, обратным холодильником и охлажденную до -5 °С льдом с солью, вноси- ли 36,5 г (0,65 моль) перегнанного пропаргилового спирта и 6 мл пиридина. К этой смеси при перемешивании по каплям прибавляли 61,6 г (0,23 моля) PBr3 в 2 мл пиридина. Температуру реакционной смеси постепенно в течение одного часа доводили до комнатной и смесь кипятили один час на водяной бане. Затем обратный холодильник заменяли на нисходящий и отгоня-
ли бромистый пропаргил в приемник на сухой поташ. Через некоторый промежуток времени
бромистый пропаргил перегоняли еще раз. Вы- ход – 43,3 г (56 %). Т 1,4920 [1].
84 ° С / 760 мм рт. ст., n D20
кип
Синтез метилпропаргилового эфира
В трехгорлую колбу на 1 л, снабженную мешалкой, обратным холодильником и капельной воронкой, охлажденную смесью льда с солью, вносили 84 г (1,5 моля) пропаргилового спирта, 201 г (1,65 моля) диметилсульфата, 60 мл воды и прибавляли по каплям раствор едкого натра (82 г NaOH в 82 мл воды) с такой скоростью, чтобы температура реакционной смеси не превышала -15 ° С. Затем продолжали перемешивание в течение 2 часов. Органический слой отделяли от водного и сушили безводным CaCl2. После перегонки получали 84 г (80 %) метилпропаргилового эфира. Т 61-62 ° С / 760 мм рт. ст., n D20 1,3965. Литературные данные: Т 61-62 ° С / 760 мм рт. ст., nD 20 1,3975 [31]. кип
Синтез 1-метокси-2-гептина [19]
В трехгорлую колбу на 1 л, снабженную мешалкой, обратным холодильником и капельной воронкой, охлажденную до -50 ° С твердой углекислотой в эфире, наливали около 500 мл жидкого аммиака и при перемешивании вносили 500 мг Fe(NO)3∙9H2O (катализатор) и 1 г металлического натрия. После перехода окраски из синей в серую в колбу вносили 23 г (1 гатом) мелконарезанного натрия и продолжали перемешивание в течение 2 часов. Образование густой темно-серой взвеси указывает на конец превращения. Охладив колбу до -60 ° С, по каплям прибавляли 70 г (1 моль) метилпропаргилового эфира, растворенного в 100 мл абсолютного эфира, и продолжали перемешивание еще в течение 1,5–2 часов. Далее охлаждали колбу до -70-75 ° С и добавляли раствор 137 г (1 моль) бромистого бутила в 110 мл абсолютного эфира. Реакционную смесь оставляли на ночь для испарения аммиака и на следующий день в колбу последовательно добавляли 200 мл сухого эфира, 5 г NH4Cl и 100 мл воды. Эфирный слой отделяли от водного, водный слой несколько раз экстрагировали эфиром, эфирные вытяжки обь-единяли и пропускали через них CO2 из аппарата Кипа до нейтральной реакции. Эфирный раствор сушили безводным MgSO4. После удаления растворителя остаток перегоняли в вакууме. Из одного синтеза получали в среднем 81 г (65 %) 1-метокси-2-гептина. Т 50-51 ° С /10 мм рт. ст., n D20 1,4320. Литературные данные: Ткип 53-54 ° С /
11 мм рт. ст., n D20 1,4300 [26], Т кип 56-57 ° С /12 мм рт. ст., nD 20 1,4320 [19].
Синтез 1-бром-2-гептина
В трехгорлую колбу на 100 мл, снабженную мешалкой, обратным холодильником и капельной воронкой, помещали 16 г (0,13 моля) бромистого ацетила и 0,25 г безводного ZnCl2 (катализатор), по каплям при интенсивном перемешивании прибавляли 16,5 г (0,13 моля) 1-ме-токси-2-гептина. Реакционную смесь нагревали на водяной бане при температуре 50 ° С. После прибавления эфира температуру бани поднимали до 70 ° С и продолжали перемешивание в течение 1,5 часа. Далее реакционную смесь выливали в ледяную воду, органический слой отделяли, водный слой экстрагировали несколько раз эфиром. Эфирный раствор сушили безводным MgSO4 и после отгонки растворителя остаток перегоняли в вакууме. Из одного синтеза получали 18 г (79 %) 1-бром-2-гептина.
Ткип 69 ° С / 10 мм рт. ст., nD 25 1,4895. Литературные данные: Ткип 71-73 ° С / 12 мм рт. ст., n D25 1,4890 [26], Ткип 88,7 ° С / 27 мм рт. ст., n D20 1,4898 [24].
Синтез бромистого ди-н-октил-ди-(2-гептинил) аммония
Реакционную смесь, содержащую 0,034 моля 1-ди-н-октиламино-2-гептина, 0,03 моля 1-бром-2-гептина и 10 мл ацетонитрила, перемешивали при комнатной температуре в течение 3–4 часов. Ацетонитрил отмывали водой. Выделившееся масло промывали пентаном, растворяли в эфире и сушили безводным MgSO4. Эфир удаляли в вакууме. Выход продукта – 50 %.
Остальные ЧАС получали аналогично. В ацетофеноне реакционную смесь оставляли на ночь, в пентане реакцию проводили в течение 3–4 дней (в последнем случае нерастворимые ЧАС промывали пентаном и растворитель удаляли в вакууме).
Определение чувствительности микроорганизмов к химиотерапевтическим препаратам проводили диско-диффузионным методом [18], [20].
Для исследования использовали стандартные питательные среды: АГВ – для определения чувствительности бактерий к химиотерапевтическим препаратам, Мюллер–Хинтон с добавлением метиленового синего и глюкозы – для определения чувствительности грибов к химиотерапевтическим препаратам.
На поверхность подсушенной питательной среды в чашке Петри наносили 1 мл исследуемой культуры (18–20-часовой бульонной культуры или стомиллионной агаровой суспензии из агаровой культуры). Диски, пропитанные насыщенными растворами исследуемых ЧАС и N-оксида в ДМСО, накладывали пинцетом на равном расстоянии друг от друга и на 2 см от края чашки. Чашки с посевами бактерий инкубировали при 35-37 °С в течение 18-20 часов. Чашки с посевами грибов инкубировали при 22-25 °С в течение 7–10 суток.
Для учета результатов с помощью линейки измеряли диаметр зон подавления роста вокруг дисков с точностью до 1 мм.
Тест-культуры: Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Proteus vulgaris , Proteus mirabilis , Penicillium spp. , Bacillus cereus , Saccharomyces cerevisiae .
Список литературы Бактерицидные и фунгицидные свойства ацетиленовых четвертичных аммониевых солей
- Андреев В. П. Молекулярные комплексы гетероароматических N-оксидов и ацетиленовых аминов с v-акцепторами как модель исследования нуклеофильности и основности соединений с пространственно доступными реакционными центрами: Дисс.... д-ра хим. наук. Петрозаводск, 2007. 427 с.
- Андреев В. П., Батоцыренова Е. Г., Рыжаков А. В., Родина Л. Л. Процессы внутримолекулярного переноса заряда в ряду стирильных производных N-оксидов пиридина и хинолина//ХГС. 1998. № 8. C. 1093-1102.
- Андреев В. П., Вукс Е. М., Кочеткова Е. В., Ремизова Л. А., Фаворская И. А. Кватернизация ацетиленовых аминов 2-пропинил-и алкилгалогенидами//ЖОрХ. 1979. Т. 5. Вып. 3. С. 464-467.
- Волкова С. В., Клементенок Е. В., Ефремова М. И. Оптимизация состава современного дезинфицирующего средства на примере препарата «Лизафин» [Электронный ресурс]. Режим доступа: http://www.petrospirt.ru/articles/1/index.html
- Волкова Т. О., Немова Н. Н. Молекулярные механизмы апоптоза лейкозной клетки. М.: Наука, 2006. 205 с.
- Гудзь О. В. Влияние этония на процесс дегидрирования метаболитов цикла трикарбоновых кислот культурами клетки Escherichia coli и Pseudomonas aeruginosa//Микробиологический журнал. 1985. Т. 47. № 2. С. 60-63 [Электронный ресурс]. Режим доступа: http://www.provisor.com.ua/archive/1998/N12/klin_dez.htm
- Гудзь О. В. Итоги и перспективы клинического применения дезинфекционных средств из группы четвертичных аммониевых соединений. Совет по регламентации применения и внедрения дезинфекционных средств Минздрава Украины (г. Киев)//Провизор. 1998. Вып. 12.
- Гудзь О. В., Писько Г. Т. Молекулярные аспекты действия поверхностно-активных веществ на микроорганизмы//Фармакология и токсикология: Республ. междувед. сборник. Киев: Здоров’я, 1983. С. 106-111.
- Гудзь О. В., Писько Г. Т. Влияние четвертичных аммониевых соединений на функциональное состояние цитоплазматической мембраны Escherichia coli//Микробиологический журнал. 1988. Т. 50. № 3. С. 75-78.
- Иванов А. Ю., Фомченков В. М. Зависимость повреждающего действия поверхностно-активных веществ на клетки Escherichia coli от фазы роста культуры//Микробиология. 1989. Т. 58. Вып. 6. С. 969-975.
- Инструкция по применению средства дезинфицирующего «ДЕЗЭФЕКТ-САНИТ» на предприятиях мясной промышленности [Электронный ресурс]. Режим доступа: http://www.dezefekt.ru/san_meat_instruction.doc
- Йоффе Б. С., Бабаян Е. П., Злотник Р. Е. Синтез и применение катионных ПАВ//Хлорная промышленность. М.: НИИТЕХИМ, 1988. 42 с.
- Колямшин О. А., Кормачев В. В., Митрасов Ю. Р., Братилов Б. И. N-окиси пиридина. Чебоксары: Чувашский ГУ, 1987. 95 с.
- Крученок Т. Б. Научные основы направленного поиска новых дезинфицирующих средств и изучение механизма их действия//Проблемы дезинфекции и стерилизации. М., 1985. С. 6-13.
- Лиманов М. О., Иванов С. Б., Крученок Т. Б. Синтез и бактерицидная активность катионных поверхностноактивных веществ, содержащих асимметричный атом азота//Хим.-фарм. журн. 1984. № 6. С. 703-706.
- Лиманов В. Е., Эпштейн А. Е., Скворцова Е. К., Арефьева Л. И. 5-я всесоюзная конференция по химии ацетилена. Тбилиси, 1975.
- Ляпунов Н. А., Бобылева Л. Г., Иванов Л. В., Грецкий В. М., Чуева И. Н., Рудько А. П. Исследование катионных поверхностно-активных веществ -солей алкиламидопропилдиметилбензиламмония//Фармация. 1984. Т. ХХХШ. № 3. С. 26-30.
- Медицинская микробиология/Под. ред. А. М. Королюка, В. Б. Сбойчакова. СПб., 1999. 272 с.
- Мкрян Г. М., Гаспарян С. М., Волнина Э. А., Капланян Э. Е. Исследование в области соединений ацетиленового ряда. V. Присоединение алкилхлорметиловых эфиров к однозамещенным ацетиленовым углеводородам. Синтез алкин-2-илалкиловых эфиров//Арм. хим. журнал. 1970. Т. 23. № 5. С. 419-424.
- МУК 4.12.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам. М.: Минздрав России, 2004.
- Писько Г. Т., Гудзь О. В. Зависимость между строением катиона и биологической активностью катионных поверхностно-активных веществ//Фармакология и токсикология. 1980. № 5. С. 210-215.
- Писько Г. Т., Овчинников В. Г., Гудзь О. В., Смирнова Н. А., Тарасенко В. С. Противомикробные свойства производных гексаметилендиамина, содержащих остатки высокомолекулярных спиртов//Физиологически активные вещества. 1984. Вып. 16. С. 54-57.
- Чернявская М. А., Павлова И. Б. Структурно-функциональные изменения клеток сферопластов эшерихий при воздействии катионного поверхностно-активного вещества//Журнал микробиологии, эпидемиологии и иммунобиологии. 1983. № 2. С. 62-66.
- Bartlett P. D., Rosen L. J. An acetylenic analog of neopentyl bromide; evidence that the hindrance to displacement reactions in neopentyl halides is steric in nature//J. Am. Chem. Soc. 1962. Vol. 64. № 3. P. 542-546.
- Best M., Sattar S. A., Springthorpe V. S., Kennedy M. E. Efficacies of selected disinfectants against Mycobacterium tuberculosis//J. Clin. Microbiol. 1990. № 10. Р. 2234-2239.
- Couffignal R., Gaudemar M., Perriot P. Sur la preparation des bromures propargyliques du type R-C=C-CH2-Br (note de laboratoire)//Bull. Soc. Chim. Fr. 1967. № 10. P. 3909-3910.
- Desinfektionsmittel-Liste der DGHM. Wiesbaden, 1997.
- Kabara J. J., Mckillip W. J., Sedor E. A. Ammimides. 1. Antimicrobial tffect of some long chain fatty acid derivatives//J. Amer. Oilchem. Soc. 1975. № 8. Р 316-317.
- Frank M. J., Schaffner W. Contaminated Aqueous Benzalkonium Chloride an Unnecessary Hospital Infection Hazard//J. Amer. Med. ABS. 1976. Vol. 236. № 21. Р 2418-2419.
- Girardo P., Reverdy M. E., Martra A., Fleurette J. Determsnation de la concentration minimale bactericide de trois antiseptiques et un desinfectant sur S 80 soudes de bacilles gram negatife d,origine hospitaliere//Pathol. Biol. 1989. № 5 bis. P. 605-611.
- Perriot P., Gaudemar M. Sur la preparation des estersd’alcools a-acetyleniques y-halogenes//Bull. Soc. Chim. Fr. 1968. F. 8. P. 3239-3244.
- Russell A. D. Bactarial spores and chemical sporicidal agents//Clin. Mcrobiol. Rev. 1990. № 2. Р. 99-119.


