Бактерии-деструкторы дибутилфталата, выделенные из ризосферы мятлика лугового (Poa pratensis L.)
Автор: Корсакова Е.С., Пьянкова А.А., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Изучена способность трех бактериальных штаммов класса Actinomycetes, выделенных из ризосферы растений мятлика лугового (Poa pratensis L.), произрастающих на территории промышленных разработок Верхнекамского месторождения солей (Пермский край), к росту на дибутилфталате (ДБФ) в качестве единственного источника углерода и энергии. На основе анализа гена 16S рРНК показано, что штамм Rh7bel проявлял сходство на уровне 100% с Rhodococcus wratislaviensis NBRC 100605T, а штаммы NKDBFbel и NKDBFgelt филогенетически близки двум типовым штаммам видов Pseudarthrobacter oxydans и Pseudarthrobacter polychromogenes (сходство 99.83%). Штаммы-деструкторы ДБФ характеризуются эффективным ростом на ключевом метаболите разложения ДБФ - ортофталевой кислоте, и утилизацией этого метаболита. Штамм Rhodococcus sp. Rh7bel демонстрировал наиболее высокие показатели утилизации ДБФ: максимальную удельную скорость потребления субстрата 0.018±0.002 ч-1, утилизацию субстрата 70.7% за 72 ч. (начальная концентрация ДБФ 0.2 г/л). Таким образом, ризосферные штаммы-деструкторы ДБФ Rhodococcus sp. Rh7bel, Pseudarthrobacter sp. NKDBFbel и NKDBFgelt являются перспективными для дальнейшего изучения и разработки технологии фиторемедиации почв, загрязненных фталатами.
Мятлик луговой, ризосфера, дибутилфталат, деструкция, rhodococcus, pseudoarthrobacter
Короткий адрес: https://sciup.org/147242768
IDR: 147242768 | УДК: 579.26: | DOI: 10.17072/1994-9952-2023-4-349-355
Текст научной статьи Бактерии-деструкторы дибутилфталата, выделенные из ризосферы мятлика лугового (Poa pratensis L.)
В настоящее время вследствие интенсивного производства и применения синтетических полимеров наблюдается широкое распространение эфиров фталевой кислоты (фталатов) в объектах окружающей среды. Наиболее широко используется в различных областях промышленности один из эфиров фталевой кислоты – дибутилфталат (ДБФ). Он обладает высокой растворяющей способностью и низкой вязкостью, что обусловливает его применение для изменения свойств полимеров с целью повышения их эластичности, морозостойкости. ДБФ применяется в резинотехническом производстве, при изготовлении искусственных пленок, кабельных пластикатов, эфира целлюлозы, линолеумов, лаков и искусственных смол. Фталаты и их метаболиты признаны потенциально опасными для человека и животных, т.к. обладают гепатотоксичными, тератогенными и канцерогенными свойствами [Liang et. al., 2008].
Наличие значительного количества фталатов (в том числе ДБФ) выявлено в районах интенсивной работы предприятий горнодобывающей промышленности. Так, данные соединения обнаружены в глинисто-солевых шламах, избыточных рассолах и отходах калийного производства вследствие использования в технологическом цикле обогащения калийных руд реагентов (оксиэтилированных жирных кислот, нефтепродуктов, диоксановых спиртов и др.), продуктами трансформации которых являются фталаты [Бачурин, Одинцова, 2006].
Известно, что период полураспада ДБФ в окружающей среде составляет от нескольких месяцев до 20 лет, и основную роль в процессе разложения этого соединения выполняют бактерии-деструкторы [Liang et. al., 2008]. Среди штаммов, осуществляющих аэробную деструкцию ДБФ, обнаружены бактерии различных филумов, наиболее часто встречаются представители родов Arthrobacter , Bacillus , Burkholderia , Gordonia , Pseudomonas , Rhodococcus [Liang et al., 2008; Jin et al., 2010; Stanislauskiene et al., 2011; Ka-naujiya, Sivashanmugam, Pakshirajan, 2022]. Метаболические пути разложения эфиров фталевой кислоты аэробными бактериями сочетают два процесса – первичную деградацию диэфиров фталата до моноэфиров и последующую их деструкцию до орто -фталевой кислоты (ФК), являющейся центральным метаболитом деструкции большинства фталевых эфиров. Дальнейшее разложение ФК осуществляется через образование протокатеховой кислоты (в качестве ключевого метаболита) до основных продуктов жизнедеятельности микробной клетки [Eaton, 2001; Liang et al., 2008; Vamsee-Krishna, Phale, 2008; Kasai et al,, 2019].
Фиторемедиация становится все более популярной и востребованной технологией восстановления загрязненных почв, поскольку является высокоэффективным, надежным, малозатратным и экологически чистым методом. При этом для эффективной очистки почв предполагается использование устойчивых растительно-микробных ассоциаций, содержащих в ризосфере бактерии, способные осуществлять деструкцию органических поллютантов, присутствующих в почве [Wenzel, 2009; Randika et al., 2022]. В ряде исследований показано положительное влияние высадки растений на очистку почвы от фталатов [Li et al., 2014; Liao, Nishikawa, Shih, 2019; Wu et al., 2019]. Однако исследования микроорганизмов ризосферы растений, выращенных на загрязненной фталатами почве, на сегодняшний день крайне немногочисленны [Zhang et al., 2015; Wu et al., 2019].
Цель работы – характеристика бактерий-деструкторов дибутилфталата, выделенных из ризосферы растений мятлика лугового, произрастающих в районе промышленных разработок Верхнекамского месторождения солей (Пермский край).
Материалы и методы
Объекты исследования . Из рабочей коллекции микроорганизмов Лаборатории микробиологии техногенных экосистем Института экологии и генетики микроорганизмов УрО РАН для исследования были отобраны 76 штаммов, выделенных из ризосферы растений, произрастающих на территории Верхнекамского промышленного региона (Пермский край).
Также в работе использованы два штамма NKDBFbel и NKDBFgelt, полученные из накопительной культуры при инкубировании на ДБФ в качестве субстрата. Штаммы были выделены из образца ризосферы мятлика лугового ( Poa pratensis L.), отобранного вблизи солеотвала (г. Соликамск, Пермский край, Россия).
Среды и условия культивирования . Для культивирования бактерий использовали минеральную среду Раймонда (МСР) следующего состава (г/л): NH 4 NO 3 – 2.0, MgSO 4 х 7H 2 O – 0.2, K 2 HPO 4 – 2.0, Na 2 HPO 4 - 3.0, CaCl 2 x 6H 2 O - 0.01, Na 2 CO3 - 0.1, дополненную 1%-ным раствором MnSO 4 x 2H 2 O -2 мл/л и 1%-ным раствором FeSO 4 x 7H 2 O - 1 мл/л среды [Raymond, 1961]. В качестве субстратов использовали ФК и ДБФ в концентрации 1.0 г/л. Для приготовления богатой среды Раймонда (БСР) в МСР добавляли 5 г/л триптона («VWR Life Science Amresco», США) и 2.5 г/л дрожжевого экстракта («Bi-ospringer», Франция) в качестве ростовых субстратов. Для приготовления плотных сред вносили агар («Helicon», Россия) до конечной концентрации 15 г/л.
Морфологические характеристики бактерий определяли при выращивании на агаризованной БСР. Культивирование осуществляли при температуре 28°С. Описание морфологии колоний проводили на седьмой день культивирования. Для микроскопирования клеток использовали 48-часовые культуры бактерий [Методы ..., 1983].
Секвенирование и анализ генов 16S рРНК. Определение нуклеотидных последовательностей проводили с применением набора реактивов «GenSeq-100» («Синтол», Россия) на автоматическом секвенаторе Нанофор 05 («Синтол», Россия) согласно рекомендациям производителя. Анализ полученных последовательностей осуществляли с использованием программ Sequence Scanner v. 2.0, MEGA v. 11.0 . Поиск гомологов генов 16S рРНК осуществляли по международным базам данных GenBank (http:/ и EzBioCloud .
Рост бактерий на ФК и ДБФ оценивали при культивировании в жидкой МСР. Субстрат вносили до конечной концентрации 1.0 г/л. Инокулятом служила культура, выращенная на агаризованной БСР при 28°С. Биомассу бактерий ресуспендировали в МСР, полученную суспензию бактериальных клеток (ОП 600 =1.0) добавляли в 100 мл среды в количестве 1% об./об. Культивирование штаммов бактерий осуществляли в колбах объемом 250 мл (объем среды – 100 мл) на термостатируемом шейкере Environmental Shaker Incubator ES-20/60 («BioSan», Латвия) при температуре 28°С и скорости вращения 140 об/мин. Оптическую плотность (ОП) культуральной жидкости определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см. Расчет удельной скорости роста ( μ , ч-1) проводили по стандартной формуле
μ = (lnB2 – lnB1) / (t2 – t1), где В1 и В2 – оптические плотности культуры в моменты времени t1 и t2 соответственно [Нетрусов, 2005].
Оценку разложения ДБФ бактериями осуществляли методом газожидкостной хроматографии-масс-спектрометрии (ГЖХ-МС). Штаммы выращивали в среде МСР, содержащей дибутилфталат (1.0 г/л), клетки собирали центрифугированием (9 000 об/мин, 5 мин.) и отмывали при помощи МСР. Отмытые дважды клетки (ОП 600 =2.0) инокулировали в 1 мл МСР с ДБФ (0.2 г/л) и инкубировали при 28°С в течение трех суток при аэрации на роторном шейкере (150 об/мин). Экстракцию ДБФ осуществляли равным объемом гексана в течение 120 мин. на шейкере при 100 об/мин. Остаточную воду удаляли из образцов путем введения безводного сульфата натрия. Анализ проводили на газовом хроматографе-масс-спектрометре «Agilent» 7890B модель G3440B («Agilent», США), с кварцевой колонкой RESTEK RTx-5MS («Restek», США). Анализ хроматограмм проводили с использованием программы MassHunter Qualitative Analysis 10.0 («Agilent», США.). Идентификацию ДБФ проводили путем сравнения времени выхода пиков со временем выхода пиков контрольного соединения, а также по хромато-масс спектрам.
Расчет удельной скорости утилизации ( μ , сут-1) проводили по стандартной формуле
μ = (lnС1 – lnC2) / (t2 – t1), где С1, С2 – концентрация субстрата в начальный и конечный моменты времени t1 и t2 соответственно [Нетрусов, 2005].
Статистическая обработка результатов . Все эксперименты были выполнены в трехкратной повторности. Полученные данные обрабатывали с использованием программы Microsoft Excel 2007.
Результаты и их обсуждение
В ходе проведенной работы 76 штаммов, выделенные из образцов ризосферы растений с территории солеразработок (г. Березники, г. Соликамск, Пермский край), были исследованы на способность к росту на ДБФ и ФК – ключевом метаболите бактериального разложения ДБФ. В результате из 14 активных деструкторов ФК только один штамм (Rh7bel), изолированный из ризосферы мятлика лугового (Poa pratensis L.), был способен к росту на дибутилфталате как единственном источнике углерода и энергии. При культивировании на агаризованной БСР штамм Rh7bel формировал округлые непрозрачные колонии диаметром 1.5–2.5 мм с ровным краем, гладкой матовой поверхностью, выпуклым профилем, мелкозернистой структурой и мягкой консистенцией. Клетки штамма грамположительные, неподвижные, в стационарной фазе роста представлены длинными палочками. На основе анализа фрагмента гена 16S рРНК (808 п.н.) было установлено, что штамм Rh7bel проявлял сходство на уровне 100% с Rhodococcus wratislaviensis NBRC 100605T.
Штаммы-деструкторы дибутилфталата NKDBFbel и NKDBFgelt имели округлые полупрозрачные колонии диаметром 2–4 мм с ровным краем, гладкой блестящей поверхностью, выпуклым профилем, однородной структурой и мягкой консистенцией. Штамм NKDBFbel на агаризованной БСР формировал колонии белого цвета, а штамм NKDBFgelt – желтого цвета. Клетки обоих штаммов грамположительные, неподвижные, в стационарной фазе представлены утолщенными короткими палочками. На основе анализа фрагмента гена 16S рРНК штаммы NKDBFbel и NKDBFgelt по гену 16S рРНК (594 и 602 п.н., соответственно) имели сходство на уровне 99.83% с двумя типовыми штаммами – Pseudarthrobacter oxydans DSM 20119T и Pseudarthrobacter polychromogenes DSM 20136T.
Исследованы ростовые характеристики штаммов Rh7bel, NKDBFbel и NKDBFgelt при росте на ДБФ и ФК в качестве субстратов (рис. 1, 2; таблица). Штаммы имели высокие показатели максимальной ОП при росте на ФК (>1.0), но только у штамма NKDBFgelt были зарегистрированы сравнимые значения ОП при росте на ДБФ (таблица). Максимальные значения удельной скорости роста культуры выявлены у штамма NKDBFgelt при росте на обоих субстратах. Штамм Rhodococcus sp. Rh7bel демонстрировал высокие показатели при росте на ФК, однако в процессе инкубирования на ДБФ клетки штамма формировали конгломераты, что могло повлиять на регистрацию низких значений параметров роста культуры (рис. 1, 2; таблица).
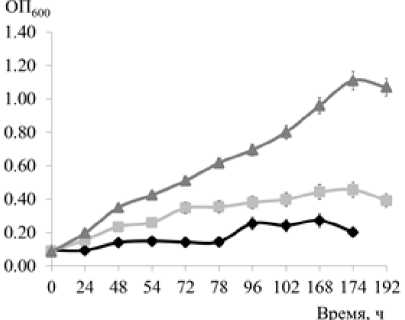

О 24 48 54 72 78 96 102 168 174
Параметры роста штаммов Rh7bel, NKDBFbel, NKDBFgelt на ДБФ и утилизации ДБФ [Growth parameters of strains Rh7bel, NKDBFbel, NKDBFgelt and DBP utilization]
|
Параметры роста |
Rhodococcus sp. Rh7bel |
Pseudarthrobacter sp. NKDBFbel |
Pseudarthrobacter sp. NKDBFgelt |
|||
|
Ростовой субстрат, 1.0 г/л |
ФК |
ДБФ |
ФК |
ДБФ |
ФК |
ДБФ |
|
Удельная скорость роста, ч-1 |
0.041± 0.003 |
0.002± 0.001 |
0.008± 0.001 |
0.003± 0.001 |
0.054± 0.003 |
0.016± 0.002 |
|
Максимальное значение ОП 600 |
1.10 |
0.27 |
1.04 |
0.46 |
1.25 |
1.11 |
|
Лаг-фаза роста, ч |
24 |
78 |
78 |
24 |
54 |
24 |
|
Удельная скорость утилизации, ч-1 |
н.о. |
0.018± 0.002 |
н.о. |
0.008± 0.002 |
н.о. |
0.009± 0.003 |
|
Утилизация, % |
н.о. |
70.7±0.4 |
н.о. |
43.3±0.3 |
н.о. |
45.1±0.3 |
Примечание: н.о. – не определяли.
Время, ч
-♦■Rh7bcl 1 NKDBFbel *NKDBFgelt ♦Rh7bel 4 NKDBFbel *NKDBFgelt
Л /;
Рис. 1. Рост штаммов-деструкторов на ФК ( A ) и ДБФ ( B ) (1.0 г/л) в МСР
[Growth of destructor strains on FA ( A ) and DBP ( B ) (1.0 g/L) in MMR]
С использованием метода ГЖХ-МС исследована способность штаммов к утилизации ДБФ (рис. 2). Наиболее высокие показатели утилизации субстрата (70.7% за 72 ч.) и максимальная удельная скорость потребления дибутилфталата (0.018±0.002 ч-1) зафиксированы у штамма Rhodococcus sp. Rh7bel. Два других штамма-деструктора рода Pseudarthrobacter показали снижение количества ДБФ лишь на 43–45% за 72 ч. эксперимента.
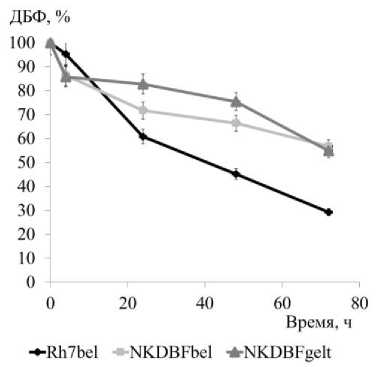
Рис. 2. Утилизация ДБФ (0.2 г/л) исследуемыми штаммами
[Utilization of DBP (0.2 g/L) by the studied strains]
На основании известных путей деструкции эфиров фталевых кислот бактериями рода Rhodococcus и Pseudarthrobacter можно предположить, что разложение дибутилфталата исследуемыми штаммами осуществляется до монобутилфталата, затем до образования ключевых метаболитов – фталевой кислоты и протокатеховой кислоты, которые далее метаболизируются в цикле трикарбоновых кислот [Choi et al., 2005; Jin et al., 2010; Chen et al., 2021].
Заключение
В результате проведенных исследований установлено, что штаммы-деструкторы Rhodococcus sp. Rh7bel, Pseudarthrobacter sp. NKDBFbel и NKDBFgelt, выделенные из ризосферы растений мятлика лугового ( Poa pratensis L.), произрастающих на почвах, загрязненных отходами калийного производства, способны к эффективному росту на среде с дибутилфталатом в качестве субстрата. Активность штаммов-деструкторов ДБФ подтверждена ростом на ключевом метаболите разложения ДБФ – орто фталевой кислоте, и эффективной утилизацией этого метаболита. Штамм Rhodococcus sp. Rh7bel имел наиболее высокое значение утилизации ДБФ (70.7% за 72 ч., при начальной концентрации субстрата 0.2 г/л) и максимальную удельную скорость потребления ДБФ (0.018±0.002 ч-1). Таким образом, ризосферные штаммы-деструкторы ДБФ Rhodococcus sp. Rh7bel, Pseudarthrobacter sp. NKDBFbel и NKDBFgelt являются перспективными для дальнейшего изучения и разработки технологии фиторемедиации почв, загрязненных фталатами.
Список литературы Бактерии-деструкторы дибутилфталата, выделенные из ризосферы мятлика лугового (Poa pratensis L.)
- Бачурин Б.А., Одинцова Т.А. Стойкие органические загрязнители в отходах горного производства // Современные экологические проблемы Севера. Апатиты: Изд-во Кольского НЦ РАН. 2006. Ч. 2. С. 7–9.
- Методы общей бактериологии / под ред. Ф. Герхардта и др. М.: Мир, 1983. Т. 1–3.
- Нетрусов А.И. Практикум по микробиологии. М.: Академия, 2005. 608 с.
- Chen F. et al. High-efficiency degradation of phthalic acid esters (PAEs) by Pseudarthrobacter defluvii E5: performance, degradative pathway, and key genes // Sci. Total Environ. 2021. Vol. 794. 148719.
- Choi K.Y. et al. Molecular and biochemical analysis of phthalate and terephthalate degradation by Rho-dococcus sp. strain DK17 // FEMS Microbiol. Letters. 2005. Vol. 252. P. 207–213.
- Eaton R.W. Plasmid-encoded phthalate catabolic pathway in Arthrobacter keyseri 12B // J. Bacteriol. 2001. Vol. 183. P. 3689–3703.
- Jin D.-C. et al. Biodegradation of di-n-butyl phthalate by Rhodococcus sp. JDC-11 and molecular detec-tion of 3,4-phthalate dioxygenase gene // J. Microbiol. Biotechnol. 2010. Vol. 20(10). P. 1440–1445.
- Kanaujiya D.K., Sivashanmugam S., Pakshirajan K. Biodegradation and toxicity removal of phthalate mixture by Gordonia sp. in a continuous stirred tank bioreactor system // Environmental Technology & Innova-tion. 2022. Vol. 26. 102324.
- Kasai D. et al. 2,3-dihydroxybenzoate meta-cleavage pathway is involved in o-phthalate utilization in Pseudomonas sp. strain PTH10 // Scientific Reports. 2019. Vol. 9. 1253.
- Li Y.W. et al. Plant uptake and enhanced dissipation of di(2-ethylhexyl) phthalate (DEHP) in spiked soils by different plant species // International Journal of Phytoremediation. 2014. Vol. 16. P. 609–620.
- Liang D.-W. et al. Phthalates biodegradation in the environment // Appl. Microbiol. Biotechnol. 2008. Vol. 80. P. 183–198.
- Liao C.S., Nishikawa Y., Shih Y.T. Characterization of di-n-butyl phthalate phytoremediation by garden lettuce (Lactuca sativa L. var. longifolia) through kinetics and proteome analysis // Sustainability. 2019. Vol. 11. P. 1–16.
- Randika J.L.P.C. et al. Bioremediation of pesticidecontaminated soil: a review on indispensable role of soil bacteria // The Journal of Agricultural Sciences – Sri Lanka. 2022. Vol. 17(1). P. 19–43.
- Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Develop. Ind. Microbiol. 1961. Vol. 2(1). P. 23–32.
- Stanislauskiene R. et al. Analysis of phthalate degradation operon from Arthrobacter sp. 68b // Biologi-ja. 2011. Vol. 57(3). P. 45–54.
- Vamsee-Krishna C., Phale P.S. Bacterial degradation of phthalate isomers and their esters // Indian J. Microbiol. 2008. Vol. 48. P. 19–34.
- Wenzel W.W. Rhizosphere processes and management in plant-assisted bioremediation (phytoremedia-tion) of soils // Plant & Soil. 2009. Vol. 321. P. 385–408.
- Wu K. et al. Responses of soil microbial community and enzymes during plant-assisted biodegradation of di-(2-ethylhexyl) phthalate and pyrene // International Journal of Phytoremediation. 2019. Vol. 21(7). P. 683–692.
- Zhang Y. et al. Effect of di-n-butyl phthalate on root physiology and rhizosphere microbial community of cucumber seedlings // Journal of Hazardous Materials. 2015. Vol. 289. P. 9–17.


