Бактерии-деструкторы орто-фталевой кислоты, выделенные из отходов калийного производства
Автор: Пастухова Е.С., Егорова Д.О., Ястребова О.В., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Из образцов техногенно-минеральных образований района солеразработок (г. Березники, Пермский край) выделено восемь галотолерантных штаммов-деструкторов орто-фталата. На основании морфологических, биохимических свойств и анализа нуклеотидных последовательностей гена 16S рРНК четыре изолята были отнесены к родам Rhodococcus, Pseudomonas, Bacillus. Установлено, что штаммы-деструкторы орто-фталата способны к росту на различных ароматических углеводородах и продуктах их разложения. Показана способность штаммов рода Rhodococcus использовать орто-фталат в качестве ростового субстрата в условиях повышенного содержания хлорида натрия в среде.
Орто-фталат, бактерии-деструкторы, rep-пцр, вох-пцр, определение нуклеотидной последовательности гена 16s ррнк
Короткий адрес: https://sciup.org/147204512
IDR: 147204512 | УДК: 579:678.049.4
Текст научной статьи Бактерии-деструкторы орто-фталевой кислоты, выделенные из отходов калийного производства
Фталаты представляют собой производные фталевой кислоты, которая существует в виде трех изомерных форм: орто-изомер (фталевая кислота), мета-изомер (изофталевая кислота) и пара-изомер (терефталевая кислота), структурно различающиеся радикалами R, R’ сложноэфирной группы (рис. 1). Фталаты широко используются в качестве пластификаторов, при синтезе полиэфирных волокон и полиэтилена. Выявлены гепатотоксичные, тератогенные и канцерогенные свойства этих соединений (Liang et al., 2008). Фталаты отнесены к группе суперэкотоксикантов (стойким органическим загрязнителям, СОЗ), к которым в настоящее время предъявляются наиболее жесткие экологические требования (Стокгольмская конвенция. .
Фталаты обнаружены в отходах горнодобывающей промышленности, в том числе в глинистосолевых шламах, избыточных рассолах отходов калийного производства (разработки Верхнекамского месторождения солей, Пермский край). Учитывая полное отсутствие этих соединений в породах галогенных формаций, высокий уровень загрязнения отходов данного производства обусловлен использованием в технологическом цикле обогащения калийных руд целой гаммы реагентов (оксиэтилированные жирные кислоты, нефтепродукты, диоксановые спирты и др.), продуктами трансформации которых и являются фталаты (Бачурин, Одинцова, 2006).
Известны бактерии, способные осуществлять разложение фталатов. Среди таких организмов вы- явлены представители родов Sphingomonas, Com-amonas, Pseudomonas, Arthrobacter, Rhodococcus, Gordonia, Bacillus, Delftia, Acinetobacter (Liang et al., 2008). На рис. 1 представлены метаболические пути разложения эфиров фталевой кислоты, сочетающие два процесса: первичная биодеградация диэфиров фталата до моноэфиров и последующая их деструкция до орто-фталевой кислоты. Разложение ортофталевой кислоты аэробными бактериями осуществляется через образование протокатеховой кислоты (ПКК), в качестве основного метаболита, до основных продуктов жизнедеятельности микробной клетки (Vamsee-Krishna et al., 2006).
Цель работы – исследование разнообразия бактерий-деструкторов орто -фталевой кислоты, выделенных из глинисто-солевых шламов района солеразработок.
Материалы и методы исследования
Образцы техногенно-минеральных образований (ТМО) были отобраны из шламохранилища предприятия БКРУ1 ОАО «Уралкалий» (г. Березники). В составе исследуемых образцов обнаружены органические соединения различного строения, в том числе углеводороды (алифатические, нафтеновые, ароматические) и фталаты (Бачурин, Одинцова, 2006).
Метод накопительных культур
Для выделения штаммов микроорганизмов использовали метод накопительного культивирования. Образцы ТМО (1 г) были помещены в 250 мл
колбы со 100 мл минеральной среды Раймонда (МР), содержащей 3% NaCl (Розанова, Назина, 1982). В качестве единственного источника углерода и энергии был использован орто -фталат (1 г/л). Инкубация проводилась в течение двух недель на термокачалке (100 об./мин.) при температуре 28 ° С. Из накопительных культур путем высева на агари-
СОО(СН,)„СН3
зованную МР (АМР), содержащую 1 г/л орто фталата, выделяли чистые культуры микроорганизмов. Чистота культур контролировалась путем высева на агаризованную богатую среду Раймонда (АБР), в составе которой присутствуют триптон (5,0 г/л) и дрожжевой экстракт (2,5 г/л).
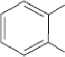
СОО(СН,)„СН3
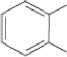
СОО(СН2)„.2СНз
СОО(СН2)П.2СН3
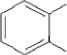
СОО(СН2)3СНз
СОО(СН2)зСНз
Фталат с длинной алкильной цепью
Фталат с короткой алкильной цепью
Дибутил фталат
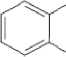
СОО(СН2)лСНз
,СООСН2СН3
С ООН
Моно-эфир фталевой кислоты
^^сэон
Мон о этил фталат
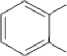
COOCH2CH3
СООСН2СН3


Ди этил фталат
СООН
'^^^'ССХЗН
Фталевая кислота
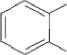
СООСН2СН<
СООСН3

СООСНз
Этил-метил фталат
ОЗОН
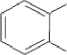
СООСН3
СООСНз
Монометил фталат
Ди метил фталат
Рис. 1 . Пути бактериальной деградации фталатов (Liang et al., 2008)
Изучение физиологических и биодеградативных свойств бактерий
Устойчивость бактерий к повышенной солености среды (концентрация NaCl от 3 до 15%) определяли при культивировании на АБР и АМР ( орто -фталат, 1 г/л). При изучении биодеградативных свойств бактерии выращивали на АМР (концентрация NaCl 3%), используя в качестве единственного источника углерода и энергии одно из следующих соединений: пара -гидроксибензойную кислоту (ПГБК), протокатеховую кислоту (ПКК), салицилат, бензоат, гентизат, орто -фталат (концентрация в среде 1 г/л); а также нафталин, бифенил, бензол, толуол, фенол (бактерии выращивали в парах, добавляя вещества на крышку перевернутой чашки Петри). Рост бактерий на агаризован-ных средах учитывали на седьмые сутки. Оценка роста проводилась по формированию колоний: слабый рост «+» – колонии размером менее 1 мм; средний рост «++» – колонии размером 1–2 мм; хороший рост «+++» – колонии размером более 3
Ростовые характеристики штаммов-деструкторов изучали в жидкой минеральной среде Раймонда с 3% NaCl и орто -фталатом (1 г/л) в качестве источника углерода и энергии. Штаммы выращивали в колбах Эрленмейера объемом 250 мл в 50 мл минеральной среды при температуре 28 ° С и аэрации на шейкере со скоростью 120 об./мин. Оптическую плотность культур измеряли на спектрофотометре BioSpec-mini («Shimadzu», Япония) при длине волны 540 нм.
Типирование и таксономическое положение изолированных штаммов
Типирование бактериальных штаммов проводили методом REP-ПЦР и ВОХ-ПЦР (Versalovic, 1994). Продукты реакции разделяли при электрофоретической разгонке в 1,5% агарозном геле, приготовленном на 1 х ТВЕ буфере (Маниатис и др., 1984).
Предварительную идентификацию изолятов осуществляли на основании изучения их морфологических, биохимических свойств (Определитель мм.
бактерий Берджи, 1997; Методы общей бактериологии, 1983), а также путем анализа нуклеотидных последовательностей гена 16S рРНК исследуемых бактерий.
Определение нуклеотидных последовательностей гена 16S рРНК, амплифицированных с использованием универсальных бактериальных праймеров (Гавриш и др., 2004), проводили с применением набора реактивов CEQ Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе MegaBAСE 1000 (JSC GE «Healthcare», США). Нуклеотидные последовательности гена 16S рРНК изучаемых изо-лятов сравнивали с нуклеотидными последователь- ностями типовых штамммов близкородственных видов из баз данных GenBank (http://www. и EzTaxon .
Результаты и анализ
Выделение, типирование и идентификация изолятов
Из образцов ТМО методом накопительного культивирования было выделено восемь штаммов бактерий, отличавшихся морфологическими и биохимическими признаками (табл. 1).
Таблица 1
Характеристика штаммов бактерий, выделенных из ТМО
|
Штамм |
Морфология колоний |
Морфология клеток |
^ Й ^ Щ H O sgS lls |
сё К „
§ Н |
2 |
|
КТ112-7 |
Светло-розовые, круглые, гладкие, неблестящие, размер 1–3 мм |
Мелкие кокки, одиночные/ пары/ цепочки |
+ |
+ |
– |
|
КТ1131 |
Светло-розовые, круглые, гладкие, блестящие, размер 2–3 мм |
Кокки, одиночные/ па-ры/цепочки (4, 8 клеток) |
+ |
+ |
– |
|
КТ1132 |
Светло-желтые, круглые, гладкие, блестящие, размер 2–4 мм |
Мелкие одиночные кокки |
– |
+ |
– |
|
КТ15412 |
Светло-розовые, круглые, гладкие, блестящие, размер1–2 мм. |
Кокки, одиночные/пары/ цепочки из 4 клеток |
+ |
+ |
– |
|
КТ1612 |
Желто-оранжевые, округлые, с неровным краем, размер 2–3 мм. |
Мелкие палочки, подвижные |
– |
+ |
– |
|
РО2 |
Кремовые, округлые, с неровным краем, блестящие, размер 4–8 мм. |
Мелкие палочки, подвижные |
+ |
+ |
– |
|
РО11 |
Светло-розовые, круглые, гладкие, блестящие, размер 1–2 мм. |
Кокки, одиночные/пары/ цепочки из 4 клеток |
+ |
+ |
– |
|
РО12 |
Ярко-оранжевые, круглые, гладкие, блестящие, размер 1–2 мм. |
Мелкие кокки, одиночные/ пары/ цепочки из 4 клеток |
+ |
+ |
– |
Проведена сравнительная характеристика выделенных штаммов с использованием методов REP-ПЦР и ВОХ-ПЦР. Анализ полученных REP-ПЦР профилей фрагментов геномной ДНК исследуемых штаммов показал, что грамположительные штаммы КТ112-7, КТ15412, КТ1131, характеризующиеся сходными морфологическими признаками (табл. 1), принадлежат к трем геномогруппам (рис. 2А). Штамм КТ1131 имеет подобный ПЦР-профиль со штаммом КТ81, изолированным из нафталиновой накопительной культуры (данные не приводятся), что предполагает идентичность выделенных штаммов.
Анализ ВОХ-ПЦР профилей подтвердил принадлежность штаммов КТ112-7 и КТ1131 к гено-могруппам I и II соответственно. Фингерпринт грамотрицательного штамма КТ1612 имеет значительные отличия от таковых грамположительных изолятов (рис. 2Б).
У штаммов КТ112-7, КТ1131 (геномогруппы I и II), КТ1612 и PO2 были определены нуклеотид- ные последовательности фрагмента гена 16S рРНК (табл. 2).
Таким образом, штаммы-деструкторы орто фталата из ТМО, сформировавшихся в шламоот-стойниках соледобывающего производства, характеризуются таксономическим разнообразием: выявлены актинобактерии рода Rhodococcus, споровые бактерии рода Bacillus и протеобактерии рода Pseudomonas.
Устойчивость бактерий-деструкторов к повышенной солености среды
Бактерии способны к росту как при отсутствии в среде хлорида натрия, так и при повышенной солености (табл. 3), на основании чего они были отнесены к галотолерантным/галофильным микроорганизмам (Кашнер, 1981). Так, пять штаммов росли в диапазоне концентраций NaCl от 0% до 6%, штамм Pseudomonas sp. КТ1612 – до 7%, грамположительный штамм КТ15412 – до 8%, а штамм Bacillus sp. РО2 – до 15% соли на богатой агаризованной среде Раймонда.
1 2 3 4 M Ml 1 2 3 4 5 М2
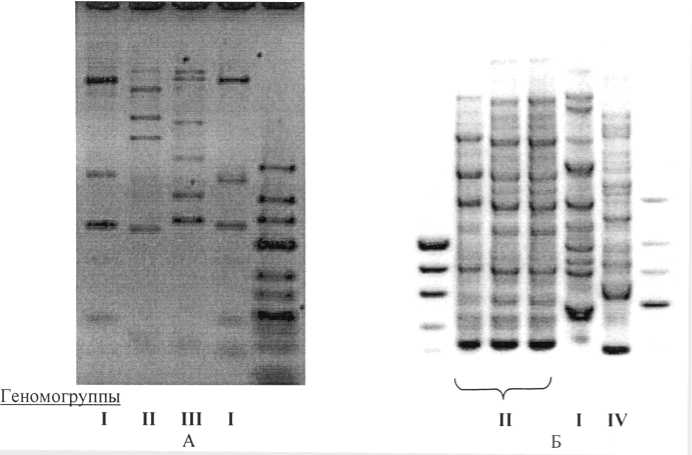
1 – КТ1131; 2 – КТ112-7; 3 – КТ15412; 4 – КТ81 (штамм-деструктор нафталина); M – маркер Gene Ruler DNA Ladder Low Range («Fermentas», Литва)
Рис. 2 . (А) Электрофореграмма продуктов REP-ПЦР штаммов-деструкторов:
(Б) Электрофореграмма продуктов ВОХ-ПЦР штаммов-деструкторов:
М1 – pUC19 DNA/MspI ( Hpa II) Marker, 23 («Fermentas», Литва); 1, 2, 3 – клоны штамма КТ112-7; 4 – КТ1131; 5 – КТ1612; M2 – маркер Gene Ruler DNA Ladder Low Range («Fermentas», Литва)
Таблица 2
Анализ нуклеотидных последовательностей генов 16S рРНК бактерий-деструкторов орто -фталата
|
Штамм |
Размер нуклеотидной последовательности, п.н. |
Типовые штаммы из международной базы данных GenBank |
Сходство (%) |
|
КТ112-7 |
1400 |
Rhodococcus wratislaviensis NCIMB 13082T |
100 |
|
КТ1131 |
682 |
Rhodococcus erythropolis NBCC 100887 T |
99,7 |
|
КТ1612 |
885 |
Pseudomonas xanthomarina KMM 1447T |
98,1 |
|
PO2 |
568 |
Bacillus marisflavi TF-11T |
99,4 |
На минеральной агаризованной среде с орто фталатом в качестве субстрата исследуемые штаммы росли как без добавления соли, так и при содержании хлорида натрия в среде: штамм
КТ1132 – до 3%, штаммы КТ112-7, КТ1131, КТ15412, КТ1612, РО11 – до 6%, штаммы РО2 и
РО12 – до 9% соли (табл. 3).
Таблица 3
Рост бактерий в присутствии различных концентраций хлорида натрия
|
Штамм |
Концентрация NaCl (%), среда АБР |
Концентрация NaCl (%), АМР, орто -фталат |
||||||||||||
|
Без NaCl |
3 |
5 |
6 |
7 |
8 |
9 |
10 |
12 |
15 |
Без NaCl |
3 |
6 |
9 |
|
|
КТ112-7 |
++ |
+++ |
+++ |
++ |
– |
– |
– |
– |
– |
– |
+++ |
+++ |
++ |
– |
|
КТ1131 |
++ |
+++ |
+++ |
++ |
– |
– |
– |
– |
– |
– |
+++ |
++ |
++ |
– |
|
КТ1132 |
++ |
+++ |
+++ |
++ |
– |
– |
– |
– |
– |
– |
+++ |
++ |
– |
– |
|
КТ15412 |
++ |
+++ |
+++ |
+++ |
+++ |
+ |
– |
– |
– |
– |
+++ |
++ |
++ |
– |
|
КТ1612 |
++ |
+++ |
+++ |
+++ |
++ |
– |
– |
– |
– |
– |
++ |
++ |
++ |
– |
|
РО2 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
+ |
|
РО11 |
+++ |
+++ |
+++ |
++ |
+ |
– |
– |
– |
– |
– |
+++ |
+++ |
++ |
– |
|
РО12 |
+++ |
+++ |
+++ |
++ |
– |
– |
– |
– |
– |
– |
++ |
+++ |
++ |
– |
Примечание. «+» – слабый рост; «++» – средний рост; «+++» – хороший рост; «–» – отсутствие роста бактерий.
Деструкция ароматических углеводородов изолированными бактериями
Исследуемые штаммы были выделены из накопительных культур, где орто- фталат добавлялся в качестве субстрата. Показано, что максимальная оптическая плотность (ОП 540 ) индивидуальных культур (штаммов КТ1131, КТ1132, КТ15412), растущих в жидкой минеральной среде Раймонда на орто -фталате, составляла 0,2 о.е. Наиболее эффективный рост при перечисленных выше условиях наблюдался у штамма КТ112-7 (ОП 540 = 0,85 о.е.).
Микробная деструкция многих полиароматиче- ских соединений осуществляется через образование орто-фталевой кислоты (Seo et al., 2009). Нами было установлено, что выделенные бактерии-деструкторы способны к росту на различных ароматических углеводородах и продуктах их разложения (табл. 4). Все культуры росли на бензоле, толуоле, феноле, пара-гидроксибензойной и про-токатеховой кислотах. Активный штамм-деструктор орто-фталата КТ112-7, в отличие от других штаммов, обладает наиболее широкой субстратной специфичностью и характеризуется интенсивным ростом на бифениле, нафталине, бензоате, гентизате (табл. 4).
Таблица 4
Рост бактерий на различных ароматических углеводородах
|
Штамм |
Субстрат |
|||||||||
|
Бензол |
Толуол |
Фенол |
Биф. |
Наф. |
Бензоат |
Сал. |
Гент. |
ПГБК |
ПКК |
|
|
КТ112-7 |
+++ |
++ |
+++ |
+++ |
+++ |
+++ |
– |
+++ |
+++ |
++ |
|
КТ1131 |
++ |
++ |
+++ |
+++ |
– |
– |
+ |
++ |
++ |
+++ |
|
КТ1132 |
++ |
++ |
++ |
+ |
– |
н.о |
– |
++ |
н.о |
+++ |
|
КТ15412 |
+++ |
++ |
+++ |
– |
– |
+++ |
+ |
+++ |
+++ |
+++ |
|
КТ1612 |
++ |
+++ |
+++ |
+ |
+ |
+ |
– |
– |
+++ |
+++ |
|
РО2 |
++ |
+++ |
+++ |
+ |
+ |
+ |
+ |
– |
+++ |
+++ |
|
РО11 |
++ |
++ |
+++ |
+ |
+ |
+++ |
+ |
++ |
+++ |
+++ |
|
РО12 |
+ |
++ |
++ |
– |
– |
+++ |
++ |
++ |
+++ |
++ |
Рост бактерий: «+» – слабый, «++» – средний, «+++» – хороший; «–» – отсутствие роста; Биф. – бифенил; Наф. – нафталин; Сал. – салицилат; Гент. – гентизат, ПГБК – пара -гидроксибензойная кислота; ПКК – протокатеховая кислота.
Заключение
В исследуемых образцах техногенноминеральных образований района разработок Верхнекамского месторождения солей обнаружены грамположительные и грамотрицательные бактерии-деструкторы орто -фталата, отличающиеся по физиологическим, деструктивным характеристикам и таксономическому положению. На основании фенотипических и генетических особенностей четыре изолята были отнесены к родам Rho-dococcus , Pseudomonas , Bacillus . Было показано, что исследуемые штаммы являются галотолерант-ными/галофильными бактериями и, кроме того, штаммы рода Rhodococcus способны использовать орто -фталат как единственный источник углерода и энергии в условиях повышенной солености среды (при содержании NaCl до 9%). Полученные результаты указывают на перспективность дальнейшего исследования выделенных бактерий, в том числе с целью изучения возможности их использования при очистке засоленных почв, грунтов, водоемов от стойких органических загрязнителей (фталатов, полиароматических углеводородов).
Работа поддержана Программой Президиума РАН «Молекулярная и клеточная биология», проект «Исследование метаболизма токсичных органических соединений у аэробных бактерий, анализ генетических и ферментных систем биотрансфор- мации» (ГР №01200963682), ФЦП «Научные и научно-педагогические кадры инновационной России».
Список литературы Бактерии-деструкторы орто-фталевой кислоты, выделенные из отходов калийного производства
- Бачурин Б.А., Одинцова Т.А. Стойкие органические загрязнители в отходах горного производства//Совр. экол. проблемы Севера. Апатиты: Изд-во Кольского НЦ РАН, 2006. Ч. 2. С. 7-9.
- Гавриш Е. Ю., Краузова В.И., Потехина Н.В. и др. Три новых вида бревибактерий -Brevibacterium antiguum sp. nov., Brevibacterium aurantiacum sp. nov. и Brevibacterium permense sp. nov.//Микробиология. 2004. Т. 73, № 2. С. 218-225.
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир, 1981. 390 с.
- Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии//Молекулярное клонирование. М.: Мир, 1984. 390 с.
- Методы общей бактериологии/под ред. Ф. Герхардт и др. М.: Мир, 1983. Т. 1-3.
- Определитель бактерий Берджи/под ред. Дж. Хоулта и др. М.: Мир, 1997. Т. 1-2.
- Розанова Е.П., Назина Т.Н. Углеводородокисляющие бактерии и их активность в нефтяных пластах//Микробиология. 1982. Т. 51. С. 324-348.
- Liang D.-W., Zhang T., Fang H. et al. Phthalates biodegradation in the environment//Appl. Microbiol. Biotechnol. 2008. Vol. 80. P. 183-198.
- Seo J-S., Keum Y-S., Li Q.X. Bacterial degradation of aromatic compounds//Int. J. Environ. Res. Public. Health. 2009. Vol. 6. P. 278-309.
- Vamsee-Krishna C., Mohan Y., Phale P.S. Biodegradation of phthalate isomers by Pseudomonas aeruginosa PP4, Pseudomonas sp. PPD and Acinetobacter lwoffii ISP4//Appl. Microbiol. Biotechnol. 2006. Vol. 72. P. 1263-1269.
- Versalovic J., Schneider M., de Bruijn F.J. Genomic fingerprinting of bacteria using repetitive sequencebased polymerase chain reaction//Meth. Cell. Mol. Biol. 1994. Vol. 5. P. 25-40.


