Бактерии-деструкторы полихлорированных бифенилов из почв с различным уровнем загрязнения
Автор: Егорова Д.О., Шестакова Е.А., Первова М.Г., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Наличие в почвах специфического загрязнения, в частности присутствие галогенароматиче-ских соединений, привело к формированию в микробном сообществе бактерий, способных разрушать вещества группы «стойкие органические загрязнители» (СОЗ): штаммы Rhodococ-cus sp. Ch628, Microbacterium oxydans B51 и Rhodococcus erytropolis B7a эффективно разлагали как индивидуальные ПХБ, так и их промышленные смеси. В то же время, в почвах, отобранных в экологически чистом районе (Республика Бурятия), не были выявлены активные штаммы-деструкторы токсичных соединений.
Полихлорированные бифенилы, соз, почва, загрязнение, штаммы-деструкторы
Короткий адрес: https://sciup.org/147204697
IDR: 147204697 | УДК: 579.87
Текст научной статьи Бактерии-деструкторы полихлорированных бифенилов из почв с различным уровнем загрязнения
Процессы естественной селекции бактерий с теми или иными свойствами протекают в почвах непрерывно. При этом направление отбора зависит от спектра и количества химических соединений, присутствующих в почве.
В настоящее время остро стоит проблема поиска бактериальных штаммов, обладающих высокой деструктивной активностью по отношению к стойким органическим загрязнителям (СОЗ). В группу СОЗ включены хлорароматические соединения, в частности полихлорированные бифенилы (ПХБ), линдан, гексахлорбензол, особо устойчивые к воздействию физических, химических и биологических факторов .
Анализ научных публикаций и собственные исследования показали, что бактериальная деструкция – это один из оптимальных способов утилизации данных соединений как с экологических, так и с экономических позиций [Unterman, 1996; Зана-вескин, Аверьянов, 1998; Pieper, 2005; Васильева, Стрижакова, 2007; Хоменков и др., 2008; Егорова и др., 2010; Егорова, Демаков, Плотникова, 2011; Егорова, Плотникова, 2011]. Однако для очистки обширных территорий от ПХБ и других СОЗ, перспективно применение штаммов, деструктивные свойства которых являются результатом естественного отбора в природных эконишах.
Цель работы – выделение и исследование штаммов-деструкторов хлорароматических веществ из районов с разной техногенной нагрузкой.
Материалы и методы исследования
Образцы почв. Почвы отбирали в районах, находящихся на значительном расстоянии друг от друга и отличающихся уровнем экологического благополучия:
-
1. Образцы под шифром SSE были получены с территории, прилегающей к оз. Сульфатное Селен-гинского р-на республики Бурятия. 51°22'N106°35'E
-
2. Образцы под шифром SBE – с территории, прилегающей к оз. Белое Иволгинского р-на республики Бурятия. 51°32'N107°1'E
-
3. Образцы BP – с территории г. Березники, прилегающей к промышленным предприятиям, Пермский край. 59°28'N56°46'E
-
4. Образцы СH – с территории предприятия ОАО СВЗХ, г. Чапаевск, Самарской обл.
52°59'N49°41'E
Формат координат: Ddd градусов mm минут ss.s секунд.
Все образцы отобраны по методу «конверта» с соблюдением правил асептики в радиусе 100 м от указанной точки. Для дальнейшего анализа брали усредненную пробу.
Анализ почв на загрязнение. Обработку проб почвы проводили по «Методике выполнения измерений массовой концентрации полихлорбифенилов в воздухе рабочей зоны, промвыбросах, природных и сточных водах и почвах методом газожидкостной хроматографии» № 88-16358-25-2000. Условия хроматографирования.
ГХ-ПИД условия : газовый хроматограф «Shimadzu GC 2010», с пламенно-ионизационным детектором, кварцевой капиллярной колонкой ZB-5 длиной 30 м, диаметром 0.25 мм, толщина пленки 0.25 мкм. Начальная температура колонки 40°С (выдержка 3 мин.), далее нагрев со скоростью 10°С/мин. до 280°С (выдержка 30 мин.). Температура испарителя 250°С, детектора 300°С. Газ-носитель – азот, деление потока 1:30, расход через колонку 1.0 мл/мин. Вводили 1.0 мкл.
ГХ-ЭЗД условия : газовый хроматограф «Shi-madzu GC 2010Plus», с электроно-захватным детектором, кварцевой капиллярной колонкой GsBP-5MS длиной 30 м, диаметром 0.25 мм, толщина пленки 0.25 мкм. Начальная температура колонки 40°С (выдержка 3 мин.), далее нагрев со скоростью 10°С/мин., до 280°С (выдержка 30 мин.). Температура испарителя 250°С, детектора 300°С. Газ-носитель – азот, деление потока 1:30, расход через колонку 1.0 мл/мин. Вводили 1.0 мкл.
ГХ-МСД условия: газовый хроматограф-масс-спектрометр «Agilent GC 7890A MS 5975C Inert XL EI/CI» с квадрупольным масс-спектрометрическим детектором, кварцевой капиллярной колонкой HP-5MS длиной 30 м, диаметром 0.25 мм, толщина пленки 0.25 мкм.; электронная ионизация (70 эВ); сканирование по полному ионному току в интервале m/z 20–1000 Da; газ-носитель – гелий, деление потока 1:50, расход через колонку 1.0 мл/мин.; температура колонки – начальная 40°С (выдержка 3 мин.), программирование со скоростью 10°С/мин. до 290°С (выдержка 30 мин.), температура испарителя – 250°С, температура источника – 230°С, квадруполя – 150°С, переходной камеры – 280°С. Вводили 1.0 мкл.
Идентификацию компонентов проводили на основании базы масс-спектров NIST05 и калибровочных хроматограмм ГСО 7821-2000 «Совол».
Штаммы-деструкторы. В работе использованы штаммы, осуществляющие разложение одного или нескольких хлорароматических соединений: Microbacterium oxydans B51 [Рыбкина и др., 2003],
Rhodococcus erytropolis B7a [Егорова и др., 2010], Rhodococcus sp. Ch628 и Pseudomonas sp. SBE14a (настоящее исследование).
Выделение штаммов-деструкторов проводили двумя методами: методом накопительного культивирования, как описано [Рыбкина и др., 2003], и прямого высева на минеральную среду с бифенилом, в качестве источника углерода и энергии. Для выделения и роста бактерий-деструкторов из образцов BP и CH использовали минеральную среду К1 [Зайцев, Карасевич, 1981], для образцов SSE и SSВ – минеральную среду АММ [Заварзина и др., 2006].
Для получения агаризованной среды добавляли агар до конечной концентрации 1.5%. При выращивании бактерий на агаризованных средах бифенил добавляли на крышку чашки Петри.
Определение таксономического положения изолированных штаммов. Морфологические признаки микроорганизмов изучали по общепринятым методикам [Методы…, 1983; Методы…, 1991]. Амплификацию генов 16S рРНК проводили с использованием бактериальных праймеров 27F и 1492R [Tiirola et al., 2002]. Секвенирование продуктов амплификации осуществляли с помощью набора реактивов DYEnamic ET Dye Terminator Cycle sequencing Kit на автоматическом секвенаторе Genetic analyser 3500XL (Applied Biosystems, США) согласно рекомендациям производителя. Полученные нуклеотидные последовательности анализировали с использованием программ CLUSTAL W [Thompson, Higgins, Gibson, 1994], TREECON [van de Peer, DeWachter, 1994], BLAST . Поиск гомологичных последовательностей производили по базам данных GenBank и EzTaxon .
Ростовые характеристики штаммов изучались в жидкой минеральной среде К1 [Zaitsev et al., 1991] или АММ [Заварзина и др., 2006]. Штаммы выращивали в колбах Эрленмейера объемом 250 мл в 100 мл минеральной среды при температуре 28оС и аэрации на шейкере со скоростью 220 об/мин. В качестве субстрата использовали бифенил в концентрации 1 г/л. Рост контролировали по изменению оптической плотности среды, измерение проводили на спектрофотометре Shimadzu BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм.
Деструкцию соединений группы СОЗ проводили, как описано [Егорова и др., 2010].
Продукты деградации хлорбифенилов (ХБ) определяли спектрофотометрически (спектрофотометр Shimadzu BioSpec-mini) и методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (хроматограф Shimadzu LC-20A, детектор Shima- dzu RF-20A, колонка Discovery C18 (150 x 4.6 мм) («Supelco», «Sigma-Aldrich», США)), как описано [Егорова и др., 2011]. Эксперименты с «отмытыми клетками» проводили аналогично экспериментам Д.О. Рыбкиной и др. [Рыбкина и др., 2003].
Статистическая обработка результатов. Все эксперименты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel.
Результаты и их обсуждение
Анализ почв, отобранных на территории г. Березники делены и описаны активные штаммы-деструкторы полихлорированных бифенилов и хлорбензойных кислот – Microbacterium oxydans B51 [Рыбкина и др., 2003] и Rhodococcus erytropolis B7a [Егорова и др., 2010]. Способность данных штаммов к разложению веществ группы СОЗ, в частности полихлорированных бифенилов, позволила предположить, что естественная селекция данных штаммов протекала в условиях специфического химического загрязнения.
Анализ образцов почв в условиях газовой хроматографии с применением различных детекторов показал наличие широкого спектра галогенированных ароматических и циклических соединений, а также алифатических углеводородов (рис. 1, табл. 1).
В результате ранее проведенных исследований
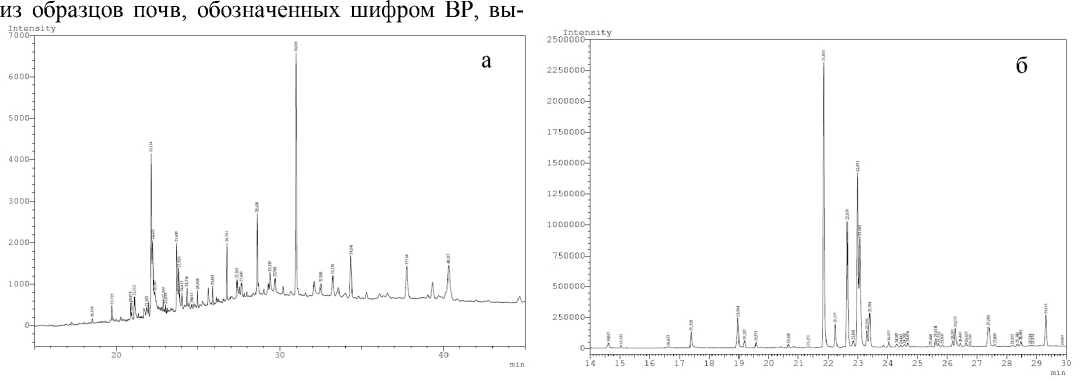
Рис. 1 . Хроматограммы усредненного образца почвы ВР с применением различных детекторов:
а – условия ГХ-ПИД, б – условия ГХ-ЭЗД
Таблица 1
Основные загрязнители, выявленные в усредненном образце почвы ВР 4
|
Время удерживания, мин |
Название |
Брутто-формула |
Молек. масса |
Структура |
|
|
ПИД |
ЭЗД |
||||
|
18.524 |
18.964 |
Pentadecane Benzene, tribromo- |
C15H32 C6H3Br3 |
212 312 |
Br Br Br |
|
19.725 |
Hexadecane |
C16H34 |
226 |
Линейный углеводород |
|
|
20.874 |
21.853 |
Thiophene, tetrabromo- |
C4Br4S |
396 |
Br S Br Br Br |
|
20.941 |
Heptadecane, |
C17H36 |
230 |
Линейный углеводород |
|
|
21.112 |
22.237 |
Dibromobenzo(b)thiophene |
C8H4Br2S |
290 |
S Br |
|
21.853 |
22.639 |
Benzene, tetrabromo- |
C6H2Br4 |
390 |
Br Br Br Br |
|
22.134 |
22.991 |
Naphthalene, dibromo- |
C10H6Br2 |
284 |
Br Br |
Окончание табл. 1
|
Время удерживания, мин |
Название |
Брутто-формула |
Молек. масса |
Структура |
|
|
ПИД |
ЭЗД |
||||
|
22.221 |
23.061 |
Naphthalene, dibromo- |
C10H6Br2 |
284 |
Br Br |
|
23.299 |
Naphthalene, dibromo- |
C10H6Br2 |
284 |
Br Br |
|
|
22.869 |
23.394 |
Benzene, tetrabromo- |
C6H2Br4 |
390 |
Br Br Br Br |
|
23.014 |
Nonadecane |
C19H40 |
268 |
Линейный углеводород |
|
|
23.689 |
24.307 |
Dibutyl phthalate |
C16H22O4 |
278 |
O OO O |
|
24.013 |
Eicosane |
C20H42 |
282 |
Линейный углеводород |
|
|
24.316 |
18-Norabietane |
C19H34 |
262 |
||
|
25.614 |
1,1'-Biphenyl, dibromo- |
C12H8Br2 |
310 |
Br ^оуУ(5у- Br |
|
|
24.968 |
Heneicosane |
C21H44 |
296 |
Линейный углеводород |
|
|
25.883 |
Docosane |
C22H46 |
310 |
Линейный углеводород |
|
|
27.380 |
DDE - Benzene, 1,1'-(dichloroethenylidene)bis[4-chloro- 2,4,6-Tribromobiphenyl |
C14H8Cl4 C12H7Br3 |
316 388 |
Cl Cl ууу Cl Cl Br Br Br Br |
|
|
26.761 |
Tricosane |
C23H48 |
324 |
Линейный углеводород |
|
|
27.385 |
29.315 |
p,p'-DDT |
C14H9Cl5 |
352 |
Cl Cl IC^JOJ Cl Cl Cl |
|
27.643 |
Tetracosane |
C24H50 |
338 |
Линейный углеводород |
|
|
28.610 |
Pentacosane |
C25H52 |
352 |
Линейный углеводород |
|
|
29.387 |
Di-n-octyl phthalate |
C24H38O4 |
390 |
O OO O |
|
|
29.708 |
Hexacosane |
C26H54 |
366 |
Линейный углеводород |
|
|
30.985 |
Heptacosane |
C27H56 |
380 |
Линейный углеводород |
|
|
32.500 |
Octacosane |
C28H58 |
394 |
Линейный углеводород |
|
Штаммы Microbacterium oxydans B51 и Rhodococcus erytropolis B7a осуществляли разложение моноароматических соединений, таких как бензол, толуол и ряд других, отличающихся типом и количеством заместителей в кольце [Рыбкина и др., 2003, Егорова и др., 2010]. Как видно из полученных данных, в почве присутствуют производ- ные бензола и фталевой кислоты (табл. 1). Таким образом, наличие данных соединений способствовало естественной селекции штаммов, обладающих ферментными системами окисления ароматических веществ.
Среди выявленных в ВР-образцах загрязнителей высока доля соединений, состоящих из двух ароматических колец. Известно, что разложение таких веществ происходит в результате ферментативного окисления кольца молекулы [Pieper, 2005, Solyanikova et al., 2008]. При этом в случае присутствия нескольких соединений, близких по структуре, в клетках бактерий могут активироваться уникальные сочетания ферментативных путей. Следует отметить, что штаммы Microbacterium oxydans B51 и Rhodococcus erytropolis B7a характеризуются высокой деструктивной активностью по отношению к полихлорированным бифенилам и их химически модифицированным производным, а также обладают уникальным сочетанием ферментов, обусловливающих окисление сложных ароматических соединений [Рыбкина и др., 2003, Егорова и др., 2010; Егорова, Демаков, Плотникова, 2011; Егорова, Плотникова, 2011].
Для дальнейших исследований были отобраны образцы почв на двух территориях, отличающихся по уровню экологического благополучия.
Анализ образцов почв с территории республики Бурятия
Районы оз. Сульфатное и Белое республики Бурятия являются экологически благополучными.
Газохроматографический анализ с применением трех возможных детекторов не выявил загрязнения в почвах Селенгинского р-на (образцы SSE). В образцах SBE из Иволгинского р-на обнаружены в следовых количествах гексахлорбензол и линдан, входящие в группу СОЗ и являющиеся инсектицидами (табл. 2).
Таблица 2
Основные загрязнители, выявленные в почвах образцов SBE
|
Время удерживания, мин. |
Название |
Брутто-формула |
Молек. масса |
Структура |
|
|
ПИД |
ЭЗД |
||||
|
21.499 |
22.278 |
Benzene, hexachloro- |
C6Cl6 |
282 |
Cl Cl Cl Cl Cl |
|
22.680 |
22.786 |
Lindane |
C6H6Cl6 |
288 |
Cl Cl Cl Cl Cl Cl |
Выделение штаммов-деструкторов из образцов почв с территории республики Бурятия
Из образцов почв SSE ни одним из использованных способов не удалось получить штаммы, способные расти на минеральной среде с бифенилом в качестве единственного источника углерода и энергии.
Методом накопительного культивирования в минеральной среде с бифенилом с последующим рассевом до единичных колоний из образцов SВE получено 1.5 х 10 6 КОЕ/г почвы. Все колонии были разделены на 2 морфотипа:
-
а) колонии округлые диаметром 3 мм, поверхность гладкая, блестящая, профиль выпуклый, прозрачные, бесцветные, край ровный, структура однородная;
-
б) колонии округлые диаметром 2–3 мм, поверхность гладкая, блестящая, профиль выпуклый, прозрачные, цвет бледно-желтый, ровный край, однородная структура.
Представители морфогрупп были идентифицированы на основе анализа нуклеотидных последовательностей гена 16S рРНК. Показано, что среди обнаруженных бактерий присутствуют представи- тели родов Achromobacter, Pseudomonas и Halomonas.
Для дальнейших исследований был отобран штамм SBE14а. У данного штамма определена нуклеотидная последовательность гена 16S рРНК длиной 1412 п.н. и проведено сравнение с гомологичными последовательностями, имеющимися в международных базах данных GenBank/EMBL/DDBJ и на сервере EzTaxon . Выявлена филогенетическая близость исследуемого штамма с типовым штаммом Pseudomonas stutzeri CCUG11256T (GenBank U26262). На настоящем этапе исследования штамм идентифицирован как Pseudomonas sp.
Исследование ростовых характеристик показало, что штамм Pseudomonas sp. SBE14а активно растет в жидкой минеральной среде (максимальная оптическая плотность составляла ОП 600 =0.78 оп.ед.) и использует незамещенный бифенил как источник углерода и энергии. Однако штамм не проявлял деградативной активности к хлорированным бифенилам.
Таким образом, из почв с низким уровнем загрязнения хлорароматическими соединениями не удалось выделить активных штаммов-деструкторов.
Анализ образцов почв с территории г. Чапаевск
Город Чапаевск с 1999 г. признан зоной экологического бедствия . На его территории находятся предприятия, на которых длительное время производили вещества хлорароматического ряда.
В ходе данной работы проведен анализ почвы, отобранной на территории предприятия, производившего широкий спектр химических соединений (рис. 2, табл. 3).
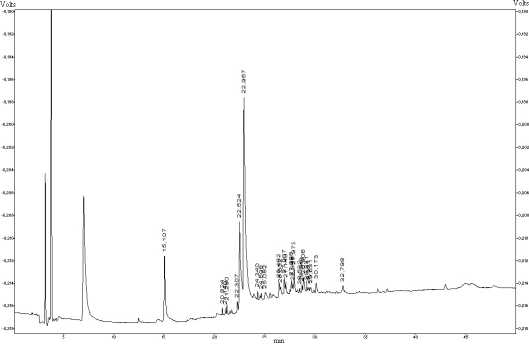
Рис. 2 . Хроматограмма усредненной пробы почв образцов СН
Таблица 3
Основные загрязнители, выявленные в усредненной пробе образцов СН
|
Время удерживания, мин. |
Название |
Брутто-формула |
Молек. масса |
Структура |
|
|
ПИД |
ЭЗД |
||||
|
21.499 |
22.278 |
Benzene, hexachloro- |
C6Cl6 |
282 |
Cl Cl Cl Cl Cl |
|
22.680 |
22.786 |
Lindane |
C6H6Cl6 |
288 |
Cl Cl Cl Cl Cl Cl |
|
26.482 – 32.798 |
Polychlorobiphenyl (mix) |
C 12 H n Cl m |
Cl Cl Cl Cl Cl Cl Cl дод Cl Cl Cl |
||
При анализе в условиях ГХ-ПИД на хроматограммах образцов почвы регистрируется пики соединений, соответствующие смеси углеводородов С 17 -С 25 , дибутил- и диоктилфталатам. При регистрации в условиях ГХ-ЭЗД на хроматограммах регистрируются пики ПХБ, гексахлорбензола и линдана (γ-гексахлор-циклогексан).
Количественная оценка показала, что содержание данных веществ в почве превышает допустимые нормы (табл. 4).
Таблица 4
Содержание веществ группы СОЗ в образце почвы СН
|
Соединение |
ПДК, мг/кг |
В образце СН, мг/кг |
|
гексахлорбензол |
0.03 |
0.816 |
|
линдан |
0.1 |
5.468 |
|
смесь ПХБ |
0.06 |
0.408 |
Выделение штаммов-деструкторов из образцов почв г. Чапаевска
Методом прямого высева установлено, что в образцах почвы СН в значительном количестве присутствуют бактерии, способные расти на мине- ральной среде с бифенилом (8.6 х 106 КОЕ/г почвы).
Методом накопительного культивирования с последующим рассевом до единичных колоний из образцов СН получено 25.9 х 106 КОЕ/г почвы, способных использовать бифенил в качестве ростового субстрата. Выделено две доминирующие группы бактерий, отличающихся морфологией колоний. Анализ нуклеотидных последовательностей гена 16S рРНК показал принадлежность основных представителей данных морфогрупп к родам Pseudomonas и Rhodococcus.
Для дальнейшего исследования отобран штамм Сh628. Анализ нуклеотидной последовательности гена 16S рРНК длиной 1390 п.н. и сравнение с гомологичными последовательностями выявил филогенетическую близость исследуемого штамма с типовым штаммом Rhodococcus wratislaviensis NCIMB 13082T (GenBank Z37138).
При культивировании штамма Сh628 в жидкой минеральной среде с бифенилом установлено, что максимальная оптическая плотность культуры составляет ОП 600 =0.299 оп.ед. и достигается за 72 ч.
Установлено, что штамм Rhodococcus sp. Ch628 проявляет высокую активность к хлорированным бифенилам (табл. 5).
Штамм Ch628 осуществляет почти 100%-ное разложение моно- и дихлорированных бифенилов за 48 ч. Несколько ниже показатель при разложении трихлорированных бифенилов. Следует отметить, что исследуемый штамм разрушает не только отдельные хлорбифенилы, но и их промышленные смеси (табл. 5). Подобная деградативная активность описана для ограниченного круга бактериальных штаммов-деструкторов [Pieper, 2005; Ade-busoye et al., 2007; Егорова и др., 2010].
Таблица 5
Разложение хлорированных бифенилов и их промышленных смесей штаммом Rhodococcus sp. Ch628
|
ПХБ |
Время деструкции, сут |
Концентрация ПХБ, мг/л |
Промежуточные продукты |
||
|
ГОФДК, ОП 397 |
ХБК, мг/л |
(ОН)БК, мг/л |
|||
|
0 |
18.9±0.02 |
Н.О. |
Н.О. |
Н.О. |
|
|
2ХБ |
1 |
0.51±0.02 |
Н.О. |
0.41±0.02 |
2.79±0.02 |
|
2 |
0.05* ±0.01 |
Н.О. |
0.46±0.01 |
2.77±0.01 |
|
|
0 |
18.9±0.03 |
Н.О. |
Н.О. |
Н.О. |
|
|
4ХБ |
1 |
0.936±0.02 |
Н.О. |
0.09±0.02 |
0.08±0.01 |
|
2 |
0.59±0.01 |
Н.О. |
0.11±0.01 |
0.16±0.01 |
|
|
0 |
22.3±0.02 |
Н.О. |
Н.О. |
Н.О. |
|
|
2,4'-ХБ |
1 |
2.29±0.04 |
0.612±0.002 |
0.01±0.03 |
0.42±0.02 |
|
2 |
0.17±0.01 |
0.465±0.001 |
0.02±0.01 |
0.57±0.03 |
|
|
0 |
12.9±0.03 |
Н.О. |
Н.О. |
Н.О. |
|
|
2,4,4'-ХБ |
1 |
4.79±0.02 |
0.289±0.001 |
0.001±0.0002 |
0.11±0.01 |
|
2 |
2.88±0.01 |
Н.О. |
0.002±0.0001 |
0.08±0.01 |
|
|
0 |
12.9±0.02 |
Н.О. |
Н.О. |
Н.О. |
|
|
2,4,2'-ХБ |
1 |
5.77±0.04 |
Н.О. |
0.003±0.0003 |
0.12±0.01 |
|
2 |
5.16±0.01 |
Н.О. |
0.005±0.0001 |
0.11±0.01 |
|
|
0 |
0.13±0.03 |
Н.О. |
Н.О. |
Н.О. |
|
|
«Делор 103» |
5 |
0.034 ±0.02 |
0.869±0.001 |
0.09±0.02 |
0.03±0.01 |
|
8 |
0.003 ±0.01 |
1.167±0.002 |
0.12±0.01 |
0.06±0.01 |
|
|
0 |
0.55±0.02 |
Н.О. |
Н.О. |
Н.О. |
|
|
«Совол» |
5 |
0.016 ±0.04 |
Н.О. |
0.14±0.03 |
Н.О. |
|
8 |
0.005 ±0.01 |
0.270±0.001 |
0.31±0.01 |
Н.О. |
|
Примечание. Н.О. – не обнаружено, «*» - жирным шрифтом выделены концентрации ниже значения ПДК.
Показано, что штамм Rhodococcus sp. Ch628 способен разлагать и ряд других соединений группы СОЗ (табл. 6). Так как данные вещества особо устойчивые как к химическому, так и к биологическому разложению, то уровень деструкции, показанный данным штаммом, несомненно, является значимым.
Таблица 6
Разложение соединений группы СОЗ штаммом Rhodococcus sp. Ch628
|
Вещество |
Начальная концентрация, мкг/мл |
Концентрация через 4 сут., мкг/мл |
Деструкция, % |
|
Хлорбензол |
10±0.1 |
0 |
100 |
|
Линдан |
0.2±0.01 |
0.15±0.01 |
20.7 |
|
ГХБ |
2.5±0.02 |
1.95±0.01 |
21.8 |
|
ДДТ |
0.2±0.01 |
0.13±0.01 |
30.5 |
Таким образом, штамм Rhodococcus sp. Ch628 обладает уникальным сочетанием деградативных свойств в отношении ряда соединений группы СОЗ.
Заключение
Загрязнение галогенароматическими углеводородами различных территорий является важным фактором в процессах естественного отбора групп бактерий, способных к разложению одного или нескольких веществ группы СОЗ.
В результате проведенных исследований установлено, что наиболее активные штаммы-деструкторы полихлорированных бифенилов, обладающие уникальным сочетанием ферментативных путей, выделены из почв, длительное время загрязненных галогенароматическими углеводородами. Показано, что штамм Rhodococcus sp. Ch628, способный эффективно разлагать смеси ПХБ и ряд других СОЗ, выделен из почв с высоким уровнем загрязнения данными веществами, а штаммы Microbacterium oxydans B51 [Рыбкина и др., 2003] и Rhodococcus erytropolis B7a [Егорова и др., 2010] – из почвы, загрязненной различными галогенароматическими и алифатическимим углеводородами. Напротив, в почвах из экологически чистого района не удалось обнаружить бактериальные штаммы с искомыми свойствами.
Работа поддержана грантом РФФИ-Урал №14-04-96021р_урал_а.
Список литературы Бактерии-деструкторы полихлорированных бифенилов из почв с различным уровнем загрязнения
- Васильева Г.К., Стрижакова Е.П. Биоремедиация почв и седиментов, загрязненных полихлори-рованными бифенилами//Микробиология. 2007. Т.76, №6. С. 725-741.
- Егорова Д.О. и др. Разложение хлорированных бифенилов и продуктов их биоконверсии штаммом Rhodococcus sp. В7а//Прикладная биохимия и микробиология. 2010. Т. 46, № 6. С. 644 -650.
- Егорова Д.О., Демаков В.А., Плотникова Е.Г. Разложение смеси (три-гекса)хлорированных би-фенилов штаммами рода Rhodococcus//Прикладная биохимия и микробиология. 2011. Т. 47, № 6. С. 655-662.
- Егорова Д.О., Плотникова Е.Г. Разложение смеси хлорированных бифенилов с преобладанием тетразамещенных конгенеров штаммом Microbacterium sp. B51//Вестник Уральской медицинской академической науки. 2011. № 4.1. С. 172-173.
- Заварзина Д.Г. и др. GEOALKALIBACTER FER-RIHYDRITICUS GEN. NOV., SP. NOV., первый алкалофильный представитель семейства GEOBACTERACEAE, выделенный из содового озера//Микробиология. 2006. Т. 75, № 6. С. 775-785
- Зайцев Г.М., Карасевич Ю.Н. Подготовительный метаболизм 4-хлорбензойной кислоты у Arthrobacter globiformis//Микробиология. 1981. T.50. C. 423-428.
- Занавескин Л.Н., Аверьянов В.А. Полихлорбифенилы: проблемы загрязнения окружающей среды и технологические методы обезвреживания//Успехи химии. 1998. Т. 67, № 8. С. 788-800.
- Методы общей бактериологии/под ред. Ф. Гер-хардт и др. М.: Мир, 1983. Т. 1-3.
- Методы почвенной микробиологии и биохимии: учеб. пособие/под ред. Д.Г. Звягинцева. М.: Изд-во МГУ, 1991. 304 с.
- Рыбкина Д. О. и др. Новый аэробный грамположительный микроорганизм с уникальными свойствами деструкции орто-и пара-хлорированных бифенилов//Микробиология. 2003. Т. 72, № 6. С. 759-765.
- Хоменков В.Г. и др. Организация метаболических путей и молекулярно-генетические механизмы биодеградации ксенобиотиков у микроорганизмов//Прикладная биохимия и микробиология. 2008. Т. 44, № 2. С. 133-152.
- Adebusoye A.S. et al. Growth on dichlorobipnenyls with chlorine substitution on each ring by bacteria isolated from contaminated African soils//Appl. Microbial. Biotechnol. 2007. Vol. 74. P. 484-492.
- Pieper D.H. Aerobic degradation of polychlorinated biphenyls//Appl. Microbiol. Biotechnol. 2005. Vol. 67. P. 170-191.
- Solyanikova I.P. et al. Varyability of enzyme system of Nocardioform bacteria as a basis of their metabolic activity//J. Environmental Science and Health. Part B. 2008. Vol. 43. P. 241-252.
- Thompson J.D., Higgins D.G., Gibson T.J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment son///Nucleic. Acids. Res. 1994. Vol. 22. P. 4673-4680.
- Tiirola M.A. et al. Isolation and characterization of Novosphingobium sp. Strain MT1, a dominant polychlorophenol-dagrading strain in a groundwa-ter bioremediation system//Appl. Environ. Mi-crobiol. 2002. Vol. 68. P. 173-180.
- Unterman R. A history of PCB biodegradation//Bio-remediation. Principles and Applications/Eds. Crawford R.L., Crawford D.L. Cambridge Univarsity Press: New York, 1996. P. 209-253.
- Van de Peer Y., DeWachter R. TREECON for Windows a software package for the construction and drawing of evolutionary trees for the Microsoft Windows environment//Comput. Appl. Biosci. 1994. Vol. 10. P. 569-570.
- Zaitsev G.M. et al. Genetic control of degradation of chlorinated benzoic acids in Arthrobacter globiformis, Corynebacterium sepedonicum and Pseu-domonas cepacia strains//FEMS Microbiol. Lett. 1991. Vol. 81. P. 171-176.


