Бактериоцины молочнокислых бактерий
Автор: Сультимова Т.Д., Захаров Е.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Биологические науки
Статья в выпуске: 2 (59), 2016 года.
Бесплатный доступ
Антимикробное действие молочнокислых бактерий люди использовали издавна для увеличения срока годности пищевых продуктов за счет образования молочной кислоты с сопровождающимся понижением уровня рН. В настоящее время доказано, что некоторые штаммы молочнокислых бактерий образуют так называемые бактериоцины - антимикробные вещества белковой природы. Синтез бактериоцинов - наследственная особенность микроорганизмов, проявляющаяся в том, что каждый штамм способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ. В настоящее время возрастает интерес к бактериоцинобразующим лактококкам рода Lactococcus lactis, которые вследствие своей безвредности, высокой ферментативной и антимикробной активности являются объектом фундаментальных исследований по созданию новых активных пробиотиков и биологических консервантов. В настоящее время предъявляются высокие требования к качеству продуктов питания и их безопасности для здоровья, поскольку широко используемые химические консерванты, увеличивающие срок хранения продуктов питания, вызывают опасения у потребителей.
Молочнокислые бактерии, бактериоцин, низин, низинпродуцирующий штамм
Короткий адрес: https://sciup.org/142148241
IDR: 142148241 | УДК: 577.18.05:577.182.44
Текст научной статьи Бактериоцины молочнокислых бактерий
Антимикробный эффект молочнокислых бактерий издавна использовался для продления срока годности пищевых продуктов [1]. Классические работы Л. Пастера открыли первые страницы в изучении этой группы микроорганизмов [2]. По мнению ряда исследователей, образование органических кислот (молочной и уксусной) из углеводов приводит к снижению рН среды и предотвращает развитие других микроорганизмов [3]. Кроме того, бактерицидным действием на специфические группы микроорганизмов, включая патогенные формы, развивающиеся в продуктах питания в процессе хранения и выделяющие энтеротоксины, обладают белковые вещества, выделяемые некоторыми видами бактерий - бактерио-цинов [4].
Бактериоцины представляют собой комплекс пептидов с молекулярной массой от 2 до 35 кДа, существенно отличающихся друг от друга по физико-химическим характеристикам и биологическим эффектам [6, 7]. Выявлено, что на проявление антагонистической активности бактериоцинов, продуцируемых молочнокислыми бактериями, влияют температура, электрическое поле, рН, состав, консистенция среды, присутствие Ca2+ и Mg2+ и другие факторы [7, 8, 9].
К числу общих свойств бактериоцинов относится их чувствительность к температуре, хотя это свойство также может варьировать в широких пределах. Некоторые разрушаются при температуре 48-50 ° С, другие кратковременно выдерживают температуру 60-70 ° С, а отдельные сохраняют активность даже при 100 ° С. Низин выдерживает кипячение до 120 ° С без потери активности.
Бактериоцины чувствительны к воздействию протеаз и имеют различный молекулярный вес (30000-100000 Да). Белок бактериоцина связан с липополисахаридом клеточной оболочки, но только белковая часть молекулы обладает антибактериальной активностью [11, 12].
На основании физико-химических свойств, аминокислотного состава, способов выведения, а также антимикробного спектра действия бактериоцины энтерококков различные исследователи разделяют на три класса: I, II, III [8, 13, 14].
Бактериоцины I класса
К первому классу бактериоцинов относятся лантибиотики, низкомолекулярные катионные, гидрофобные, устойчивые к нагреванию пептиды, в состав которых входят такие редкие тиоэфирные аминокислоты, как лантионин и Р —метиллантионин, дегидроаланин, дегидробутирин, и несколько тиоэфирных мостиков, которые замещают дисульфидные связи и придают этим белковым соединениям некоторую полициклическую структуру [6].
К этой группе относятся низины, образуемые Lactococcus (Streptococcus) lactis , эпидермин, галлидермин, продуцентом которого является St. gallinarum , а также субтилин (B. subtilis).
Примером первого класса бактериоцинов является низин - лантибиотик, секретируемый бактериями Lactococcus lactis . Содержит 34 остатка аминокислот (из них 30 остатков кислот (Lis, His, Asp, Ser, Pro, Gli, Ala, Val, Met, Ile, Leu), а также остатки редко встречающихся серосодержащих аминокислот: лантионина, р —метиллантионина и ненасыщенных аминокислот дегидроаланина и Р —метилдегидроаланина. Низин обладает бактерицидным действием на грамположительные микроорганизмы: стрептококки различных серологических групп, стафилококки, пневмококки, микобактерии, споровые - аэробные и анаэробные бактерии. Обладая способностью адсорбироваться на поверхности спор чувствительных к нему спорообразующих микроорганизмов, низин нарушает проницаемость спор, снижает устойчивость спор к воздействию высоких температур. Из аэробных споровых бактерий рода Bacillus к низину наиболее чувствительны Bac. stearothermophilus, Bac. coagulans, Bac. cereus , вызызвающие порчу молочных продуктов. Также чувствительны к действию низина споровые анаэробы рода Clostridium (Budde, Rasch, 2001) .
Бактериоцины II класса
Большинство бактериоцинов относится ко II классу. Представляют собой низкомолекулярные катионные термостабильные пептиды, сохраняющие свою активность при широком диапазоне рН (3–9), слабо иммуногенные и нетоксичные для человека и животных [6, 20, 21]. Они вызывают повреждение цитоплазматической мембраны грамположительных бактерий, а по современным данным - и грамотрицательных бактерий [10, 21, 22, 23]. Бактериоцины II класса чаще всего синтезируются как препептиды, а затем без модификации их аминокислотных остатков, в процессе секреции из клетки продуцентов утрачивают свои лидирующие компоненты. Гены, необходимые для продукции бактериоцинов II класса (регуляторные, гены, кодирующие препептид (или пептид), обеспечивающие транспорт через мембрану и устойчивость бактерий к собственному антимикробному пептиду), располагаются в плазмидах или в хромосоме. Кроме того, гены бактериоцинов могут быть обнаружены в мобильных транспозоноподобных генетических модулях ДНК-содержащих бактериофагов [20].
Бактериоцины II класса по химическому строению, особенностям выведения из клетки продуцента, спектру антимикробной активности разделяют на 3 подкласса: IIa, IIb, IIc [11, 20, 25].
Бактериоцины подкласса IIа
Бактериоцины подкласса IIa наиболее хорошо изучены. Чаще всего их называют пе-диоциноподобными пептидами. Во время экспорта через клеточную мембрану от молекулы их препептидов отрезается N-терминальная лидирующая последовательность с двумя глициновыми аминокислотными остатками на конце [26]. После секреции из клетки эти бактерио-цины представляют собой пептиды с молекулярной массой до 10 кДа, образующие, как правило, один дисульфидный мостик. После попадания в окружающую среду бактериоцины данного подкласса атакуют клетку-мишень за счет электростатического гидрофобного взаимодействия с последующим проникновением внутрь чувствительной клетки. Для специфического распознавания бактериоцином клетки-мишени необходимо присутствие на ее клеточной мембране маннозопротеиновых рецепторов, являющихся частью фосфотрансфераз-ной системы. В то же время нельзя исключить, что подобное взаимодействие является необязательным условием для проявления антагонистической активности к бактериям, в том числе и рода Listeria [22]. При помощи C-части пептиды проникают в мембрану и действуют на клетку-мишень, что определяет антибактериальную активность и специфичность бактерио-цина. Показано, что степень проникновения зависит от заряда липосом, а также от расположения аминокислотных остатков в С-части молекулы бактериоцина. Бактериоцины IIa типа формируют ионоселективные поры в клетках-мишенях, вызывая выход из последних ионов калия, аминокислот и других низкомолекулярных веществ. Это приводит к изменению ионного баланса, уровня рН в клетке и последующей быстрой потере внутриклеточной АТФ [26].
Бактериоцины подкласса IIb
Бактериоцины этого подкласса для наличия высокой антибактериальной активности должны состоять из двух различных субъединиц или пептидов, действующих только вместе или раздельно как синергисты [10, 11, 20]. До настоящего времени, несмотря на способность проявлять антибактериальную активность самостоятельно и расположение в различных генах, эти вещества не были выделены.
Бактериоцины подкласса IIс
К подклассу IIc относятся однопептидные бактериоцины, не имеющие каких-либо свойств, характерных для IIa бактериоцинов.
Бактериоцины подкласса IId
Этот подкласс бактериоцинов выделяют немногие авторы [20], предлагая отдельно рассматривать пептиды с особенным строением. Примером такого белкового соединения является бактериоцин AS-48. Бактериоцин AS-48 - первый из выделенных, один из наиболее изученных бактериоцинов [6, 12, 18, 22]. Он является циклическим пептидом с молекулярной массой 7,2 кДа, представляет собой полипептидную цепь из 70 аминокислотных остатков, замкнутых в кольцо. Известно, что подобная молекула обладает высокой конформационной изменчивостью [20]. Это свойство позволяет молекуле бактериоцина AS-48 связываться с поверхностными структурами широкого спектра бактерий. Девять генов, необходимых для синтеза, модификации, секреции этого первоначально пребактериоцина, устойчивости к нему продуцента, образуют кластер в плазмиде pAD1 (59 кБ) [21].
Бактериоцины III класса
Бактериоцины этого класса представляют собой антимикробные чувствительные к изменениям температуры белки с молекулярной массой более 30 кДа, способные расщеплять муреин клеточной стенки. К их числу относится энтеролизин А.
Классификация бактериоцинов позволяет систематизировать наши знания о природе и механизмах действия соответствующих групп антимикробных пептидов. Это создает возможность осуществлять подбор антимикробных пептидов или их комбинаций для терапии и профилактики соответствующей инфекционной патологии [17].
43 Вестник ВСГУТУ. № 2 (59). 2016
Механизм действия бактериоцинов
Учитывая большое разнообразие химического строения бактериоцинов, можно предположить, что они воздействуют на жизненно важные функции чувствительных клеток, но большинство действуют, образуя в мембране поры или каналы, способствующие нарушению мембранного потенциала чувствительных клеток [24, 25].
Анионные липиды цитоплазматической мембраны являются основными рецепторами бактериоцинов молочнокислых бактерий для стимуляции порообразования. Бактериоцины I класса могут вызывать формирование пор по типу клиноподобной модели, в то время как бактериоцины II класса способны функционировать, создавая поры, посредством которых пептиды располагаются параллельно мембранной поверхности и оказывают влияние на структуру мембран [36].
Наиболее хорошо изучен механизм действия бактериоцинов на примере низина (рис.).
При изучении действия низина стало ясно, что часть C-конца молекулы деполяризует цитоплазматическую мембрану, что ведет к мгновенной остановке синтеза компонентов клеточной стенки и всех биосинтетических процессов в клетке. Основной характер действия низина - это взаимодействие с отрицательно заряженными мембранами (билипидный слой), предпочтительно с мембранами, содержащими анионные липиды. Грамположительные бактерии имеют более высокие концентрации анионного липида в их цитоплазматической мембране по сравнению с грамотрицательными. Бактериоцин сначала связывает его C-конец с анионными липидами, после чего N-конец опускается в липид мембраны и пептид принимает параллельное положение на мембранной поверхности. И, в конечном счете, целый пептид имеет возможность переместиться по всей длине поры [24].
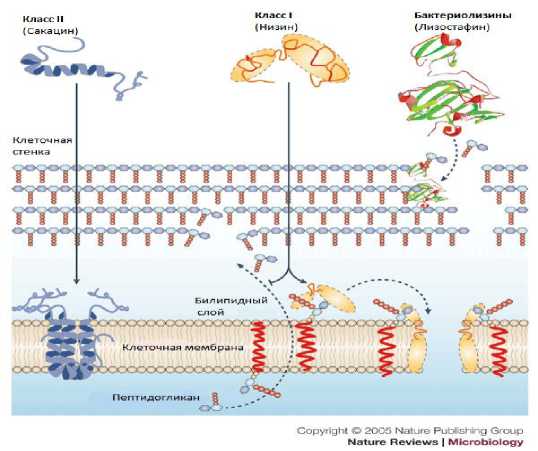
Рисунок - Механизм действия бактериоцинов
Низин ингибирует синтез муреина клеточной стенки. В результате действия антибиотика происходит накопление промежуточного липида, с которым низин образует прочный комплекс, что и приводит к остановке дальнейшего синтеза пептидогликана бактериальной стенки. Низин может вызывать лизис клеток вследствие необратимой деструкции клеточной мембраны, которая регулирует осмотическое давление клетки. Он изменяет поверхностное натяжение цитоплазматической мембраны, что приводит к нарушению клеточной проницаемости и, как следствие этого, к бактериальному лизису.
Перспективы применения бактериоцинов молочнокислых бактерий
Бактериоцин низин (имеет GRAS-cтатус – «признанный как безопасный», Е234), образуемый Lactococcus lactis, с успехом используют для увеличения сроков годности продуктов питания в пищевой промышленности многих стран уже более 50 лет. Низин впервые был ис- пользован в промышленном производстве как консервант в Великобритании для производства и сохранения сыров, и с этого момента его стали активно использовать в пище и напитках. В дальнейшем эффективность использования низина возможна вследствие его синер-гидного действия с хелатными и другими бактериоцинами как добавка в новые технологические процессы пищевой промышленности, при которых, возможно, будут пересмотрены режимы стерилизации при производстве консервов и пресервов для сохранения пищевой ценности продуктов [25].
Потребительский спрос на минимально обработанные пищевые продукты или «свежую еду» без химических консервантов стимулировал исследователей на поиск натуральных антимикробных средств [26]. Кроме того, бактериоцины, в отличие от антибиотиков, полностью расщепляются в организме, и вероятность возникновения осложнений от бактериоци-нов минимальна, а применение антибиотиков имеет для человека отрицательные последствия. Однако сферы применения известных форм бактериоцинов, как уже отмечалось, ограничены из-за низкой активности при нейтральных или щелочных значениях pH. Поэтому поиск бактериоцинов с улучшенными физико-химическими свойствами и широким антимикробным спектром представляет большой интерес не только для пищевой промышленности, но и для фармацевтической - при создании альтернативных антибиотиков, что является одной из самых актуальных проблем в области микробиологии и биотехнологии.
Список литературы Бактериоцины молочнокислых бактерий
- Нурушев М.Ж., Стоянова Л.Г., Бекеева С.А. и др. О проекте создания природного консерванта пищевых продуктов на основе бактериоцинов молочнокислых бактерий в Казахстане//Л.Н. Гумилев атындагы ЕҰУ Хабаршысы. -Вестник ЕНУ им. Л.Н. Гумилева. -2011. -№ 4.
- Тюрин М.В., Шендеров Б.А., Рахимова Н.Г. и др. К механизму антагонистической активности лактобацилл//Журн. микробиол., эпидемиол. и иммунобиол. -1989. -№ 2. -С. 3-8.
- Шлегель Г. Общая микробиология. -М.: Мир, 1987. -567 с.
- Блинкова Л.П., Альтшуллер М.Л., Дорофеева Е С. и др. Молекулярные основы продукции и действия бактериоцинов//Журн. микробиол. -2007. -№ 2. -С. 97-104.
- Ускова М.А. Изучение свойств пробиотических молочнокислых бактерий как биологически активных компонентов пищи: автореф.. канд. биол. наук. -М., 2010. -28 с.
- Minah C.J., Morero R.D. Inhibition of enterocin CRL35 antibiotic activity by mono-and divalent ions//Lett. Appl. Microbiol. -2003. -Vol. 37, N 5. -P. 374-379.
- Van den Berghe E., de Winter T., de Vuyst L. Enterocin A production by Enterococcus faecium FAIR-E 406 is characterised by a temperature and pH-dependent switch-off mechanism when growth is limited due to nutrient depletion//Int. J. Food Microbiol. -2006. -Vol. 107, Is. 2. -P. 159-165.
- Moreno M. R. F., Sarantinopoulos P., Tsakalidou, De Vuyst L. The role of appplication of enterococci in food and health//Int. J. Food Microbiol. -2006. -Vol. 106. -P. 1-24.
- De Vuyst L., Leroy F. Bacteriocins from Lactic Acid Bacteria: Production, Purification, and Food Applications//Mol. Microbiol. Biotechnol. -2007. -Vol. 13. -P. 194-199.
- Kraus A., Peschel D. Molecular Mechanisms of Bacterial Resistance to Antimicrobial Peptides. -Berlin; Heidelberg, 2006. -P. 231-250.
- Oscariz J.C., Pissabarro A.G. Classification and mode of action of membrane-active bacteriocins produced by gram-positive bacteria//Int. Microbiol. -2011. -N 18. -P. 13-19.
- Segarra R.A., Gilmore M. S., Booth M C. Genetic structure of the Enterococcus faecalis plasmid pAD1-encoded cytolytic toxin system and its relationship to lantibiotic determinants//J. Bacteriol. -2004. -Vol. 176. -P. 734-735.
- Bittencourt E., Suzart S. Occurrence of virulence-associated genes in clinical Enterococcus faecalis strains isolated in Londrina, Brazil//J. Med. Microbiol. -2004. -Vol. 53. -P. 1069-1073.
- Drider D., Fimland G., Héchard Y. The Continuing Story of Class IIa Bacteriocins//Microbiol. Mol. Biol. Rev. -2006. -Vol. 70, N 2. -Р. 564-582.
- Klaenhammer T.R. Genetics of bacteriocins produced by lactic acid bacteria//FEMS Microbiol. Rev. -2008. -N 22. -P. 39-86.
- Diep D.B., Havarstein L.S., Nes I.F. A family of bacteriocin ABC transporters carry out proteolytic processing of their substrates concomitant with export//Mol. Microbiol. -2008. -N 26. -P. 230-261.
- Ennahar S., Descamps N. Anti-Listerial effect of enterocin A, produced by cheese-isolated Enterococcus faecium EFMO1, relative to other bacteriocins from lactic acid bacteria//J. Appl. Microbiol. -2010. -Vol. 76, Is. 3. -P. 449-457.
- Brasseui R. Bennik M. H. J., Berlinda V. A novel bacteriocin from vegetable associated Enterococcus mundtii: full characterization and interaction with target organisms//Biochim. Biophys. Acta: Biomembr. -2008. -Vol. 1679, Is. 1. -P. 47-58.
- Zendo T., Eungruttanagorn N., Fujoka S. Identification and production of a bacteriocin from Enterococcus mundtii QU2 isolated from soybean//J. Appl. Microbiol. -2005. -Vol. 99, Is. 5. -P. 1181-1516.
- Farias R. N., Farias M. E., Holgado R. Letters in Purification and N-terminal acid sequence of enterocin CRL35, a pediocin-like bacteriocin produced by Enterococcus faecium CRL35//Appl. Microbiol. -2005. -Vol. 56. -P. 417-419.
- Dicks L. M. T., Balla E., Toit M. Characterization and Cloning of the Genes Encoding Enterocin 1071A and Enterocin 1071B, Two Antimicrobial Peptides Produced by Enterococcus faecalis BFE 1071//Appl. Environ. Microbiol. -2013. -Vol. 93, N 4. -P. 1298-1304.
- Criado R., Dzung B., Diep A. et al. Complete Sequence of the Enterocin Q-Encoding Plasmid pCIZ2 from the Multiple Bacteriocin Producer Enterococcus faecium L50 and Genetic Characterization of Enterocin Q Production and Immunity//Ibid. -2006. -Vol. 72, N 10. -P. 6653-6666.
- Глушанова Н.А., Шендеров Б.А. Взаимоотношения пробиотических и индигенных лактобацилл хозяина в условиях совместного культивирования in vitro II Журнал микробиол. -2005. -№ 2. -С. 56-61.
- Surugau L.N. Peptide separation by capillary electrophoresis with ultraviolet detection: some simple approaches to enhance detection sensitivity and resolution//The Malaysian Journal of Analytical Sciences. -2011. -Vol. 15 (2). -P. 273-287.
- Сультимова Т.Д. Выделение активных бактериоцинобразующих лактококков и их практическое использование: автореф.. канд. биол. наук. -М., 2006. -30 с.
- Ермоленко Е.И. Бактериоцины энтерококков: проблемы и перспективы использования II Вестник Санкт-Петербургского университета. Сер. 11. -2009. -Вып. 3.


