Белки клеточной подвижности при раке яичников: связь с клинико-морфологическими параметрами и эффективностью неоадъювантной химиотерапии
Автор: Юнусова Наталья Валерьевна, Кондакова Ирина Викторовна, Коломиец Лариса Александровна, Тропина Т.В., Виллерт А.Б., Шпилева О.В., Коваль В.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
Изучена экспрессия связанных с клеточной миграцией белков в злокачественных опухолях яичников эпителиального происхождения у 18 больных. Исследование актинсвязывающих белков (Arp3, гельзолина, кофилина-1 и тимозина-β4) и p45 Ser β-катенина выявило особенности их экспрессии в зависимости от клинико-морфологических параметров рака яичников (РЯ). Показаны различия в экспрессии кофилина-1 в зависимости от гистологического типа опухоли. Уровень экспрессии наиболее важного белка актинветвящего комплекса – Arp3 – и разрывающего актиновые филаменты кофилина был выше в перитонеальных метастазах по сравнению с метастатически пораженным сальником. Выявлено, что уровень p45 Ser формы β-катенина, доля клеток, экспрессирующих гельзолин и тимозин-4β, ассоциировались со степенью лечебного патоморфоза после неоадъювантной химиотерапии (НАХТ). При лечебном патоморфозе II–IV степени уровень p45 Ser формы β-катенина, а также доля клеток, экспрессирующих гельзолин и тимозин-4β, была значительно выше по сравнению с этими показателями в ткани остаточной опухоли и пораженного сальника при I степени лекарственного патоморфоза. Полученные результаты могут являться основой для поиска новых прогностических критериев, маркеров метастазирования и факторов, предсказывающих эффективность НАХТ при РЯ.
Белки клеточной подвижности, рак яичников, имплантационные метастазы, неоадъювантная химиотерапия
Короткий адрес: https://sciup.org/14056329
IDR: 14056329 | УДК: 618.11-006.6:
Текст научной статьи Белки клеточной подвижности при раке яичников: связь с клинико-морфологическими параметрами и эффективностью неоадъювантной химиотерапии
Раку яичников (РЯ), как никакой опухоли, свойственны все возможные способы диссеми-нации опухолевых клеток – имплантационный, лимфогенный и гематогенный, причем метастазы могут быть как высокочувствительными к химиотерапии, так и рефрактерными. При эпителиальных вариантах опухолей по частоте метастатического поражения брюшина стоит на первом месте, на втором – большой сальник. По мнению ряда авторов, метастатически пораженный большой сальник, способствующий накапливанию асцитической жидкости, является постоянным источником дальнейшего метастазирования [1, 13]. Процессы инвазии и метастазирования определяются совокупностью многих изменений, среди которых важное значение имеет нарушение адгезивных взаимодействий и приобретение клетками способности к передвижению, которые являются неотъемлемой характеристикой злокачественных клеток и компонентом опухолевой прогрессии [2, 3].
В формировании способности к локомоции важную роль играет реорганизация актинового цитоскелета. Ремоделирование цитоскелета осуществляется актинсвязывающими белками, среди которых выделяют мономер связывающие белки (тимозин-4β); филамент- деполимеризующие белки (кофилин); кэппирующие белки, ограничивающие рост филаментов (CapZ); белки, разрывающие актиновые филаменты и формирующие два фрагмента (гельзолин); поперечносвязывающие белки, участвующие в формирование пучков филаментов, их ветвлении и формировании трехмерных структур (белки Arp2/3 комплекса) [4]. Экспрессия основных белков, участвующих в ремоделировании цитоскелета, при РЯ изучена недостаточно. Имеются публикации, где актиндеполимеризующие и актинразрывающие белки обсуждаются в плане развития химиорезистентности опухолей яичника к препаратам платины [15]. При взаимодействии гиалуроновой кислоты (компонента межклеточного матрикса) с молекулой адгезии CD44 (специфический рецептор адгезии) в клеточной линии РЯ происходит активация Arp2/3 комплекса с последующей перестройкой актинового цитоскелета и повышением миграционной способности опухолевых клеток, что, по мнению авторов, может быть причиной прогрессии овариального рака [5].
Изменение инвазивного и метастатического потенциала опухолевых клеток также связано с изменениями адгезионных межклеточных взаимодействий с участием катенин-кадгериновых комплексов. Двойственная роль β-катенина обусловлена тем, что, с одной стороны, в клетке данный белок присутствует в основном в составе этих комплексов, обеспечивая адгезию и снижая миграционную активность клеток. С другой стороны, при высвобождении β-катенина из катенин-кадгериновых комплексов он становится сигнальной молекулой в Wnt/β-катенин сигнализации и участвует в активации TCF/LEF транскрипционных факторов, что приводит к повышению миграции, снижению адгезии и повышению пролиферации клеток. При этом происходит накопление p45 Ser формы β-катенина в цитоплазме с последующим ее перераспределением в ядро [5, 9].
Несмотря на важную роль ассоциированных с миграцией белков в процессах инвазии и метастазирования до настоящего времени на их основе не разработаны молекулярные критерии для прогноза заболевания и эффективности химиотерапии. Необходимо отметить, что при РЯ, по-видимому, важно изучение ассоциированных с миграцией белков как в первичной опухоли, так и в метастазах, особенно в имплантационных (перитонеальных и в большом сальнике), поскольку наличие или отсутствие именно этих метастазов и их чувствительность к химиотерапевтическим препаратам определяют в целом исход заболевания.
Неоадъювантная химиотерапия (НАХТ) с последующей интервальной циторедукцией является оптимальным терапевтическим подходом для ряда больных РЯ [6]. Степень лечебного патоморфоза рассматривается как наиболее объективный показатель, отражающий эффективность проводимой терапии. Несмотря на достаточно высокую чувствительность злокачественных опухолей яичников эпителиального происхождения к современным цитостатикам примерно у 20 % больных наблюдается прогрессирование при проведении НАХТ. Таким образом, достаточно актуальным является поиск факторов, предсказывающих эффективность НАХТ. Необходимо отметить, что при местнораспространенном раке молочной железы экспрессия отдельных генов и протеинов уже активно изучается в качестве таких предикторов, которые коррелировали с клиническим ответом на НАХТ и частотой полного патологического ответа [7, 14]. При РЯ таких критериев практически не существует. В качестве предикторов оказались несостоятельными как большинство клинических маркеров, так и традиционные опухолевые маркеры. Опухолевые маркеры СA-125 и HE-4 позволяют оценить эффективность уже проведенных курсов химиотерапии [16]. Таким образом, актуальным является изучение экспрессии ассоциированных с миграцией белков при РЯ во взаимосвязи как с основными клинико-морфологическими параметрами, так и с показателями, отражающими чувствительность опухоли к химиотерапии.
Материал и методы
В исследование были включены 18 больных со злокачественными опухолями яичников эпителиального происхождения (серозные и эндометриоидные карциномы) II–III стадии в соответствии с международной классификацией FIGO (2009), проходившие обследование и лечение в отделении гинекологии ФГБУ «НИИ онкологии» СО РАМН. Исследование было одобрено этическим комитетом ФГБУ «НИИ онкологии» СО РАМН. Из 18 больных 11 пациенток на первом этапе лечения получали НАХТ по схеме паклитаксел 175 мг/м2+ цисплатин 75 мг/м2 или паклитаксел 175 мг/м2 + карбоплатин AUC 6 от 2 до 4 курсов с интервалом 3 нед. Количество курсов определялось в зависимости от эффективности НАХТ по клиническим, ультразвуковым параметрам и динамике опухолевых маркеров CA-125 и HE-4. В последующем выполнялась циторедуктивная операция и адъювантная химиотерапия. Выбор схемы адъювантной химиотерапии проводился в зависимости от клинической эффективности НАХТ с учетом степени лечебного патоморфоза. Остальные 7 больных получили на первом этапе хирургическое лечение, далее адъювантную химиотерапию по аналогичным схемам. Забор материала (ткань опухоли и имплантационных метастазов) для определения экспрессии ассоциированных с клеточной подвижностью белков осуществлялся на этапе хирургического вмешательства. У больных, получавших НАХТ, забор материала для исследования производился как при выполнении диагностической лапароскопии, так и при циторедуктивной операции. Уровень экспрессии перечисленных маркеров в ткани остаточной опухоли и имплантационных метастазов (после НАХТ) анализировался во взаимосвязи со степенью лечебного патоморфоза. При статистической обработке данные по экспрессии ассоциирован- ных с клеточной подвижностью белков в тканях, полученные у больных при лапароскопии (до назначения НАХТ) и у больных при выполнении первичной циторедукции, объединяли.
Анализ уровня экспрессии основных актин-связывающих белков (актинветвящего белка Аrp3, гельзолина, кофилина-1, тимозина-4β), а также p45 Ser β-катенина проводился методом проточной цитометрии на цитофлюориметре FACS Canto II (Becton Dickinson (BD), США). Хирургически удаленные образцы опухолей и имплантационных метастазов (сальник, перитонеальные метастазы) были дезинтегрированы. Суспензия клеток была получены на дезагрегирующем устройстве Medimachine (BD, США) с использованием фосфатно-солевого буфера («Сell Wash», BD, США) по стандартной методике. Приготовленная суспензия клеток отмывалась буфером дважды. Фиксация и пермеабилизация клеток проводилась с помощью набора Cytofix/Cytoperm (BD, США). Аликвоты подготовленных суспензий тканей были проинкубированы с соответствующими первичными конъюгированными и неконъюгирован-ными антителами, а затем отмыты и докрашены вторичными антителами. В качестве первичных антител использовались anti-arp3, anti-cofilin, anti-thymosin-4β «Abcam» (Великобритания), antigelsolin, anti-p45-Ser-бета-catenin phycoerythrin (PE) фирмы «BD» (США). В качестве вторичных – goat anti-mouse IgG fluorescein isothiocyanate (FITC) фирмы «BD» (США). Оценка результатов производилась с помощью программы FACS Diva 6.1. Проанализированы количество клеток, экспрессирующих маркеры в процентах (%), а также медиана интенсивности флюоресценции (MFI) – в условных единицах (у.е.).
Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 6.0. В таблицах все данные представлены как медиана с интерквартильным размахом (25-й и 75-й процентили) – Me (25 % – 75 %). Значимость различий исследовали с помощью критерия Манна–Уитни или теста Kruskal–Wallis.
Результаты и обсуждение
Типичные данные по экспрессии p45 Ser β-катенина, Arp3, гельзолина, кофилина-1 и тимозина-4β представлены на рис. 1. Показано распределение событий, гейтированных по по-
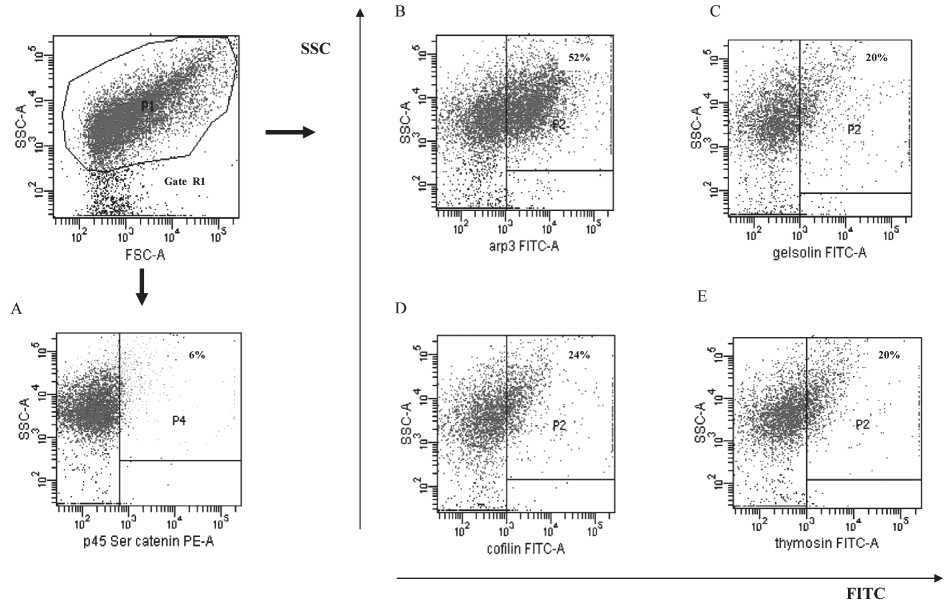
Рис. 1. Экспрессия p45 Ser β-катенина (A), Arp3 (B), гельзолина (C), кофилина (D) и тимозина-4β (E) в ткани опухоли больных РЯ, проанализированная методом проточной цитометрии. Показано распределение событий, гейтированных по показателям светорассеяния (Гейт R1). Пример представлен из выборки репрезентативных экспериментов, выполненных у 18 больных РЯ
казателям светорассеяния (гейт R1). Доля клеток, экспрессирующих каждый маркер, представлена в процентах в правом верхнем квадранте. Пример представлен из выборки репрезентативных экспериментов, выполненных у 18 больных РЯ.
Уровень экспрессии белков клеточной подвижности в ткани первичной опухоли у больных РЯ во взаимосвязи с основными клиникоморфологическими параметрами представлен в табл. 1. Не выявлено значимых различий в экспрессии указанных белков в ткани опухоли у больных с различной стадией заболевания. При распределении больных в соответствии с гистологическим типом выявлено, что MFI кофилина, отражающий уровень экспрессии этого белка, при эндометриоидных карциномах была выше по сравнению с серозными опухолями, 3162 у.е. (2892–3432) и 2097 у.е. (1665–2705) соответственно (p<0,05). Вследствие абсолютного преобладания аденокарцином с низкой степенью дифференцировки данные об экспрессии белков клеточной подвижностью во взаимосвязи со степенью дифференцировки опухоли не представлены.
Уровень экспрессии ассоциированных с миграцией белков в ткани первичной опухоли и имплантационных метастазов у больных РЯ представлен в табл. 2. Выявлено, что имплантационные метастазы значимо различаются по экспрессии данных маркеров. Так, доля клеток, экспрессирующих один из наиболее важных белков актинветвящего комплекса (Arp3), и разрывающего актиновые филаменты кофилина-1 выше в перитонеальных метастазах по сравнению с метастатически пораженным сальником. Также имелась тенденция к более высокой частоте экспрессии всех изученных белков в ткани перитонеальных метастазов по сравнению с первичной опухолью.
Содержание p45 Ser формы β-катенина и актинсвязывающих белков в ткани остаточной опухоли и метастатически пораженного сальника у больных РЯ после НАХТ с различной степенью лекарственного патоморфоза представлено в табл. 3 и 4. Лекарственный патоморфоз I степени, свидетельствующий об отсутствии эффекта НАХТ, отмечен у 5 больных, II–IV – у 6 больных. Выявлено, что при лекарственном патоморфозе
II–IV степени уровень p45 Ser формы β-катенина в ткани остаточной опухоли был выше, чем при патоморфозе I степени. Причем возрастали как доля клеток, экспрессирующих маркер, так и MFI. Выявлено также повышение процента клеток, экспрессирующих гельзолин и тимозин-4β в
Таблица 1
Зависимость экспрессии ассоциированных с клеточной подвижностью белков в ткани первичной опухоли от основных клинико-морфологических параметров ря
|
Параметры |
Процент клеток, экспрессирующих маркер (%) и MFI (у.е.), Me (25%-75%) |
|||||||||
|
p45 Ser β -катенин, % |
p45 Ser β -катенин, MFI |
Arp3, % |
Arp3, MFI |
Гельзолин, % |
Гельзолин, MFI |
Кофилин, % |
Кофилин, MFI |
Тимозин-4 β , % |
Тимозин-4 β , MFI |
|
|
Стадия РЯ |
||||||||||
|
II–IIIB (n=5) |
25,1 (18,8–30,2) |
1823 (1461– 2214) |
40,2 (27,7– 45,5) |
2265 (2122– 2560) |
35,9 (23,0–45,1) |
2568 (2460– 2792) |
37,0 (20,3–40,0) |
1701 (1628– 2282) |
40,8 (27,3– 45,7) |
2002 (1645– 2292) |
|
IIIC (n=9) |
19,2 (12,5–27,8) |
1611 (1344– 2025) |
44,3 (18,7– 63,0) |
3013 (2576– 3047) |
25,6 (21,7–61,5) |
2479 (2476– 3047) |
26,3 (22,5–46,7) |
2700 (1910– 2710) |
46,3 (21,6– 58,0) |
2555 (2431– 3000) |
|
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
p>0,05 |
|
|
Гистологический тип |
||||||||||
|
Серозные карциномы (n=9) |
19,2 (13,2–25,1) |
2197 (1573– 3243) |
40,2 (23,1– 29,9) |
2418 (2122– 3562) |
26,2 (20,5–53,2) |
2489 (2449– 2842) |
31,7 (21,4–43,6) |
2097 (1665– 2705) |
40,9 (19,2– 52,6) |
2367 (1719– 2777) |
|
Эндометриоидные карциномы (n=5) |
26,0 (12,5–33,0) |
1927 (1000– 2396) |
33,6 (17,4– 48,2) |
2809 (2725– 3636) |
44,3 (37,5–48,2) |
2948 (2748– 3900) |
30,0 (25,2–34,7) |
3162 (2892– 3432) |
34,9 (27,8– 47,4) |
3167 (2280– 3335) |
|
p<0,05 |
||||||||||
Таблица 2
Экспрессия ассоциированных с клеточной подвижностью белков в ткани первичной опухоли и имплантационных метастазов у больных ря
|
Ткань |
Процент клеток, экспрессирующих маркер (%) и MFI (у.е.), Me (25%-75%) |
|||||||||
|
p45 Ser β -катенин, % |
p45 Ser β -катенин, MFI |
Arp3, % |
Arp3, MFI |
Гельзолин, % |
Гельзолин, MFI |
Кофилин, % |
Кофилин, MFI |
Тимозин-4 β , % |
Тимозин-4 β , MFI |
|
|
Опухоль (n=12) |
22,0 (13,6–28,5) |
1624 |
40,2 |
2625 |
41,3 (23,7–51,1) |
2569 |
34,7 |
2284 |
40,8 |
2367 |
|
(1357– 2078) |
(18,9– 58,9) |
(2122– 3468) |
(2449– 2998) |
(22,5– 46,1) |
(1701– 2892) |
(24,7– 51,7) |
(1812– 3076) |
|||
|
Сальник (n=11) |
14,8 (13,5–23,5) |
2196 |
33,1 |
2120 |
30,4 (25,0–50,0) |
2452 |
36,1 |
2240 |
38,5 |
2694 |
|
(1435– 2691) |
(29,2– 37,3) |
(1907– 2830) |
(1524– 2967) |
(26,0– 40,1) |
(1567– 2566) |
(36,9– 40,8) |
(2046– 3221) |
|||
|
Перито- |
22,6 (17,6–29,3) |
2170 |
48,0 |
2411 |
51,7 (44,0–62,8) |
2767 |
45,3 |
2137 |
47,6 |
2070 |
|
неальные метастазы (n=6) |
(1862– 3627) |
(42,8– 59,7) |
(1933– 2662) |
(2561– 3300) |
(41,1– 58,0) |
(1994– 2516) |
(40,0– 54,0) |
(1817– 2731) |
||
|
р2,3<0,05 |
Р2,3<0,05 |
|||||||||
Примечание: р2,3 – значимость различий в экспрессии белков между метастатически пораженным сальником и перитонеальными метастазами.
остаточной опухоли у больных со II–IV степенью лекарственного патоморфоза. В метастатически пораженном сальнике отмечались сходные изменения (табл. 3, 4).
По мнению ряда авторов, у большинства больных РЯ, подвергшихся комбинированному лечению, первичная опухоль была полностью или частично удалена во время операции, и летальный исход был связан с наличием, ростом и дальнейшим распространением, прежде всего, имплантационных метастазов [1, 13]. Необходимо отметить, что процесс формирования, роста и прогрессирования имплантационных метастазов при РЯ сложен и недостаточно изучен, однако имеются публикации, где клеточная сократимость и миграционная активность клеток (как опухолевых, так и окружающих опухоль стромальных клеток) обсуждаются в качестве важнейших факторов, определяющих формирование метастазов, в том числе имплантационных [8, 13]. Полученные данные о высоком уровне экспрессии компонента актинветвящего комплекса – белка Arp3 – в перитонеальных метастазах по сравнению с метастазами в сальник и тенденции к повышению экспрессии в перитонеальных метастазах по сравнению с первичной опухолью согласуются с данными, приведенными в работе L.Y. Bourguignon et al. (2007) [5]. В этом исследовании показано, что в клеточных линиях РЯ при разрушении экстраклеточного матрикса происходит формирование активного Arp2/3 комплекса с β-катенин зависимой активацией генной транскрипции посредством трансактивации TCF/LEF транскрипционных факторов, что приводило к повышению пролиферации и особенно миграционной активности клеток, что может быть причиной прогрессирования овариального рака. Аналогичные
Таблица 3
Экспрессия ассоциированных с клеточной подвижностью белков в ткани остаточной опухоли и степень лекарственного патоморфоза
|
Степень лекарственного пато-морфоза |
Процент клеток, экспрессирующих маркер (%) и MFI (у. е.), Me (25%-75%) |
|||||||||
|
p45 Ser β -катенин, % |
p45 Ser β -катенин, MFI |
Arp3, % |
Arp3, MFI |
Гельзолин, % |
Гельзолин, MFI |
Кофилин, % |
Кофилин, MFI |
Тимозин-4 β , % |
Тимозин-4 β , MFI |
|
|
I (n=5) |
13,5 (5,1–19,0) |
1113 (1072– 1125) |
32,0 (28,7– 35,8) |
2454 (2450– 2600) |
21,0 (11,0–24,0) |
2200 (18002307) |
21,0 (11,0–24,0) |
2000 (1980– 2575) |
17,0 (15,0– 20,0) |
2010 (1887– 2066) |
|
II–IV (n=6) |
22,0 (18,6–25,4) |
1521 (1509– 1573) |
27,5 (23,1– 31,9) |
2595 (2368– 2822) |
34,2 (29,2–39,6) |
2401 (22702762) |
28,9 (22,6– 35,2) |
2620 (2400– 2979) |
35,1 (27,5– 45,0) |
2251 (1923– 2580) |
|
p<0,05 |
p<0,05 |
р<0,05 |
p<0,05 |
|||||||
Таблица 4
Экспрессия ассоциированных с клеточной подвижностью белков в ткани метастатически пораженного сальника и степень лекарственного патоморфоза
|
Степень лекарственного пато-морфоза |
Процент клеток, экспрессирующих маркер (%) и MFI (у.е.), Me (25%-75%) |
|||||||||
|
p45 Ser β -катенин, % |
p45 Ser β -катенин, MFI |
Arp3, % |
Arp3, MFI |
Гельзолин, % |
Гельзолин, MFI |
Кофилин, % |
Кофилин, MFI |
Тимозин-4 β , % |
Тимозин-4 β , MFI |
|
|
I (n=5) |
11,4 (9,2–12,9) |
1406 (1207– 1521) |
26,7 (23,8– 44,0) |
2727 (2301– 2789) |
19,7 (14,3–20,2) |
1979 (1531– 2226) |
21,4 (9,1–23,0) |
2053 (1629– 2461) |
9,5 (9,0–18,5) |
1638 (1438– 2332) |
|
II–IV (n=6) |
24,2 (11,3– 25,4) |
2197 (1573– 3243) |
25,0 (23,1– 29,9) |
2822 (1945– 3700) |
30,3 (26,6–32,9) |
2762 (2004– 3200) |
25,1 (22,6– 32,9) |
2461 (1900– 2567) |
26,4 (24,5– 31,2) |
2580 (1940– 3420) |
|
p<0,05 |
p<0,05 |
P<0,05 |
p<0,05 |
|||||||
Значительный интерес представляют данные, полученные о взаимосвязи экспрессии ассоциированных с клеточной подвижностью белков в тканях больных РЯ с различной степенью лекарственного патоморфоза после НАХТ. Сходные изменения экспрессии изученных белков выявлены как в остаточной опухоли, так и в метастатически пораженном сальнике. Выявлено, что при лечебном патоморфо-зе II–IV степени у больных РЯ после проведения НАХТ уровень p45 Ser формы β-катенина (как доля клеток, экспрессирующих маркер, так и MFI), а также процент клеток, экспрессирующих гельзолин и тимозин-β4, был значительно выше по сравнению с уровнем маркеров в ткани остаточной опухоли и пораженного сальника при I степени лекарственного патоморфоза. Накопление p45 Ser формы β-катенина в клеточных линиях РЯ происходит при CD44-N-WASP-зависимой активации клеток и сопровождается стимуляцией пролиферативной и миграционной активности [5]. Однако в нашем случае эти изменения сочетались с повышением экспрессии гельзолина и тимозина-β4, непосредственно участвующих в ремоделировании актинового цитоскелета, необходимого для изменения формы, подвижности и сократимости клеток.
Заключение
Проведенное исследование выявило особенности экспрессии белков клеточной подвижности в злокачественных опухолях яичников в зависимости от клинико-морфологических параметров. В частности, показаны различия в экспрессии кофилина-1 в зависимости от гистологического типа опухоли. Уровень экспрессии наиболее важного белка актинветвящего комплекса – Arp3 и разрывающего актиновые филаменты кофилина был выше в перитонеальных метастазах по сравнению с метастатически пораженным сальником. Выявлено, что уровень p45 Ser формы β-катенина (как доля клеток, экспрессирующих маркер, так и интенсивность флюоресценции), процент клеток, экспрессирующих гельзолин и тимозин-4β, ассоциировались со степенью лекарственного патомор-фоза. При патоморфозе II–IV степени у больных РЯ после проведения НАХТ уровень p45 Ser формы
β-катенина (как процент клеток, экспрессирующих маркер, так и MFI), а также процент клеток, экспрессирующих гельзолин и тимозин-4β, был значительно выше по сравнению с уровнем маркеров в ткани остаточной опухоли и пораженного сальника при лекарственном патоморфозе I степени. Полученные результаты могут являться основой для поиска новых прогностических факторов, маркеров метастазирования и факторов, предсказывающих эффективность НАХТ при РЯ.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 13–04–00169a).


