Бессимптомная бактериальная колонизация как причина воспалительной инфильтрации биопротезов клапанов сердца на поздних сроках их функционирования
Автор: Костюнин А.Е., Глушкова Т.В., Асанов М.А., Акентьева Т.Н., Клышников К.Ю., Резвова М.А., Онищенко П.С., Овчаренко Е.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Обоснование. Средняя долговечность биопротезов клапанов сердца ограничена 10-15 годами из-за структурной дегенерации их биологической составляющей. Одной из причин развития дегенеративных изменений в имплантатах является инфильтрация иммунными клетками. Как правило, воспаление развивается через несколько лет после биопротезирования, что плохо согласуется с гипотезой иммунного отторжения, вызванного остаточной иммунногенностью протезной биоткани. Мы предположили, что главным стимулом иммунного ответа на поздних сроках функционирования биопротезов становится их бессимптомная колонизация бактериальными агентами.Цель: исследовать серию биопротезов, эксплантированных из-за структурной дегенерации, на предмет бактериальной инвазии; выявить закономерности в локализации микроорганизмов и клеточных инфильтратов.Материал и методы. Изучено 23 биопротеза клапанов сердца, иссеченных при репротезировании по причине структурной дегенерации. Детекцию бактерий в образцах осуществляли путем окрашивания гистологических срезов по Граму и посредством ПЦР-анализа. Для фенотипирования иммунных клеток применяли метод иммуногистохимического окрашивания с использованием антител к CD45 (пан-лейкоцитарный маркер), CD68 (маркер макрофагов), CD3 (маркер Т-лимфоцитов) и эластазе нейтрофилов (ELA2). Компонентный состав тканей исследовали с помощью пентахромного окрашивания по Расселу - Мовату. Анализ окрашенных срезов выполняли методом световой микроскопии.
Биопротезы клапанов сердца, бактериальная инвазия, протезный эндокардит, структурная дегенерация клапана
Короткий адрес: https://sciup.org/149145648
IDR: 149145648 | УДК: 616.126.3/.5-77-022 | DOI: 10.29001/2073-8552-2024-39-2-175-182
Текст научной статьи Бессимптомная бактериальная колонизация как причина воспалительной инфильтрации биопротезов клапанов сердца на поздних сроках их функционирования
На сегодняшний день протезирование клапанов сердца остается основным подходом к лечению тяжелых клапанных патологий [1]. Чаще всего для замены пораженных клапанов используют биопротезы, изготовленные из химически стабилизированных тканей животного происхождения: аортального комплекса свиньи, фрагментов бычьего или свиного перикарда [2]. В отличие от своих механических аналогов, выполненных из углерода и металлических сплавов, биопротезы характеризуются низкой тромбогенностью, вследствие чего они не требуют от реципиентов пожизненного приема антикоагулянтов [3]. Впрочем, долговечность биопротезов лимитирована, составляя в среднем 10–15 лет [3]. Указанная особенность ограничивает возможности биопротезирования клапанов сердца у лиц моложе 65 лет, чья ожидаемая продолжительность жизни превышает средние сроки функционирования имплантатов [1].
Главной причиной дисфункций биопротезов клапанов сердца является структурная дегенерация их биологического компонента, которая проявляется фрагментацией и кальцификацией волокнистой основы протезного биоматериала [4]. Накопление дегенеративных изменений в коллагеновой матрице биоткани ведет к повреждению и минерализации створчатого аппарата клапана и, как следствие, нарушению его гемодинамических характеристик [4].
Одним из основных механизмов, ответственных за развитие структурной дегенерации биопротезов, выступает агрессивный ответ со стороны иммунной системы реципиента [5]. В частности, ткани клапана подвержены инфильтрации разными типами иммунных клеток (преимущественно макрофагами, гигантскими многоядерными клетками и нейтрофилами), которые являются источником широкого спектра протеолитических, окислительных и прокальцифицирующих факторов [5]. Триггеры описываемой реакции мало изучены, причем ее рассматривают как асептический процесс.
В настоящее время главными виновниками развития иммунного ответа на биопротезы клапанов считают остаточные углеводные антигены животных, такие как галак-тоза-α1,3-галактоза и N-гликолилнейраминовая кислота [6]. Ксеногликаны связывают циркулирующие в крови специфичные антитела, что ведет к осаждению в тканях протезов клеточных элементов иммунной системы [5]. Тем не менее, несмотря на наличие экспериментальных и клинических доказательств, эта концепция не объясняет ряд наблюдений. Так, воспалительный клеточный ответ на имплантаты, как правило, развивается только через несколько лет после биопротезирования клапанов, когда углеводные антигены не могут быть детектированы в биологической ткани посредством антител (по-види-мому, из-за их разрушения или экранирования другими белками) [7]. Поэтому кажется маловероятным, что углеводные молекулы могут стать триггером воспалительной инфильтрации биопротезов на поздних сроках их функционирования. Недавно была выдвинута гипотеза, согласно которой развитие воспаления и дегенеративных изменений в искусственных клапанах может быть связано с бессимптомной колонизацией бактериальными агентами [8]. Настоящая статья нацелена на проверку этого предположения.
Цель исследования: изучить серию удаленных по причине структурной дегенерации биопротезов клапанов сердца на присутствие микроорганизмов; выявить закономерности в локализации бактериальных колоний и клеточных инфильтратов.
Материал и методы
Материалом для исследования стали 23 биопротеза клапанов сердца, иссеченные при выполнении операций репротезирования клапанов в 2018–2022 гг. Экспланти-рованные биопротезы помещали в стерильный 0,9% раствор натрия хлорида и доставляли в лабораторию. После макроскопического изучения их готовили для гистологического исследования и ПЦР-анализа. Так, створки каждого биопротеза отделяли от каркаса, вырезая фрагменты с дегенеративными изменениями биоматериала (участки с утолщением, макрокальцификацией и / или разрывами биологической ткани).
Фрагменты створок, отобранные для изучения гистохимическим методом, фиксировали в среде для быстрого замораживания тканей Neg-50 (6502, Thermo Fisher Scientific, США) и использовали для приготовления срезов толщиной 6 мкм с помощью микротом-криостата HM525 (Thermo Fisher Scientific, США). Готовые срезы размещали на предметные стекла.
С целью визуализации микроорганизмов срезы обрабатывали реактивами из коммерческого набора для окрашивания по Граму (ab150672, Abcam, Великобритания). Компонентный состав створок и локализацию клеточных элементов оценивали с помощью набора для пентахром-ного окрашивания по Расселу – Мовату (ab245884, Abcam). Указанные виды окрашиваний производили в соответствии с протоколами производителя.
Фенотипы инфильтрирующих биопротезы клеток устанавливали методом иммуногистохимического окрашивания, выполненного с применением набора NovoLink Polimer DS (RE7150-CE, Leica Biosystems, Германия) и антител к пан-лейкоцитарному маркеру CD45 (ab10558, Abcam, в разведении 1:4000), маркеру макрофагов CD68 (ab227458, Abcam, 1:500), T-лимфоцитов CD3 (ab16669, Abcam, 1:1000) и эластазе нейтрофилов ELA2 (MAB91671-100, Novus Biologicals, США, 1:2000). Перед выполнением иммуногистохимической реакции срезы фиксировали в 4% параформальдегиде при комнатной температуре в течение 10 мин, далее трижды (по 5 мин) отмывали в фосфатно-солевом буфере, после чего окрашивали по протоколу производителя упомянутого набора. Первичные антитела разводили в 1% солевом растворе бычьего сывороточного альбумина, оптимальные разведения были подобраны в ходе серийных окрашиваний. Время инкубации срезов с первичными антителами составляло 20 ч при +4 °C. По завершении окрашивания срезы заключали под покровное стекло, используя монтирующую среду Витрогель (HM-VI-A250, БиоВитрум, Россия).
Микроскопию окрашенных срезов выполняли с помощью микроскопа AxioImager A1 (Carl Zeiss, Германия), изображения готовили с использованием программы AxioVision (Carl Zeiss). Результаты оценивали два гистолога независимо друг от друга.
Часть фрагментов тканей биопротезов массой около 5 мг служили для выполнения ПЦР-тестов. Их гомогенизировали в приборе FastPrep-24 5G (MP Biomedicals, США), а после выделяли нуклеиновые кислоты с помощью наборов НК-сорбент Tissue (0232-2, Литех, Россия) в соответствии с протоколом производителя. Для определения этиологии бактериальных структур применяли тест-системы OneStep, детектирующие следующие таксоны: Enterobacter spp. (01766-РВ-OS-96, Литех), Enterococcus faecalis (01767-РВ-OS-96, Ли-тех), Escherichia coli (01768-РВ-OS-96, Литех), Proteus spp. (01769-РВ-OS-96, Литех), Serratia spp. (01771-РВ-OS-96, Литех), Staphylococcus spp. (01757-РВ-OS-96, Литех) и Streptococcus spp. (01773-РВ-OS-96, Литех). ПЦР-амплификацию производили на анализаторе RealTime CFX96 Touch (Bio-Rad Laboratories, США) с использованием программы Bio-Rad CFX Manager 3.1, каналы FAM (специфический сигнал) и HEX (сигнал внутреннего контроля).
Следует подчеркнуть, что у всех включенных в исследование биопротезов отсутствовали макроскопические признаки протезного эндокардита, результаты посевов крови и смывов с протезов были отрицательны. Сбор анамнеза также не выявил любых признаков, указывающих на развитие инфекционного процесса в клапане у реципиентов. Причиной реоперации во всех случаях стала структурная дегенерация, обусловленная кальцификацией и / или разрывами створок. Первичные операции проведены по поводу недостаточности или стеноза митрального клапана на фоне ревматической болезни сердца, а также кальцинирующего аортального стеноза, при этом у пациентов не было признаков инфекционного эндокардита нативных клапанов.
Статистическую обработку полученных данных выполняли в программе GraphPad Prism 8 (GraphPad Software, США). Характер распределения в выборках оценивали при помощи критерия Колмогорова – Смирнова. В группах наблюдали распределение, отличное от нормального ( р < 0,01), в связи с чем данные представлены как медиана, процентили и минимальные / максимальные значения ( Me [25–75%; max–min]).
Исследование проводили в соответствии с принципами Надлежащей клинической практики и Хельсинкской декларации Всемирной медицинской ассоциации. Исследование одобрено локальным этическим комитетом НИИ КПССЗ (протокол № 19 от 06.11.2018 г.). Все пациенты подписали письменное информированное согласие.
Результаты
В среднем сроки функционирования изученных биопротезов составили 148 [75–175; 30–297] мес., возраст реципиентов на момент имплантации – 55 [44–62; 30–72] лет. Только один биопротез был удален из аортальной позиции (модель ТиАра, ЗАО «НеоКор», Россия), тогда как остальные 22 имплантата иссечены из митральной позиции (модели КемКор (n = 7), ПериКор (n = 8) и Юни-Лайн (n = 7), ЗАО «НеоКор»). Макроскопическое изучение удаленных клапанов продемонстрировало классические признаки структурной дегенерации. Для створок ксеноа-ортальных биопротезов (модели КемКор и ПериКор) были характерны мелкие перфорации в куполе и разрывы в комиссуральной зоне, присутствие крупных кальцификатов в основании; створки перикардиальных протезов (ТиАра и ЮниЛайн) сохраняли целостность, однако имели кальциевые депозиты в основании, куполе и комиссуральной зоне. Три биопротеза модели ЮниЛайн характеризовались тотальной кальцификацией и почти полной утратой подвижности створчатого аппарата.
Помимо прочего, мы наблюдали разрастание соединительной ткани (паннуса) на створках всех ксеноаор-тальных и двух перикардиальных протезов. Паннус располагался со стороны оттока, фиксируя створки к каркасу и несколько ограничивая открытие клапанов. Вегетаций на поверхности створок не выявлено.
Микроскопический анализ срезов, окрашенных пентахромом по Расселу – Мовату, продемонстрировал полную деградацию аморфного компонента ткани (мукополисахаридов), а также наличие фибриновых сгустков на поверхности биоматериала (рис. 1А). Необходимо подчеркнуть, что отложения фибрина присутствовали в створках всех изученных биопротезов вне зависимости от типа ткани, из которой изготовлен их створчатый аппарат (аортального комплекса свиньи или бычьего перикарда). В свою очередь клеточные инфильтраты располагались преимущественно на поверхности створок и в разрыхленных предповерхностных слоях биоматериала, а также по краям перфораций и вблизи крупных кальци-фикатов. Наиболее интенсивную инфильтрацию наблюдали в основании створок на стороне оттока. Иммунофе-нотипирование показало, что в основной массе клетки в инфильтратах положительны на пан-лейкоцитарный и макрофагальный маркеры (CD45+ и CD68+ соответственно) (рис. 1Б). Также в составе клеточных инфильтратов во всех протезах присутствовали единичные сегментоядерные нейтрофилы (ELA2+). Только в 7 клапанах обнаружены единичные Т-лимфоциты (CD3+).
Посредством окрашивания срезов по Граму в 19 из 23 клапанов (82,6%) были обнаружены микроорганизмы, представленные грамотрицательными палочковидными бактериями (присутствовали во всех контаминированных образцах) и грамположительными кокками (выявлены в 6 клапанах) (рис. 2А). Первые располагались в виде плотных или рассеянных скоплений одиночных бактерий, вторые образовывали гроздевидные колонии или цепочки, состоящие из 3–5 бактериальных клеток. В основном микроорганизмы локализовались в составе микротромбов, присутствующих на поверхности створок; мелкие их колонии встречались в разрыхленных предповерхностных слоях биоткани, а также на границе между биоматериалом протезов и паннусом. Важно отметить, что бактерии не формировали характерных для эндокардита вегетаций, при этом наиболее крупные бактериальные колонии были локализованы у основания и в куполе створок. ПЦР-анализ гомогенатов тканей подтвердил присутствие Streptococcus ssp. в 11 (47,8%) клапанах, причем один биопротез оказался дополнительно заселен представителями рода Staphylococcus .
А
Б
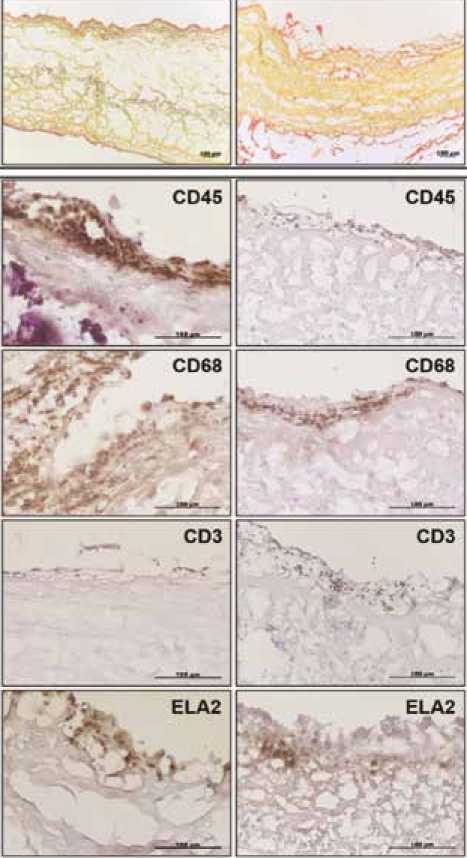
Рис. 1. Компонентный состав и клеточная инфильтрация створок изученных биопротезов клапанов сердца (слева показаны срезы створок ксеноаортальных протезов, справа – ксеноперикардиальных). А – основой волокнистой матрицы биоматериала клапанов является коллаген (желтое окрашивание). Обратите внимание на отложения фибрина (красное окрашивание) на поверхности створок (пентахромное окрашивание по Расселу – Мовату). Б – результаты иммунотипирования клеточных элементов в створках иссеченных биопротезов антителами к CD45 (пан-лейкоцитарный маркер), CD68 (маркер макрофагов), CD3 (маркер Т-лимфоцитов), ELA2 (эластаза нейтрофилов)
Fig. 1. Composition and cellular infiltration of the studied bioprosthetic heart valves (sections of xenoaortic prosthetic valves are shown on the left, sections of xenopericardial valves are shown on the right). A – the basis of the fibrous matrix of the valves consists of collagen (yellow staining).
Pay attention to fibrin deposits (red staining) on the surface of the leaflets (Russell – Movat pentachrome staining). B – immunotyping of cellular elements of the leaflets of excised bioprostheses with antibodies to CD45 (pan-leukocyte marker), CD68 (macrophage marker), CD3 (T-lymphocyte marker), ELA2 (neutrophil elastase)
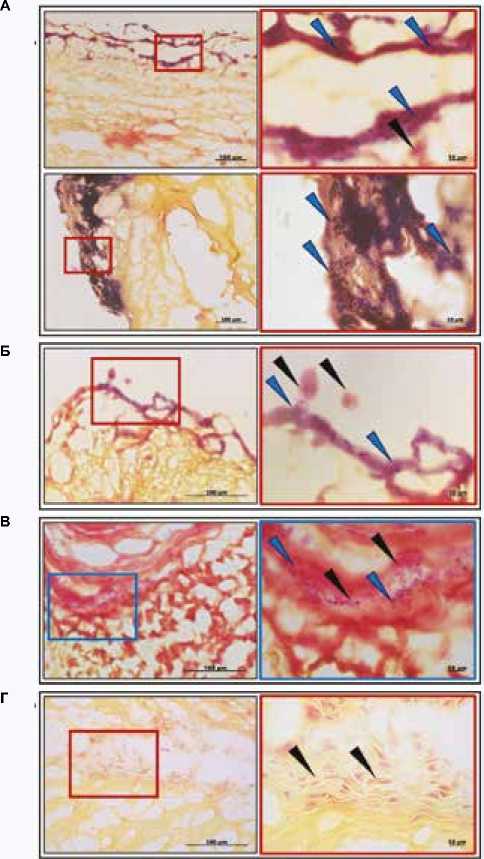
Рис. 2. Бактериальная колонизация биопротезов клапанов сердца (окрашивание по Граму; изображения справа являются крупным планом изображений слева; черные стрелки указывают на клеточную инфильтрацию, синие – на бактериальные колонии). А – примеры контаминации сформированных на поверхности клапана тромбов неиден-тифицированными палочковидными бактериями (вверху) и участков разрыхленного протезного биоматериала ими же и стрептококками (внизу). Б – адгезия иммунных клеток к поверхности биоматериала, заселенного бактериями. В – плотный клеточный инфильтрат на границе между створкой протеза и паннусом, солокализованный с мелкими бактериальными колониями. Г – крупный клеточный инфильтрат на участке без бактериальной контаминации
Fig. 2. Bacterial colonization of bioprosthetic heart valves (Gram staining; the images on the right are close–ups of the images on the left; black arrows indicate cellular infiltration; blue arrows indicate bacterial colonies). A – blood clots formed on the valve`s surface by unidentified rod-shaped bacteria (upper row), and the area where the bacteria and streptococci affected the biomaterial (lower row). B – adhesion of immune cells to the surface of a biomaterial populated by bacteria. C – dense cellular infiltrate at the border between the prosthetic leaflet and pannus co-localized with small bacterial colonies. D – large cell infiltrate in the area without bacterial contamination
Располагающиеся на поверхности створок колонии бактерий, как правило, солокализовались с единичными иммунными клетками, адгезированными к поверхности контаминированного биоматериала и к заселенным микротромбам (рис. 2А, Б). Также отмечены примеры соло- кализации бактерий и клеточных инфильтратов на границе между биоматериалом створок и паннусом (рис. 2В), хотя в типичном варианте крупные скопления иммунных клеток располагались на участках без признаков бактериальной инвазии (рис. 2Г). Наконец, воспалительные инфильтраты присутствовали в свободных от микроорганизмов биопротезах, при этом закономерности их локализации не отличались от таковых в контаминированных клапанах.
Обсуждение
Воспалительная клеточная инфильтрация биопротезов клапанов сердца представляет собой хорошо документированное явление, сопровождающее и отчасти обуславливающее их структурную дегенерацию [9–11]. Основной причиной развития иммунного ответа на искусственные клапаны считают остаточную иммуногенность биологической ткани, из которой они изготовлены [5, 6]. Так, даже в химически стабилизированных тканях животных сохраняются молекулы иммунореактивных ксеногликанов (например, молекулы галактоза-α1,3-галактозы и N-гли-колилнейраминовой кислоты) [5, 6]. Кроме того, реакцию иммунитета могут вызывать некоторые матриксные и ма-трикс-ассоциированные белки животного происхождения, такие как коллаген и альбумин [12]. При этом исследователи редко рассматривают версию о бактериальной природе стимулов, провоцирующих воспаление в створках биопротезов, как правило, считая этот процесс асептическим.
Важно отметить, что данные ряда недавних исследований подразумевают постепенное уменьшение иммуногенности биопротезов при функционировании в организме реципиента. В частности, у прооперированных пациентов отмечено снижение уровней сывороточных антител к галактоза-α1,3-галактозе и N-гликолилнейра-миновой кислоте в течение 24 мес. после замены клапана биопротезом, что косвенно указывает на элиминацию антигенов [6]. Более того, почти полную потерю ксеногли-канов протезными клапанами уже через 2,5 года после имплантации демонстрируют результаты иммуногистохимических окрашиваний [7]. Поскольку в типичном варианте инфильтрацию биопротезов иммунными клетками детектируют лишь на поздних сроках их функционирования (когда наиболее иммунореактивные антигены оказываются разрушенными), кажется маловероятным, что основным или, по крайней мере, единственным стимулом развития воспаления становится остаточная иммуногенность биологической ткани.
Активный инфекционный эндокардит выявляют у 1–6% реципиентов клапанных протезов, однако истинная распространенность этого заболевания (особенно его латентных форм) может быть значительно выше [13]. Это наглядно демонстрируют результаты настоящего исследовании: несмотря на отсутствие клинических и эхокардиографических признаков инфекционного эндокардита, а также отрицательных посевов крови, 80% эксплантиро-ванных клапанов были колонизированы бактериальными агентами и могли быть поражены латентной инфекцией (см. ограничения исследования).
С позиции фундаментальных знаний присутствие бактерий в створчатом аппарате биопротезов клапанов сердца кажется закономерным явлением. В противоположность нативным клапанам, биопротезы лишены эндотелиальной выстилки, защищающей матрикс створок от имбибиции циркулирующих в крови веществ и проникновения клеточных элементов (включая бактериальные агенты). Также ввиду деградации аморфного компонента (мукополисахаридов) при химической фиксации протезный биоматериал имеет губчатую структуру, а полости в межфибриллярном пространстве служат в качестве депо для молекул крови. Аккумуляция в протезной биоткани фибриногена и других факторов свертывания крови с их последующей активацией приводит к спонтанному образованию микротромбов на поверхности и в толще створок [14], что создает среду, подходящую для прикрепления и пролиферации бактерий [8]. При этом микроорганизмы, по-видимому, оседают в тканях биопротезов при транзи-торных бактериемиях.
Следует подчеркнуть, что по данным настоящего исследования бактерии встречались в куполе и основании створок биопротезов на участках с разрыхленным матриксом, подверженных наибольшему механическому стрессу и вихревому воздействию кровотока. Описываемый характер локализации бактериальных колоний подразумевает, что микроорганизмы, вероятнее всего, заселяют биопротезы после развития в них усталостных повреждений, возникающих под действием циклических нагрузок.
Согласно литературным данным, первые эхокардиографические признаки структурной дегенерации в современных моделях биопротезов обычно регистрируют через 7–8 лет после их имплантации [15]. Можно предположить, что возникающие в клапане первичные дегенеративные изменения становятся входными воротами для бактериальной инвазии. Присутствие бактерий на поврежденных участках стимулирует привлечение к ним клеток иммунной системы, способствуя развитию воспалительной реакции в клапане. Поскольку бактерии и иммунные клетки скапливаются преимущественно в местах, где уже наблюдается дегенерация биоткани, они могут существенно ускорить ее темпы благодаря продукции окислительных и протеолитических ферментов, а также других матрикс-де-градирующих и прокальцифицирующих факторов [5]. В конечном счете синергизм между механическим стрессом и вызванным микроорганизмами воспалением приводит к быстрому локализованному разрушению биоматериала створчатого аппарата и дисфункции биопротеза. Важно отметить, что бактериальные колонии могут выступать в качестве триггера иммунного ответа даже в случае их гибели (например, на фоне приема антибиотиков), поскольку бактериальный дебрис сохраняется в биоматериале в течение нескольких месяцев [16].
Необходимо подчеркнуть, что не все полученные нами данные хорошо вписываются в обсуждаемую концепцию. Хотя единичные иммунные клетки часто располагались на участках с бактериальной инвазией, крупные клеточные инфильтраты редко солокализовались с колониями микроорганизмов, а также присутствовали в клапанах без признаков бактериальной колонизации. Впрочем, эти наблюдения можно объяснить реакцией реципиента на чужеродный материал, предполагая, что собственная иммуногенность биоткани продолжает оставаться важным провоспалительным фактором даже на поздних сроках функционирования биопротезов. Альтернативно, скопления иммунных клеток могут располагаться на участках, где бактерии или бактериальный дебрис присутствовали ранее, однако были поглощены фагоцитами.
Заключение
Полученные нами результаты указывают на широкую распространенность бессимптомной бактериальной колонизации биопротезов клапанов сердца (у 80% реципиентов), что предполагает ее возможную связь с иммунологическими механизмами структурной дегенерации. Потенциально улучшение методов антибактериальной обработки биопротезов может не только уменьшить риск развития инфекционного эндокардита, но и замедлить темпы структурной дегенерации клапанов.
Ограничения исследования
Настоящее исследование имеет ряд ограничений. Во-первых, нами не была изучена жизнеспособность детектируемых в образцах микроорганизмов, и они могут быть представлены бактериальным дебрисом, что объяс- няет отсутствие характерных для активного эндокардита клинических и гистологических проявлений. Во-вторых, с целью выявления бактерий в биоматериале методом ПЦР мы использовали ограниченный набор тест-систем (выбраны для наиболее часто встречающихся возбудителей инфекционного эндокардита), поэтому таксономический состав микроорганизмов в исследованных клапанах остался неизученным. Тем не менее приведенные недостатки не влияют на основные выводы настоящей работы.
Список литературы Бессимптомная бактериальная колонизация как причина воспалительной инфильтрации биопротезов клапанов сердца на поздних сроках их функционирования
- Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P., Gentile F. et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. Circulation. 2021;143(5):e72-e227. https://doi.org/10.1161/CIR.0000000000000923.
- Барбараш Л.С., Журавлева И.Ю. Эволюция биопротезов клапанов сердца: достижения и проблемы двух десятилетий. Комплексные проблемы сердечно-сосудистых заболеваний. 2012;(1):4-11. https://doi.org/10.17802/2306-1278-2012-1-4-11.
- Pibarot P., Dumesnil J.G. Prosthetic heart valves: selection of the optimal prosthesis and long-term management. Circulation. 2009;119(7):1034- 1048. https://doi.org/10.1161/CIRCULATIONAHA.108.778886.
- Dvir D., Bourguignon T., Otto C.M., Hahn R.T., Rosenhek R., Webb J.G. et al. Standardized definition of structural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation. 2018;137(4):388-399. https://doi.org/10.1161/CIRCULATIONAHA.117.030729.
- Kostyunin A.E., Yuzhalin A.E., Rezvova M.A., Ovcharenko E.A., Glushkova T.V., Kutikhin A.G. Degeneration of bioprosthetic heart valves: update 2020. J. Am. Heart Assoc. 2020;9(19):e018506. https://doi.org/10.1161/JAHA.120.018506.
- Senage T., Paul A., Le Tourneau T., Fellah-Hebia I., Vadori M., Bashir S. et al. The role of antibody responses against glycans in bioprosthetic heart valve calcification and deterioration. Nat. Med. 2022;28(2):283- 294. https://doi.org/10.1038/s41591-022-01682-w.
- Костюнин А.Е., Глушкова Т.В., Резвова М.А., Клышников К.Ю., Онищенко П.С., Овчаренко Е.А. N-гликолилнейраминовая кислота как возможный триггер иммунного отторжения эпоксиобработанных ксеноперикардиальных биопротезов клапанов сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2023;12(3):173-180. https://doi.org/10.17802/2306-1278-2023-12-3-173-180.
- Kossar A.P., George I., Gordon R., Ferrari G. Bacterial infiltration and bioprosthetic valve failure: Emerging diagnostics for emerging therapies. J. Thorac. Cardiovasc. Surg. 2020;159(4):1279-1282. https://doi.org/10.1016/j.jtcvs.2019.07.149.
- Nair V., Law K.B., Li A.Y., Phillips K.R., David T.E., Butany J. Characterizing the inflammatory reaction in explanted Medtronic Freestyle stentless porcine aortic bioprosthesis over a 6-year period. Cardiovasc. Pathol. 2012;21(3):158-168. https://doi.org/10.1016/j.carpath.2011.05.003.
- Kostyunin A., Mukhamadiyarov R., Glushkova T., Bogdanov L., Shishkova D., Osyaev N. et al. Ultrastructural pathology of atherosclerosis, calcific aortic valve disease, and bioprosthetic heart valve degeneration: commonalities and differences. Int. J. Mol. Sci. 2020;21(20):7434. https://doi.org/10.3390/ijms21207434.
- Shetty R., Pibarot P., Audet A., Janvier R., Dagenais F., Perron J. et al. Lipid-mediated inflammation and degeneration of bioprosthetic heart valves. Eur. J. Clin. Invest. 2009;39(6):471-480. https://doi.org/10.1111/j.1365-2362.2009.02132.x.
- Böer U., Buettner F.F.R., Schridde A., Klingenberg M., Sarikouch S., Haverich A. et al. Antibody formation towards porcine tissue in patients implanted with crosslinked heart valves is directed to antigenic tissue proteins and αGal epitopes and is reduced in healthy vegetarian subjects. Xenotransplantation. 2017;24(2):e12288. https://doi.org/10.1111/xen.12288.
- Habib G., Lancellotti P., Antunes M.J., Bongiorni M.G., Casalta J.P., Del Zotti F. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015;36(44):3075- 3128. https://doi.org/10.1093/eurheartj/ehv319.
- Sakaue T., Nakaoka H., Shikata F., Aono J., Kurata M., Uetani T. et al. Biochemical and histological evidence of deteriorated bioprosthetic valve leaflets: the accumulation of fibrinogen and plasminogen. Biol. Open. 2018;7(8):bio034009. https://doi.org/10.1242/bio.034009.
- Fazzari F., Baggiano A., Fusini L., Ghulam Ali S., Gripari P., Junod D. et al. Early biological valve failure: structural valve degeneration, thrombosis, or endocarditis? J. Clin. Med. 2023;12(17):5740. https://doi.org/10.3390/jcm12175740.
- Morris A.J., Drinkovic D., Pottumarthy S., Strickett M.G., MacCulloch D., Lambie N. et al. Gram stain, culture, and histopathological examination findings for heart valves removed because of infective endocarditis. Clin. Infect. Dis. 2003;36(6):697-704. https://doi.org/10.1086/367842.


