Безопасность и иммуногенность живой аттенуированной бивалентной вакцины против блютанга на мышах и овцах
Автор: Абдураимов Е.О., Ершебулов З.Д., Жугунисов К.Д., Таранов Д.С., Булатов Е.А., Баракбаев К.Б., Кошеметов Ж.К., Кондибаева Ж.Б.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
В статье представлены результаты изу-чения безопасности живой бивалентной вак-цины против блютанга на овцах и белых мы-шах и иммуногенной активности на овцах. Блютанг - неконтагиозная вирусная транс-миссивная инфекция, передающаяся кровосо-сущими насекомыми из рода Culicoides, харак-теризующаяся лихорадочным состоянием, воспалительно-некротическими поражениями ротовой полости, особенно языка, пищевари-тельного тракта, эпителия венчика и основы кожи копыт, а также дегенеративными изме-нениями скелетных мышц. Исследования про-ведены в Жамбылской области Республики Казахстан. Установлено, что овцы на введе-ние вакцины реагируют незначительным по-вышением температуры тела до 40,1-40,5 ºС в течение первых 2-4 сут и образованием уп-лотнения на месте инъекции препарата, ко-торое рассасывается в течение последующих 2-3 сут. Полученные результаты показывают низкую реактогенность и безопасность вак-цины для овец. Проверка безопасности вакци-ны на белых мышах, использованных в качест-ве лабораторной модели, также показало от-сутствие изменений как в общем состоянии животных, так и местной реакции. Вакцина обладает выраженными иммуногенными свой-ствами, так, у овец после введения отмечено максимальное повышение титра вируснейт-рализующих антител до 3,66 log2на 21 сут с сохранением до 90 сут. На 180-е сут титр антител снизился до 1,6 log2 и сохранялся на этом уровне до 360 сут. Установлено форми-рование комплементсвязывающих антител в организме вакцинированных овец на 7-е сут с сохранением до 360 сут. Оценка клинических признаков заболевания при контрольном зара-жении показало наличие разницы в проявлении признаков болезни у привитых и не привитых животных с разницей в 26 баллов, что свиде-тельствует о высокой иммуногенной актив-ности испытуемой вакцины. Проведенные опыты показали, что вакцина против блю-танга безопасна для овец и лабораторных мышей, стимулирует в организме овец фор-мирование вируснейтрализующих и компле-ментсвязывающих антител.
Безопасность, иммуно-генность, вакцина, блютанг
Короткий адрес: https://sciup.org/14084627
IDR: 14084627 | УДК: 578.823.1:72:74
Текст научной статьи Безопасность и иммуногенность живой аттенуированной бивалентной вакцины против блютанга на мышах и овцах
Введение. Блютанг – неконтагиозная вирусная трансмиссивная инфекция, передающаяся кровососущими насекомыми из рода Culicoides , характеризующаяся лихорадочным состоянием, воспалительно-некротическими поражениями ротовой полости, особенно языка, пищеварительного тракта, эпителия венчика и основы кожи копыт, а также дегенеративными изменениями скелетных мышц [1]. Вирус блютанга относится к семейству Reoviridae , роду Orbivirus , в который входят также вирусы болезни Ибараки и эпизоотической геморрагической болезни оленей. Возбудитель Bluetongue отличается высоким уровнем антигенного плюралитета, в настоящее время в мире известно 27серотипов [2, 3].
Блютанг у овец впервые был зарегистрирован на африканском континенте, заболевание среди местного скота протекало практически бессимптомно. Инфекция приобрела злокачественный характер в связи с завозом в Африку европейских высокочувствительных к возбудителю пород овец [4]. Заболевание зарегистрировано также в России, с 1993 г. некоторые районы Бурятии считаются неблагополучными по данной инфекции [5–7]. В последние годы в Европе отмечается новая волна эпизоотии блю-танга. Заболевание распространяется в основном при торговле племенными животными из неблагополучных стран [8].
Согласно данным Министерства сельского хозяйства Республики Казахстан, в целях реализации программы по развитию экспортного потенциала мяса крупного рогатого скота (КРС) в 2011–2014 гг. в Казахстан из США, Чехии, Канады, России, Украины, Франции, Австралии, Ирландии, Австрии и Германии было завезено более 50 000 голов КРС [9]. Данное обстоятельство включает Казахстан в перечень рисковых зон распространения инфекции и требует проведения постоянных мониторинговых исследований для контроля над заболеванием.
Основными переносчиками и векторами возбудителя служат мокрецы, москиты и кровососки, переносящие как патогенный, так и вакцинный вирус [10]. Важной эпизоотологической особенностью борьбы с болезнью является способность вируса формировать природные очаги даже при однократном его заносе на определенную территорию. Это объясняется тем, что возбудитель может длительно персистировать в организме жвачных, сохраняться в организме кровососущих насекомых и передаваться трансфазно в течение нескольких поколений переносчиков [5]. В связи с этим, учитывая расширение ареала распространения возбудителя заболевания в мире и сопредельных государствах, представляет большой интерес разработка вакцины против Bluetongue для крупных и мелких жвачных животных на территории Республики Казахстан.
Цель исследований: изучение безопасности и иммуногенности живой аттенуированной бивалентной вакцины против блютанга 4-го и 16-го серотипов на лабораторных мышах и овцах.
Объекты и методы исследований
Вакцина. Образцы опытно-экспериментальной серии вакцины, изготовленные в НИИПББ. Вакцина лиофилизированная бивалентная живая культуральная против блютанга, состав защитной среды: пептон 3 %, лактоза 2 %.
Вирус. В работе для контрольного заражения использовали вирулентные штаммы вируса блютанга: Хуросон-07/04 (BTV-4) и RT/RIBSP-07/16 (BTV-16), депонированные в коллекции микроорганизмов Научно-исследовательского института проблем биологической безопасности (НИИПББ) № М-14-08/Д и М-13-08/Д синфекци-онной активностью (6,83 ± 0,16) и (6,91 ± 0,91) lg TЦД 50 /мл, соответственно.
Животные. В экспериментах использовали серонегативных к вирусу блютанга местных беспородных овец(грубошерстные, мясосального направления), в количестве 208 голов, в возрасте 3–6 мес., с живой массой 25–30 кг, и 20 белых мышей живой массой 18–21 г, которые были получены из отдела подопытных животных НИИПББ.
Животных разделили на две группы: вакцинированные и невакцинированные. Каждую группу животных содержали в отдельном поме- щении, они имели свободный доступ к воде и корму на протяжении всего эксперимента.
Проведение контроля безопасности вакцины против блютанга. Безопасность вакцины проверяли методом подкожного введения 10 овцам в дозе 1×106 TЦД 50 в объеме 1,0 мл и 20 белым мышам в дозе 1×106 TЦД 50 в объеме 0,1 мл.
Животным контрольной группы подкожно ввели стерильную воду для иньекций в вышеуказанных объемах. После вакцинации в течение 14 дней за овцами вели ежедневный клинический осмотр с термометрией, а у белых мышей ежедневно измеряли массу тела. Животных с клиническими признаками блютанга (потеря более 20 % массы тела, тяжелый конъюнктивит или любые другие признаки) подвергали эвтаназии.
Вакцинация овец. 192 головы овец прививали вакциной подкожно в дозе (1 × 104ТЦД 50 /мл). Животные были помещены в изоляторы и находились под постоянным клиническим наблюдением (термометрия и на наличие клинических признаков болезни) в течение одного года. У привитых животных периодическиотбирали пробы кровина 7, 14, 21, 28, 90, 180, 270 и 360-е сут, и сыворотки тестировали на наличие антител к вирусу блютанга в реакции нейтрализации (РН) и методом иммуноферментного анализа (ИФА).
Контрольное заражение. Вакцинированных и интактных животных заражали внутривенно патогенным вирусом гомологичного штамма в объеме 10 мл (5,5 lgТЦД50/мл). Клиническое наблюдение за животными вели в течение 30 сут с ежедневным измерением температуры тела. Учет реакции на контрольное заражение проводили по балльной шкале по клиническим признакам заболевания [1].
ИФА (иммуноферментный анализ). Обнаружение специфических антител к вирусу блютан-га в сыворотках крови исследовали с использованием сэндвич ИФА (cELISA, ID-ScreenBluetongueEarlydetectionELISA, ID-Vet, France) в соответствии с инструкцией изготовителя.
РН. Данную реакцию проводили в соответствии с методом Хейга [12].
Статистический анализ. Все статистические анализы проводились в GraphPadPrism® версии 6.0.
Результаты исследований и их обсуждение. Определение безопасности бивалентной вакцины против вируса блютанга. В результате проведенных исследований установлено (табл.), что у овец на введение вакцины наблюдалось только незначительное повышение температуры тела до 40,1–40,5 ºС в течение 2– 4 сут и уплотнение на месте введения вакцины, которое рассасывалось в течение 2–3 сут. Общее состояние животных было удовлетворительным.
Контроль безопасности вакцины на овцах
|
Материал |
Инвентарный номер животных |
Способ введения |
Доза и объем введения, TЦД 50 /мл |
Клинический признак болезни |
|||||||
|
1— о о S 1= |
аз о X |
1— аз о о |
ф аз d |
со 1— 2 г* о ^ |
ф 1— О |
аз аз о X |
ф X ф В" о 1 |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Исследуемая вакцина против блютанга |
134 |
п/к |
1×106 / 1,0 |
+ |
40,1 |
- |
- |
- |
- |
- |
- |
|
182 |
–//– |
–//– |
+ |
40,5 |
- |
- |
- |
- |
- |
- |
|
|
163 |
–//– |
–//– |
+ |
39,8 |
- |
- |
- |
- |
- |
- |
|
|
132 |
–//– |
–//– |
+ |
40,5 |
- |
- |
- |
- |
- |
- |
|
|
336 |
–//– |
–//– |
+ |
39,7 |
- |
- |
- |
- |
- |
- |
|
|
181 |
–//– |
–//– |
+ |
40,1 |
- |
- |
- |
- |
- |
- |
|
|
178 |
–//– |
–//– |
+ |
40,3 |
- |
- |
- |
- |
- |
- |
|
Окончание табл.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
333 |
-//- |
-//- |
+ |
39,5 |
- |
- |
- |
- |
- |
- |
|
|
192 |
—//— |
-//- |
+ |
40,3 |
- |
- |
- |
- |
- |
- |
|
|
Вода для инъекций (контроль) |
398 |
—//— |
1,0 мл |
+ |
39,8 |
- |
- |
- |
- |
- |
- |
|
353 |
-//- |
1,0 мл |
+ |
39,7 |
- |
- |
- |
- |
- |
- |
Примечание: п/к - подкожно; (+) - положительная реакция (наличие клинических признаков), (-) - отрицательная реакция (отсутствие клинических признаков).
Полученные результаты (см. табл.) свидетельствуют о том, что в течение всего периода клинического наблюдения (14 сут) за подопытными животными контрольной и опытной групп не отмечали клинических признаков болезни, характерных для блютанга.
Проверка безопасности вакцины на мышах показало отсутствие изменений, как в общем состоянии животных, так и местной реакции (рис. 1).
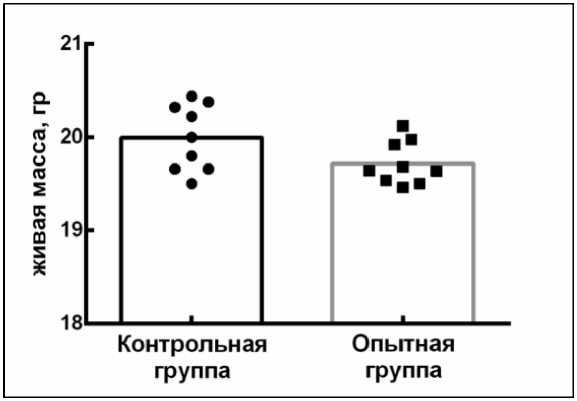
Рис. 1. Показатели живой массы белых мышей при изучении безопасности вакцины против блютанга
Анализ литературы по использованию вакцин показал, что моновалентная вакцина против 2-го серотипа вируса блютанга был использована в Корсике (с 2001 по 2004 г.) и Италии (с 2002 г.) приблизительно на 130 000 овец и коз. После вакцинации в вышеуказанных регионах у животных наблюдались незначительные побочные реакции [13]. Однако, когда эта вакцина была использована в 2000–2001 гг. в Менорке и Майорке на 320 000 овец, реактогенность наблюдались у 0,13 % и абортову 0,16 % вакцинированных животных [14].
С 2002 г. в некоторых регионах Италии для вакцинации овец и коз используется бивалентная вакцина против 2-го и 9-го серотипов блютанга. После вакцинации из более чем 1 700 000
животных на 7–14 сут у небольшого процента (0,1 %) отмечены повышение температуры тела и отек головы [15].
В наших экспериментах при иммунизации овец испытываемой вакциной вышеуказанных реакций не наблюдалось. Кроме того, в момент вакцинации 2 овцематки находились во второй половине суягности. В период опыта от суягных овцематок был получен здоровый приплод (рис. 2).
Следовательно, полученные результаты позволяют утверждать, что опытноэкспериментальные серии разработанной в НИИПББ бивалентной живой культуральной вакцины против вируса блютанга безопасны для овец и белых мышей.
Результаты РН. После вакцинации животных изучали динамику формирования ВНА в сыворотках крови. На 7-е сут после вакцинации у животных в сыворотке крови обнаруживались ВНА в титрах 1,0 log 2 и выше. Затем данный показатель к 28-м сут достиг до 3,56–3,66 log 2 , и этот уровень антител сохранялся до 90 сут. После чего уровень антител, постепенно снижаясь, к 180-м сут составил 1,6–1,8 log 2 и на таком уровне сохранился до 360 сут.
Анализ полученных результатов исследований показывает, что уровень ВНА в сыворотках крови иммунизированных овец между двумя серотипами имел существенную разницутолько на 14-е и 21-е сут (Р ≤ 0,001).
Результаты ИФА. Динамику формирования специфических антител к вирусу блютанга, а также их длительность циркуляции в организме вакцинированных животных исследовали в ИФА (рис. 3).
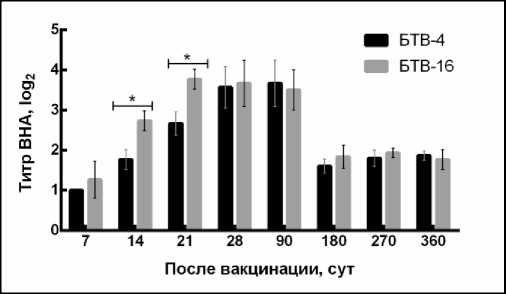
Рис. 2. Динамика формирования ВНА у овец, привитых аттенуированной бивалентной вакциной против 4-го и 16-го серотипов вируса блютанга
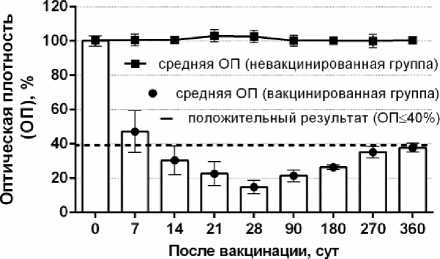
Рис. 3. Титр специфических антител у овец после вакцинации
При определении групп специфических антител на основе белка VP7 в организме вакцинированных овец во всех исследуемых группах установлено наличие тестируемых антител (выявляемый по оптической плотности согласно инструкции производителя на тест-систему) с 7 по 360 сут (срок наблюдения).
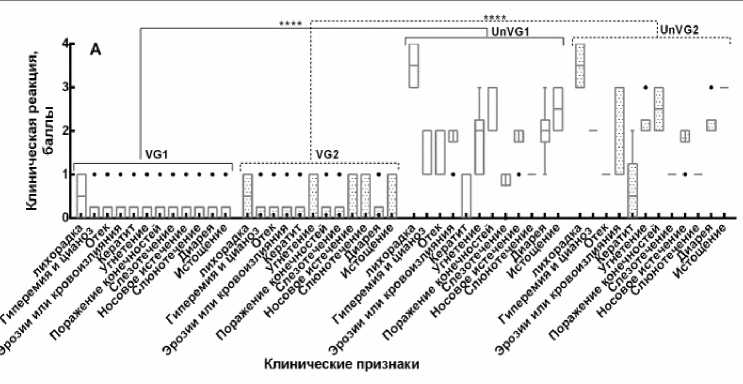
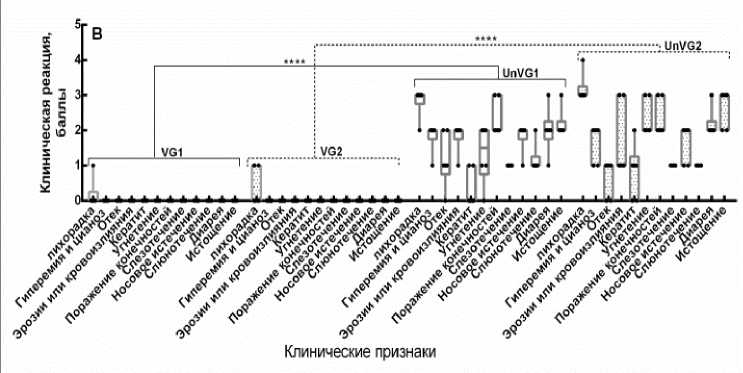
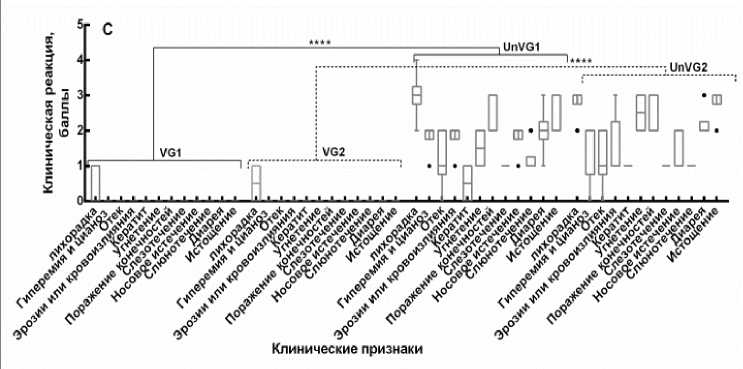
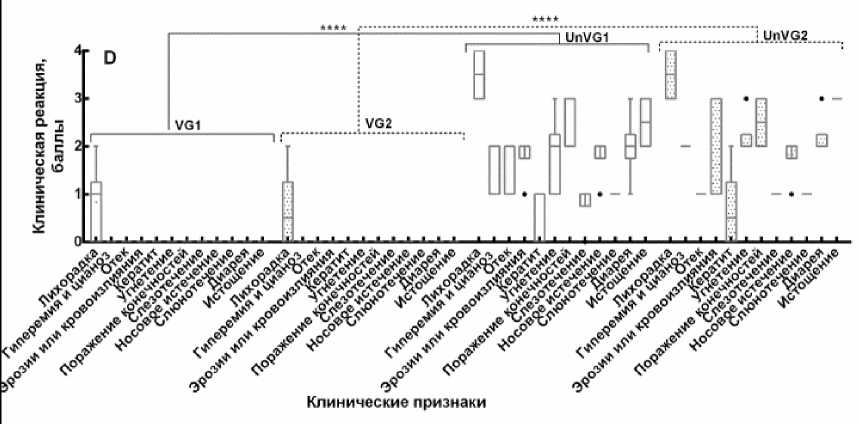
Контрольное заражение. После контрольного заражения вакцинированных и контрольных животных вели ежедневное наблюдение с регистрацией клинических признаков и результатов термометрии. Клиническое наблюдение включало выявление лихорадки, одышки, кашля, конъюнктивита, диареи, поражения ротовой полости, отека морды, поражения слизистых оболочек, угнетение животных, а также других патологических изменений. Выявленные характерные клинические признаки болезни оценивали по специальной бальной шкале и выражали в баллах индивидуально для каждого привитого животного и в среднем для группы контрольных овец (рис. 4).
:UnVG2
1»nVG1
VG1
VG2
Клинические признаки
z o’" /
.^WW«WWWZ«r'
У +<г° У У УЧА* у у у у .ЛА*
жж
>w Z
.....• UnVG2
1UnVG1
VG2
VG1
о’
Клинические признаки
JWWWW^WW#^^ zwWz^ zWWX*+^ z
ШЖЖ
UnVG1
.UnVG2
VG2
VG1
o’* o° O’ Клинические признаки
Я о а3 к с
2 S £ ю
^шжошжж^^ш
Zy /У ZZ У'»0 Л* / ЛО* ’ °
Рис. 4. Оценка клинической реакции иммунизированных овец на контрольное заражение вирулентными штаммами вируса блютанга (по балльной шкале):
A – контрольное заражение на 7-е сут после вакцинации; B – контрольное заражение на 90 сут после вакцинации; C – контрольное заражение на 270-е сут после вакцинации; D – контрольное заражение на 360 сут после вакцинации; VG1 – группа, вакцинированная бивалентной вакциной против BTV-4 и BTV-16, зараженная вирулентным штаммом BTV-4 (n = 30); VG2 – группа, вакцинированная бивалентной вакциной против BTV-4 и BTV-16, зараженная вирулентным штаммом BTV-16 (n = 30); UnVG1 – невакцинированная группа, зараженная вирулентным штаммом BTV-4 (n = 4); UnVG2 – невакцинированная группа, зараженная вирулентным штаммом BTV-16 (n = 4); «±» – данные средней стандартной ошибки; P < 0,0001
Окончание рис. 4
Данный опыт показал, что через 7 дней после иммунизации у животных образуется иммунитет к данным серотипам вируса блютанга (рис. 4, А). Но вакцинированные животные при контрольном заражении недостаточно защищены от гомологичного вирулентного вируса блю-танга, что выражается проявлением некоторых клинических признаков, характерных при вирусе блютанга, которые были оценены в 10 баллов, что соответствует реакции средней тяжести. Тогда как не вакцинированные животные заболели блютангом, клиническая реакция этих животных была оценена в 20,8 баллов. При этом разница в проявлении клинической картины болезни у привитых и непривитых животных составляла 10,8 баллов. На 14, 90 и 270-е сут после иммунизации у животных формировался прочный и напряженный иммунитет против BTV-4 и BTV-16 серотипов вируса блютанга (рис. 4, В, С). На введение вирулентного вируса блю-танга у вакцинированных групп отмечали незначительное повышение температуры тела у 0,2 % животных, в то время как невакциниро-ванные животные заболели с проявлением клинических признаков болезни. У этих животных на 4-5 день после введения вирулентного материала отмечали повышение температуры тела от 40,5 до 41,2 ºС в течение 5-6 дней. Затем появились отеки в области морды (век, губ, подчелюстного пространства), кератиты, эрозии на слизистой оболочке рта, носогубном зеркале, кровоизлияния на венчике копыт, хромата. На 360-е сут после иммунизации при контрольном заражении животные имели выраженный иммунитет, однако у одной привитой овцы наблюдалось повышение температуры тела до 41,5 ºС в течение 2 сут, которая затем снижалась до физиологической нормы. Реакция на контрольное заражение вирулентным вирусом 4-го и 16-го серотипов у привитых живой аттенуированной бивалентной вакциной против блютанга в среднем по группе составила один балл, а у непривитых – 27 баллов. Согласно шкалы оценки клинических признаков заболевания при блю-танге, установлено, что разница в проявлении клинической картины болезни у привитых и непривитых животных составила 26 баллов, что свидетельствует о высокой иммуногенной активности испытуемой вакцины, которая подтверждается результатами контрольного заражения животных, привитых живой бивалентной аттенуированной вакциной.
Выводы. Результаты проведенных опытов показали, что вакцина против блютанга при введении лабораторным мышам не вызывает у последних патологических изменений, заболевания и снижения массы. Введение вакцины овцам показало, что препарат не вызывает в организме животных патологических изменений характерных для инфекционного процесса.
Таким образом, проведенные лабораторные исследования показали, что разработанная вакцина против 4-го и 16-го серотипов вируса блю-танга является безопасным и иммуногенным препаратом.
Список литературы Безопасность и иммуногенность живой аттенуированной бивалентной вакцины против блютанга на мышах и овцах
- Roy P. 2002. Orbivirus. 1stEdn. In: Tidona, C.D. and G. Darai (Eds.). The Springer Index of viruses. Springer-Verlag, Berlin, Germany, P. 957-963.
- OIE terrestrial manual 2009, 2014. 1. Blue-tongue and Epizootic haemorrhagic disease Chapter 2.1.3.
- Complete Genome Characterisation of a Novel 26th Bluetongue Virus Serotype from Kuwait/S. Maan, N.S. Maan, K. Nomikou //PLoS ONE. -2011. -№ 6-10. -e26147.
- Theiler A. Bluetongue in sheep//Annual Report. -1906. -P. 115-121.
- Бакулов И.А. Эпизоотическая ситуация в ми-ре по особо опасным болезням животных к концу ХХ столетия//Диагностика, профилак-тика и меры борьбы с особо опасными, экзо-тическими и зооантропонозными болезнями животных: мат-лы науч.-практ. конф. -По-кров, 2000. -С. 11-17.
- Идентификация и типирование вируса ката-ральной лихорадки овец/И.Ф. Вишняков, М.Б. Новикова, А.А. Стрижаков //Ве-теринария. -1995. -№4. -С. 20-25.
- Жугунисов К.Д., Абдураимов Е.О, Мамадалиев С.М. Катаральная лихорадка овец -новая опасность для Казахстана//Биотехнология. Теория и практика. -2009. -№ 3. -С. 34-39.
- Муруева Г.Б. Актуальность контроля блютанга овец при обеспечении продовольственной безопасности Республики Бурятия//Овцы, ко-зы, шерстяное дело. -2011. -№ 3. -С. 48-50.
- URL: http://kapital.kz/economic/30953/rk-ogranichit-import-krupnogo-rogatogo-skota.html.
- Sperlova A., Zendulkova D.Bluetongue: a re-view//VeterinarniMedicina, 56, 2011 (9): 430-452.
- Duration of protective immunity after a single vaccination with a live attenuated bivalent blue-tongue vaccine/K. Zhugunissov, Z. Yershebulov, K. Barakbayev //Vet. Res. Commun. -2015 Dec; 39(4):203-10.
- Haig DGMaRAA DA. The cytopathic action of Bluetongue virus on tissue cultures and its ap-plication to the detection of antibodies in the serum of sheep. Onderstepoort Journal of Vet-erinary Research 1956;27(2).
- The epidemiology anddiagnosis of bluetongue with particular reference to Corsica/E. Breґard, C. Hamblin, S. Hammoumi //Res. Vet. Sci. 2004. -V. 77. -P. 1-8.
- Gerbier G., Hendrikx P., Roger F. Blue-tongue control using vaccines: an experience from the mediterranean islands in Europe. In: Proceedings of the third OIE bluetongue inter-national symposium, Taormina, Sicily, 26-29 October, 2003. -P.151.
- Dott. Marco Canalis Monovalent modifiedlive vaccine against Bluetongue serotype 1: Safety & Efficacy studies in sheep // Tesi di Dottorato in - Scienze e Tecnologie Zootecniche // UniversitàdegliStudi di Sassari. - 2008. - P.146.
- Roy P. 2002. Orbivirus. 1stEdn. In: Tidona, C.D. and G. Darai (Eds.). The Springer Index of vi-ruses. Springer-Verlag, Berlin, Germany, P. 957-963.
- OIE terrestrial manual 2009, 2014. 1. Blue-tongue and Epizootic haemorrhagic disease Chapter 2.1.3.
- Complete Genome Characterisation of a Novel 26th Bluetongue Virus Serotype from Kuwait/S. Maan, N.S. Maan, K. Nomikou //PLoS ONE. -2011. -№ 6-10. -e26147.
- Theiler A. Bluetongue in sheep//Annual Report. -1906. -P. 115-121.
- Bakulov I.A. Jepizooticheskaja situacija v mire po osobo opasnym boleznjam zhivotnyh k koncu HH stoletija//Diagnostika, profilaktika i mery bor'by s osobo opasnymi, jekzoticheskimi i zooantroponoznymi boleznjami zhivotnyh: mat-ly nauch.-prakt. konf. -Pokrov, 2000. -S. 11-17.
- Identifikacija i tipirovanie virusa kataral'noj lihoradki ovec/I.F. Vishnjakov, M.B. Novikova, A.A. Strizhakov //Veterinarija. -1995. -№ 4. -S. 20-25.
- Zhugunisov K.D., Abduraimov E.O, Mamadaliev S.M. Kataral'naja lihoradka ovec -novaja opasnost' dlja Kazahstana//Biotehnologija. Teorija i praktika. -2009. -№ 3. -S. 34-39.
- Murueva G.B. Aktual'nost' kontrolja bljutanga ovec pri obespechenii prodovol'stvennoj bezopasnosti Respubliki Burjatija//Ovcy, kozy, sherstjanoe delo. -2011. -№3. -S. 48-50.
- URL: http://kapital.kz/economic/30953/rk-ogran ichit-import-krupnogo-rogatogo-skota.html.
- Sperlova A., Zendulkova D. Bluetongue: a re-view//VeterinarniMedicina, 56, 2011 (9): 430-452.
- Duration of protective immunity after a single vaccination with a live attenuated bivalent blue-tongue vaccine/K. Zhugunissov, Z. Yershebulov, K. Barakbayev //Vet. Res. Commun. -2015 Dec; 39(4):203-10.
- Haig DGMaRAA DA. The cytopathic action of Bluetongue virus on tissue cultures and its ap-plication to the detection of antibodies in the se-rum of sheep. Onderstepoort Journal of Veteri-nary Research 1956;27(2).
- The epidemiology anddiagnosis of bluetongue with particular reference to Corsica/E. Breґard, C. Hamblin, S. Hammoumi //Res. Vet. Sci. 2004. -V. 77. -P. 1-8.
- Gerbier G., Hendrikx P., Roger F. Blue-tongue control using vaccines: an experience from the mediterranean islands in Europe. In: Proceedings of the third OIE bluetongue inter-national symposium, Taormina, Sicily, 26-29 October, 2003. -P.151
- Dott. Marco Canalis Monovalent modified-live vaccine against Bluetongue serotype 1: Safety & Efficacy studies in sheep // Tesi di Dottorato in - Scienze e Tecnologie Zootecniche // UniversitàdegliStudi di Sassari. - 2008. - P.146.


