Безопасность и эффективность торакоскопической лобэктомии у больных немелкоклеточным раком легкого I стадии
Автор: Рябов Андрей Борисович, Пикин Олег Валентинович, Багров Владимир Алексеевич, Колбанов Константин Иванович, Глушко Владимир Алексеевич, Вурсол Дмитрий Анатольевич, Амиралиев Али Магомедович, Бармин Виталий Валерьевич, Александров Олег Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оценить непосредственные и отдаленные результаты торакоскопической лобэктомии у больных немелкоклеточным раком легкого (НМРЛ), оперированных в одном лечебном учреждении. Материл и методы. Проведен анализ непосредственных и отдаленных результатов торакоскопической лобэктомии у 479 больных НМРЛ с клинической I стадией заболевания, оперированных в торакальном отделении МНИОИ им. П.А. Герцена с 2010 по 2019 г. Результаты. Конверсия в торакотомный доступ потребовалась у 62 (12,9 %) больных. Частота послеоперационных осложнений в группе торакоскопических операций составила 19,9 %, в группе конверсий - 25,8 %, летальность -0,4 % и 1,6 % соответственно. Наиболее частое осложнение - длительная негерметичность легочной ткани - встретилось в 11,9 % и 8,0 % соответственно. У больных старше 70 лет частота осложнений после торакосокпической операции составила 35,6 %, а в группе конверсии - 41,2 %. Отмечено преимущество торакоскопической лобэктомии в виде менее выраженного болевого сидрома и изменений показателей ОФВ1 в послеоперационном периоде. Общая и безрецидивная 5-летняя выживаемость в группе больных НМРЛ I стадии (pT1a-bN0M0; pT2aN0M0) после торакоскопической лобэктомии составила 92,2 % и 86,6 %, а у больных, перенесших конверсию, - 87,5 % и 81,2 % соответственно. Заключение. Торакоскопическая лобэктомия - относительно безопасная операция у больных НМРЛ I стадии. Для освоения техники выполнения торакоскопической лобэктомии необходимо пройти «кривую обучения». Отдаленные результаты торакоскопической лобэктомии не уступают таковым в открытой хирургии.
Рак легкого, торакоскопическая лобэктомия, конверсия
Короткий адрес: https://sciup.org/140254413
IDR: 140254413 | УДК: 616.24-006.6-089.87 | DOI: 10.21294/1814-4861-2021-20-1-24-33
Текст научной статьи Безопасность и эффективность торакоскопической лобэктомии у больных немелкоклеточным раком легкого I стадии
Торакоскопическая лобэктомия вошла в клиническую практику у больных раком легкого в начале 90-х гг. прошлого века [1–3]. С тех пор в мире накоплен значительный опыт выполнения подобных операций, однако ряд вопросов относительно безопасности и эффективности торакоскопической лобэктомии остаются нерешенными [4, 5].
Цель исследования – оценить непосредственные и отдаленные результаты торакоскопической лобэктомии у больных немелкоклеточным раком легкого (НМРЛ), оперированных в одном лечебном учреждении.
Материал и методы
В исследование включено 479 больных периферическим НМРЛ I стадии (cT1-2aN0M0), оперированных в торакальном отделении МНИОИ им. П.А. Герцена с 1 января 2010 г. по 31 декабря 2019 г. Для стадирования использовали классификацию TNM 7-го пересмотра (2009). Всем больным предпринята попытка выполнения торакоскопической лобэктомии, переход к торакотомии осуществлен у 62 (12,9 %) больных. Торакоскопически операция завершена у 417 (87,1 %) больных. Таким образом, больных разделили на две группы: в 1-ю группу включили больных, которым операция завершена торакоскопически, 2-ю группу составили
больные, которым выполнена конверсия (табл. 1). Сравниваемые группы были сопоставимы по большинству показателей. В группе торакоскопических операций 59 (14,1 %) пациентов были старше 70 лет, а в группе конверсий – 17 (27,4 %).
Перед операцией всем больным проводили общеклинические исследования, изучали функ-циональноое состояние дыхательной и сердечнососудистой систем (ФВД, ЭКГ, ЭХО-КГ, УЗИ вен нижних конечностей), а также осуществляли поиск возможных отдаленных метастатических очагов. План обследования, наряду с КТ органов грудной клетки, видеобронхоскопией со смывами из бронхов и эндобиопсией лимфатических узлов, УЗИ органов брюшной полости и надключичных зон, МРТ головного мозга, радионуклидным исследованием скелета, нередко дополняли позитронно-эмиссионной томографией с 18-фтор-дезоксиглюкозой.
Операции выполняли 6 хирургов по единой многопортовой методике: в первый период (с 2010 по 2013 г.) использовали методику с мини-доступом, с 2014 по 2019 г. – методику полной эндоскопии, описанной в предыдущих публикациях [6].
Анализ полученных результатов проводили на основе методов описательной статистики. Количественные и качественные показатели обрабатывались с помощью Т-теста Стьюдента, U-критерия Манна–Уитни. Для сравнения достоверности разли-
Таблица 1/table 1
Характеристика групп больных в зависимости от выполненного доступа patient characteristics according to surgical approach
|
Характеристика больных/ Patient characteristics |
Торакоскопия/ Thoracoscopy (n=417) |
Конверсия/ Conversion (n=62) |
р |
|
Женщины/Women |
225 (54,0 %) |
27 (43,5 %) |
>0,05 |
|
Мужчины/Men |
192 (46,0 %) |
35 (56,5 %) |
>0,05 |
|
Возраст (лет)/Age (years) |
60,2 (23–83) |
62,7 (35–80) |
>0,05 |
|
Сопутствующая патология |
|||
|
ХОБЛ/Chronic obstructive pulmonary disease |
243 (58,3 %) |
38 (61,3 %) |
>0,05 |
|
Сердечно-сосудистая патология/Cardiovascular disease |
245 (58,7 %) |
41 (66,1 %) |
>0,05 |
|
Хронический гастрит/Chronic gastritis |
183 (43,8 %) |
30 (48,4 %) |
>0,05 |
|
Язвенная болезнь/Peptic ulcer |
40 (9,6 %) |
5 (8,0 %) |
>0,05 |
|
Сахарный диабет/Diabetes mellitus |
16 (3,8 %) |
2 (3,2 %) |
>0,05 |
|
Индекс коморбидности Чарльсона (в баллах)/ Charlson Comorbidity Index (in points) |
|||
|
<5 |
252 (60,5 %) |
40 (64,5 %) |
>0,05 |
|
>5 |
165 (39,5 %) |
22 (35,5 %) |
>0,05 |
|
ОФВ1, % |
|||
|
80–100 |
174 (41,7 %) |
24 (38,7 %) |
>0,05 |
|
50–79 |
205 (49,2 %) |
34 (54,8 %) |
>0,05 |
|
<50 |
38 (9,1 %) |
4 (6,5 %) |
>0,05 |
|
Операция/Surgery |
|||
|
Верхняя лобэктомия справа/Right upper lobectomy |
124 (29,7 %) |
25 (56,6 %) |
<0,05 |
|
Cредняя лобэктомия справа/Right middle lobectomy |
37 (8,9 %) |
3 (4,8 %) |
<0,05 |
|
Нижняя лобэктомия справа/Right lower lobectomy |
90 (21,6 %) |
4 (6,4%) |
<0,05 |
|
Верхняя лобэктомия слева/Left upper lobectomy |
72 (17,3%) |
13 (20,9%) |
>0,05 |
|
Нижняя лобэктомия слева/Left lower lobectomy |
94 (22,5%) |
7 (11,3%) |
<0,05 |
|
Гистотип опухоли/Histology |
|||
|
Аденокарцинома/Adenocarcinoma |
348 (83,6 %) |
51 (82,3 %) |
>0,05 |
|
Плоскоклеточный рак/Squamous carcinoma |
63 (15,1 %) |
10 (16,1 %) |
>0,05 |
|
Аденоплоскоклеточный рак/Adeno-squamous carcinoma |
6 (1,4 %) |
1 (1,6 %) |
>0,05 |
|
сTNM (2009) |
|||
|
cT1aN0M0 |
208 (49,8 %) |
24 (38,7 %) |
>0,05 |
|
cT1bN0M0 |
165 (39,6 %) |
30 (48,4 %) |
>0,05 |
|
cT2aM0M0 |
44 (10,6 %) |
8 (12,9 %) |
>0,05 |
Таблица 2/table 2
Интра- и послеоперационные показатели в зависимости от вида конверсии intra- and postoperative parameters according to the type of conversion
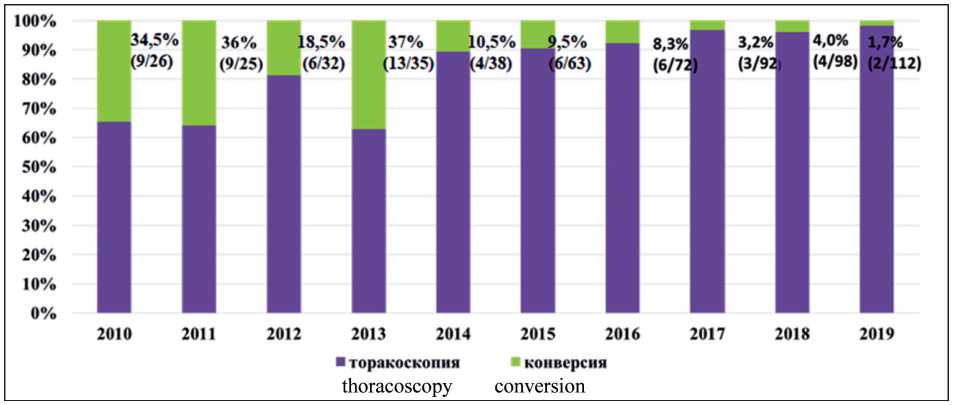
Рис. 1. Динамика частоты конверсий по годам Fig. 1. Dynamic of conversion rate
чий использовали Log rank test. Анализ выживаемости проводили путем построения кривых дожития по методу Каплана–Майера. Для обработки результатов использовали пакет прикладных программ Statistica 7.0, программы Microsoft office Excel 2007.
Результаты
Так называемая «экстренная» конверсия в связи с повреждением бронха и кровотечением предпринята у 20 (32,3 %), а «плановая», обусловленная выраженным спаечным процессом, невозможностью выделения сегментарных сосудов из-за кальцинированных или метастатически измененных лимфатических узлов, – у 42 (67,7 %) больных. По мере накопления опыта частота конверсий снизилась с 34,5 % в 2010 г. до 1,7 % в 2019 г. (рис. 1)
Увеличение показателя частоты конверсии до 37 % в 2013 г. обусловлено переходом всех хирургов отделения на методику «полной эндоскопии», что потребовало прохождения так называемой кривой обучения. Причинами конверсии в торакотомный доступ явились: выраженный спаечный процесс – у 30 (48,8 %), кровотечение – у 18 (29,0 %), распространенность опухолевого процесса – у 12 (19,4 %) и повреждение бронха – у 2 (3,2 %) больных. Показатели в группе «экстренной» и «плановой» конверсии значимо отличались только по объему интраоперационной кровопотери (табл. 2).
Послеоперационные осложнения констатированы у 99 (20,7 %) больных (табл. 3). Одним из наиболее частых осложнений торакоскопической операции является длительная негерметичность
Таблица 3/table 3
Послеоперационные осложнения у больных после торакоскопической операции и конверсии postoperative complications in patients after thoracoscopic surgery and conversion
Частота осложнений у больных старшей возрастной группы (старше 70 лет) представлена в табл. 4. Статистически значимые различия достигнуты только по частоте развития пароксизма фибрилляции предсердий в сторону ее увеличения в группе конверсий, однако общая частота ослож- нений у больных старше 70 лет была достоверно выше, чем в общей группе больных.
При анализе степени тяжести послеоперационных осложнений по классификации Clavien–Dindo не получено достоверных различий между группой больных с торакоскопически завершенной операцией и больными, которым выполнена конверсия (табл. 5).
Летальный исход после торакоскопической лобэктомии зафиксирован у 2 (0,4 %) больных (в обоих случаях причиной явилась тромбоэмболия легочной артерии), в группе конверсий летальность составила 1,6 % (умер 1 больной). При неосложненном течении послеоперационного периода
Таблица 4/table 4
Частота осложнений у больных старше 70 лет по группам the frequency of complications in patients aged over 70 years by groups
|
Осложнения/ Complications |
Торакоскопия/ Thoracoscopy (n=59) |
Конверсия/ Conversion (n=17) |
р |
|
Длительная негерметичность паренхимы легкого/ Long-term leakage of the lung parenchyma |
15 (25,4 %) |
4 (23,5 %) |
>0,05 |
|
Пароксизм фибрилляции предсердий/ Paroxysm of atrial fibrillation |
3 (5,0 %) |
2 (11,8 %) |
˂0,05 |
|
Разрыв буллы/Lung bulla rupture |
1 (2,5 %) |
– |
– |
|
Хилоторакс/Chylothorax |
1 (2,5 %) |
– |
– |
|
Пневмония/Pneumonia |
– |
1 (7,1 %) |
– |
|
Острая спаечная кишечная непроходимость/ Acute adhesive intestinal obstruction |
1 (2,5 %) |
– |
– |
|
Итого/Total |
21 (35,6 %) |
7 (41,2 %) |
>0,05 |
Таблица 5/table 5
Степень тяжести послеоперационных осложнений по классификации clavien–dindo the severity of postoperative complications according to the clavien–dindo classification
|
Градация осложнений/ Complication grades |
Торакоскопия/ Thoracoscopy (83/417) |
Конверсия Conversion (16/62) |
р |
|
Малые осложнения (уровень I–II)/ Minor complications (level I–II) |
62 (14,9 %) |
9 (14,5 %) |
˃0,05 |
|
Серьезные осложнения/Serious complications |
|||
|
Уровень IIIa/ Level IIIa Уровень IIIb/ Level IIIb |
20 (4,8 %) 2 (0,4 %) |
6 (9,6 %) 1 (1,6 %) |
˃0,05 |
Таблица 6/table 6
Количество удаленных внутригрудных лимфатических узлов в зависимости от доступа Number of removed intrathoracic lymph nodes depending on surgical approach
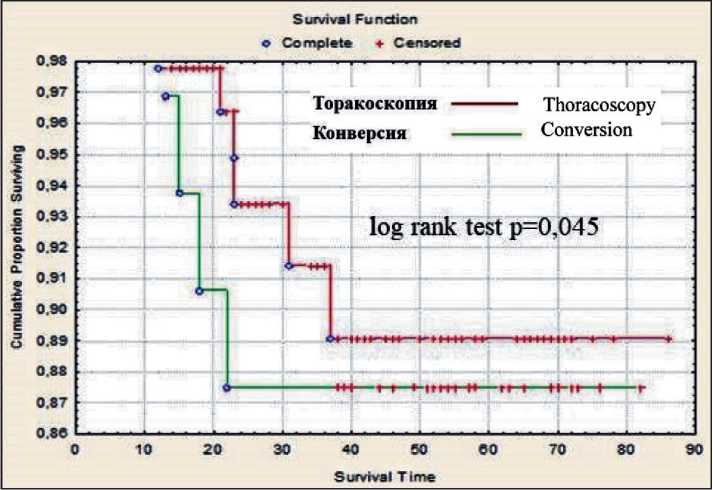
Рис. 2. Общая 5-летняя выживаемость у больных НМРЛ I стадии (pT1a-bN0M0; pT2aN0M0) после торакоскопической лобэктомии и конверсии
Fig. 2. Overall survival in stage I NSСLС patients (pT1a-bN0M0; pT2aN0M0) after thoracoscopic lobectomy and conversion
Анализ функциональных результатов торакоскопической лобэктомии показал значимо более высокие показатели ОФВ1 (%) через 1 и 6 мес после операции: 71,9 ± 11,6 против 66,7 ± 9,7 (р=0,04) в группе конверсий и 80,5 ± 12,2 против 70,2 ± 4,7 в группе конверсий (р=0,002). Через год после операции отмечено нивелирование разницы в показателях ОФВ1 в исследуемых группах: 87,3 ± 6,8 против 83,8 ± 9,4 (р=0,09).
Сравнение интенсивности болевого синдрома по визуально-аналоговой шкале (в баллах) [7] после торакоскопической лобэктомии также показало меньшую его выраженность в 1-е, 3-и сут и через 3 мес после операции по сравнению с группой конверсии – 3,8 (2,6–5,1) и 4,8 (3,0–6,6) (р=0,042); 2,9 (1,3–4,2) и 3,8 (2,4–5,2) (р=0,026); 1,9 (1,1–2,7) и 2,9 (1,6–4,2) (р=0,015) с нивелированием разницы через 6 мес после операции (1,7 (1,1–2,8) и 2,1 (1,4–3,2) (р=0,182)).
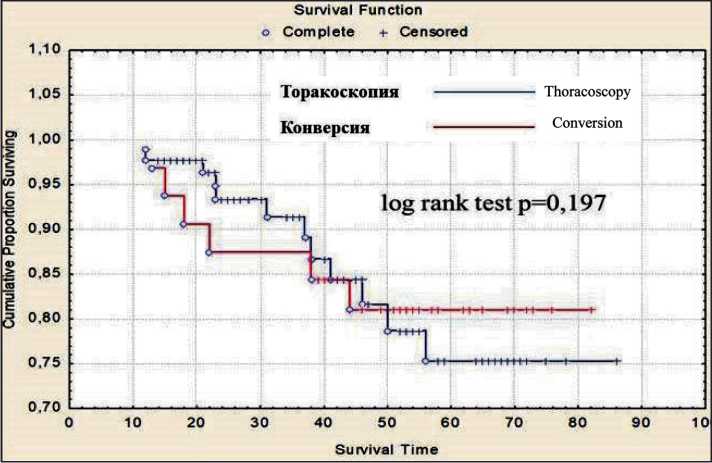
Рис. 3. Безрецидивная 5-летняя выживаемость в группе у больных НМРЛ I стадии (pT1a-bN0M0; pT2aN0M0) после торакоскопической лобэктомии и конверсии
Fig. 3. Disease-free survival in stage I NSСLС patients (pT1a-bN0M0; pT2aN0M0) after thoracoscopic lobectomy and conversion
Количество удаленных внутригрудных лимфатических узлов в ходе торакоскопической операции и конверсии в торакотомию оказалось идентичным и полностью соответствует критериям адекватности медиастинальной лимфаденэктомии (табл. 6). При плановом морфологическом исследовании рестадирование по индексу N произошло у 67 (14,1 %) больных: метастазы в лимфатических узлах N1 выявлены у 42 (8,8 %) и средостенных лимфатических узлах (N2) – у 25 (5,3 %) больных.
Отдаленные результаты прослежены у 389 (81,2 %) больных. Общая и безрецидивная 5-летняя выживаемость у больных НМРЛ I стадии (pT1a-bN0M0; pT2aN0M0) после торакоскопической лобэктомии составила 92,2 % и 86,6 %, у больных, перенесших конверсию, – 87,5 % и 81,2 % соответственно (рис. 2, 3). Общая 5-летняя выживаемость при аденокарциноме – 92,9 %, при плоскоклеточном раке легкого – 89,2 %.
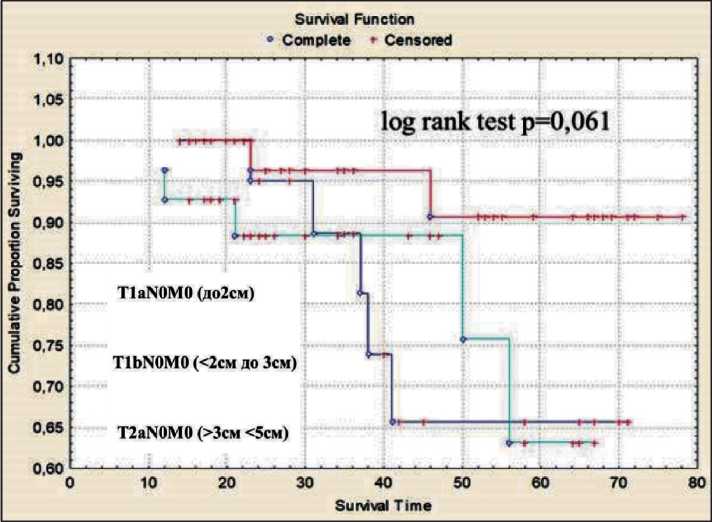
Рис. 4. Безрецидивная 5-летняя выживаемость у больных I стадии НМРЛ после торакоскопической лобэктомии в зависимости от размеров первичной опухоли
Fig. 4. Disease-free survival in stage I NSСLС patients after thoracoscopic lobectomy and tumor size
Безрецидивная 5-летняя выживаемость при pT1aN0M0 (опухоль до 2 см в диаметре) составила 94,3 %, при pT1bN0M0 (от 2 до 3 см) – 81,5 % и при pT2aN0M0 (от 3 до 5 см) – 82,1 % (рис. 4). Безрецидивная выживаемость в зависимости от стадии заболевания: при pT1a,b-2aN0M0 (I стадия) 86,6 % больных пережили 5 лет, при pT1-2aN1M0 – 53,8 %, при IIIA стадии (pT1-2aN2M0) – 27,2 % (рис. 5).
Обсуждение
В настоящее время торакоскопическая лобэктомия у больных НМРЛ I стадии является стандартом хирургического лечения [8, 9]. По нашим данным, 65,0 % всех анатомических резекций легкого в отделении торакальной хирургии выполняются торакоскопически. Однако многие
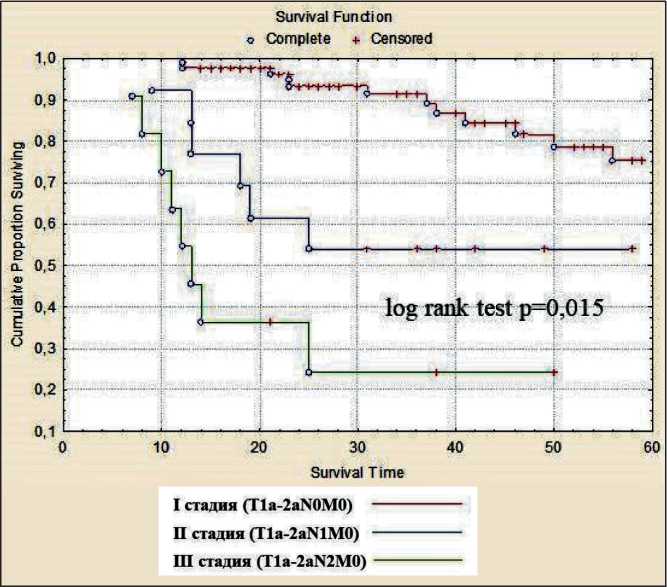
Рис. 5 Безрецидивная выживаемость у больных НМРЛ после торакоскопической лобэктомии в зависимости от стадии заболевания
Fig. 5. Disease-free survival in NSСLС patients and the stage аспекты безопасности и эффективности торакоскопической лобэктомии остаются до конца не изученными. По данным литературы, частота конверсии при торакосокпической лобэктомии варьирует в широких пределах – от 1,6 до 23,0 % [4, 10, 11]. Этот показатель зависит от многих факторов: опыта хирурга, анатомических особенностей больного, стадии опухолевого процесса. По нашим данным, частота конверсии составила 12,9 % с закономерным снижением этого показателя по мере накопления опыта с 34,5 до 1,7 %. Наиболее частой причиной перехода к открытой операции являются интраоперационное кровотечение, спаечный процесс, кальцинированные или метастатически измененные лимфатические узлы [11, 12]. Это положение подтверждают и наши данные. Важным критерием освоения методики торакоскопической лобэктомии является прохождение так называемой кривой обучения, которая в среднем составляет 50 операций на одного хирурга, после чего частота интраоперационных осложнений и, как следствие, показатель конверсии снижаются [11–13]. Многие авторы считают, что конверсия, выполненная в плановом порядке, т.е. когда хирург сталкивается с непреодолимыми для себя трудностями в продолжение операции торакоскопически, не приводит к ухудшению непосредственных результатов, в отличие от «экстренной» конверсии, чаще выполняемой при неконтролируемом интраоперационном кровотечении [4, 11, 12, 14]. Не получено достоверных отличий в частоте послеоперационных осложнений у больных, перенесших «плановую» и «экстренную» конверсию, однако у больных старше 70 лет имелась тенденция к их увеличению. Это отразилось и на продолжительности пребывания больных в стационаре. Так, при нео- сложненном течении послеоперационного периода средний послеоперационный койко-день составил 6,7 ± 1,8 сут, а при осложненном течении и конверсии – 12,6 ± 3,2 сут. Одной из серьезных проблем послеоперационного периода у больных, перенесших торакоскопическую лобэктомию, является длительная негерметичность легочной ткани (>5 сут). Частота этого осложнения составляет 1,5–13,6 % [4, 15, 16]. Предрасполагающими факторами развития данного осложнения являются использование энергетических установок для разделения легочной ткани, плохо выраженная междолевая борозда, хроническая обструктивная болезнь легких, эмфизема и невозможность адекватного ушивания образовавшихся дефектов легочной ткани при торакоскопии [17]. В нашей выборке продленный сброс воздуха отмечен у 11,9 % больных. Использование прецизионной техники, «туннельного» метода при невыраженной междолевой борозде за последние три года нашей работы позволило снизить частоту данного осложнения до 6,3 %. Летальность после торакоскопической лобэктомии не превышает 2,0 % [4, 15, 18, 19]. В нашей серии наблюдений в послеоперационном периоде умерло 2 больных, летальность составила 0,4 %.
Неоспоримым преимуществом торакоскопической лобэктомии являются меньшей выраженности болевой синдром и, как следствие, менее значимое снижение показателей ОФВ1 в послеоперационном периоде [20, 21]. Проведенный нами анализ динамики показателей ОФВ1 и степени выраженности болевого синдрома показал достоверные преимущества торакоскопического доступа в первые сутки и месяцы после операции с нивелированием различий к концу первого года после вмешательства.
Критерием адекватности оперативного вмешательства у больных раком легкого являются качество медиастинальной лимфаденэктомии и 5-летняя выживаемость. Полученные нами результаты подтверждают возможность выполнения адекватной медиастинальной лимфаденэктомии и полностью соответствуют принятым критериям [22, 23]. Интересные данные получены при плановом морфологическом исследовании удаленных лимфатичесикх узлов. Несмотря на тщательное предоперационное стадирование и отбор больных с клинической I стадией заболевания, метастазы во внутригрудных лимфатических узлах диагностированы у 14,1 % (метастазы в N2 коллекторе – у 5,3 %) больных, что еще раз подтверждает необходимость выполнения полноценной медиастинальной лимфаденэктомии у всех больных НМРЛ.
Полученные нами показатели общей и безреци-дивной выживаемости в зависимости от размера, гистологической структуры опухоли и стадии заболевания соответствуют данным литературы и демонстрируют онкологическую целесообразность торакоскопической лобэктомии у больных НМРЛ I стадии [24, 25].
Выводы
Торакоскопическая лобэктомия – относительно безопасный вариант операции у больных НМРЛ: общее количество осложнений при лобэктомии торакоскопическим методом сходно с лобэктомией в случае конверсии, наиболее частым из которых в обеих группах является длительная негерметичность легочной ткани. Объем лимфаденэктомии при торакоскопической операции адекватен, соответствует критериям ESTS как по общему количеству удаленных лимфатических узлов, так и лимфатических узлов средостения (N2). Освоение метода торакоскопической лобэктомии проходит так называемую кривую обучения, для сокраще- ния которой необходима слаженная операционная бригада, имеющая достаточный опыт в «открытой» торакальной хирургии, а также в диагностической торакоскопии. Продолжение торакоскопической операции при высоком риске развития интраоперационных осложнений нецелесообразно. В этом случае предпочтительна плановая конверсия в торакотомный доступ. Торакоскопическая лобэктомия способствует быстрой реабилитации больных в виде более быстрого восстановления показателей функции внешнего дыхания и меньшей степени выраженности болевого синдрома. Торакоскопическая лобэктомия является адекватной операцией у больных НМРЛ I стадии, о чем свидетельствуют показатели общей и безрецидивной 5-летней выживаемости, соответствующие таковым после открытой хирургии.
Список литературы Безопасность и эффективность торакоскопической лобэктомии у больных немелкоклеточным раком легкого I стадии
- Landreneau R.J., Mack M.J., Hazelrigg S.R., Dowling R.D., Acuff T.E., Magee M.J., Ferson P.F. Video-assisted thoracic surgery: basic technical concepts and intercostal approach strategies. Ann Thorac Surg. 1992 Oct; 54(4): 800-7. https://doi.org/10.1016/0003-4975(92)91040-g.
- McKenna R.J.Jr. Thoracoscopic lobectomy with mediastinal sampling in 80-year-old patients. Chest. 1994; 106(6): 1902-4. https://doi.org/10.1378/chest.106.6.1902.
- Sigal E.I. Pervyi opyt torakoskopicheskikh operatsii. Kazanskii meditsinskii zhurnal. 1994; 75(6): 74-81.
- Decaluwe H., Petersen R.H., Hansen H., Piwkowski C., Augustin F., Brunelli A., Schmid T., Papagiannopoulos K., Moons J., Gossot D.; ESTS Minimally Invasive Thoracic Surgery Interest Group (MITIG). Major intraoperative complications during video-assisted thoracoscopic anatomical lung resections: an intention-to-treat analysis. Eur J Cardiothorac Surg. 2015; 48(4): 588-98. https://doi.org/10.1093/ejcts/ezv287.
- Blasberg J.D., Seder C.W., Leverson G., Shan Y., Maloney J.D., Macke R.A. Video-Assisted Thoracoscopic Lobectomy for Lung Cancer: Current Practice Patterns and Predictors of Adoption. Ann Thorac Surg. 2016 Dec; 102(6): 1854-1862. https://doi.org/10.1016/j.athoracsur.2016.06.030.
- Bagrov V.A., Ryabov A.B., Pikin O.V., Kolbanov K.I., Glushko V.A., Vursol D.A., Amiraliev A.M., Rudakov R.V., Barmin V.V. Prichiny i posledstviya konversii pri torakoskopicheskikh anatomicheskikh rezektsiyakh legkikh. Onkologiya. Zhurnal im. P.A. Gertsena. 2017; 6(3): 11-16. https://doi.org/10.17116/onkolog20176311-16.
- Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken). 2011 Nov; 63 Suppl 11: S24052. https://doi.org/10.1002/acr.20543.
- Boffa D.J., Kosinski A.S., Furnary A.P., Kim S., Onaitis M.W., Tong B.C., Cowper P.A., Hoag J.R., Jacobs J.P., Wright C.D., Putnam J.B.Jr., Fernandez F.G. Minimally Invasive Lung Cancer Surgery Performed by Thoracic Surgeons as Effective as Thoracotomy. J Clin Oncol. 2018 Aug 10; 36(23): 2378-2385. https://doi.org/10.1200/JCO.2018.77.8977.
- Cao C., Zhu Z.H., Yan T.D., Wang Q., Jiang G., Liu L., Liu D., Wang Z., Shao W., Black D., Zhao Q., He J. Video-assisted thoracic surgery versus open thoracotomy for non-small-cell lung cancer: a propensity score analysis based on a multi-institutional registry. Eur J Cardiothorac Surg. 2013 Nov; 44(5): 849-54. https://doi.org/10.1093/ejcts/ezt406.
- Onaitis M.W., Petersen R.P., Balderson S.S., Toloza E., Burfeind W.R., Harpole D.H. Jr., D’Amico T.A. Thoracoscopic lobectomy is a safe and versatile procedure: experience with 500 consecutive patients. Ann Surg. 2006; 244(3): 420.
- Samson P., Guitron J., Reed M.F., Hanseman D.J., Starnes S.L. Predictors of conversion to thoracotomy for video-assisted thoracoscopic lobectomy: a retrospective analysis and the influence of computed tomography-based calcification assessment. J Thorac Cardiovasc Surg. 2013 Jun; 145(6): 1512-8. https://doi.org/10.1016/j.jtcvs.2012.05.028.
- Pishchik V.G., Zinchenko E.I., Kovalenko A.I. Analiz prichin konversii pri videotorakoskopicheskikh anatomicheskikh rezektsiyakh legkikh i ikh vliyaniya na blizhaishie rezul'taty. Klinicheskaya bol'nitsa. 2016; 18(4): 6-13.
- Divisi D., Barone M., Zaccagna G., De Palma A., Gabriele F., Crisci R. Video-assisted thoracoscopic surgery lobectomy learning curve: what program should be offered in a residency course? J Vis Surg. 2017 Oct 18; 3: 143. https://doi.org/10.21037/jovs.2017.08.04.
- Fourdrain A., De Dominicis F., Iquille J., Lafitte S., Merlusca G., Witte-Pfister A., Meynier J., Bagan P., Berna P. Intraoperative conversion during video-assisted thoracoscopy does not constitute a treatment failure†. Eur J Cardiothorac Surg. 2019 Apr 1; 55(4): 660-665. https://doi.org/10.1093/ejcts/ezy343.
- Pishchik V.G., Zinchenko E.I., Obornev A.D., Kovalenko A.I. Videotorakoskopicheskie anatomicheskie rezektsii legkikh: opyt 246 operatsii. Khirurgiya. Zhurnal im. N.I. Pirogova. 2016; (1): 10-15 https://doi.org/hirurgia20161210-15.
- Whitson B.A., Groth S.S., Duval S.J., Swanson S.J., Maddaus M.A. Surgery for early-stage non-small cell lung cancer: a systematic review of the video-assisted thoracoscopic surgery versus thoracotomy approaches to lobectomy. Ann Thorac Surg. 2008; 86(6): 2008-16. https://doi.org/10.1016/j.athoracsur.2008.07.009.
- Decaluwe H., Sokolow Y., Deryck F., Stanzi A., Depypere L., Moons J., Van Raemdonck D., De Leyn P. Thoracoscopic tunnel technique for anatomical lung resections: a ‘fissure first, hilum last’ approach with staplers in the fissureless patient. Interact Cardiovasc Thorac Surg. 2015 Jul; 21(1): 27. https://doi.org/10.1093/icvts/ivv048.
- Laursen L.Ø., Petersen R.H., Hansen H.J., Jensen T.K., Ravn J., Konge L. Video-assisted thoracoscopic surgery lobectomy for lung cancer is associated with a lower 30-day morbidity compared with lobectomy by thoracotomy. Eur J Cardiothorac Surg. 2016 Mar; 49(3): 870-5. https://doi.org/10.1093/ejcts/ezv205.
- Bagrov V.A., Ryabov A.B., Pikin O.V., Kolbanov K.I., Glushko V.A., Vursol D.A., Amiraliev A.M., Rudakov R.V., Barmin V.V. Oslozhneniya posle torakoskopicheskoi lobektomii u bol'nykh so zlokachestvennymi opukholyami legkikh. Onkologiya. Zhurnal im. P.A. Gertsena. 2018; 7(4): 26-33.
- Nakata M., Saeki H., Yokoyama N., Kurita A., Takiyama W., Takashima S. Pulmonary function after lobectomy: video-assisted thoracic surgery versus thoracotomy. Ann Thorac Surg. 2000 Sep; 70(3): 938-41. https://doi.org/10.1016/s0003-4975(00)01513-7.
- Nagahiro I., Andou A., Aoe M., Sano Y., Date H., Shimizu N. Pulmonary function, postoperative pain, and serum cytokine level after lobectomy: a comparison of VATS and conventional procedure. Ann Thorac Surg. 2001 Aug; 72(2): 362-5. https://doi.org/10.1016/s0003-4975(01)02804-1.
- Lardinois D., De Leyn P., Van Schil P., Porta R.R., Waller D., Passlick B., Zielinski M., Lerut T., Weder W. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg. 2006 Nov; 30(5): 787-92. https://doi.org/10.1016/j.ejcts.2006.08.008.
- Lee P.C., Kamel M., Nasar A., Ghaly G., Port J.L., Paul S., Stiles B.M., Andrews W.G., Altorki N.K. Lobectomy for Non-Small Cell Lung Cancer by Video-Assisted Thoracic Surgery: Effects of Cumulative Institutional Experience on Adequacy of Lymphadenectomy. Ann Thorac Surg. 2016 Mar; 101(3): 1116-22. https://doi.org/10.1016/j.athoracsur.2015.09.073.
- Berry M.F., D’Amico T.A., Onaitis M.W., Kelsey C.R. Thoracoscopic approach to lobectomy for lung cancer does not compromise oncologic efficacy. Ann Thorac Surg. 2014; 98(1): 197-202. https://doi.org/10.1016/j.athoracsur.2014.03.018.
- Mei J., Guo C., Xia L., Liao H., Pu Q., Ma L., Liu C., Zhu Y., Lin F., Yang Z., Zhao K., Che G., Liu L. Long-term survival outcomes of video-assisted thoracic surgery lobectomy for stage I-II non-small cell lung cancer are more favorable than thoracotomy: a propensity score-matched analysis from a high-volume center in China. Transl Lung Cancer Res. 2019 Apr; 8(2): 155166. https://doi.org/10.21037/tlcr.2018.12.04.


