Безопасность и преимущества раннего перорального питания в рамках программы Fast-Track среди пациентов, перенесших гастрэктомию по поводу рака желудка
Автор: Павлов Р.В., Тимофеева К.О., Черных М.А., Данилин В.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
На протяжении последнего десятилетия рак желудка продолжает оставаться одним из самых распространенных заболеваний в мире. В настоящее время методы консервативного и хирургического лечения данного заболевания достаточно стандартизированы. Однако тактика послеоперационного ведения больных, в том числе сроков начала перорального питания после оперативного вмешательства, до сих пор дискутабельна. К тому же современные методы лечения основываются на применении про-токолов ускоренного восстановления после операции, вопрос безопасности которых остается спорным и требует обсуждения. Целью исследования явилась оценка безопасности и преимуществ раннего энтерального питания пациентов, перенесших гастрэктомию. Материал и методы. Представлен собственный опыт нутритивной поддержки больных после гастрэктомии. В исследование вошли 82 пациента с местнораспространенным раком желудка, получившие оперативное лечение в Клинике высоких медицинских технологий им. Н.И. Пирогова в период с 2016 по 2019 г. Результаты. Доказан положительный эффект от применения раннего перорального питания в виде снижения времени до отхождения первых газов (2,8 ± 1,0 сут vs 3,9 ± 1,2 сут; p=0,001), сокращения послеоперационного пребывания пациентов в стационаре (5,4 ± 1,5 сут vs 9,5 ± 2,3 сут; р=0,001), а также более динамичного восстановления лабораторных показателей. Заключение. Раннее пероральное питание позволяет сократить продолжительность пребывания пациентов в стационаре и как следствие снизить расходы на лечение, не увеличивая при этом частоту возникновения осложнений, что указывает на его безопасность и целесообразность включения в клинические рекомендации.
Рак желудка, гастрэктомия, послеоперационная нутритивная поддержка, раннее пероральное питание, энтеральное питание, ускоренная реабилитация
Короткий адрес: https://sciup.org/140293901
IDR: 140293901 | УДК: 616.33-006.6-089
Текст научной статьи Безопасность и преимущества раннего перорального питания в рамках программы Fast-Track среди пациентов, перенесших гастрэктомию по поводу рака желудка
При стандартном ведении пациентов после операций на желудочно-кишечном тракте практикуется голодание до появления перистальтики кишечника для профилактики несостоятельности швов анастомоза. Однако в обзоре И.Н. Пасечника и соавт. отмечено, что раннее энтеральное введение питательных веществ способствует сохранению и восстановлению целостности слизистой оболочки кишечника. При отсутствии энтерального поступления пищи происходят изменения в слизистой оболочке и развивается атрофия лимфоидной ткани, ассоциированной с кишечником [6]. Ряд исследований указывает на безусловные преимущества раннего начала перорального питания, в т. ч. более быстрое восстановление функций ЖКТ и перистальтики после операции [7–9]. Аналогичные рекомендации представлены в руководстве Европейского общества парентерального и энтерального питания (ESPEN) [10].
Кроме того, раннее пероральное питание было включено в протокол программы ускоренного восстановления после операции – ERAS (Enhanced Recovery After Surgery) или FAST-TRACK. Протоколы ERAS начали широко распространяться в мире с 1990-х гг. Целью внедрения их являлось уменьшение частоты хирургических осложнений, сокращение длительности госпитализации и уменьшение затраченных на лечение пациента ресурсов. Впервые термин «ERAS» был использован на ежегодном съезде ESPEN в 2002 г., позже, в 2009 г., выпущены первые руководства по ERAS для пациентов после колоректальных операций [11]. В 2012 г. ERAS Study Group выпустила рекомендации для ведения пациентов после операций на панкреатодуоденальной зоне, в 2014 г. – после гастрэктомии [12, 13]. Сегодня программа Fast Track делает акцент на минимизацию медицинских манипуляций и снижение травматического стресса в отношении организма, а каждый ERAS-протокол включает мультидис-циплинарный подход к диагностике и лечению, адекватное обезболивание, отказ от механической подготовки кишечника перед операцией, свободное потребление пациентом жидкостей, отказ от рутинного применения назогастральных зондов, дренирования брюшной полости и раннее энтеральное питание.
Цель исследования – оценка безопасности и преимуществ раннего энтерального питания пациентов, перенесших оперативное лечение в объеме гастрэктомии.
Материал и методы
Статистический анализ данных выполнялся с помощью электронных таблиц Microsoft Excel и программы Statistica (версия 7.0). Данные представлены в виде M ± SD, где M – среднее значение, SD – среднеквадратичное отклонение. Проверка показателей на нормальность закона распределения проводилась с использованием критерия Шапиро–Уилка и с учетом правила распределения Гаусса. Для сравнения полученных количественных показателей в группах, при условии нормального закона распределения, использовали параметрический критерий Стьюдента. Во всех остальных случаях – непараметрический
U-критерий Манна–Уитни. Результаты считали статистически значимыми при р<0,05.
Результаты
Проведено ретроспективное исследование на базе Клиники высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета. Все пациенты были разделены на 2 группы (табл. 1):
– исследуемую группу составили 37 пациентов, у которых в послеоперационном периоде использовались протоколы FTS, в т. ч. с применением раннего перорального питания, из них мужчин – 24 (64,9 %), женщин – 13 (35,1 %); средний возраст – 50 ± 7,7 года (27–63); распределение РЖ по стадиям: I стадия – 2 (5,4 %), II стадия – 20 (54,1 %), III стадия – 15 (40,5 %) пациентов;
– контрольную группу составили 45 пациентов после гастрэктомии, у которых применялись стандартные методы послеоперационного ведения, из них мужчин – 27 (60,0 %), женщин – 18 (40,0 %); средний возраст – 52 ± 8,3 года (26–65); распределение РЖ по стадиям: I стадия – 3 (6,7 %), II стадия – 24 (53,3 %), III стадия – 18 (40,0 %) пациентов.
Пациентам контрольной группы было рекомендовано воздержание от употребления жидкости и пищи в течение суток после операции, в то время как первое употребление жидкости пациентами исследуемой группы производилось через 2–4 ч после операции, а через 24 ч они начинали употреблять питательные смеси (пептисорб Nutrison® / Nutridrink® 250 мл + 250 мл воды). Вместе с питательными смесями пациенты принимали капсулы Креон® (75 000 ЕД) и Эспумизан ® (по 9 таблеток в сут). Назначение Креона® было обусловлено тем, что данные ферменты облегчают переваривание углеводов, жиров и белков, что способствует их более полному всасыванию в тонкой кишке. Эспумизан®, в свою очередь, снижал симптомы вздутия, которые проявлялись после употребления питательной смеси. Кроме этого, пациентам исследуемой группы было рекомендовано жевание жевательной резинки без сахара 3 раза в сутки для стимуляции работы желудочно-кишечного тракта. Пациенты контрольной группы данные препараты не получали. Вместо этого им в качестве парентерального питания назначали питательную эмульсию Кабивен®. Данный препарат был ассоциирован с высокой частотой жалоб на боли в животе, головные боли, учащение дыхания, повышение температуры тела. В 5 (11,1 %) случаях наблюдались нарушения водно-электролитного баланса и повышение активности ферментов печени на фоне его введения. Вышеперечисленные симптомы отсутствовали у пациентов исследуемой группы.
При сравнении групп отмечалась статистически значимая тенденция к уменьшению времени до
Таблица 1/table 1
|
Характеристика/ Сharacteristics |
Исследуемая группа/ Study group (n=37) |
Контрольная группа/ Control group (n=45) |
|
Мужской пол/Male |
24 (64,9 %) |
27 (60,0 %) |
|
Женский пол/Female |
13 (35,1 %) |
18 (40,0 %) |
|
Средний возраст, лет/Average age, years |
50 ± 7,7 |
52 ± 8,3 |
|
Cтадия опухолевого процесса (TNM 7-th ed., 2019)/ Stage (TNM 7-th ed., 2019) |
||
|
I стадия /Stage I |
2 (5,4 %) |
3 (6,7 %) |
|
II стадия /Stage II |
20 (54,1 %) |
24 (53,3 %) |
|
III стадия /Stage III |
15 (40,5 %) |
18 (40,0 %) |
Таблица 2/table 2
Сравнение тактики ведения и результатов лечения у пациентов двух групп comparison of patient-management strategies and treatment outcomes between the groups
|
Показатели/Parameters |
Исследуемая группа/ Study group |
Контрольная группа/ Control group |
p |
|
Длительность пареза кишечника, сут/ First exhaust time, days |
2,8 ± 1,0 |
3,9 ± 1,2 |
p=0,001 |
|
Послеоперационное пребывание в стационаре, сут/ Postoperative hospital stay, days |
5,4 ± 1,5 |
9,5 ± 2,3 |
p=0,001 |
|
Повторная госпитализация в течение 30 дней после выписки/ Re-hospitalization within 30 days after discharge |
2 (5,4 %) |
4 ( 8,8 %) |
p=0,05 |
Таблица 3/table 3
|
Показатель/Parameter |
Исследуемая группа/ Study group |
Контрольная группа/ Control group |
p |
|
Прокальцитонин, нг/мл/Procalcitonin ng/ml |
|||
|
До операции/Before operation |
0,04 ± 0,013 |
0,03 ± 0,01 |
p=0,05 |
|
1-й день после операции/The 1-st postoperative day |
0,46 ± 0,05 |
0,55 ± 0,1 |
p=0,05 |
|
3-й день после операции/The 3-d postoperative day |
0,08 ± 0,02 |
0,22 ± 0,011 |
p<0,05 |
|
5-й день после операции/The 5-th postoperative day |
0,05 ± 0,016 |
0,09 ± 0,02 |
p<0,05 |
|
СРБ,мг/л/CRP, mg/l |
|||
|
До операции/Before operation |
3,80 ± 0,10 |
2,6 ± 0,88 |
p>0,05 |
|
1-й день после операции/The 1-st postoperative day |
41,11 ± 10,51 |
69,4 ± 11,82 |
p=0,05 |
|
3-й день после операции/The 3-d postoperative day |
60,05 ± 12,32 |
59,3 ± 9,22 |
p<0,05 |
|
5-й день после операции/The 5-th postoperative day |
35,63 ± 11,23 |
22,6 ± 10,1 |
p=0,05 |
|
Амилаза плазмы, Ел/л/Serum amylase, U/l |
|||
|
До операции/Before operation |
48 ± 15 |
49 ± 11 |
p>0,05 |
|
1-й день после операции/The 1-st postoperative day |
105 ± 21 |
116 ± 3 |
p=0,05 |
|
3-й день после операции/The 3-d postoperative day |
96 ± 9 |
107 ± 6 |
p=0,001 |
|
5-й день после операции/The 5-th postoperative day |
65 ± 11 |
89 ± 10 |
p=0,05 |
|
Амилаза дренажной жидкости, Ед/л/Drain fluid amylase, U/l |
|||
|
1-й день после операции/The 1-st postoperative day |
102 ± 10 |
109 ± 90 |
p=0,05 |
|
3-й день после операции/The 3-d postoperative day |
98 ± 13 |
105 ± 70 |
p=0,05 |
|
5-й день после операции/The 5-th postoperative day |
55 ± 6 |
80 ± 35 |
p=0,001 |
Характеристика исследуемой и контрольной групп characteristics of the study and control groups
Лабораторные показатели пациентов двух групп laboratory parameters of patients of two groups
момента отхождения первых газов в исследуемой группе 2,8 ± 1,0 сут vs 3,9 ± 1,2 сут (p=0,001). С момента восстановления активной перистальтики кишечника пациентам исследуемой группы вводилась жидкая диета (например, овсяный отвар, бульон, компот и т. д.). Как правило, на следующие сутки разрешалась жидкая диета (каши, вермишель, картофельное пюре и т. д.). В свою очередь, пациенты контрольной группы приступали к пероральному питанию, в среднем на 4–5-е сут послеоперационного периода.
При анализе частоты послеоперационных осложнений выявлено, что несостоятельность анастомоза возникла у 2 (5,4 %) пациентов исследуемой и у 3 (6,6 %) пациентов контрольной группы (p<0,05) (рис. 1). В исследуемой группе наблюдались следующие послеоперационные осложнения со стороны легких: пневмония – у 3 (8,1 %), ОРДС – у 1 (2,7 %) пациента. В контрольной группе легочные осложнения отмечены у 9 (19,8 %) больных (p=0,05), в т. ч. пневмония – у 5 (11 %), ОРДС – у 3 (6,6 %), ТЭЛА – у 1 (2,2 %) больного. Панкреатическая фистула возникла у 3 (8,1 %) и у 2 (4,4 %) пациентов в исследуемой и контрольной группах соответственно (p=0,05), раневые инфекционные осложнения – у 4 (10,8 %) и у 6 (13,2 %) пациентов соответственно (p=0,05).
Следует отметить снижение продолжительности послеоперационных койко-дней в исследуемой группе по сравнению с контрольной – 5,4 ± 1,5 vs 9,5 ± 2,3 (p=0,001). Также зафиксирована разница в частоте повторных госпитализаций пациентов в течение 30 дней после выписки (табл. 2), в исследуемой группе 2 (5,4 %) пациента были вновь госпитализированы для устранения возникших осложнений, в контрольной группе таких пациентов оказалось 4 (8,8 %) (p=0,05).
В послеоперационном периоде проводились контроль и оценка лабораторных показателей у всех пациентов сравниваемых групп: прокальцитонин, СРБ крови, значения амилазы плазмы крови и амилазы дренажной жидкости на 1, 3 и 5-й день после вмешательства (табл. 3). Лабораторные показатели пациентов в исследуемой группе отражали более благоприятную динамику восстановления функций организма по сравнению с пациентами из группы контроля.
Обсуждение
Современный подход к периоперационному ведению больных все чаще включает в себя концепцию FAST-TRACK. Основной причиной, по которой данная программа пока не применяется повсеместно, особенно после операций на верхних отделах ЖКТ, является не до конца изученный вопрос безопасности раннего энтерального питания в послеоперационном периоде. Однако влияние нутритивного статуса пациента на процессы восстановления, заживления послеоперационных ран и продолжительности пребывания в стационаре, бесспорно, велико. Результаты нашего ретроспективного исследования показывают, что раннее назначение энтерального питания пациентам после гастрэктомии не ухудшает результаты лечения и может быть активно внедрено в клиническую практику. Полученные нами результаты в целом не противоречат данным зарубежных коллег.
Одним из важных оцениваемых параметров была частота несостоятельности эзофагоэнтероа-настомоза, которая возникла у 2 (5,4 %) пациентов исследуемой и у 3 (6,6 %) пациентов контрольной группы (p<0,05). A. Jang et al. в ретроспективном исследовании показали значимую разницу между группой раннего перорального питания и группой обычного питания – 1,5 % vs 4,9 % (p=0,048) [14]. В проспективном когортном исследовании J.S. Ford et al., при аналогичном нашему подходу ведении больных, выявили несостоятельность анастомоза у 3 (4 %) пациентов исследуемой и у 2 (5 %) пациентов контрольной группы (p=0,05) [15].
Нами установлено наличие взаимосвязи между сроками начала перорального питания и восстановлением функций желудочно-кишечного тракта. Так, в исследуемой группе значительно снизилось время до отхождения первых газов – 2,8 ± 1,0 vs 3,9 ± 1,2 сут (p=0,001). Аналогичные данные получены в крупных зарубежных исследованиях. В частности, Y.X. Lu et al. в проспективном ко-
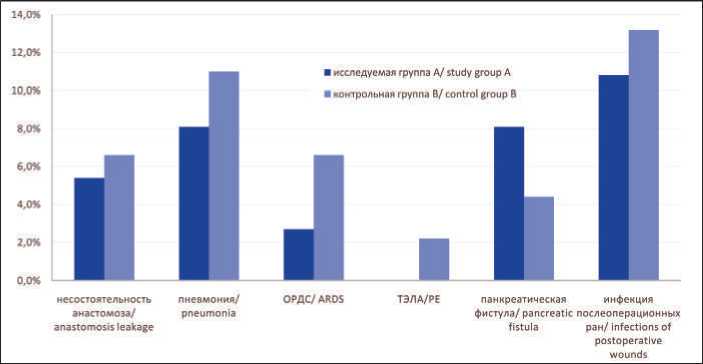
Рис. 1. Частота послеоперационных осложнений в группах
Fig. 1. Frequency of postoperative complications in groups
гортном исследовании отметили более короткое время восстановления перистальтики кишечника в группе раннего перорального питания – 2,48 ± 1,17 vs 3,37 ± 1,42 сут (p=0,001) [16].
В связи с частым наличием у онкологических больных опухолевой интоксикации, истощения, анемии, а также учитывая предшествующую химиотерапию, крайне важно было оценить влияние диеты на возникновение инфекционных осложнений после оперативного вмешательства. Нами отмечена некоторая разница в частоте раневой инфекции – 10,8 vs 13,2 % (p=0,05) в исследуемой и контрольной группах соответственно. Однако стоит обратить внимание на неоднородность распределения пациентов по методу хирургического вмешательства (открытый метод или лапароскопия), что может несколько искажать результаты.
В послеоперационном периоде наблюдался ряд осложнений со стороны дыхательной системы, с процентным преобладанием в контрольной группе: пневмония 11 vs 8,1 % (p<0,05), ОРДС – 6,6 vs 2,7 % (p=0,05). В контрольной группе 32 пациентам была проведена назогастральная интубация. В исследуемой группе назогастральный зонд пациентам вводился лишь с целью декомпрессии воздуха, попавшего в желудок во время вентиляции легких при вводном наркозе. Зонд удалялся после операции в обеих группах пациентов. Вероятно, в связи с этим частота легочных осложнений у пациентов контрольной группы была выше.
С учетом объема операции нами также были проведены контроль и оценка лабораторных показателей в послеоперационном периоде. Отмечены отсутствие явного прироста маркеров воспаления, а также тенденция к более динамичному восстановлению показателей в группе пациентов с ранним пероральным питанием. Подобные резуль- таты в своих исследованиях получили зарубежные коллеги [17, 18].
Список литературы Безопасность и преимущества раннего перорального питания в рамках программы Fast-Track среди пациентов, перенесших гастрэктомию по поводу рака желудка
- Machlowska J., Baj J., SitarzM., Maciejewski R., SitarzR. Gastric Cancer: Epidemiology, Risk Factors, Classification, Genomic Characteristics and Treatment Strategies. Int J Mol Sci. 2020; 21(11): 4012. doi: 10.3390/ijms21114012.
- SungH., Ferlay J., SiegelR.L., LaversanneM., Soerjomataram I., JemalA., BrayF. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. doi: 10.3322/caac.21660.
- Kim Y.W., Baik Y.H., Yun Y.H., Nam B.H., Kim D.H., Choi I.J., Bae J.M. Improved quality of life outcomes after laparoscopy-assisted distal gastrectomy for early gastric cancer: results of a prospective randomized clinical trial. Ann Surg. 2008; 248(5): 721-7. doi: 10.1097/ SLA.0b013e318185e62e.
- ParkJ.M., JinS.H., LeeS.R., KimH, JungI.H., Cho Y.K., HanS.U. Complications with laparoscopically assisted gastrectomy: multivariate analysis of 300 consecutive cases. Surg Endosc. 2008; 22(10): 2133-9. doi: 10.1007/s00464-008-9962-4.
- Kanda M., Mizuno A., Tanaka C., Kobayashi D., Fujiwara M., Iwata N., Hayashi M., Yamada S., Nakayama G., Fujii T., Sugimoto H., Koike M., Takami H., Niwa Y., Murotani K., Kodera Y. Nutritional predictors for postoperative short-term and long-term outcomes of patients with gastric cancer. Medicine (Baltimore). 2016; 95(24): 3781. doi: 10.1097/ MD.0000000000003781.
- Пасечник И.Н., Губайдуллин Р.Р., Борисов А.Ю. Основы нутритивной поддержки больных в критических состояниях. М., 2012. 160 с. [Pasechnik I.N., Gubaidullin R.R., Borisov A.Yu. Fundamentals of nutritional support for patients in critical conditions. Moscow, 2012. 160 p. (in Russian)].
- Hur H., Kim S.G., Shim J.H., Song K.Y., Kim W, Park C.H., Jeon H.M. Effect of early oral feeding after gastric cancer surgery: a result of randomized clinical trial. Surgery. 2011; 149(4): 561-8. doi: 10.1016/j. surg.2010.10.003.
- Laffitte A.M., Polakowski C.B., Kato M. Early oral re-feeding on oncology patients submitted to gastrectomy for gastric cancer. Arq Bras Cir Dig. 2015; 28(3): 200-3. doi: 10.1590/S0102-67202015000300014.
- SierzegaM., ChoruzR., Pietruszka S., KuligP., KolodziejczykP., Kulig J. Feasibility and outcomes of early oral feeding after total gastrectomy for cancer. J Gastrointest Surg. 2015; 19(3): 473-9. doi: 10.1007/ s11605-014-2720-0.
- Arends J., Bachmann P., Baracos V., Barthelemy N., Bertz H., Bozzetti F., Fearon K., Hutterer E., Isenring E., Kaasa S., Krznaric Z., LairdB., LarssonM., LavianoA.,MühlebachS., MuscaritoliM., OldervollL., Ravasco P., Solheim T., Strasser F., de van der Schueren M., Preiser J.C. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017; 36(1): 11-48. doi: 10.1016/j.clnu.2016.07.015.
- LassenK., SoopM., Nygren J., CoxP.B., Hendry P.O., Spies C., von MeyenfeldtM.F., Fearon K.C., Revhaug A., Norderval S., Ljungqvist O., Lobo D.N., Dejong C.H.; Enhanced Recovery After Surgery (ERAS) Group. Consensus review of optimal perioperative care in colorectal surgery: Enhanced Recovery After Surgery (ERAS) Group recommendations. Arch Surg. 2009; 144(10): 961-9. doi: 10.1001/archsurg.2009.170.
- LassenK., CoolsenM.M., SlimK., CarliF., deAguilar-Nascimen-to J.E., SchäferM., ParksR.W., FearonK.C., LoboD.N., DemartinesN., Braga M., Ljungqvist O., Dejong C.H.; ERAS® Society; European Society for Clinical Nutrition and Metabolism; International Association for Surgical Metabolism and Nutrition. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr. 2012; 31(6): 817-30. doi: 10.1016/j. clnu.2012.08.011.
- Mortensen K., Nilsson M., Slim K., Schäfer M., Mariette C., Braga M., Carli F., Demartines N., Griffin S.M., Lassen K.; Enhanced Recovery After Surgery (ERAS®) Group. Consensus guidelines for enhanced recovery after gastrectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Br J Surg. 2014; 101(10): 1209-29. doi: 10.1002/bjs.9582.
- Jang A., Jeong O. Early Postoperative Oral Feeding After Total Gastrectomy in Gastric Carcinoma Patients: A Retrospective Before-After Study Using Propensity Score Matching. J Parenter Enteral Nutr. 2019; 43(5): 649-57. doi: 10.1002/jpen.1438.
- Ford S.J., Adams D., Dudnikov S., Peyser P., Rahamim J., Wheatley T.J., BerrisfordR.G., Sanders G. The implementation and effectiveness of an enhanced recovery programme after oesophago-gastrectomy: a prospective cohort study. Int J Surg. 2014; 12(4): 320-4. doi: 10.1016/j. ijsu.2014.01.015.
- Lu Y.X., Wang Y.J., Xie T.Y., Li S, Wu D, Li X.G., Song Q.Y., Wang L.P., Guan D., Wang X.X. Effects of early oral feeding after radical total gastrectomy in gastric cancer patients. World J Gastroenterol. 2020; 26(36): 5508-19. doi: 10.3748/wjg.v26.i36.5508.
- Chen Z.X., Liu A.H., Cen Y. Fast-track program vs traditional care in surgery for gastric cancer. World J Gastroenterol. 2014; 20(2): 578-83. doi: 10.3748/wjg.v20.i2.578.
- Liu G., Jian F., Wang X., Chen L. Fast-track surgery protocol in elderly patients undergoing laparoscopic radical gastrectomy for gastric cancer: a randomized controlled trial. Onco Targets Ther. 2016; 9: 3345-51. doi: 10.2147/0TT.S107443.


