Безотходная технология переработки вторичных ресурсов рыбной промышленности для получения пищевых добавок с кальцийобогащающими и хондропротекторными cвойствами
Автор: Кириллов Александр Игоревич, Линчевская Анастасия Александровна, Куприна Елена Эдуардовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
В данной статье рассматривается комплексная безотходная технология переработки вторичных ресурсов рыбной промышленности, возможность повышения экологичности рыбоперерабатывающих производств за счет использования технологии переработки хрящекостных отходов.
Электрохимический способ, переработка отходов рыбы на судах, минеральный преципитат, продукты гидролиза коллагена
Короткий адрес: https://sciup.org/148202057
IDR: 148202057 | УДК: 639.2639.2.068
Текст научной статьи Безотходная технология переработки вторичных ресурсов рыбной промышленности для получения пищевых добавок с кальцийобогащающими и хондропротекторными cвойствами
Исходя из современного анализа литературы, известно, что изучение протеома клеточных ядер растений до сих пор остается на начальном этапе [1]. Однако первые публикации наших сотрудников по динамике протеома клеточных ядер растений относятся к 1975 г. [2]. Представленная работа является развитием идей по дальнейшему исследованию молекулярно-генетических механизмов динамики протеома клеточного ядра.
Доказано, что хромосомы располагаются не беспорядочно внутри ядра, а формируют строго упорядоченные структуры [3]. Обращает внимание то, что из нуклеосомного кора выпячиваются неструктурированные аминотерминальные хвосты, несущие гуанидиновую группу аргининобогащен-ных (Н3, Н4) и умеренно-лизинобогащенных (Н2А; Н2В) гистонов, входящих в состав нуклеосомы. Эти хвосты подвергаются активной модификации и межнуклеосомным взаимодействиям [3]. Однако ни биохимические, ни биофизические механизмы, функционирующие в этой области протеома клеточного ядра, недостаточно изучены. Известно, что аргининбогатые гистоны по аминокислотной последовательности эволюционно стабильные белки [4], что свидетельствует об их важной роли в сохранении и реализации генетической информации у эукариот, биохимические механизмы которой в структуризации хроматина ещё предстоит расшифровать.
Целью данной работы был анализ активности Арг-Х протеолиза в различных компартментах клеточного ядра при индукции ростового морфогенеза зародышей пшеницы.
Объектом исследования были элитные семена
пшеницы ( Triticum aestivum L.) сортов Артемовка (яровая), выведенный из нее сорт Мироновская 808 (озимая) и вновь выведенный из последнего сорт Мироновская яровая (коллекция семян Всероссийского института растениеводства им. Н.И. Вавилова). Подробное описание метода выведения сортов представлено в работах [5, 6]. В определенные интервалы времени, а именно: 0 ч (воздушно-сухое семя, находящееся в состоянии биологического покоя) и через 21 ч от начала замачивания, у проращиваемых семян отделяли от эндосперма зародыши, из которых выделяли клеточные ядра [7]. Надмолекулярные структуры: нуклеоплазму (Нп), хроматин непрочно (Хр-I) и прочно (Хр-II) связанный с ядерным матриксом (ЯМ), и собственно ЯМ выделяли из клеточных ядер при повышении ионной силы раствора способом, подробно описанным в работе [8]. Из выделенных супраструктур клеточных ядер негистоновые белки (НГБ) отделяли от гистонов способом, представленным в работе [9]. Через колонку с полиметакриловой синтетической смолой ИРЦ-50 (Amberlite, IRC-50, Serva, Heidelberg) пропускали гетерополимерные блоки исследуемых супраструктур (Нп, Хр-I, Хр-II, ЯМ). Смолу для ионообменной хроматографии готовили по методике [10]. Белки элюировали в ступенчатом градиенте (6,0; 8,9; 10,6; 13; 40%) гуанидингидрохлорида (Диаэм). В представленной работе данные по 13% фракции не приведены. Протеазочувстви-тельность Арг-Х в негистоновых и гистоновых блоках оценивали по расщеплению Арг-Х связей в ар-гининобогащенном белке – протамине Salmine - A-1 («Merk»), молекула которого состоит из 33 аминокислот (22 молекулы Арг, 4 – Сер, 3 – Про, по 2 – Глу и Вал) во всех фракциях ядер [8]. Активность протеолиза выражали в наномолях аргинина за 1 с на 1 мкг белка (нмоль/(с мкг белка).
Поскольку клетка и ее органоиды – это сложнейшая организация атомных, молекулярных, надмолекулярных систем, то любое изменение внеш- них факторов окружающей среды затрагивает пространственно-временные биохимические уровни организации живых систем. В данном случае нас интересовала взаимозависимость внутриядерных систем (нуклеоплазмы, Хр-I непрочно- и Хр-II прочносвязанных с ЯМ, а также самого ЯМ), построенных на основе сильных (т. е. ковалентных) и слабых связей.
Динамика содержания ДНК, РНК, белка и возможной степени его гексозилирования на уровне целых клеточных ядер представлена на рис. 1.
Отмечается высокий уровень синтеза ДНК в период активного роста зародыша за счет растяжения клеток (рис. 1а, 24 ч). Дальнейшее фракционирование клеточных ядер позволило получить супрамо-лекулярные структуры (нуклеоплазму, хроматин непрочно- и прочносвязанный с ядерным матриксом, а также ядерный матрикс), компонентный состав которых представлен на рис. 1б. Из рисунка видно, что в нуклеоплазме воздушно-сухих зародышей (0 ч) отмечается наличие свободного нук-леозольного пула белков, а также запасенной РНК, по-видимому, необходимой для начальных этапов трансляции, утилизирующихся при последующем росте (рис. 1 б, 0 ч ^ 24 ч). Подобные данные были получены на другом растительном объекте [11, 12]. Во фракции хроматина I (рис. 1б, Хр I) обнаруживается депротеинизированная ДНК (24 ч). Возможно, это активно транскрибируемая ДНК, количество которой, в период роста (0 ч^24 ч) увеличивается, в то время как динамика содержания ДНК во фракции белков, прочносвязанных с хроматином (рис. 1б. Хр II) прямо противоположна (рис. 1б, Хр II, 0 ч ^ 24 ч). Содержание ДНК, РНК во фракции ядерного матрикса (0 ч ^24 ч) также понижается, как и возможная степень гексозилирования белков (рис. 1б, ЯМ).
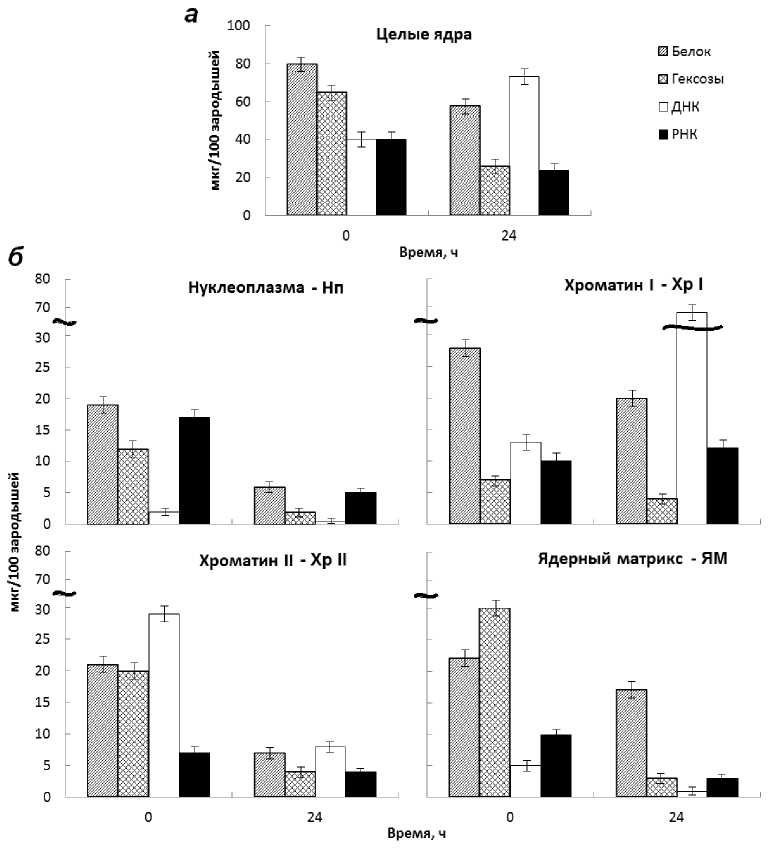
Рис. 1. Динамика содержания ДНК, РНК, белка и возможной степени его гексозилирования в целом ядре и его надмолекулярных структурах (Нп - нуклеоплазма; Хр I - хроматин непрочно связанный с ЯМ; Хр II - хроматин прочно связанный с ЯМ; ЯМ - ядерный матрикс) при индукции ростовых процессов зрелых зародышей пшеницы [13]
На следующем этапе работы из описанных выше супрамолекулярных структур (рис. 1б) были выделены негистоновые и гистоновые белки, динамика содержания которых представлена на рис. 2. Показано, что исходный сорт Артемовка в период вступления в S фазу клеточного цикла содержит высокий уровень негистоновых (НГБ) и гистоновых (НI, Н2А+Н2В) белков в супраструктуре Хр II, который заметно снижен у Мироновской озимой, что, по-видимому, связано с холодовым стрессом. Примечательно, что низкий уровень содержания НГБ и гистоновых белков сохраняется у Мироновской яровой.
Мы специально сфокусировали свое внимание на Арг-Х протеазочувствительных зонах НГБ и гистонах тотального хроматина, исходя из роли арги- нина, участвующего в эволюционной стабильности аргининбогатых гистонов, а также активности его гуанидиновой группы, способной дать резонирующий эффект биополимерной структуре. На рис. 3 представлена динамика Арг-Х протеолиза в негистоновых и гистоновых блоках супраструктур (нуклеоплазмы, хроматина, ядерного матрикса). Анализ рисунка показывает довольно низкую Арг-Х протеолитическую активность у исходного сорта Арте-мовки как во фракциях НГБ, так и гистоновых белках. Совершенно другая динамика Арг-Х протеазо-активности наблюдается у Мироновской озимой. Увеличение Арг-Х протеазоактивности обнаруживается в НГБ блоках всех супраструктур (рис. 3, Мироновская озимая, 0-21 ч).
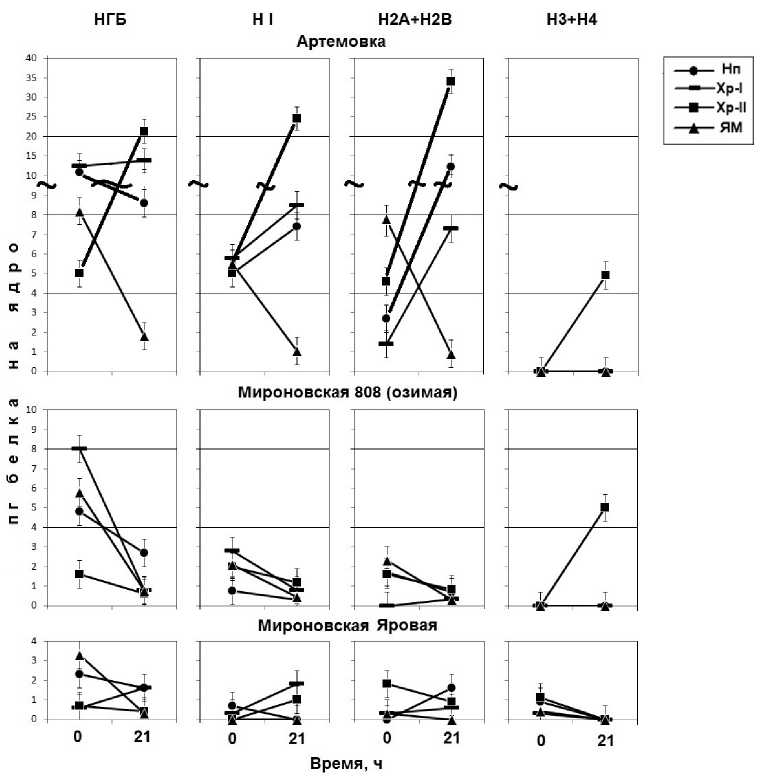
Рис. 2. Содержание негистоновых (НГБ) и гистоновых (HI, H2A+H2B, H3+H4) белков в супраструкутрах (Нп – нуклеоплазма; Хр I – хроматин непрочно связанный с ЯМ; Хр II – хроматин прочно связанный с ЯМ; ЯМ – ядерный матрикс) клеточных ядер при индукции ростовых процессов зрелых зародышей пшениц: Артемовки (яровая), Мироновской 808 (озимой) и Мироновской яровой
В гистоновых блоках высокая активность обнаруживается во фракции линкерного гистона НI хроматина непрочносвязанного с ЯМ, а также во фракции гистонов Н2А+Н2В хроматина непрочно и прочносвязанного с ЯМ и в самом ЯМ (рис.3, Мироновская озимая, 21 ч). Что касается сорта Ми- роновской яровой, на уровне негистоновых блоков супраструктур клеточных ядер существенных различий с озимым сортом выявлено не было, в то время как на уровне линкерных и коровых гистонов (НI, Н2А+Н2В), динамика Арг-Х протеолиза Мироновской яровой существенно отличалась от озимой пшеницы (рис.3, Мироновская яровая, 0 ч→21 ч). В данном случае мы предполагаем, что Арг-Х протеолиз каким-то образом связан со сборкой нуклеосом и, возможно, нуклеосомным контролем генной экспрессии [14]. Таким образом, в данной работе мы попытались показать участки в гетерополимерных структурах хроматиновой матрицы, где наиболее активно происходят динамические изменения ядерного протеома и выявляются гиперчувствительные сайты к Арг-Х протеолизу на уровне НГБ, линкерных и коровых гистонов.
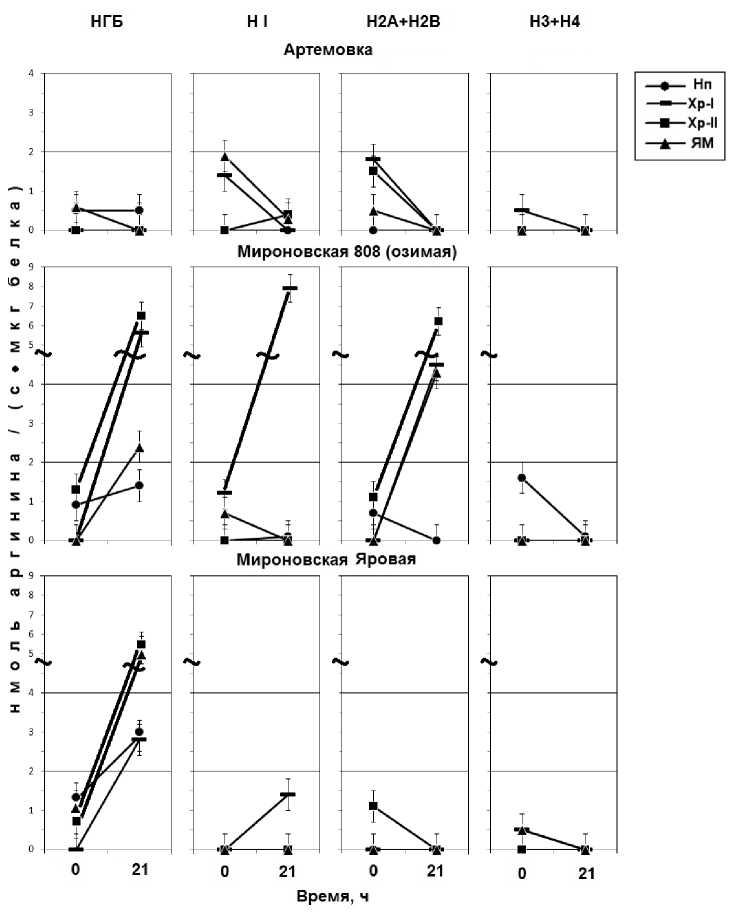
Рис. 3. Активность Арг-Х протеолиза в негистоновых (НГБ) и гистоновых (HI; H2A + H2B; H3 + H4) блоках супраструкутр (Нп - нуклеоплазма; Хр I - хроматин непрочно связанный с ЯМ; Хр II - хроматин прочно связанный с ЯМ; ЯМ - ядерный матрикс) клеточных ядер при индукции ростовых процессов зрелых зародышей пшениц: Артемовки (яровая), Мироновской 808 (озимой) и Мироновской яровой
-
1. Mistelli T., Spector D.L. The Nucleus. New York: Cold Spring Harbor Laboratory Press, 2011. 463 p.
-
2. Иванова Э.А., Гилязетдинов Ш.Я., Ахметов Р.Р . Модификация гистонов растений и влияние фитогормонов на активность этого процесса // Растительные белки и их биосинтез. М: Наука, 1975. С. 301-305.
-
3. Разин С.В., Быстрицкий А.А . Хроматин: упакованный геном. М.: БИНОМ. Лаборатория знаний, 2009. 176 с.
-
4. Smith E.L., De Lange R.J., Bonner J . Chemistry and biology of histones // Physiol. Revs. 1970. V. 50. N 2. P. 159-170.
-
5. Ремесло В.Н. Озимая пшеница Мироновская 264 и Мироновская 808. М.: Колос, 1964. 72 c.
-
6. Наука и человечество: Доступно и точно о главном в мировой науке: Международный ежегодник / Всесоюз. о-во «Знание», АН СССР. Отв. ред. Е.Б. Этингоф. М.: Знание, 1980. C. 105-117.
-
7. Иванова Э.А., Вафина Г.Х . Способ выделения растительных клеточных ядер / А.с. 1701747, МКИ С12 № 9/50. Опубл. 01.09.91. Бюл. № 48.
-
8. Иванова Э.А., Вафина Г.Х . Способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью / А.с. 1733471, МКИ С12 №9/50. Опубл. 15.01.92. Бюл. № 18.
-
9. Иванова Э.А., Вафина Г.Х. Способ препаративного выделения основных белков из супраструктур клеточных ядер растений / Пат. 2408602. Опубл. 10.01.2011. Бюл. № 1.
-
10. Иванова Э.А . Фракционирование растительных гистонов на колонках с амберлитом ИРЦ-50 // Мат. 3-й науч. конф. молодых ученых. Уфа, 1972. С. 54-55.
-
11. Ahmed I.С.М., Padayatty J.D . Presense & Function of free pool histones in the nucleosol of rice embryos // Indian J. Biochem. & Biophys. 1982. V. 19. P. 155-159.
-
12. Dure L.S. Stored messenger ribonucleic acid and seed germination // The physiology and biochemistry of seed dormancy and germination Amsterdam: North-Holland' Publ. Co, 1977. P. 335-345.
-
13. Иванова Э.А., Вафина Г.Х . Физиолого-биохимический анализ интерфазных ядер в процессе прорастания семян пшеницы // Физиология и биохимия культурных растений. 1992. Т. 24. № 6. С. 577-583.
-
14. Меркулова Т.И., Ананько Е.А., Игнатьева Е.В., Колчанов Н.А . Регуляторные коды транскрипции генов эукариот // Генетика. 2013. Т. 49. № 1. С. 37-54.
PROTEOMICS OF INTERPHASE NUCLEUS DURING INDUCTION OF GROWTH MORPHOGENESIS IN WHEAT
Institute of Biology, Ufa Sci. Centre of RAS, Ufa
The properties of the dynamics bioheteropolymer structures (nucleoplasm, chromatin, nuclear matrix) of interphase nuclei during induction growth morphogenesis of mature embryos of spring, transformed from it winter and again transformed from last spring wheat were studied. The changes in the localization of Arg-X zones of proteolytic activity in histones and nonhistones, which may be due to the changes in the density of the tension and changes in chromatin structure in the implementation of the morphogenetic program of plant development were shown.
Список литературы Безотходная технология переработки вторичных ресурсов рыбной промышленности для получения пищевых добавок с кальцийобогащающими и хондропротекторными cвойствами
- Единые нормы отходов, потерь, выхода готовой продукции и расхода сырья при производстве охлажденной, мороженой и кормовой продукции из гидробионтов морского промысла и прибрежного лова. М.: Изд-во ВНИРО, 2004. 165 с.
- Землякова Е.С., Мезенова О.Я. Биологически активные композиции остеотропного и хондропротекторного действия на основе вторичного сырья гидробионтов. Калининград: Изд-во ФГОУ ВПО «КГТУ», 2011. 169 с.
- Суховертова Г.Ю. Биохимическая характеристика хрящевой ткани гидробионтов и технология БАД к пище: дис. … канд. техн. наук. Владивосток, 2006. 157 с.
- Воробьев В.И. Использование рыбного коллагена и продуктов его гидролиза//Известия КГТУ. 2008. № 13. С. 55-58.
- Михайлов А.Н. Химия и физика коллагена кожного покрова. М., 1980. 232 с.
- Мазуров В.П. Биохимия коллагеновых белков. М., 1974. 248 с.
- Пат. № 2110926 РФ, МКИ6 А 23 J 1/04, 1/12, 1/14, 1/18. Способ растворения белка/Куприна Е.Э., Маслова Г.В. (РФ). Заявл.11.01.96; Опубл.20.05.98. Бюл. № 14.


