Бикомпонентные янус-наночастицы ZnO-Ag с высокой противоопухолевой активностью in vitro
Автор: Бакина О.В., Чжоу В.Р., Лернер М.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.21, 2022 года.
Бесплатный доступ
Введение. Наночастицы оксида цинка и серебра являются перспективными противоопухолевыми агентами, применение которых может усилить современные подходы к лечению рака. Применяя бикомпонентные наночастицы ZnO-Ag, можно увеличить эффективность благодаря возникновению синергетического противоопухолевого эффекта. Среди основных физико-химических параметров, влияющих на противоопухолевую активность наночастиц, можно выделить их размер и распределение компонентов внутри частицы или их микроструктуру, однако данные аспекты до сих пор являются мало изученными. Целью исследования является синтез наночастиц ZnO-Ag при помощи электровзрывной технологии и исследование in vitro противоопухолевой активности НЧ в отношении адено-карциномы протоков молочной железы MCF-7 (ATCC HTB-22) и клеточной линии HeLa. Материал и методы. Для получения наночастиц ZnO-Ag использовали совместный электрический взрыв скрутки проволок цинка и серебра в смешанной атмосфере аргона и кислорода. Физико-химические свойства исследованы при помощи рентгенофазового анализа, тепловой десорбции азота, просвечивающей электронной микроскопии. Противоопухолевую активность in vitro исследовали при помощи МТТ-теста в отношении клеточных линий HeLa и MCF-7. Результаты. В результате электрического взрыва скрутки цинковой и серебряной проволок в газовой смеси аргон + кислород получены НЧ ZnO-Ag с различным содержанием компонентов и структурой янус-наночастиц. Исследование физико-химических свойств наночастиц показало, что увеличение содержания серебра приводит к снижению среднего размера частиц, увеличению их удельной поверхности, увеличению их фотохимической активности и способности генерировать активные формы кислорода. Высокую противоопухолевую активность НЧ с минимальным содержанием серебра можно объяснить снижением размера фрагментов серебра с 46 до 23 нм и снижением среднего размера частиц с 92 до 54 нм. Снижение размера НЧ и их компонентов способствует увеличению их растворимости и, соответственно, цитотоксичности. Кроме того, снижение размера кристаллитов позволяет увеличить количество и протяженность границы раздела фаз ZnO-Ag. Заключение. Бикомпонентные НЧ ZnO-Ag были синтезированы при помощи совместного электрического взрыва цинковой и серебряной проволок в смешанной атмосфере аргона и кислорода. При исследовании физико-химических свойств наночастиц установлено, что они имеют структуру янус-наночастиц, средний размер от 54 до 92 нм, обладают фотохимической активностью и способностью генерировать АФК. При помощи МТТ-теста подтверждена противоопухолевая активность НЧ с использованием клеточных линий MCF-7 и HeLa. Высокая эффективность НЧ ZnO-Ag, содержащих 20 % серебра, указывает на возможность применения данных НЧ в противоопухолевой терапии.
Серебро, оксид цинка, опухолевые клетки, наночастицы
Короткий адрес: https://sciup.org/140296699
IDR: 140296699 | УДК: 616-006-092:546.57:57.085.23 | DOI: 10.21294/1814-4861-2022-21-6-99-105
Текст научной статьи Бикомпонентные янус-наночастицы ZnO-Ag с высокой противоопухолевой активностью in vitro
Синтез бикомпонентных наночастиц (НЧ) привлекает все большее внимание благодаря синергетическому эффекту компонентов, который не может быть достигнут НЧ по отдельности или при механическом смешивании [1]. В большом числе работ сообщалось о различных методах синтеза бикомпонентных наночастиц, включая методы химического восстановления из растворов [2], золь-гель синтез [3], метод лазерной абляции [4], электрический взрыв проводников [5].
В исследованиях in vitro и in vivo установлено, что НЧ серебра сами по себе обладают противоопухолевой активностью [6–8]. Добавление второго компонента приводило к повышению эффективности и снижению токсичности бикомпонентных НЧ, что было подтверждено на примере биметал- лических НЧ Ag-Au со структурой ядро-оболочка [9]. Исследования ряда авторов показали, что бикомпонентные НЧ Cu/Ag и Zn/Cu обладали эффективностью в отношении клеточной линии рака носоглотки (KB) [10] и клеток рака молочной железы (MDA-MB-231) [11].
Среди бикомпонентных НЧ большое внимание уделяется НЧ ZnO-Ag. Оксид цинка ZnO представляет собой полупроводник n -типа и характеризуется фотокаталитической и антимикробной активностью, низкой токсичностью, невысокой стоимостью [12]. Широкая запрещенная зона (3,37 эВ), высокая энергия экситонов (60 МэВ), наличие пьезоэлектрического эффекта и электрохимическая стабильность делают ZnO многообещающим реагентом-фотокатализатором для генерации активных форм кислорода АФК
Таблица 1/table 1
Обозначение wZn (%), расч. wAg (%), расч.
|
образца/ Sample designation |
dZn , мм |
dAg , мм |
l, мм |
масс. % |
ат.% |
масс. % |
ат.% |
U , кВ |
С, мкФ |
|
Zn80‒Ag20 |
0,38 |
0,15 |
90 |
81,4 |
87,9 |
18,6 |
12,1 |
23 |
3,2 |
|
Zn60‒Ag40 |
0,38 |
0,25 |
90 |
61,1 |
72,3 |
38,9 |
27,7 |
27 |
3,2 |
|
Zn50‒Ag50 |
0,25 |
0,38 |
80 |
43,1 |
55,7 |
56,9 |
44,3 |
33 |
3,2 |
Примечание: d – диаметр проволок; l – длина проволок; w – массовая (отношение массы металла к массе скрутки) и атомная (отношение атомной массы элемента к сумме атомных масс обоих металлов в скрутке) доля металла в скрутке проволок; U – напряжение; С – емкость конденсатора.
Описание и условное обозначение образцов наночастиц ZnO-ag
Description and symbol of ZnO-ag nanoparticle
Note: d – wire diameter; l – wire length; w – weight (the ratio of the mass of metal to the twist wire atomic mass) and atomic (the ratio of the metal mass to the twist wire mass) ratio in twist wire; U – voltage; С – capacitor capacitance.
[13, 14]. Импрегнация ZnO благородными металлами, в частности Ag, приводит к значительному улучшению его фотохимических характеристик и увеличению генерации АФК под действием видимого света [15]. Это обусловлено эффективным разделением заряда в присутствии атомов благородных металлов, в результате чего увеличивается количество активных центров. Серебро действует как сток электронов, фотоиндуцированных при облучении ZnO, а образовавшаяся дырка индуцирует образование гидроксильных радикалов [16]. Авторами [17] показано, что такая структура позволяет одновременно использовать фотокаталитические свойства ZnO и плазмонные свойства Ag и придать синергетический эффект НЧ при генерации АФК. Уже сообщалось о применении бикомпонентных НЧ ZnO-Ag в биомедицинских приложениях в качестве антибактериальных агентов, главный механизм действия которых основан на индуцировании АФК [18, 19].
Показана более высокая цитотоксическая активность (в 2–3 раза) НЧ Ag и ZnO в отношении модельной клеточной линии рака простаты PC3 по сравнению с нормальными клетками Vero [20]. Дозозависимая ингибирующая активность композита Ag-Zn в отношении клеток рака печени HepG2 показана в работе [21]. НЧ ZnO, легированные НЧ серебра, полученные при помощи золь-гель технологии, показали противоопухолевую активность в отношении клеточной линии кератиноцитов человека HaCaT [22]. Авторы исследования [23] связали противоопухолевую активность пары Ag-Zn с индукцией апоптоза за счет генерации АФК, приводящих к повреждению опухолевых клеток.
Однако аспекты, связанные с влиянием структуры НЧ ZnO-Ag и топологического распределения компонентов относительно друг друга, остаются неизученными, что ограничивает эффективность применения НЧ. В настоящей работе мы сообщаем о синтезе НЧ ZnO-Ag при помощи электровзрывной технологии и исследовании in vitro противоопухолевой активности НЧ в отношении аденокарциномы протоков молочной железы MCF-7 (ATCC HTB-22) и клеточной линии HeLa, выделенной из опухоли шейки матки.
Целью исследования является синтез наночастиц ZnO-Ag при помощи электровзрывной технологии и исследование in vitro противоопухолевой активности НЧ в отношении аденокарциномы протоков молочной железы MCF-7 (ATCC HTB-22) и клеточной линии HeLa.
Материал и методы
Для получения наночастиц (НЧ) ZnO/Ag использовали совместный электрический взрыв серебряной и цинковой проволок в атмосфере 80 % об. аргона и 20 % об. кислорода. Количественный состав наночастиц регулировали соотношением диаметра взрываемых проволок. В результате электрического взрыва скрутки цинковой и серебряной проволок в газовой смеси аргон + кислород были получены НЧ ZnO-Ag с различным содержанием компонентов (табл. 1).
Для оценки морфологии НЧ использовали просвечивающую электронную микроскопию (JEM-2100, Япония) со встроенной приставкой энергодисперсионного анализа X-Max. Распределение наночастиц и агломератов наночастиц по размерам определяли методом седиментации частиц в градиенте плотности на высокоскоростной дисковой центрифуге CPS 24000 (CPS Disk Instruments, США). Для исследования кристаллической структуры НЧ использовали метод рентгенофазового анализа (Shimadzu XRD 6000, Япония). Для оценки размера кристаллитов отдельных фаз использовали уравнение Уильямсона‒Холла. Текстуру НЧ исследовали методом тепловой десорбции азота (Сорб-тометр М, Россия). Для оценки фотохимической активности НЧ и их способности генерировать АФК использовали модельную реакцию разложения красителя метиленового голубого.
Противоопухолевую активность НЧ исследовали при помощи МТТ-теста в отношении клеточных линий MCF-7 (ATCC HTB-22) и HeLa, предостав-

Рис. 1. Микрофото. Электронномикроскопическое изображение НЧ ZnO-Ag при различном увеличении Fig. 1. Microphoto. Transmission electron microscopic image of ZnO-Ag NPs at various magnifications
ленных ФБУН ГНЦ ВБ «Вектор» (Россия). Для оценки влияния НЧ клетки в количестве 500 тыс. клеток/лунка инкубировали в 12-луночных культуральных планшетах в присутствии суспензий НЧ в концентрации 1–10 мкг/мл. %. Клетки предварительно культивировали при 37 °Ϲ в атмосфере 5 % CO2/95 % воздуха (СО2-инкубатор Sanyo, Япония) в среде DMEM (HiClone) с добавлением 5 % сыворотки эмбрионов коров и гентамицина. Через 24 ч инкубирования цитотоксичность НЧ оценивали при помощи МТТ-теста [24]. Измерение оптической плотности проводили при длине волны 540 нм с использованием планшетного спектрофотометра (Multiscan FC, Thermo Scientific, США).
Количественные данные представлены как средние и стандартные ошибки. Исследования проводили в трех параллельных экспериментах, для каждого образца проводили по пять измерений.
Результаты и обсуждение
Все НЧ имели преимущественно ограненную форму и состояли из электронно-контрастных фрагментов (рис. 1). Согласно данным энергодисперсионного анализа, электронно-плотные фрагменты были обогащены серебром, светлые участки гексагональной формы ‒ цинком. Такую структуру бикомпонентных НЧ можно отнести к янус-наночастицам [25]. Такие наночастицы обычно формируются при соединении двух металлов с различными поверхностными энергиями.
По данным рентгенофазового анализа независимо от содержания металлов в скрутке в НЧ дифракционные пики соответствовали только двум фазам – оксиду цинка (ZnO) со структурой вюрцита и серебру (Ag) с ГЦК-структурой. Структура вюр-цита для оксида цинка формируется в случае, если атом неметалла имеет сравнительно небольшой размер и большую электроотрицательность.
Исследование физико-химических характеристик НЧ показало, что увеличение содержания серебра в НЧ ZnO-Ag приводит к снижению среднего размера частиц ( a ) и увеличению удельной поверхности ( S ) порошков (табл. 2). Кроме того, наблюдалась корреляция размера областей когерентного рассеяния рентгеновского излучения ( DОКР ) фаз Ag и ZnO от содержания металлов в скрутках. Таким образом, при электрическом взрыве цинковой и серебряной проволок в кислородосодержащей атмосфере независимо от диаметра и длины проводников проволок формируются наночастицы со структурой янус-наночастиц.
Исследование фотохимической активности НЧ ZnO-Ag при разложении модельного красителя метиленового голубого (МГ) показало, что снижение содержания серебра в НЧ приводит к увеличению их фотохимической активности и способности генерировать АФК [5]. В течение 90 мин эксперимента концентрация МГ мало изменялась под действием видимого света (холостой опыт), поэтому фотоиндуцированным саморазложением красителя пренебрегали, а разложение красителя в присутствии наночастиц рассматривали как результат их фотохимического действия. Все синтезированные образцы обладали фотохимической
Таблица 2/table 2
Параметры микроструктуры бикомпонентных наночастиц ZnO-ag parameters of the microstructure of ZnO-ag bicomponent nanoparticles
|
Образец/ Sample |
a, нм |
S , м2/г |
DОКР (Ag), нм |
DОКР (ZnO), нм |
|
Zn80‒Ag20 |
92 ± 3 |
5,3 ± 0,7 |
23 |
54 |
|
Zn60‒Ag40 |
78 ± 4 |
6,5 ± 0,1 |
35 |
44 |
|
Zn50‒Ag50 |
54 ± 2 |
8,2 ± 0,4 |
46 |
35 |
Примечание: ± стандартное отклонение для n=3 при определении удельной поверхности (Sуд); n=5, для определения среднего размера частиц ( an ).
Note: ± standard deviation for n=3 when determining the specific surface area (SSA); n=5, to determine the average particle size ( an ).
Таблица 3/table 3
Фотохимическая активность бикомпонентных наночастиц ZnO-ag photochemical activity of ZnO-ag bicomponent nanoparticles
Противоопухолевую активность НЧ ZnO-Ag исследовали на клеточных линиях клеток рака шейки матки (HeLa) и рака молочной железы (MCF-7). Ранее уже было показано, что НЧ Ag и НЧ ZnO в концентрации 10 мкг/мл по отдельности не оказывали влияния на жизнеспособность клеточной линии HeLa [4]. Кроме того, авторами было отмечено, что НЧ ZnO в концентрации 10 мкг/мл ZnO даже усиливали пролиферацию клеток.
НЧ ZnO-Ag, полученные электрическим взрывом проволок, не проявляли цитотоксического эффекта в отношении обеих клеточных линий в концентрации до 2,5 мкг/мл. Дальнейшее увеличение концентрации до 5 мкг/мл приводило к снижению жизнеспособности клеточной линии MCF-7 до 72 % в присутствии НЧ Zn80-Ag20, линии HeLa – до 77 %, что указывало на их умеренную цитотоксичность (рис. 2). При увеличении концентрации НЧ Zn80-Ag20 до 10 % масс. оставались живыми только 26 и 35 % клеток MCF-7
и HeLa соответственно. В данной концентрации НЧ Zn60-Ag40 и Zn50-Ag60 также подавляли рост клеток, но в меньшей степени.
ЛД50 НЧ Zn80-Ag20 для клеток MCF-7 составила 7,36 мкг/мл и 8,17 мкг/мл для линии HeLa, что указывает на то, что линия MCF-7 более чувствительна к НЧ ZnO-Ag, чем клетки линии HeLa.
Оптимальное содержание Ag составило ≈20 %, дальнейшее его увеличение приводило к снижению фотокаталитической и противоопухолевой активности НЧ. Высокую противоопухолевую активность НЧ с минимальным содержанием серебра можно объяснить снижением размера фрагментов серебра с 46 до 23 нм и снижением среднего размера частиц с 92 до 54 нм. Снижение размера НЧ и их компонентов способствует увеличению их растворимости и, соответственно, цитотоксичности. Кроме того, снижение размера кристаллитов позволяет увеличить количество и протяженность границы раздела фаз ZnO-Ag.
В свою очередь, синергетический противоопухолевый эффект обусловлен двумя факторами: с одной стороны, в бикомпонентной НЧ увеличиваются растворимость серебра и выделение ионов Ag+, способных взаимодействовать с поверхностью клетки и изменять проницаемость мембраны. С другой стороны, наличие серебра на границе раздела фаз ZnO-Ag вносит существенный вклад в перенос фотогенерированных в ZnO носителей заряда. Действуя как сток электронов, серебро предотвращает рекомбинацию электронно-дырочных пар, увеличивает время жизни носителей заряда и приводит к образованию большего количества АФК, взаимодействие с которыми вызывает гибель
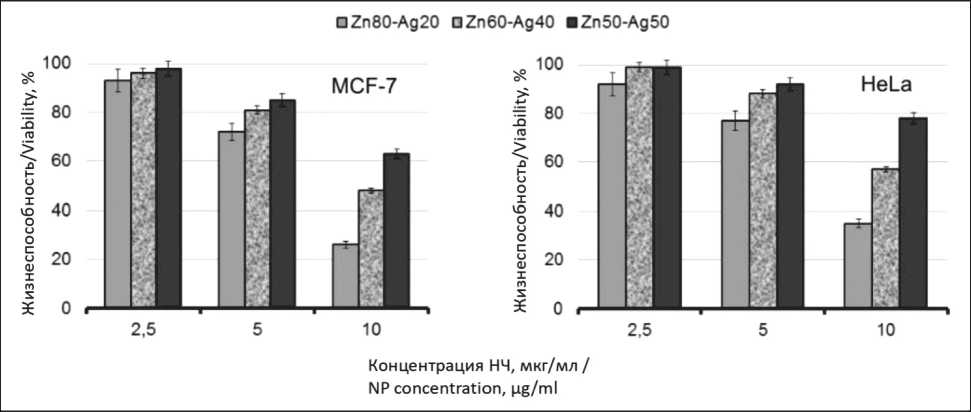
Рис. 2. Жизнеспособность клеточных линий MCF-7 и HeLa в присутствии НЧ ZnO-Ag, рассчитанная в % относительно контроля Fig. 2. MCF-7 and HeLa cell viability in the presence of ZnO-Ag NPs, calculated in % relative to control
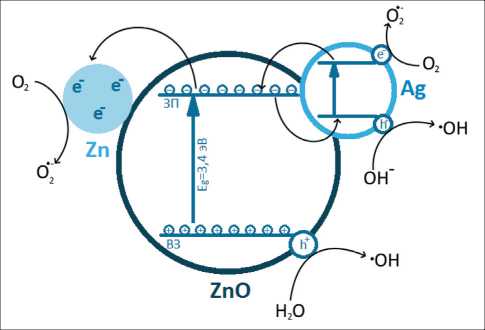
Рис. 3. Схема генерации АФК наночастицами ZnO-Ag Fig. 3. Scheme of ROS generation by ZnO-Ag nanoparticles клеток. Схематично процесс генерации АФК в системе ZnO/Ag изображен на рис. 3.
Оксид цинка при экспозиции в клеточной среде также способен выделять ионы Zn2+, которые могут взаимодействовать с клеткой и генерировать АФК [26]. Эти совокупные данные показывают, что комбинация ZnO-Ag в виде наночастиц эффективна против линий раковых клеток.
Заключение
В настоящей работе бикомпонентные НЧ ZnO-Ag были синтезированы при помощи совместного электрического взрыва цинковой и серебряной проволок в смешанной атмосфере аргона и кислорода. Проведено исследование физико-химических свойств наночастиц и установлено, что все они имеют структуру янус-наночастиц, средний размер от 54 до 92 нм и обладают фотохимической активностью и способностью генерировать АФК. При помощи МТТ-теста подтверждена противоопухолевая активность НЧ с использованием клеточных линий MCF-7 и HeLa. Высокая эффективность НЧ ZnO-Ag, содержащих 20 % серебра, указывает на возможность применения данных НЧ в противоопухолевой терапии.
Список литературы Бикомпонентные янус-наночастицы ZnO-Ag с высокой противоопухолевой активностью in vitro
- Sharma G., Kumar A., Sharma S., Naushad Mu., Dwivedi R.P., Alothman Z.A., Mola G.T. Novel development of nanoparticles to bimetallic nanoparticles and their composites: A review. Journal of King Saud University-Science. 2019; 31(2): 257-69. https://doi.org/10.1016/j.jksus.2017.06.012.
- Helgadottir I.S., Arquillière P.P., Bréa P., Santini C.C., Haumesser P.H., Richter K., Mudring A.V., Aouine M. Synthesis of bimetallic nanoparticles in ionic liquids: Chemical routes vs physical vapor deposition. Microelectronic engineering. 2013; 107: 229-32. https://doi.org/10.1016/j.mee.2012.09.015.
- Devarajan S., Bera P., Sampath S. Bimetallic nanoparticles: a single step synthesis, stabilization, and characterization of Au-Ag, Au-Pd, and Au-Pt in sol-gel derived silicates. J Colloid Interface Sci. 2005; 290(1): 117-29. https://doi.org/10.1016/j.jcis.2005.04.034.
- Elsayed K.A., Alomari M., Drmosh Q.A., Alheshibri M., Baroot A.A., Kayed T.S., Manda A.A., Al-Alotaibi A.L. Fabrication of ZnO-Ag bimetallic nanoparticles by laser ablation for anticancer activity. Alexandria Engineering Journal. 2022; 61(2): 1449-57. https://doi.org/10.1016/j.aej.2021.06.051.
- Bakina O.V., Glazkova E.A., Pervikov A.V., Rodkevich N.G., Vornakova E.A., Chzhou V.R., Lerner M.I. Electric explosion of wires as versatile method for antibacterial Janus-like ZnO-Ag nanoparticles preparation. Journal of Materials Science: Materials in Electronics. 2021; 32(8): 10623-34. https://doi.org/10.1007/s10854-021-05718-8.
- Chakraborty B., Pal R., Ali M., Singh L.M., Shahidur Rahman D., Kumar Ghosh S., Sengupta M. Immunomodulatory properties of silver nanoparticles contribute to anticancer strategy for murine fbrosarcoma. Cell Mol Immunol. 2016; 13(2): 191-205. https://doi.org/10.1038/cmi.2015.05.
- Loutfy S.A., Al-Ansary N.A., Abdel-Ghani N.T., Hamed A.R., Mohamed M.B., Craik J.D., Eldin T.A., Abdellah A.M., Hussein Y., Hasanin M.T., Elbehairi S.E. Anti-proliferative Activities of Metallic Nanoparticles in an in Vitro Breast Cancer Model. Asian Pac J Cancer Prev. 2015; 16(14): 6039-46. https://doi.org/10.7314/apjcp.2015.16.14.6039.
- Gomathi A.C., Rajarathinam S.R., Sadiq A.M., Rajeshkumar S. Anticancer activity of silver nanoparticles synthesized using aqueous fruit shell extract of Tamarindus indica on MCF-7 human breast cancer cell line. Journal of Drug Delivery Science and Technology. 2020; 55: 101376.
- Shmarakov I., Mukha I., Vityuk N., Borschovetska V., Zhyshchynska N., Grodzyuk G., Eremenko A. Antitumor activity of alloy and coreshell-type bimetallic AgAu nanoparticles. Nanoscale research letters. 2017; 12(1): 1-10. https://doi.org/10.1186/s11671-017-2112-y.
- Merugu R., Gothalwal R., Deshpande P.K., Mandal S.D., Padala G., Chitturi K.L. Synthesis of Ag/Cu and Cu/Zn bimetallic nanoparticles using toddy palm: Investigations of their antitumor, antioxidant and antibacterial activities. Materials Today: Proceedings. 2021; 44: 99-105. https://doi.org/10.1016/j.matpr.2020.08.027.
- Sharma D., Ledwani L., Kumar N., Mehrotra T., Pervaiz N., Kumar R. An Investigation of Physicochemical and Biological Properties of Rheum Emodi-Mediated Bimetallic Ag-Cu Nanoparticles. Arabian Journal for Science and Engineering. 2021; 46(1): 275-85.
- Ali A., Phull A.R., Zia M. Elemental zinc to zinc nanoparticles: is ZnO NPs crucial for life? Synthesis, toxicological, and environmental concerns. Nanotechnology Reviews. 2018; 7(5): 413‒41. https://doi.org/10.1515/ntrev-2018-0067.
- Karthikeyan C., Arunachalam P., Ramachandran K., Al-Mayouf A.M., Karuppuchamy S. Recent advances in semiconductor metal oxides with enhanced methods for solar photocatalytic applications. Journal of Alloys and Compounds. 2020; 828. https://doi.org/10.1016/j.jallcom.2020.154281.
- Kumar S., Pandit V., Bhattacharyya K., Krishnan V. Sunlight driven photocatalytic reduction of 4‒nitrophenol on Pt decorated ZnO‒ RGO nanoheterostructures. Materials Chemistry and Physics. 2018; 214: 364‒76. https://doi.org/10.1016/j.matchemphys.2018.04.113.
- Moniz S.J.A., Shevlin S.A., Martin D.J., Guo Z.X., Tang J. Visiblelight driven heterojunction photocatalysts for water splitting-a critical review. Energy & Environmental Science. 2015; 8(3): 731-59.
- Rokesh K., Mohan S.C., Karuppuchamy S., Jothivenkatachalam K. Photo‒assisted advanced oxidation processes for Rhodamine B degradation using ZnO-Ag nanocomposite materials. Journal of environmental chemical engineering. 2018; 6(3): 3610‒20. https://doi.org/10.1016/j.jece.2017.01.023.
- Seong S., Park I.S., Jung Y.C., Lee T., Kim S.Y., Park J.S., Ko J.H., Ahn J. Synthesis of Ag‒ZnO core‒shell nanoparticles with enhanced photocatalytic activity through atomic layer deposition. Materials & Design. 2019; 177. https://doi.org/10.1016/j.matdes.2019.107831.
- Zare M., Namratha K., Alghamdi S., Mohammad Y.H.E., Hezam A., Zare M., Drmosh Q.A., Byrappa K., Chandrashekar B.N., Ramakrishna S., Zhang X. Novel green biomimetic approach for synthesis of ZnO-Ag nanocomposite; antimicrobial activity against food-borne pathogen, biocompatibility and solar photocatalysis. Scientifc reports. 2019; 9(1): 1-15.
- Elango M., Deepa M., Subramanian R., Musthafa A.M. Synthesis, characterization of polyindole/AgZnO nanocomposites and its antibacterial activity. Journal of Alloys and Compounds. 2017; 696: 391-401. https://doi.org/10.1016/j.jallcom.2016.11.258.
- Priyadharshini R.I., Prasannaraj G., Geetha N., Venkatachalam P. Microwave-mediated extracellular synthesis of metallic silver and zinc oxide nanoparticles using macro-algae (Gracilaria edulis) extracts and its anticancer activity against human PC3 cell lines. Appl Biochem Biotechnol. 2014; 174(8): 2777-90. https://doi.org/10.1007/s12010-014-1225-3.
- Mousavi-Kouhi S.M., Beyk-Khormizi A., Amiri M.S., Mashreghi M., Taghavizadeh Yazdie M.E. Silver-zinc oxide nanocomposite: From synthesis to antimicrobial and anticancer properties. Ceramics International. 2021; 47(15): 21490-7. https://doi.org/10.1016/j.ceramint.2021.04.160.
- Rajendran R., Mani A. Photocatalytic, antibacterial and anticancer activity of silver-doped zinc oxide nanoparticles. Journal of Saudi Chemical Society. 2020; 24(12): 1010-24.
- Dong Y., Yang, Y, Wei Y., Gao Y., Jiang W., Wang G., Wang D. Facile synthetic nano-curcumin encapsulated Bio-fabricated nanoparticles induces ROS-mediated apoptosis and migration blocking of human lung cancer cells. Process Biochemistry. 2020; 95: 91-8.
- van Meerloo J., Kaspers G.J., Cloos J. Cell sensitivity assays: the MTT assay. Methods Mol Biol. 2011; 731: 237-45. https://doi.org/10.1007/978-1-61779-080-5_20.
- Kumar S. Structural evolution of iron-copper (Fe-Cu) bimetallic janus nanoparticles during solidifcation: An atomistic investigation. The Journal of Physical Chemistry. 2019; 124(1): 1053-63.
- Lozhkomoev A.S., Bakina O.V., Glazkova E.A., Svarovskaya N.V., Lerner M I. Patterns of the formation of antimicrobial micro/nanocomposites during the oxidation of bimetallic Al/Zn nanoparticles. Russian Journal of Physical Chemistry A. 2018; 92(12): 2530-4.


